Журнал «Почки» Том 14, №4, 2025
Вернуться к номеру
Рівень свинцю й цинку в крові та зв’язок із поліморфізмом гена металотіонеїну при хронічній нирковій недостатності
Авторы: Arwa M. Nasser (1), Essam F. Al-Jumaili (2)
(1) - Scientific Research Commission, Research and Technology Center of Environment, Water and Renewable Energy, Iraq
(2) - Institute of Genetic Engineering and Biotechnology, University of Baghdad, Baghdad, Iraq
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
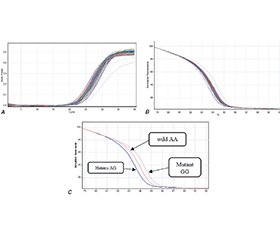
Актуальність. Хронічна хвороба нирок визначається пошкодженням нирок або розрахунковою швидкістю клубочкової фільтрації менше 60 мл/хв/1,73 м2. Свинець є повсюдним фактором навколишнього середовища, що може призводити до тривалих клінічних ускладнень у людей із хронічною хворобою нирок. Вони можуть зазнавати змін у гомеостазі цинку. Ген MT2A також має широкий спектр фізіологічних та патологічних ефектів. Матеріали та методи. У цьому дослідженні вивчено 60 зразків крові від осіб із захворюваннями нирок, які перебувають на гемодіалізі, та 60 від практично здорових осіб (контрольна група). Мета: визначити молекулярний характер генотипу SNP (A>G) (rs28366003) гена MT2A у пацієнтів із хронічною хворобою нирок та в контрольній групі. Результати. Рівні свинцю в крові та цинку в сироватці крові порівнювали в обох групах за допомогою полум’яної атомно-абсорбційної спектрофотометрії. Уміст свинцю в крові був значно вищим, із суттєвими відмінностями (p > 0,01) між когортою пацієнтів та здоровими особами, тоді як рівень цинку в сироватці крові був значно знижений. Чоловіки частіше страждають на хронічну хворобу нирок, ніж жінки, а пацієнти старше 40 років мали більший ризик ускладнень. Виявлено значущий позитивний зв’язок гіпертензії із хронічною хворобою нирок, тому її вважають можливим фактором ризику розвитку останньої. Генотип rs28366003 A>G, пов’язаний із підвищеним ризиком захворювання нирок в іракських пацієнтів, продемонстрував значну варіабельність. Медіанний вік осіб із хворобами нирок становив від 20 до 69 років. Генотипи та частота алелів rs28366003, A>G у популяції із захворюваннями нирок: 51,7 % (n = 31) були дикого типу (AA), 33,3 % (n = 20) — гетерозиготними (AG) та 15 % (n = 9) — гомозиготними (GG). Частота алелів A та G становила 68,3 та 31,7 %. Висновки. Таким чином, зниження рівня цинку та шкідливе підвищення рівня свинцю в крові пацієнтів із хронічною нирковою недостатністю, які мають варіанти SNP гена MT2A, зокрема rs28366003, можуть бути пов’язані зі схильністю до хвороб нирок.
Background. Chronic kidney disease is defined by renal damage or an estimated glomerular filtration rate less than 60 ml/min/1.73 m2. Lead is a ubiquitous environmental factor that can contribute to lengthy clinical complications in individuals with chronic kidney disease. They can be exposed to changes in zinc homeostasis. The MT2A gene also expresses a wide range of physiological and pathological effects. Materials and methods. This study involved 60 blood samples from individuals with kidney disease on hemodialysis, and 60 samples from apparently healthy individuals as a control. The purpose was to identify the molecular character of the genotype of the MT2A gene SNP (A>G) (rs28366003) in a cohort of chronic kidney disease subjects and apparently healthy controls. Results. Blood lead and zinc serum levels were compared between patients and healthy controls by flame atomic absorption spectrophotometry. Lead contents were significantly and considerably higher, with significant differences (p > 0.01) between the patient cohort and the healthy controls, while serum zinc was significantly decreased. Males are more affected than females with chronic kidney disease, and individuals older than 40 years had a greater risk of complications. Hypertension has a meaningful positive relation to chronic kidney disease, and it is therefore considered a possible risk factor. The rs28366003 A>G genotype associated with increased risk of kidney disease in Iraqi patients demonstrated considerable variation. The median age of kidney disease patients was 20 to 69 years. Genotypes and allele frequencies of rs28366003, A>G in the kidney disease population: 51.7 % (n = 31) were wild-type (AA), 33.3 % (n = 20) were heterozygous (AG) and 15 % (n = 9) were homozygous (GG). The allele frequencies of A and G were 68.3 and 31.7 %. Conclusions. Thus, the drop in zinc levels and the harmful increase in blood lead in chronic kidney failure patients who possess SNP variants of the MT2A gene, specifically rs28366003, may be involved in kidney disease susceptibility.
хронічна хвороба нирок; поліморфізм гена металотіонеїну; вплив свинцю; дефіцит цинку; SNP гена rs28366003; гемодіаліз
chronic kidney disease; metallothionein gene polymorphism; lead exposure, zinc deficiency; gene SNP rs28366003; hemodialysis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Hamid RH, Al-Jumaily RMK. Evaluation of oxidative stress activity, DNA damage and global DNA methylation among patients with chronic kidney disease. Iraqi J Sci. 2024;65(9):4963-72. doi: 10.24996/ijs.2024.65.9.13.
- Al-Shattawi SS, Al-Jumili EF. Pin1 gene expression and some biochemical parameters in Iraqi population with chronic kidney di–sease. Iraqi J Biotechnol. 2024;23(2):105-11. Available from: https://jige.uobaghdad.edu.iq/index.php/IJB/article/view/701.
- Abd AL-Razak MJ, AlSaadi BQH, Al Saedi AJH. Investigate some biochemical parameters and impact of NOS3 gene polymorphism among Iraqi patients with chronic kidney disease. Iraqi J Biotechnol. 2025;24(1):243-52. Available from: https://jige.uobaghdad.edu.iq/index.php/IJB/article/view/817.
- Al-Jumaili RA, Al-Jumaili EF, Ramadhan OM. Role of calcium sensing receptor gene polymorphism r1801725 in the evaluation of kidney disease. Iraqi J Biotechnol. 2024;23(1):235-40. Available from: https://iasj.rdd.edu.iq/journals/uploads/2024/12/11/168ece67f74db1ac7d192b205454c633.pdf.
- Attia RI, Naji Abed NA. Evaluation of some biochemical parameters and the effect of oxidative stress during hemodialysis in patients with chronic renal disease. Biochem Cell Arch. 2021;21(1). Available from: https://openurl.ebsco.com/EPDB%3Agcd%3A10%3A2714106/detailv2?sid=ebsco%3Aplink%3Ascholar&id=ebsco%3Agcd%3A150029157&crl=c&link_origin=scholar.google.com.
- Abdul-Jabbar MA, Kadhim DJ. Adherence to different treatment modalities among patients on maintenance hemodialysis. Iraqi J Pharm Sci. 2022;31(1):95-101. doi: 10.31351/vol31iss1pp95-101.
- Al-Shibly KH, Al-Diwan JK. Effect of the dietary protein intake on urea reduction rate in patients on maintenance hemodialysis in Merjan Teaching Hospital. Med J Babylon. 2022;19(2):244-9. doi: 10.4103/MJBL.MJBL_19_22.
- Narayanan M, Setia S. Chronic kidney disease. Perioperative Med Consult Handb. 2020;3:301-5. Available from: https://link.springer.com/chapter/10.1007/978-3-030-19704-9_38.
- Filler G, Elder S. Trace elements in dialysis. Pediatr Nephrol. 2014;29:1329-35. doi: 10.1007/s00467-013-2585-6.
- Jebur NJ, Yahya RN. The actual benefits of zinc for cardiovascular diseases: Mini review. Al-Rafidain J Med. Available from: https://doi.org/10.54133/ajms.v3i.92.
- Marreiro DDN, Cruz KJC, Morais JBS, Beserra JB, Severo JS, De Oliveira ARS. Zinc and oxidative stress: Current mechanisms. Antioxidants. 2017;6(2):24. doi: 10.3390/antiox6020024.
- Gao B, Chi L, Mahbub R, Bian X, Tu P, Ru H, Lu K. Multi-omics reveals that lead exposure disturbs gut microbiome development, key metabolites, and metabolic pathways. Chem Res Toxicol. 2017;30(4):996-1005. doi: 10.1021/acs.chemrestox.6b00401.
- Ekong EB, Jaar BG, Weaver VM. Lead-related nephrotoxicity: A review of the epidemiologic evidence. Kidney Int. 2006;70(12):2074-84. doi: 10.1038/sj.ki.5001809.
- Yang R, Roshani D, Gao B, Li P, Shang N. Metallothionein: A comprehensive review of its classification, structure, biological functions, and applications. Antioxidants. 2024;13(7). doi: 10.3390/antiox13070825.
- Hamed OM, Khalil MI, Alsaffar RS. Metallothionein gene polymorphism is considered to be a risk factor for chronic diseases. Int J Health Sci. 2022;6(S5):1691-92. doi: 10.53730/ijhs.v6nS5.9021.
- Leierer J, Rudnicki M, Braniff SJ, Perco P, Koppelstaetter C, Mühlberger I, Mayer G. Metallothioneins and renal ageing. Nephrol Dial Transplant. 2016;31(9):1444-52. doi: 10.1093/ndt/gfv451.
- SPSS. Statistical packages of social sciences-SPSS/IBM Statistics 26 step by step. 16th ed. 2019.
- Al-Jumaili RA, Al-Jumaili EF. Study of the causes of parathyroid hormone imbalance and some biochemical parameters in patients with chronic kidney disease. Rom J Diabetes Nutr Metab Dis. 2024;31(1):49-57. doi: 10.46389/rjd-2024-0049.
- Rebhi F, Khadhar M, Sarra H, Jerbi M, Aoudia R, Gaied H, Goucha R. Hypertension and chronic kidney disease: A close and proportional relationship. Nephrol Dial Transplant. 2023;38(Suppl 1). doi: 10.1093/ndt/gfad063d_6789.
- Elgenidy A, Amin MA, Awad AK, Husain-Syed F, Aly MG. Serum zinc levels in chronic kidney disease patients, hemodialysis patients, and healthy controls: Systematic review and meta-analysis. J Ren Nutr. 2023;33(1):103-15. doi: 10.1053/j.jrn.2022.04.004.
- Yao S, Xu D. Relationships between blood concentrations of cadmium, lead, mercury, selenium, and manganese and the risk of chronic kidney disease: A cross-sectional study based on NHANES 2011–2018. Arch Med Sci. 2024;20(6):1822-30. doi: 10.5114/aoms/181508.
- AlAni HT, Al-Lami MQ. Evaluation of some biochemical and hematological parameters in patients with chronic kidney disease. J Fac Med Baghdad. 2024;66(2):154-61. doi: 10.32007/jfacmedbagdad.2269.
- Duff R, Awofala O, Arshad MT, Lambourg E, Galla–cher P, Dhaun N, Bell S. Global health inequalities of CKD: A syste–matic review and meta-analysis examining prevalence and disparities in age, sex and socio-economic status. Nephrol Dial Transplant. 2024;39(Suppl 1):994-6. doi: 10.1093/ndt/gfae048.
- Fradelos EC. The effect of clinical and demographic factors on quality of life in end-stage renal disease: A multicenter cross-sectional study. J Ren Hepat Disord. 2020;4(1):1-9. doi: 10.15586/jrenhep.2020.58.
- Baqer HM, Jabur F, Kadhum S. Impact of end-stage renal disease upon physical activity for adult patients undergoing hemodialysis at Al-Najaf Governorate Hospitals. J Pharm Sci Res. 2018;10(5):1170-4. Available from: https://www.researchgate.net/profile/FakhriaMuhbes/publication/329885793_Impact_of_End_Stage_Renal_Disease_upon_physical_acti–vity_for_Adult_Patients_Undergoing_Hemodialysis_at_AL-Najaf_Governorate_Hospitals/links/5c20a54092851c22a3422665/Impact-of-End-Stage-Renal-Disease-upon-physical-activity-for-Adult-Patients-Undergoing-Hemodialysis-at-AL-Najaf-Governorate-Hospitals.pdf.
- Saber A, Tahami AN, Najafipour H, Azmandian J. Assessment of prevalence of chronic kidney disease and its predisposing factors in Kerman city. Nephro-Urol Mon. 2017;9(2). doi: 10.5812/numonthly.41794.
- Swastika KD. Hypertension on dialysis patients: Influence factors and management. J Endocrinol. 2022;4(4). doi: 10.32734/jetromi.v4i4.14734.
- Ku E, Lee BJ, Wei J, Weir MR. Hypertension in CKD: Core curriculum 2019. Am J Kidney Dis. 2019;74(1):120-31. doi: 10.1053/j.ajkd.2018.12.044.
- Abdollahi A, Ghahramani A, Ghahramani N. Zinc and kidney disease: A review. Iran J Kidney Dis. 2022;16(2). –Available from: https://www.researchgate.net/profile/Ashkan-Abdollahi/publication/360301336_Zinc_and_Kidney_Disease_A_Review/links/6279b2d33a23744a727215f8/Zinc-and-Kidney-Disease-A-Review.pdf.
- Tokuyama A, Kanda E, Itano S, Kondo M, Wada Y, Kadoya H, et al. Effect of zinc deficiency on chronic kidney disease progression and effect modification by hypoalbuminemia. PLoS One. 2021;16(5):1-13. doi: 10.1371/journal.pone.0251554.
- Damianaki K, Lourenco JM, Braconnier P, Ghobril JP, Devuyst O, Burnier M, et al. Renal handling of zinc in chronic kidney disease patients and the role of circulating zinc levels in renal function decline. Nephrol Dial Transplant. 2020;35(7):1163-70. doi: 10.1093/ndt/gfz065.
- Toida T, Toida R, Ebihara S, Takahashi R, Komatsu H, Uezono S, et al. Association between serum zinc levels and clinical index or the body composition in incident hemodialysis patients. Nutrients. 2020;12(10):3187. doi: 10.3390/nu12103187.
- Harari F, Sallsten G, Christensson A, Petkovic M, Hedblad B, Forsgard N, et al. Blood lead levels and decreased kidney function in a population-based cohort. Am J Kidney Dis. 2018;72(3):381-9. doi: 10.1053/j.ajkd.2018.02.358.
- Jalili C, Kazemi M, Cheng H, Mohammadi H, Babaei A, Taheri E, Moradi S. Associations between exposure to heavy me–tals and the risk of chronic kidney disease: A systematic review and meta-analysis. Crit Rev Toxicol. 2021;51(2):165-82. doi: 10.1080/10408444.2021.1891196.
- Ivanova, M., Dyadyk, O., Ivanov, D. et al. Matrix-assisted laser desorption/ionization mass spectrometry imaging to uncover protein alterations associated with the progression of IgA nephro–pathy. Virchows Arch 476, 903–914 (2020). https://doi.org/10.1007/s00428-019-02705-7.
- Mira FS, Oliveiros B, Carreira IM, Alves R, Ribeiro IP. Genetic variants related to increased CKD progression: A systematic review. Biology. 2025;14(1):1-22. doi: 10.3390/biology14010068.
- Kalantar-Zadeh K, Jafar TH, Nitsch D, Neuen BL, Perko–vic V. Chronic kidney disease. Lancet. 2021;398(10302):786-802. doi: 10.1016/S0140-6736(21)00519-5.
- Hattori Y, Naito M, Satoh M, Nakatochi M, Naito H, Kato M, et al. Metallothionein MT2A A-5G polymorphism as a risk factor for chronic kidney disease and diabetes: Cross-sectional and cohort studies. Toxicol Sci. 2016;152(1):181-93. doi: 10.1093/toxsci/kfw080.
- Tamay-Cach F, Quintana-Pérez JC, Trujillo-Ferrara JG, Cuevas-Hernández RI, Del Valle-Mondragón L, García-Trejo EM, Arellano-Mendoza MG. Impact of oxidative stress and some antioxidant therapies on renal damage: A review. Ren Fail. 2016;38(2):171-5. doi: 10.3109/0886022X.2015.1120097.
- Kayaalti Z, Aliyev V, Söylemezoğlu T. The potential effect of metallothionein 2A –5 A/G single nucleotide polymorphism on blood cadmium, lead, zinc and copper levels. Toxicol Appl Pharmacol. 2011;256(1):1-7. doi: 10.1016/j.taap.2011.06.023.