Журнал «Почки» Том 14, №4, 2025
Вернуться к номеру
Імунна відповідь на інтерферон гамма у щурів, які були інфіковані C.albicans
Авторы: Doaa Hazem Mohammed (1, 2), Meethaq Sattar Abood (2), Ali Naeem Salman (2)
(1) - Department of Pharmaceutical Sciences, College of Pharmacy, University of Thi-Qar, Thi-Qar, Iraq
(2) - Department of Biology, College of Education for Pure Science, University of Thi-Qar, Thi-Qar, Iraq
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
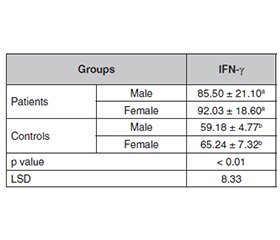
Актуальність. Candida albicans є найпоширенішим етіологічним агентом, що викликає опортуністичну грибкову інфекцію — кандидоз, системний перебіг якого може бути летальним. З огляду на збільшення кількості імунокомпрометованих осіб захворюваність на кандидоз зростає. У цьому дослідженні розглядається роль інтерферону гамма (IFN-γ) у захисті організму від інвазивного кандидозу. Мета: вивчити часові та статевозалежні зміни рівня IFN-γ у щурів, інфікованих C.albicans, щоб оцінити функціональну роль цього цитокіну в протигрибковому імунітеті. Матеріали та методи. У дослідження було залучено 100 щурів, розділених на експериментальну (n = 50) і контрольну (n = 50) групи, кожна з яких складалася з 25 самців та 25 самок. Тваринам експериментальної групи вводили циклоспорин A (10 мг) за 24 години до інфікування з метою пригнічення імунної відповіді та полегшення росту C.albicans. Контрольна група отримувала дистильовану воду. Вимірювання рівня IFN-γ проводили у п’яти часових точках: на 4-ту, 8-му, 12, 16 та 20-ту добу після інфікування. Результати. Отримані дані засвідчили вірогідне зростання концентрації IFN-γ (p < 0,05) у самців і самок щурів, інфікованих C.albicans, із максимальною концентрацією на 12-й день експерименту, після чого рівень цитокіну знижувався. У контрольній групі суттєвих змін IFN-γ протягом дослідження не зафіксовано. При цьому відмінностей в інтенсивності відповіді між статями не виявлено. Висновки. Отримані результати підтверджують важливу роль IFN-γ у протигрибковій імунній відповіді при інфікуванні Candida albicans. Відсутність виражених статевих відмінностей указує на можливу участь інших регуляторних факторів, зокрема гормональних. Необхідні подальші дослідження для з’ясування механізмів регуляції IFN-γ та його взаємодії зі статевими гормонами в контексті грибкових інфекцій.
Background. Candida albicans is the most frequent etiologic agent that causes opportunistic fungal infection called candidiasis, a disease whose systemic manifestation could prove fatal and whose incidence is increasing as a result of an expanding immunocompromised population. Here we review the role of interferon-gamma (IFN-γ) in host protection against invasive candidiasis. This study investigates the time- and sex-dependent variations in IFN-γ levels in C.albicans-infected rats, offering insights into the function of this cytokine in fungal immunity. Materials and methods. This study involved 100 rats, with 50 in the experimental group and 50 in the control group, each consisting of 25 males and 25 females. The experimental group received cyclosporine A (10 mg) 24 hours prior to the infection to suppress the immune response and facilitate C.albicans growth, whereas the control group was administered distilled water instead of C.albicans suspension. Following four days of infection, group 1 was anesthetized, and a blood sample was collected to measure IFN-γ levels. Group 2 was assessed at 8 days, group 3 at 12 days, group 4 at 16 days, and group 5 at 20 days, alongside the control group. Results. The present study demonstrated a significant increase (p < 0.05) in IL-10 concentration in both male and female rats infected with C.albicans compared to the control group. There was a significant increase in IFN-γ concentration in C.albicans-infected rats of both sexes, with a p value < 0.05, with progression of disease; the highest concentration was reached on the 12th day of the experiment and then decline. In contrast, no significant changes were observed in the control group over the same period. Conclusions. The research highlights the essential function of IFN-γ in the immune response to Candida albicans infections, observing that the absence of notable differences between male and female rats suggests that additional factors affect IFN-γ regulation. The necessity for additional research on the interactions between sex hormones and cytokines is underscored, offering insights into the sex- and time-dependent regulation of IFN-γ during infections, while also highlighting the need for clarification of observed discrepancies and their underlying mechanisms.
IFN-γ; C.albicans; кандидоз; імунна відповідь; щури
IFN-γ; C.albicans; candidiasis; immune response; rats
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Gozalbo D, Maneu V, Gil ML. Role of IFN-gamma in immune responses to Candida albicans infections. Front Biosci (Landmark Ed). 2014;19(8):1279-90. Available from: doi: 10.2741/4281.
- Brown GD. Innate antifungal immunity: the key role of phagocytes. Annu Rev Immunol. 2011;29:1-21. doi: 10.1146/annurev-immunol-030409-101229.
- Ashman RB, Papadimitriou JM. Production and function of cytokines in natural and acquired immunity to Candida albicans infection. Microbiol Rev. 1995;59(4):646-72. doi: 10.1128/mr.59.4.646-672.1995.
- Abood MS, Addai ZR, Alwaily ER. Determining the role of interleukin 6 and interleukin 10 in the immune response to vaginal candidiasis. NeuroQuantology. 2022;20(8):1784-9.
- Lopes JP, Lionakis MS. Pathogenesis and virulence of Candida albicans. Virulence. 2022;13(1):89-121. doi: 10.1080/21505594.2021.2019950.
- Conti HR, Peterson AC, Brane L, Huppler AR, Hernández-Santos N, et al. Oral-resident natural Th17 cells and γδ T cells control opportunistic Candida albicans infections. J Exp Med. 2014;211(10):2075-84. doi: 10.1084/jem.20130877.
- Qin Y, Zhang L, Xu Z, Zhang J, Jiang YY, et al. Innate immune cell response upon Candida albicans infection. Virulence. 2016;7(5):512-26. doi: 10.1080/21505594.2016.1138201.
- Austermeier S, Kasper L, Westman J, Gresnigt MS. I want to break free — macrophage strategies to recognize and kill Candida albicans, and fungal counter-strategies to escape. Curr Opin Microbiol. 2020;58:15-23. doi: 10.1016/j.mib.2020.05.007.
- Abed RE, Salman AN, Issa AH, Al-Salih M. Evaluation of the level of IL-2 in the HCV patients in the Thi Qar Province Southern Iraq. AIP Conf Proc. 2023;2845(1).
- Okab HF, Salih MB, Jarulla BA. Immunopathy of –COVID-19 patients without chronic disease: proinflammatory and anti-inflammatory cytokines attributable to disease severity. Lab Res Clin Pract. 2024;13(1):47-59. doi: 10.34883/PI.2024.13.1.004.
- Shankar J, Thakur R, Clemons KV, Stevens DA. Interplay of cytokines and chemokines in aspergillosis. J Fungi. 2024;10(4):251. doi: 10.3390/jof10040251.
- Glennon-Alty L, Moots RJ, Edwards SW, Wright HL. Type I interferon regulates cytokine-delayed neutrophil apoptosis, reactive oxygen species production and chemokine expression. Clin Exp Immunol. 2021;203(2):151-9. doi: 10.1111/cei.13525.
- Miyahara A, Umeki A, Sato K, Nomura T, Yamamoto H, et al. Innate phase production of IFN-γ by memory and effector T cells expressing early activation marker CD69 during infection with Cryptococcus deneoformans in the lungs. Infect Immun. 2024;92(6):e00024-24. doi: 10.1128/iai.00024-24.
- Abedini F, Mohammadi SR, Dahmardehei M, Ajami M, Salimi M, et al. Enhancing of wound healing in burn patients through Candida albicans β-glucan. J Fungi. 2022;8(3):263. doi: 10.3390/jof8030263.
- Harding AT, Heaton NS. The impact of estrogens and their receptors on immunity and inflammation during infection. Cancers (Basel). 2022;14(4):909. doi: 10.3390/cancers14040909.
- Dunn SE, Perry WA, Klein SL. Mechanisms and consequences of sex differences in immune responses. Nat Rev Nephrol. 2024;20(1):37-55. doi: 10.1038/s41581-023-00787-w.
- Bake S, Pinson MR, Pandey S, Chambers JP, Mota R, et al. Prenatal alcohol-induced sex differences in immune, metabolic and neurobehavioral outcomes in adult rats. Brain Behav Immun. 2021;98:86-100. doi: 10.1016/j.bbi.2021.08.207.
- Yu T, Xie M, Luo K, Zhang X, Gao W, et al. Mechanism of Chinese sturgeon IFN-γ inhibition on Mycobacterium marinum (Acipenser sinensis). Fish Shellfish Immunol. 2024;147:109436. doi: 10.1016/j.fsi.2024.109436.
- Pawar S, Markowitz K, Velliyagounder K. Effect of human lactoferrin on Candida albicans infection and host response interactions in experimental oral candidiasis in mice. Arch Oral Biol. 2022;137:105399. doi: 10.1016/j.archoralbio.2022.105399.
- Noori S, Nourbakhsh M, Imani H, Deravi N, Salehi N, et al. Naringenin and cryptotanshinone shift the immune response towards Th1 and modulate T regulatory cells via JAK2/STAT3 pathway in breast cancer. BMC Complement Med Ther. 2022;22(1):145. doi: 10.1186/s12906-022-03625-x.
- Wang J, Zhang ZQ, Gigliotti F, Wright TW. IFN-γ limits immunopathogenesis but delays fungal clearance during Pneumocystis pneumonia. J Immunol. 2023;211(9):1397-405. doi: 10.4049/jimmunol.2300460.
- Briard B, Malireddi RS, Kanneganti TD. Role of inflammasomes/pyroptosis and PANoptosis during fungal infection. PLoS Pathog. 2021;17(3):e1009358. doi: 10.1371/journal.ppat.1009358.
- Bezruk V, Ivanov D, Shkrobanets I. Chronobiological aspects of the excretory system (review). Kidneys. 2022;11(3):170-4. doi: 10.22141/2307-1257.11.3.2022.377.