Газета «Новости медицины и фармации» Маммология (298) 2009 (тематический номер)
Вернуться к номеру
Химиотерапия рака молочной железы
Авторы: И.Е. Седаков, Донецкий областной противоопухолевый центр, ДонНМУ
Версия для печати
Неоадъювантная и адъювантная химиотерапия
Адъювантная химиотерапия
Представление о раке молочной железы (РМЖ) как о системном заболевании, при котором уже на самых ранних этапах имеются отдаленные микрометастазы, является основанием для проведения системной предоперационной или послеоперационной (адъювантной) терапии у больных операбельным РМЖ. Воздействуя на микрометастазы, системная эндокринная или цитостатическая терапия способна увеличивать безрецидивную и общую выживаемость этой категории больных. Рандомизированные исследования, проведенные в Европе и США в конце 70-х годов, убедительно показали, что химиотерапия (ХТ) улучшает прогноз больных пременопаузального возраста с наличием метастазов в региональных лимфатических узлах (ЛУ). Важнейшее отличие от прежних лет состоит в том, что в настоящее время всем операбельным больным РМЖ рекомендуется проведение системной адъювантной терапии. Важнейшими прогностическими факторами остаются наличие и число пораженных подмышечных ЛУ. У больных с отсутствием метастазов в подмышечные ЛУ прогноз определяется размерами первичной опухоли (рТ), степенью дифференцировки опухолевых клеток и возрастом больной. Выбор адъювантной терапии базируется в первую очередь на информации о чувствительности опухоли к гормональным воздействиям, определяемой по содержанию рецепторов эстрогенов (РЭ) и/или прогестерона (РП) в опухолевой ткани. Считается, что опухоль потенциально гормоночувствительна, если, по данным иммуногистохимического исследования, даже 1 % опухолевых клеток содержит рецепторы к стероидным гормонам. Остается до конца не ясным значение гиперэкспрессии НЕR2/nеu, мутации р53, маркеров пролиферативной активности и многих других факторов.
Больные с отсутствием метастазов в подмышечные ЛУ могут быть разделены на группы низкого и высокого риска в зависимости от уровня РЭ в опухоли, размеров первичной опухоли, степени дифференцировки и возраста больной.
Выбор адъювантного лечения у больных с отсутствием метастазов в подмышечных ЛУ зависит от группы риска. У больных с низкой степенью риска можно рекомендовать назначение тамоксифена или вообще отказаться от дополнительного лекарственного лечения.
У больных с высокой степенью риска и отсутствием РЭ и/или РП в опухоли рекомендуется проведение адъювантной ХТ (6 курсов АС, РАС или СМР) независимо от состояния менструальной функции. У больных в пременопаузе с положительными рецепторами считается обязательным проведение ХТ с последующим назначением тамоксифена в течение 5 лет. Альтернативой ХТ у этой категории больных является выключение функции яичников с последующим назначением тамоксифена. У больных в постменопаузе с положительными рецепторами основой адъювантной терапии является прием тамоксифена в течение не менее 5 лет либо назначение ХТ всем больным с высоким риском, в том числе и при наличии менопаузы.
В старшей возрастной группе (старше 70 лет) основой адъювантной терапии должен быть тамоксифен. У больных с высоким риском и отсутствием РЭ и/или РП в опухоли может обсуждаться вопрос о назначении ХТ; при этом обязательно должны быть учтены общее состояние пациентки, сопутствующие заболевания и желание самой больной.
Прогноз больных РМЖ с метастазами в подмышечные ЛУ определяется в первую очередь числом пораженных ЛУ. Тактика адъювантной терапии при наличии метастазов в подмышечных ЛУ определяется состоянием менструальной функции и наличием РЭ и/или РП в опухоли. У больных в пременопаузе основой адъювантной терапии является ХТ. При числе метастазов в подмышечные ЛУ менее 4 показано проведение 6 курсов антрациклин-содержащих комбинаций (САР или АС) или 6 курсов классического СМР с пероральным приемом циклофосфана. При наличии 4 и более метастазов необходима более длительная адъювантная ХТ. Этим больным можно рекомендовать 4 курса доксорубицина с последующим назначением 8 курсов СМР.
Для больных в постменопаузе с положительными рецепторами основой адъювантной терапии является прием тамоксифена в течение 5 лет. Вместе с тем, как показали результаты соответствующих исследований, проведение 4 курсов ХТ антрациклин-содержащими комбинациями (АС или САР) достоверно улучшает результаты лечения этой категории больных.
Продемонстрировав хотя и умеренное, но статистически значимое улучшение безрецидивной и общей выживаемости, антрациклин-содержащие комбинации постепенно вытесняют из адъювантной терапии комбинацию СМF. Так, по данным метаанализа 11 рандомизированных исследований с участием около 7000 больных, в которых сравнивалась эффективность СМF и антрациклин-содержащих комбинаций, последние уменьшают риск развития рецидива на 12 % и смерти на 11 % по сравнению с СМF. Это приводит к увеличению 5-летней безрецидивной выживаемости на 3,2 % (54,1 и 57,3 % при использовании СМF и антрациклинов соответственно) и 5-летней общей выживаемости на 2,7 % (68,8 и 71,5 % при использовании СМF и антрациклинов соответственно). Оптимальная доза доксорубицина в комбинациях составляет 50–60 мг/м2. Повышение дозы доксорубицина не улучшает результаты лечения, но увеличивает токсичность терапии, в то время как снижение дозы доксорубицина достоверно ухудшает показатели выживаемости. Кроме того, оптимальным считается проведение 6 курсов адъювантной ХТ с включением антрациклинов, а не 4, как это было принято ранее. Классическая комбинация СМF с пероральным приемом циклофосфана в течение 14 дней может быть также использована при проведении адъювантной ХТ, особенно у больных с противопоказаниями к назначению антрациклинов или низким риском прогрессирования заболевания. Показано, что классический СМР с назначением перорального циклофосфана в течение 14 дней эффективнее суррогатных вариантов СМF с внутривенным введением циклофосфана.
Молодой возраст больных (< 35 лет) и число метастазов в подмышечных ЛУ 4 и более свидетельствуют о высоком риске прогрессирования заболевания, несмотря на проведение стандартной адъювантной ХТ. В настоящее время таким больным может быть рекомендовано последовательное применение доксорубицина и СМF.
Неоадъювантная (предоперационная) терапия
Целью предоперационной ХТ у больной операбельным РМЖ является уменьшение размеров опухоли с целью выполнения органосохраняющего лечения, а также воздействие на первичный очаг и микрометастазы для улучшения прогноза заболевания. В литературе приведены результаты нескольких рандомизированных исследований, посвященных изучению роли предоперационной ХТ. В большинстве из них было показано, что предоперационная ХТ не улучшает результаты лечения больных операбельным РМЖ по сравнению с адъювантной. В результате исследования были сделаны следующие выводы:
На основании результатов этого и других исследований экспертами VII Международной конференции по адъювантной терапии РМЖ был сделан вывод о том, что предоперационная ХТ не улучшает отдаленных результатов лечения и в настоящее время ее проведение показано лишь тем больным, у которых невозможно выполнение органосохраняющей операции на первом этапе.
Означает ли это, что применение предоперационной ХТ не имеет перспектив? Отнюдь нет. Предоперационная ХТ может быть использована в первую очередь у больных, которым выполнение органосохраняющей операции на первом этапе не представляется возможным. В этом случае успешная предоперационная ХТ даст возможность выполнить подобную операцию. Исследование В-18 убедительно показало, что достижение морфологически подтвержденной полной регрессии опухоли достоверно улучшает отдаленные результаты лечения. Таким образом, полная морфологическая регрессия служит индикатором высокой чувствительности к проводимой ХТ не только первичного очага, но и отдаленных микрометастазов. Именно успешная элиминация отдаленных микрометастазов приводит к улучшению безрецидивной и общей выживаемости. Становится очевидным, что целью проведения предоперационной ХТ является морфологически подтвержденное полное уничтожение первичной опухоли. Все остальные клинические эффекты не имеют принципиального значения.
Каким же образом мы можем повысить эффективность предоперационной ХТ? Существует несколько путей решения этой проблемы:
Предварительные результаты исследований подчеркивают перспективность интенсификации предоперационной ХТ за счет увеличения числа курсов лечения, использования регионарного внутриартериального пути введения химиопрепаратов и включения новых эффективных цитостатиков. Увеличение числа морфологически полных эффектов должно привести к значительному улучшению отдаленных результатов у больных с морфологически полной резорбцией опухоли.
Таким образом, стратегия и тактика неоадъювантной (предоперационной) и адъювантной терапии у больных РМЖ постоянно совершенствуются. Многие нерешенные вопросы являются стимулом для планирования многоцентровых рандомизированных исследований. Итогом такого рода исследований стала рекомендация проведения адъювантной системной терапии всем больным операбельным РМЖ независимо от менструального и рецепторного статуса, а также состояния подмышечных ЛУ. В ежедневную практику входят новые препараты, мишенями которых являются рецепторы факторов роста, переносчики сигналов, регуляторы клеточного цикла, ингибиторы апоптоза и ангиогенеза. Показано, что эти препараты не только обладают самостоятельной противоопухолевой активностью, но и способны в значительной степени усиливать эффект других противоопухолевых препаратов. Важнейшим инструментом для получения новых сведений об эффективности того или иного лечебного подхода, тестирования новых идей и теорий являются рандомизированные исследования с широким международным участием. Результаты подобных исследований позволяют надеяться на то, что в ближайшие годы онкологи получат новые эффективные лекарственные препараты, применение которых на предоперационном этапе или адъювантно предотвратит прогрессирование болезни и смерть у наибольшего числа больных.
Химиотерапия распространенного рака молочной железы
Химиотерапия является одним из перспективных методов лечения больных раком молочной железы. Представлена эффективность противоопухолевых препаратов и их комбинаций при лечении этого заболевания.
Монохимиотерапия (эффективность отдельных цитостатиков)
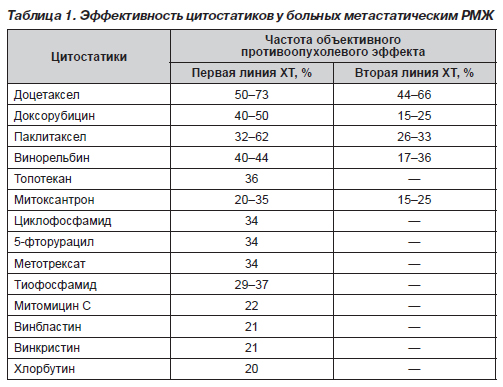
РМЖ чувствителен ко многим противоопухолевым препаратам (табл. 1). До настоящего времени наиболее популярными как для проведения монохимиотерапии, так и для комбинированной химиотерапии являются циклофосфамид, 5-фторурацил, метотрексат и доксорубицин. Именно эти препараты входят в составы наиболее популярных комбинаций, таких как СМР (циклофосфамид, метотрексат, 5-фторурацил), САР (циклофосфамид, доксорубицин, 5-фторурацил) и АС (доксорубицин, циклофосфамид).
Антрациклины (доксорубицин, эпирубицин, липосомальный доксорубицин, митоксантрон, лозоксантрон)
Доксорубицин до недавнего времени был наиболее эффективным цитостатиком при метастатическом РМЖ. При назначении доксорубицина в дозе 60–75 мг/м2 внутривенно каждые 3 недели частота объективного эффекта составляла 50–60 %. Доксорубицин обладает умеренной токсичностью. Кумулятивная токсичность доксорубицина проявляется в повреждении миокарда со снижением его сократительной способности и возникновением клинических симптомов хронической сердечной недостаточности. У 10 % больных, получивших суммарную дозу доксорубицина более 500 мг/м2, возможно развитие сердечной недостаточности.
Эпирубицин, производное доксорубицина, в эквивалентных дозах обладает равной противоопухолевой активностью и меньшей кардиотоксичностью. Соотношение дозы доксорубицина и эпирубицина составляет 1 : 1,5–2 (то есть дозе доксорубицина 50 мг/м2 соответствует 75–100 мг/м2 эпирубицина). В монорежиме доза эпирубицина может составлять 100–120 мг/м2 внутривенно каждые 3 недели, в комбинациях — 80–100 мг/ м2. Меньшая кардиотоксичность позволяет увеличить суммарную дозу препарата до 1000 мг/м2 без риска развития сердечной недостаточности.
К новым лекарственным формам доксорубицина можно отнести его соединение с липосомами. Липосомальный доксорубицин (ЛД) в течение более длительного времени циркулирует в крови и в большей концентрации накапливается в опухолевой ткани. Длительное время полураспада ЛД имитирует длительную внутривенную инфузию обычного доксорубицина и обладает характерной для этого метода введения токсичностью (стоматит и диарея). ЛД вызывает меньшую гематологическую и кардиотоксичность, алопецию, тошноту и рвоту по сравнению со струйным введением доксорубицина. ЛД доксил был изучен как в режиме монотерапии, так и в комбинации с паклитакселом, доцетакселом, винорельбином и циклофосфамидом при проведении исследований по II фазе. Доксил демонстрировал высокую эффективность и меньшую кардиотоксичность по сравнению с доксорубицином. Другой ЛД ТLC D-99 в рандомизированном исследовании показал равную эффективность, но меньшую токсичность по сравнению с доксорубицином. Если в проводящихся в настоящее время рандомизированных исследованиях подтвердится равная эффективность и меньшая токсичность ЛД по сравнению со стандартным доксорубицином, то это будет основанием для их широкого использования при лечении РМЖ, особенно в случае проведения адъювантной терапии.
Митоксантрон относится к производным антрацендиона и по своей химической структуре и механизму действия близок к антрациклинам. Митоксантрон в дозе 14 мг/м2 обладает меньшей токсичностью (тошнота и рвота, алопеция, стоматит) по сравнению с антрациклинами. Важнейшим преимуществом митоксантрона является практически полное отсутствие кардиотоксичности при использовании в стандартных дозировках (суммарно менее 150 мг/м2). Вместе с тем митоксантрон существенно уступает доксорубицину с точки зрения противоопухолевой эффективности и поэтому не может быть его альтернативой. Но митоксантрон можно рекомендовать тем больным, которые имеют признаки снижения сократительной способности миокарда, то есть имеют противопоказания к назначению антрациклинов.
Лозоксантрон — новое производное антрапиразола, имеющее более высокую противоопухолевую активность и равную токсичность по сравнению с митоксандроном. Эффективность препарата у ранее не леченных больных РМЖ составила 46 %. Изучается эффективность препарата в комбинации с паклитакселом и циклофосфамидом. Таким образом, лозоксантрон заслуживает дальнейшего изучения как препарат, обладающий сравнимой с доксорубицином эффективностью, но не имеющий кардиотоксичности.
Антиметаболиты (5-фторурацил, метотрексат, капецитабин, урацил-фторафур, ралтитрексид, гемцитабин, эдатрексат)
5-фторурацил и метотрексат — старейшие препараты из группы антиметаболитов, используемые для лечения РМЖ. Для 5-фторурацила было показано, что механизм противоопухолевого эффекта зависит от способа введения препарата (внутривенный струйный или инфузионный длительный). Длительная внутривенная инфузия 5-фторурацила может быть эффективной у больных с прогрессированием на струйном введении. Поэтому инфузии 5-фторурацила широко используются в качестве ХТ 2–3-й линии у больных РМЖ. В настоящее время были синтезированы пероральные препараты — предшественники 5-фторурацила, которые имитируют длительную внутривенную инфузию. К ним относятся капецитабин и урацил-фторафур (UFТ).
Капецитабин (кселода) после перорального приема и метаболической активации создает в крови концентрацию 5-фторурацила, аналогичную таковой при инфузионном введении 5-фторурацила в суточной дозе 300 мг/м2. Одновременно подтверждено, что прием капецитабина обеспечивает высокую концентрацию 5-фторурацила в опухолевой ткани. Препарат в дозе 2,5 г/м2 2 раза в сутки в 1–14-й день каждые 28 дней, рекомендованный в качестве ХТ второй линии больным РМЖ, продемонстрировал положительный противоопухолевый эффект у 20 % больных. Капецитабин обладал равной эффективностью (25 %) с CМF у пожилых больных. У больных с прогрессированием на антрациклинах эффективность капецитабина составила 36 % и была сопоставима с таковой при использовании паклитаксела.
Другим пероральным антиметаболитом является UFТ — комбинация урацила и фторафура в соотношении 1 : 4. Фторафур является предшественником 5-фторурацила, а урацил усиливает противоопухолевый эффект последнего. Эффективность препарата у больных с предшествующей терапией антрациклинами составила 19–29 %. Комбинация UFТ, лейковорина и метотрексата оказалась эффективной у 38 % больных с прогрессированием после проведения высокодозной ХТ.
Ралтитрексид (томудекс) — прямой ингибитор фермента тимидилатсинтетазы, играющей ключевую роль в синтезе пуриновых оснований для ДНК и РНК, был использован у больных РМЖ с прогрессированием после адъювантной ХТ антрациклинами. Препарат назначали в дозе 3 мг/м2 каждые 3 недели, при этом частота объективного противоопухолевого эффекта составила 26 % при хорошей переносимости лечения.
Гемцитабин (гемзар) — аналог существующего нуклеозида деоксицитидина, блокирующий фермент рибонуклеотидредуктазу. При этом гемцитабин активно встраивается в структуру ДНК, что приводит к нарушению синтеза ДНК и РНК. При назначении препарата больным РМЖ после предшествующей адъювантной ХТ или ХТ первой линии в дозе 725 мг/м2 еженедельно в течение 3 недель частота объективного эффекта средней продолжительностью 13,5 месяца составила 25 %. В настоящее время изучается возможность включения гемцитабина в комбинации с антрациклинами или таксанами.
Очевидно, что новые антиметаболиты, обладая умеренной эффективностью и хорошей переносимостью, являются перспективными кандидатами для комбинаций с антрациклинами и таксанами с целью повышения эффективности ХТ 1-й линии у больных РМЖ. Самостоятельно они могут использоваться в качестве ХТ 2-й линии, особенно при резистентности к антрациклинам и таксанам.
Таксаны (паклитаксел, доцетаксел)
В основе противоопухолевого механизма обоих препаратов лежит их способность полимеризировать белок тубулин, основу микротрубочек клетки, тем самым нарушая способность последних формировать веретено деления и прерывая клеточный цикл опухолевой клетки в фазе митоза. Опубликованные ранее в литературе обзоры дают более подробное представление о механизме действия и фармакологических свойствах таксанов.
Паклитаксел и доцетаксел были тщательно изучены у больных диссеминированным РМЖ. Паклитаксел обладает значительной противоопухолевой активностью при этой локализации рака. Так, эффективность его в дозах 175–250 мг/м2 у ранее не леченных больных составляет, по данным различных авторов, 29–62 % при средней продолжительности регресса 8–9 мес.
Паклитаксел эффективен и при проведении 2-й линии ХТ, а также у многократно леченных больных с резистентными к антрациклинам опухолями, то есть в группе пациентов, практически не имевших ранее перспектив в лечении. В зависимости от характера резистентности к антрациклинам эффективность паклитаксела составила 19–55 % при средней продолжительности регресса 8–9 мес. На основании приведенных выше данных паклитаксел был рекомендован для проведения ХТ 2-й линии у больных РМЖ, в том числе при наличии клинических признаков резистентности к антрациклинам.
Для проведения монотерапии паклитакселом или использования его в комбинациях была рекомендована 3-часовая инфузия паклитаксела в дозе 175 мг/м2. Повышение дозы препарата до 210–250 мг/м2 не увеличивает эффективность, но значительно усиливает гематологическую и неврологическую токсичность. Длительная инфузия паклитаксела (24 ч) увеличивает частоту объективных эффектов (с 40 до 50 % у ранее не леченных больных), но не приводит к увеличению продолжительности жизни и сочетается с выраженной нейротоксичностью. В отличие от паклитаксела клинические испытания доцетаксела проводились в режиме одночасовой инфузии в дозе 75–100 мг/м2. Эффективность доцетаксела в дозе 75 мг/м2 в качестве ХТ 1-й линии составила 40–52 % при средней продолжительности регресса 7,7 мес. При назначении доцетаксела в дозе 100 мг/м2 частота объективных эффектов составила 53–87 % при средней продолжительности регресса 8,3 мес. Была отмечена высокая активность препарата у больных с метастазами в печень, наличие которых является крайне неблагоприятным прогностическим фактором: частота достижения объективных эффектов в этой группе составила 60 %, а продолжительность регрессии — 7–8 мес.
Многообещающими были и результаты, полученные при проведении 2-й и последующих линий ХТ доцетакселом. P.M. Ravdin обобщил итоги трех многоцентровых исследований, в которых приняли участие 134 больных с резистентными к доксорубицину опухолями, которым проводилось лечение доцетакселом в дозе 100 мг/м2 каждые 3 недели. Частота объективных эффектов составила 41 % при средней продолжительности регрессии 6 мес. На основании этих исследований доцетаксел был рекомендован в качестве ХТ 2-й линии у больных РМЖ с резистентностью к антрациклинам.
Винкалкалоиды (винорельбин)
Винорельбин (навельбин) — новое производное винкалкалоидов, мишенью которого являются микротрубочки опухолевой клетки. При проведении клинических испытаний было определено, что оптимальным режимом введения винорельбина является еженедельный прием препарата в дозе 25–30 мг/м2 в течение 3–6 недель. Основными проявлениями токсичности винорельбина являются нейтропения и периферическая нейропатия.
Опубликованы результаты нескольких исследований, изучавших активность винорельбина в качестве ХТ 1-й линии у больных РМЖ. По данным различных авторов, частота объективных эффектов составила 35–60 % при средней продолжительности регрессии 5–9 месяцев и продолжительности жизни 13–18 месяцев.
Винорельбин — активный препарат при проведении ХТ 2-й линии. Объективные эффекты продолжительностью 4–8 месяцев регистрируются у 20–31 % больных, а медиана продолжительности жизни с момента назначения винорельбина составляет 13 месяцев. Полученные данные убедительно свидетельствуют о том, что винорельбин относится к числу наиболее активных препаратов при РМЖ. В настоящее время он рекомендован для проведения ХТ 2-й линии у больных РМЖ с прогрессированием после ранее проведенного лечения.
Комбинированная химиотерапия
CMF и антрациклин-содержащие комбинации
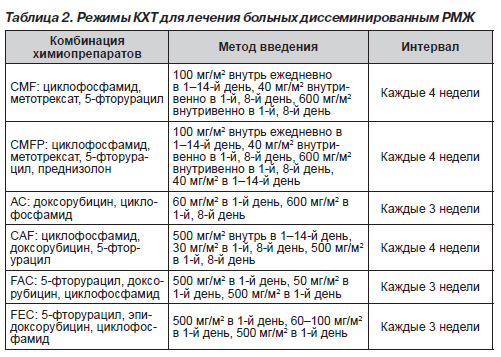
До недавнего времени основу комбинированной ХТ (КХТ) РМЖ составляли CMF или антрациклин-содержащие схемы (AC, CAF, CEF). В табл. 2 приведены наиболее популярные из них. Теоретически КХТ имеет преимущество перед монотерапией. В комбинацию включаются препараты с различным механизмом действия, что потенцирует их противоопухолевый эффект и уменьшает риск развития лекарственной резистентности опухолевых клеток. Включение в комбинацию препаратов с различными проявлениями токсичности позволяет использовать их в полных дозах без ухудшения переносимости. Проведенный недавно метаанализ рандомизированных исследований показал, что полихимиотерапия по сравнению с монохимиотерапией достоверно чаще позволяет достигать объективного противоопухолевого эффекта (48 и 34 % соответственно) и на 18 % уменьшает риск смерти от РМЖ. Это улучшает показатели годичной и трехлетней выживаемости на 5 и 3 % соответственно.
С момента публикации R. Cooper (
Однако в рандомизированном исследовании было показано, что классический режим CMF (с приемом циклофосфамида per os) имеет преимущества перед внутривенным введением с точки зрения как частоты объективных эффектов, так и выживаемости. Поэтому при назначении CMF следует отдавать предпочтение классическому режиму с пероральным приемом циклофосфамида и одновременному назначению пероральных форм антиэметиков из группы антагонистов рецепторов серотонина (гранисетрон, ондасетрон, трописетрон).
С появлением доксорубицина комбинации на его основе стали наиболее популярными при проведении 1-й линии ХТ больных РМЖ. Эффективность и токсичность различных режимов с включением доксорубицина (AC, CAF, FAC) примерно одинаковы, и все они с успехом могут быть использованы в клинической практике. Вопрос о преимуществе режимов с включением доксорубицина перед CMF остается дискутабельным даже после 30 лет их клинического применения. Проведенный метаанализ показал, что при использовании режимов с включением антрациклинов по сравнению с CMF достоверно чаще достигается противоопухолевый эффект (51 и 45 % соответственно), однако это не оказывает влияния на продолжительность жизни, которая одинакова в обеих группах. При этом частота тошноты и рвоты, миелосупрессии и алопеции выше у больных, получавших доксорубицин-содержащие комбинации.
Эпирубицин также часто используется в КХТ РМЖ. Включение эпирубицина в дозе 60 мг/м2 снижает токсичность терапии за счет уменьшения частоты и степени проявлений гематологической токсичности, мукозитов, тошноты и рвоты, а главное, кардиотоксичности. Вместе с тем при использовании эпирубицина в дозе 100 мг/м2 и более (соотношение доксорубицина и эпирубицина 1 : 2) разница в токсичности исчезает. Следует помнить, что использование эпирубицина в сниженных дозах приводит к ухудшению результатов терапии по сравнению с доксорубицином.
Какова должна быть продолжительность ХТ 1-й линии? Исследования показали, что проведение ХТ до признаков прогрессирования (10–12 циклов и более) хотя и увеличивает время до прогрессирования, но не приводит к увеличению продолжительности жизни и сопровождается серьезной токсичностью и ухудшением качества жизни. Поэтому чаще продолжительность 1-й линии ХТ ограничивается проведением 6–8 курсов лечения.
Каковы же результаты лечения при проведении режимов CMF и антрациклин-содержащих комбинаций? В табл. 3 представлены результаты применения CMF и CAF, полученные при проведении нескольких исследований.
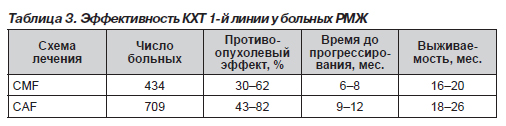
Очевидно, что проведение стандартной ХТ позволяет достичь объективного эффекта у 50–70 % больных при медиане времени до прогрессирования 7–10 месяцев и медиане продолжительности жизни 18–22 месяцев. Таким образом, проведение стандартной ХТ позволяет увеличить продолжительность жизни для большинства больных, однако только единичные пациенты (около 3 %) живут без признаков прогрессирования заболевания 5 лет и более.
Интенсивные режимы химиотерапии
Проведенные исследования показывают, что снижение интенсивности ХТ (использование цитостатиков в дозах меньших, чем стандартные, и увеличение интервала между циклами) приводит к значительной потере эффективности лечения. Вместе с тем, несмотря на многочисленные рандомизированные исследования, не удалось доказать, что интенсивная ХТ улучшает результаты лечения. Например, увеличение дозы эпирубицина с 50 до 100 мг/м2 в комбинации с циклофосфамидом и 5-фторурацилом привело к достоверному увеличению числа объективных противоопухолевых эффектов (41 и 57 % соответственно), однако время до прогрессирования (7 и 7,6 месяца) и продолжительность жизни больных (17 и 18 месяцев) были практически одинаковыми. В настоящее время нет сведений, что использование высокодозной ХТ у больных метастатическим РМЖ в качестве ХТ 1-й линии улучшает результаты лечения. Помимо этого, применение регионарной внутриартериальной ХТ позволяет значительно повысить эффективность комплексного лечения у этой группы пациенток.
Комбинации с включением новых противоопухолевых препаратов
Появление новых цитостатиков, эффективных при РМЖ, стимулирует создание комбинаций с их включением. Чаще всего для совместного применения в комбинации с новым цитостатиком используют доксорубицин, наиболее эффективный и популярный препарат для лечения больных метастатическим РМЖ.
Паклитаксел
Комбинация паклитаксела и доксорубицина продемонстрировала высокую эффективность при лечении метастатического РМЖ. В исследовании итальянских ученых показано, что при проведении 8 циклов доксорубицина в дозе 60 мг/м2 и паклитаксела в дозе 200 мг/м2 каждые 3 недели частота объективного эффекта составила 94 % при средней продолжительности полной и частичной регрессии 8 и 11 месяцев соответственно. Впоследствии высокая эффективность комбинации доксорубицина и паклитаксела при лечении больных РМЖ была подтверждена и в других исследованиях. Вместе с тем в итальянском исследовании комбинация доксорубицина и паклитаксела сопровождалась высокой частотой развития хронической сердечной недостаточности, которая зафиксирована у 18 % пациентов. Последующий анализ кардиотоксичности при лечении 922 больных показал, что при кумулятивной дозе доксорубицина 340–380 мг/м2 частота развития сердечной недостаточности составляет лишь 4 %.
В рандомизированном исследовании ЕСОО сравнивали эффективность и токсичность монохимиотерапии паклитакселом в дозе 175 мг/м2 в течение 24 ч каждые 3 недели, доксорубицином в дозе 60 мг/м2 каждые 3 недели и комбинации паклитаксела 150 мг/м2 в виде 24-часовой инфузии и доксорубицина 50 мг/м2 каждые 3 недели при проведении ХТ 1-й линии у больных диссеминированным РМЖ. Лечение проводилось до прогрессирования, далее больные, получавшие доксорубицин, продолжали лечение паклитакселом, и наоборот, больные с прогрессированием на фоне ХТ паклитакселом получали доксорубицин. Результаты лечения больных представлены в табл. 4.
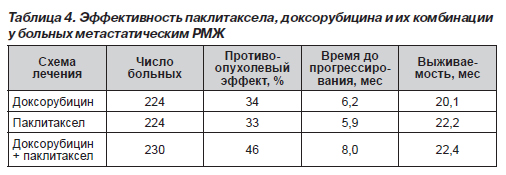
Из данных табл. 4 видно, что комбинация доксорубицина и паклитаксела обладает преимуществом в достижении объективных эффектов и времени до прогрессирования (р < 0,05), при этом эффективность монохимиотерапии с использованием каждого из компонентов этой комбинации значительно ниже и существенно не различается между собой (р = 0,84). Дальнейшее наблюдение за больными показало одинаковую продолжительность жизни во всех трех группах (р > 0,05).
Доцетаксел
Комбинация доцетаксела и доксорубицина была изучена в качестве ХТ 1-й линии при лечении 64 больных. Максимально переносимые дозы в этой комбинации составили 85 мг/м2 для доцетаксела и 50 мг/м2 для доксорубицина. Дозолимитирующей токсичностью являлась нейтропения с присоединением в ряде случаев сепсиса. Средняя частота обьективных эффектов в этих исследованиях составила 82 %. С учетом высокой гематологической токсичности рекомендуемыми дозами препаратов в такой комбинации следует считать 75 мг/м2 для доцетаксела и 50 мг/м2 для доксорубицина, причем первым следует вводить доксорубицин.
В недавно опубликованном рандомизированном исследовании комбинацию доксорубицина в дозе 50 мг/м2 и доцетаксела в дозе 75 мг/м2 сравнили с комбинацией АС (60/600 мг/м2) каждые 3 недели (до 8 циклов) при лечении 429 больных метастатическим РМЖ. Частота объективных эффектов при использовании комбинации с включением доцетаксела была достоверно выше (47 и 60 %), что привело к достоверному удлинению медианы времени до прогрессирования и продолжительности жизни. Комбинация доксорубицина и доцетаксела обладала более выраженной гематологической токсичностью.
Винорельбин
Эффективность комбинации доксорубицина в дозе 50 мг/м2 в 1-й день и винорельбина в дозе 25 мг/м2 в 1-й и 8-й день лечения каждые 3 недели в двух проведенных исследованиях составила 57 и 74 % при средней продолжительности полной и частичной регрессии 21 и 9,5 месяца соответственно.
Аргентинские исследователи сравнили комбинацию винорельбина и доксорубицина (дозы и режим введения аналогичны приведенным выше) и комбинацию РАС. В исследование были включены 168 больных. Эффективность составила 70 и 72 % соответственно при большей миелотоксичности комбинации винорельбин
В рандомизированном исследовании, проведенном в Канаде, сравнили комбинацию винорельбина в дозе
Таким образом, основой КХТ больных РМЖ в настоящее время являются антрациклины. В настоящее время лишь таксаны (паклитаксел и доцетаксел) могут претендовать на включение в 1-ю линию ХТ. Первые рандомизированные исследования показали, что комбинации доксорубицина и паклитаксела или доксорубицина и доцетаксела имеют преимущество перед стандартными доксорубицин-содержащими комбинациями с точки зрения как частоты объективных эффектов, так и продолжительности времени до прогрессирования и продолжительности жизни. «Расплатой» за эти преимущества является большая токсичность, в первую очередь гематологическая, указанных схем. Если последующие исследования подтвердят эти результаты, то комбинация доксорубицина и таксанов (паклитаксела или доцетаксела) может быть рекомендована в качестве 1-й линии ХТ больных метастатическим РМЖ.
