Газета «Новости медицины и фармации» Неврология (299) 2009 (тематический номер)
Вернуться к номеру
Статини у вторинній профілактиці мозкового інсульту
Авторы: Т.С. Міщенко, Т.Г. Перцева, ДУ «ІНПН АМН України», м. Харків
Версия для печати
Найважливішою проблемою сучасної клінічної медицини в багатьох країнах світу є проблема цереброваскулярних захворювань (ЦВЗ), що становлять одну з основних причин смертності та інвалідизації населення [22, 23].
Актуальною ця проблема є і в Україні, де, за даними офіційної статистики Міністерства охорони здоров''я, зареєстровано понад 3 млн пацієнтів з різними формами ЦВЗ; щорічно у 100–110 тис. жителів країни розвивається інсульт вперше, у 25–28 % з них — повторно. За даними офіційної статистики, в Україні у 2008 році було зареєстровано 107 124 випадків мозкового інсульту (МІ), що становить 282,9 на 100 тис. населення. Важливе значення в зниженні рівня смертності й інвалідизації населення унаслідок мозкового інсульту належить первинній і вторинній профілактиці, що полягає в превентивному лікуванні безсимптомних хворих з вираженими факторами ризику розвитку інсульту й активному зниженні ризику повторного інсульту в осіб, які перенесли МІ або транзиторну ішемічну атаку (ТІА).
Найчастішими факторами ризику розвитку МІ визнані артеріальна гіпертензія (АГ), дисліпідемія, цукровий діабет (ЦД), хвороби серця, куріння, зловживання алкоголем та ін. Ці фактори, а також їх поєднання спостерігаються практично в усіх пацієнтів із ЦВЗ. Впливаючи на вищезазначені фактори, можна значно зменшити частоту судинних захворювань головного мозку, що доведено в численних дослідженнях. У той же час щодо гіперхолестеринемії як фактора розвитку ЦВЗ довгий час питання залишалося спірним. Тільки тепер з''явилися переконливі дані про те, що корекція дисліпідемії знижує частоту розвитку ішемічного інсульту (ІІ).
Нещодавно завершені п''ять чималих досліджень з ефективності лікування статинами, що обгрунтували користь холестеринзнижуючої терапії у цієї категорії хворих. За результатами досліджень 4S, CARE, LIPID, MIRACH, HPS, продемонстровано нейропротекторну дію статинів і показано зниження ризику розвитку інсульту від 19 до 51 % у пацієнтів із ЦВЗ.
У численних клінічних дослідженнях доведено, що тривале приймання статинів зменшує смертність від серцево-судинних захворювань на 30 %, головним чином за рахунок зниження частоти розвитку інфаркту міокарда (ІМ) й інших проявів ішемічної хвороби серця (ІХС), тому статини займають лідируючі позиції в клінічних рекомендаціях з лікування і профілактики серцево-судинних захворювань [1–8]. Роль холестерину в розвитку ІХС сьогодні ні в кого не викликає сумніву.
Результати двох нещодавно проведених метааналізів показали, що зниження рівня ХС ЛПНЩ на 1 ммоль/л під впливом статинів сприяє зменшенню частоти МІ на 10–17 % [8, 9].
Лікування статинами знижує ризик розвитку МІ. За останні роки проведено чимало досліджень щодо оцінки ефективності статинів у профілактиці ІХС і ІМ. Вторинними кінцевими точками в цих дослідженнях були дані про вплив статинів на частоту розвитку МІ; ці дослідження стосувалися тільки ролі статинів у первинній профілактиці МІ. Так, дані великих досліджень стосовно статинів (4S, WOSCOPS, CARE, LIPІD, HPS, ASCOT-LLA і ін.), проведені за останні 10 років, переконливо свідчать, що ці препарати знижують ризик розвитку ішемічного інсульту на 25–30 % [1, 2, 12].
Скандинавське дослідження 4S було першим великим дослідженням з вивчення ефективності статинів [1]. Воно кардинально змінило ставлення клініцистів до лікування дисліпідемій. За хворими спостерігали 5,4 року. Основні результати дослідження такі: під впливом терапії симвастатином рівень загальної смертності знизився на 30 %, серцево-судинної — на 42 %. У дослідженні відмічено значне зниження кількості смертельних та несмертельних інсультів (70 проти 98) у групі симвастатину порівняно з групою плацебо; ішемічні інсульти (неемболічні) і транзиторні ішемічні атаки знизилися на 51 і 35 % відповідно.
У недавньому дослідженні з вторинної профілактики LIPID правастатин значно знижував частоту інсультів (на 19 %).
У дослідженні ASCOT зареєстровано зниження ризику ІІ на 40 %, що досягалося як за рахунок контролю АТ, так і за рахунок приймання аторвастатину [2].
До чотирьох метааналізів увійшли випадки інсультів усіх досліджень із застосування статинів для запобігання ІХС. Лікування статинами значно знижувало ризик МІ [13, 14, 16]. Також було встановлено позитивний вплив статинів при різних типах ІІ: атеротромботичному, кардіоемболічному та лакунарному.
Вивчено вплив аторвастатину в дозі 40 мг/сут на реактивність судин головного мозку, на L-аргинін і функцію системного ендотелію на підставі опосередкованої патології дилатації у хворих з лакунарними інфарктами. Показано, що лікування аторвастатином навіть протягом 3 місяців покращує функцію ендотелію у хворих з лакунарними інфарктами [15].
За результатами метааналізу досліджень, в яких брали участь понад 90 тис. хворих, доведено, що застосування статинів протягом 5 років призводить до зниження ризику розвитку МІ в середньому на 17–21 %. При цьому встановлено, що чим нижче рівень ХС ЛПНЩ, тим більше зменшується ризик розвитку інсульту [13].
Як показує аналіз проведених клінічних досліджень, статини довели свою ефективність як у первинній, так і у вторинній профілактиці МІ, що обумовлене не тільки їх гиполіпідемічними властивостями, але й іншими ефектами: впливом на біологічну доступність азотної кислоти, протизапальними, антитромботичними, антиоксидантними та іншими діями [19].
Натепер виявлено більше двадцяти плейотропних властивостей статинів. Тривалий досвід їх застосування, дані доказової медицини свідчать, що плейотропні властивості статинів виявляються в певній послідовності [17, 18].
Незважаючи на проведені дослідження з проблеми застосування статинів, чимало питань залишається дискусійними. Особливо це стосується термінів використання статинів. Тому метою нашого дослідження стало визначення нетривалого (3 місяці) впливу препарату аторвастатину на обмін і перерозподіл поміж фракціями ліпопротеїнів вільного холестерину та синтез ефірів холестерину, що каталізує лецитин-холестерол ацилтрансферазу (ЛХАТ), у сироватці крові пацієнтів із наслідками ішемічного інсульту.
У дослідження було залучено 24 особи, віком 53 ± 8 років, 12 чоловіків та 12 жінок. У всіх хворих, за даними анамнезу, клініко-неврологічного обстеження виявлені наслідки ішемічного інсульту. Давнина інсульту складала не більше 5,0 ± 2,5 року. 10 хворих (41,7 %) перенесли ішемічний інсульт у вертебробазилярному басейні, 8 хворих (33,3 %) — у басейні лівої середньої мозкової артерії та 6 хворих (25 %) — у басейні правої середньої мозкової артерії.
У 20 (83,3 %) обстежених хворих виявлялося стійке підвищення артеріального тиску (АТ) до 160/95 мм рт.ст. і вище, відмічався твердий, напружений пульс, іноді з прискоренням. У 22 (91,7 %) хворих спостерігалася гіпертрофія міокарда лівого шлуночка (лівий кордон серця зміщений ліворуч, верхівковий поштовх посилений), у 20 (83,3 %) — послаблення I тону і акцент II тону на аорті. На очному дні у 100 % випадків хворих відмічалися гіпертензійна або змішана ангіопатія судин сітківки.
Крім цього, в анамнезі у деяких хворих відмічалася супутня патологія. Частіше зустрічалася серцева, ниркова та легенева патологія, що була підтверджена інструментальними та лабораторними методами дослідження. Так, у 13 (54,2 %) хворих наявна ішемічна хвороба серця, ниркова патологія зустрічалась у 8 (33,3 %) пацієнтів, легенева патологія була відмічена у 4 (16,7 %) хворих.
Усі хворі одержували препарат аторвастатин протягом 3 місяців у дозі 10 мг на добу. Контрольна група включала 10 здорових донорів без ішемічного інсульту в анамнезі. На момент обстеження на спеціальній дієті ніхто не знаходився. Кров для дослідження брали натще, через 12 годин після останнього приймання їжі.
Апо А- і Апо В-вміщуючі фракції ЛП розподіляли шляхом висадження останніх за допомогою набору реактивів «Холестерин ЛВП» («Ольвек диагностикум»). Уміст загального, вільного й етерифікованого холестерину у сироватці крові та окремо у складі Апо А- і Апо В-ЛП вимірювали ензиматичним методом, використовуючи набір реактивів «Реагент».
Лецитин-холестерол-ацилтрансфе-разну активність сироватки крові визначали за методом Stokke і Norum та виражали в нмолях холестеролу, що етерифікувався в
Отримані дані опрацьовували статистично, вірогідність розбіжностей між групами оцінювали за t-критерієм Фішера — Стьюдента. Критичним рівнем значущості (р) при перевірці статистичних гіпотез вважали 0,05.
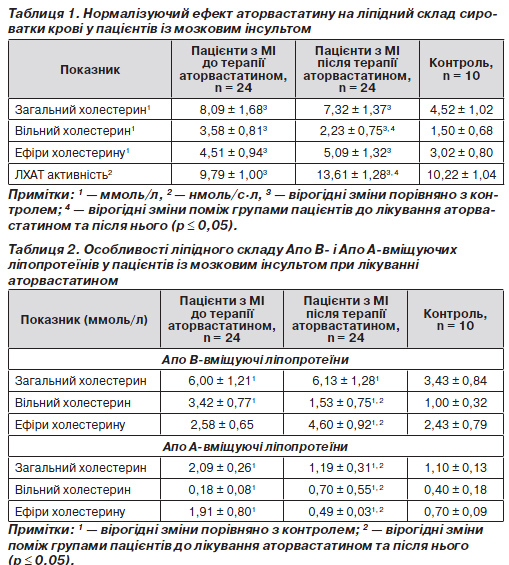
Дані, що наведені у табл. 1, свідчать про атерогенні показники сироватки крові пацієнтів із наслідками мозкового інсульту до початку терапії статинами. Спостерігається збільшення концентрації загального, вільного і етерифікованого холестерину та пригнічення ЛХАТ активності у цих хворих порівняно з контролем.
Дані подальшого докладного аналізу вмісту і перерозподілу холестерину в Апо В- і Апо А-вміщуючих фракціях ліпопротеїнів показали (табл. 2), що у тріацилгліцерол-збагачених фракціях ліпопротеїнів збільшення концентрації загального холестерину відбувається внаслідок підвищення у 3–4 рази частки саме вільного холестерину, причому концентрація ефірів холестерину відповідає контрольному рівню.
Для Апо А-вміщуючих ліпопротеїнів досліджуваних пацієнтів визначили двократне збільшення рівня загального холестерину та патологічний характер його перерозподілу поміж фракціями вільного і етерифікованого стеролу. А саме встановлено збільшення у 2,7 раза вмісту ефірів холестерину та зменшення у 2,2 раза частки вільного холестерину. Наявний дефіцит вільного холестерину у ліпідному складі Апо А-вміщуючих ліпопротеїнів може слугувати однією з причин пригнічення ЛХАТ активності через нестачу субстрату реакції етерифікації.
Лікування аторвастатином протягом 3 місяців обумовило зменшення концентрації вільного холестерину та зростання ЛХАТ активності навіть понад контрольний показник у сироватці крові обстежених пацієнтів (табл. 1). Це, насамперед, спричинено динамікою вільного холестерину у ліпідному складі Апо В- і Апо А-вміщуючих фракцій ліпопротеїнів. Дані табл. 2 ілюструють підвищення майже у 4 рази субстрату реакції етерифікації в апоА-ЛП і зменшення у 2,2 рази вільного стеролу в апоВ-ЛП, що можна трактувати як антиатерогенні зміні під впливом інгібітору синтезу холестерину у цих хворих. Етерифікована форма холестерину в складі ЛП фракцій також зазнала змін: уміст ефірів холестерину в Апо А-ЛП зменшився у 4 рази, в Апо В-ЛП зріс у 1,4 раза за дією аторвастатину. Зауважені особливості можуть характеризувати відновлення функціонування системи білків, що переносять ефіри холестерину від Апо А-ЛП, де вони утворюються, до Апо В-ЛП, а саме до ліпопротеїнів низької щільності.
На Апо В-вміщуючі ЛП інгібітор синтезу холестерину мав нормалізуючу дію. А саме знижував рівень вільного холестерину та підвищував концентрацію ефірів холестерину в ліпідному складі цих ліпід-білкових комплексів. Але рівень загального холестерину в Апо В-ЛП не зазнавав змін за дію аторвастатину.
Отже, у дослідженні вивчені ключові ланки впливу аторвастатину у пацієнтів із наслідками мозкового інсульту і зазначена його нормалізуюча дія на обмін холестерину.
Аторвастатин (10 мг на добу протягом 3 місяців) сприяв зниженню вмісту вільного холестерину та підвищенню ЛХАТ активності у сироватці крові пацієнтів із наслідками ішемічного інсульту.
У фракції Апо В-вміщуючих ліпопротеїнів за умов дії інгібітору синтезу холестерину концентрація загального холестерину не змінювалася, проте спостерігали перерозподіл фракцій стеролу антиатерогенного характеру: у 2 рази зменшувався вміст вільного холестерину та натомість збільшувалася частка ефірів холестерину.
Суттєве (у 2 рази) зменшення вмісту загального холестерину в Апо А-вміщуючих ліпопротеїнах під впливом аторвастатину в першу чергу завдячує 5-кратному зменшенню ефірів холестерину, що не компенсувало збільшення вмісту вільного холестерину в складі ЛВЩ.
Незважаючи на те, що дослідження проведене на невеликій кількості хворих, воно продемонструвало ефективний вплив аторвастатину на показники ліпідного спектра крові та перспективу його застосування у вторинній профілактиці мозкового інсульту. Необхідно і надалі проводити дослідження у цій галузі, на більшій кількості хворих.
1. The Scandinavian Simvastatin Survival Study group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S) // Lancet. — 1994. — Vol. 344. — P. 1383-1389.
2. Sever P., Dahlof B., Poulter N. et al. Prevention of coronary and stroke events w atorvastatin in hypertensive patients who have average or lower then average cholesterol concentration in the Anglo-Scandinavian cardiac outcomes trial — Liv Lowering arm (ASCOT-LLA): a multicentre randomized controlled trial // Lancet. — 2003. — Vol. 361. — P. 1149-1158.
3. Blankenhom D.H. MARS Research Group: Coronary angiographic changes with lovastatin therapy: The Monitored Atherosclerosis Study (MARS) // Ann Intern Med. — 1993. — Vol. 119. — P. 969-976.
4. Shepherd J., Blauw G., Murphy M. et al. Pravastatin in elderly individuals at risk vascular disease (PROSPER) a randomized controlled trial // Lancet. — 2002. — Vol. 360. — P. 162-163.
5. АНА/АСС Guidelines for Secondary Prevention for Patients With Coronary and Other Atherosclerotic Vascular Diseases: 2006 // Update JACC. — 2006. — Vol. 47. — P. 2130-2139.
6. ESC Guidelines for the Management of Stable Angina Pectoris // Eur Heart J. — 2006. — Vol. 27. — P. 1341-1381.
7. European guidelines on cardiovascular disease prevention in clinical practice. The Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice // Eur. Heart J. — 2003. — Vol. 24. — P. 1601-1610.
8. Expert panel on detection, evaluation, and treatment of high blood cholesterol in adult. Executive summary of the third report of National Cholesterol Education Program (NCEPT) expert panel on detection, evaluation, and treatment of high blood cholesterol in adult (Adult Treatment Panel III) // JAMA. — 2001. — Vol. 285. — P. 2486-2497.
9. Sacco R.L., Adams R., Albert M.J., Benavente O., Furie K., Kelly M., Schwamm L.H., Tomsick T. et al. American Heart Association; American Stroke Association Council on Stroke; Council on Cardiovascular Radiology and Intervention; American Academy of Neurology; Guidelines for prevention of stroke in patients with ischemic stroke and transient ischemic attack: A statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke // Stroke. — 2006. — Vol. 37. — P. 577-617.
10. Ebrahim S., Sung J., Song M., Ferrer R., Lawlor D., Smith G. Serum cholesterol, haemorragic stroke, ischemic stroke, and myocardial infarction: Korean national health system prospective cohort study // BMJ. — 2006. — Vol. 333. — P. 22-25.
11. Prospective Studies Collaboration. Cholesterol, diagnostic blood pressure, and stroke: 13000 strokes in 450 000 people in 45 рprospective cohorts // Lancet. — 1995. — Vol. 346. — P. 1647-1653.
12. Collins R., Armitage J., Parish S., Sleight P., Peto R. Heart Protection Study Collaborative Group. Effects on cholesterol lowering with simvastatin on stroke and other major vascular events in 20 536 people with cerebrovascular disease or other high risk conditions // Lancet. — 2004. — Vol. 363. — P. 757-767.
13. Cholesterol Treatment Collaboration, Efficacy and safety of cholesterol-lowering treatment; prospective meta-analysis of data from 90056 individuals in 14 randomized trials of statins // Lancet. — 2005. — Vol. 366. — P. 1267-1278.
14. Cannon C.P., Steinberg B.A., Murphy S.A., Mega J.L., Braunwald E. Meta-analysis of cardiovascular outcomes trials comparing intensive versus moderate statin therapy // J. Am. Coll. Cardiol. — 2006. — Vol. 48. — P. 438-445.
15. Sanossian N., Saver J.L., Liebeskind D.S., Kim D., Razinia T., Ovbiagele B. Achieving target cholesterol goals after stroke: is in-hospital statin intention the key? // Arch. Neurol. — 2006. — Vol. 63. — P. 1081-1083.
16. Amarenco P., Bogousslavsky J., Callahan A., Goldslein L.B., Henncrici M., Rudolh A.E., Sillesen H. Stroke Prevention by Aggressive Reduction in Сholesterol Levels (SPARCL) Investigators. High-dose atorvastatin after stroke or transient ischemic attack // N. Engl. J. Med. — 2006. — Vol. 355. — P. 549-559.
17. Selco S., Saver J.L., Goldhaber J.L. Disability-adjusted life years: applying the World Health Organization Global Burden of Disease methodology to determine optimal secondary prevention of vascular events after stroke // Neurology. — 2005. — Vol. 64. — P. A421.
18. Аронов Д.М. Каковы результаты лечения симвастатином при длительном (более 10 лет) применении? Возникает ли толерантность к симвастатину? Каковы плейотропные эффекты статинов? // Лечащий врач. — 2001. — № 1. — С. 5-6.
19. Аронов Д.М. Каскад терапевтических эффектов статинов // Кардиология. — 2004. — № 10. — C. 85-94.
20. Барашков Г.К., Зайцева Л.И. Использование законов межэлементных взаимодействий для понимания механизмов некоторых заболеваний человека // Биомедицинская химия. — 2008. — Т. 54, № 3. — С. 266-277.
21. Никитин Ю.П. Новые фундаментальные и прикладные основы атерогенеза // Бюллетень СО РАМН. — 2006. — № 2(120). — С. 6-14.
22. Бурчинский С.Г. Новые возможности нейропротекции // Международный неврологический журнал. — 2006. — № 4. — С. 153-158.
23. Верткин А.Л., Лукашов М.И., Наумов А.В. и др. Клинико-фармаколо-гические аспекты нейропротективной терапии при острых и хронических нарушениях мозгового кровообращения // Здоров''я України. — 2007. — № 61. — С. 6-8.
