Газета «Новости медицины и фармации» Неврология (299) 2009 (тематический номер)
Вернуться к номеру
Полинейропатии в соматической практике
Авторы: О.Г. Морозова, д.м.н., профессор, Харьковская медицинская академия последипломного образования
Версия для печати
В практике врача-интерниста часто встречаются осложнения со стороны нервной системы. Среди неврологических осложнений соматических заболеваний ведущее место занимают поражения периферической нервной системы, а именно полинейропатии.
Полинейропатия на сегодняшний день рассматривается как заболевание всего организма с реализацией патологического процесса на уровне периферической нервной системы в виде множественного поражения периферических нервов. Установление нозологической принадлежности полинейропатий вызывает объективные трудности. Даже в специализированных клиниках причина остается неизвестной в 25 % случаев, не говоря уже о неспециализированных, где этиологический фактор поражения нервной системы устанавливается всего в 50 % случаев.
Существует множество классификаций полинейропатий. Полинейропатии можно классифицировать в зависимости от этиологии и патогенеза. По этиологии полинейропатии делятся на токсические, инфекционные, лекарственные, наследственные, идиопатические, соматогенные. Спектр соматических заболеваний, вызывающих полинейропатии, можно представить следующим образом:
1. Эндокринопатии:
2. Системные заболевания:
3. Метаболические расстройства:
4. Заболевания крови.
5. Полинейропатия при парапротеинемии.
6. Токсические и лекарственные болезни:
В зависимости от остроты начала и течения полинейропатии разделяют на острые, подострые и хронические. Острые развиваются в течение нескольких дней (до месяца). Как острые обычно развиваются токсические, сосудистые, аутоиммунные полинейропатии. К ним относятся:
Подострые полинейропатии прогрессируют в течение нескольких недель, до 1–2 месяцев. К хроническим относят воспалительные, метаболические и токсические полинейропатии, клиническая симптоматика которых развивается в течение нескольких месяцев или лет. Это наиболее многочисленная группа полинейропатий, к которой относятся:
Клиническая картина полинейропатий зависит от того, какие волокна вовлекаются в процесс и какие морфологические изменения в них развиваются. Как известно, существуют три типа волокон: двигательные, являющиеся толстыми миелинизированными; чувствительные (волокна, проводящие глубокую чувствительность, также толстые миелинизированные, волокна, проводящие болевую и температурную — тонкие миелинизированные и немиелинизированные); вегетативные, которые являются тонкими немиелинизированными. Морфологические изменения, возникающие при полинейропатиях, характеризуются либо демиелинизацией, либо аксональной дегенерацией, либо их сочетанием. Демиелинизация развивается при аутоиммунных процессах, в возникновении аксональной дегенерации участвуют токсико-дисметаболические, микроциркуляторные нарушения, а также нарушения энергетического метаболизма и повышение перекисного окисления липидов.
Клинические проявления
В основе клинических проявлений полинейропатий лежит сенсорно-моторно-вегетативная симптоматика. В зависимости от этиологии наблюдается преобладание каких-либо симптомов или их сочетание.
Сенсорные (чувствительные) симптомы характерны для метаболических и токсических полинейропатий и, в свою очередь, делятся на позитивные и негативные.
Негативные симптомы характеризуются гипестезией в виде «перчаток» и «носков», а также нижней части живота. Подобные симптомы чаще всего возникают при хронических воспалительных демиелинизирующих полинейропатиях, при дефиците витаминов В12 и Е, интоксикации витамином В6, при паранеопластических полинейропатиях.
К позитивным симптомам относятся:
Появление позитивных симптомов связано с регенерацией аксональных отростков. При поражении волокон, проводящих глубокую чувствительность, развивается сенситивная (чувствительная) атаксия, характеризующаяся шаткостью при ходьбе, которая усиливается в темноте и при закрытых глазах.
Двигательные симптомы преобладают при синдроме Гийена — Барре, дифтерийной, свинцовой, паранеопластической, диабетической полинейропатиях, а также наследственной полинейропатии Шарко — Мари — Тута.
Негативные симптомы при этом характеризуются периферическим (вялым) тетрапарезом, начинающимся со стоп. Иногда в процесс вовлекаются мышцы туловища, шеи, краниобульбарная мускулатура или развивается бибрахиальный паралич (при порфирийной, свинцовой, амилоидной, паранеопластической полинейропатиях, ХВДП, синдроме Гийена — Барре). Максимальное развитие гипотрофии наблюдается к концу 3–4-го месяца.
Появление позитивных двигательных симптомов также связано со спонтанной эктопической генерацией нервных импульсов вследствие регенерации. К позитивным двигательным симптомам относятся: нейромиотония, фасцикуляции, миокимии, крампи, синдром беспокойных ног.
Вегетативные симптомы, появляющиеся в результате поражения вегетативных волокон, можно разделить на висцеральные, вегетативно-вазомоторные и вегетативно-трофические.
Висцеральные симптомы появляются вследствие развития автономной полинейропатии (диабетической, порфирийной, амилоидной, алкогольной и других токсических полинейропатий, а также синдрома Гийена — Барре). Среди висцеральных симптомов выделяют кардиальные (ортостатическая гипотензия, фиксированный пульс и т.п.), урогенитальные (сфинктерные дисфункции, импотенция), гастроинтестинальные (нарушение моторики желудочно-кишечного тракта), респираторные нарушения; нарушения потоотделения; зрачковых реакций; терморегуляции.
К вегетативно-трофическим относятся деформация ногтей, истончение кожи, образование язв и развитие нейроартропатий Шарко.
Вегетативно-вазомоторные симптомы характеризуются изменением температуры кожных покровов кистей и стоп, их отечностью, «мраморной» окраской.
Наиболее часто врачам соматического профиля приходится иметь дело с диабетической полинейропатией или нейропатией, которая является одним из наиболее распространенных осложнений сахарного диабета. Так, по данным эпидемиологических исследований, в зависимости от используемых методов обследования частота развития диабетической нейропатии при сахарном диабете варьирует от 5 до 100 %. Различия в частоте встречаемости диабетической нейропатии обусловлены использованием различных критериев ее диагностики. Основным фактором риска развития нейропатии является декомпенсация сахарного диабета. В ходе исследования DCCT (Diabetes Control and Complications Trial) было продемонстрировано, что достижение компенсации сахарного диабета с начала заболевания снижает риск развития диабетической нейропатии на 69 %, а обеспечение компенсации сахарного диабета на любом этапе заболевания — на 57 %. Развитие диабетической полинейропатии повышает смертность больных сахарным диабетом, в основном за счет кардиальной автономной нейропатии и косвенно — из-за осложнений, в частности синдрома диабетической стопы и его последствий. Нейропатия становится причиной 50–75 % всех нетравматических ампутаций при сахарном диабете.
Поражение периферических нервов при сахарном диабете имеет свои особенности по сравнению с другими соматическими нейропатиями. Так, при сахарном диабете кроме множественного поражения периферических нервов наблюдаются также мононейропатии. Поэтому хотелось бы остановиться подробнее на их клинических особенностях, так как именно они иногда позволяют, с одной стороны, заподозрить этиологию заболевания, а с другой — связать подобные неврологические осложнения именно с сахарным диабетом.
Клиническая классификация диабетической нейропатии
(Sima A.A.F., Thomas P.K., Ishii D. et al. Diabetic neuropathies // Diabetologia. — 1997. — 40(Suppl.). — B74B77; Thomas P.K. Classification, differential diagnosis and staging of diabetic peripheral neuropathy // Diabetes. — 1997. — 46(Suppl.). — S54S57)
Возвратная нейропатия
Полинейропатия
Очаговая нейропатия
Смешанные формы
Возвратная нейропатия обычно развивается на фоне гипергликемии, которая связана с декомпенсацией сахарного диабета. Сопровождается развитием неврологической симптоматики и транзиторными нарушениями проводимости по нервным волокнам — это так называемая транзиторная, или возвратная, нейропатия. Как правило, такое состояние является преходящим и его клиническая симптоматика купируется после достижения стойкой компенсации углеводного обмена, однако развитие возвратной нейропатии может рассматриваться в качестве критерия риска развития других форм нейропатии.
Дистальная симметричная полинейропатия представляет собой самую распространенную форму диабетических нейропатий и характеризуется комбинированным поражением периферических сенсорных, моторных и вегетативных нервных волокон. В первую очередь в патологический процесс вовлекаются наиболее длинные нервные волокна, что и объясняет топическую локализацию первых клинических симптомов в области стоп. При прогрессировании процесса симптомы возникают в более проксимальных отделах. Обычно поражаются сенсорные нервные волокна как малого, так и большого диаметра. Однако в большинстве случаев имеет место более раннее поражение нервных волокон малого диаметра. Поражение тонких сенсорных нервных волокон проявляется снижением или потерей температурной и болевой чувствительности, что в значительной мере повышает риск травматизации стоп и развития синдрома диабетической стопы. Как правило, пациенты предъявляют жалобы на парестезии, чувство зябкости, жжения, острые, колющие боли в области стоп. Дегенеративные изменения толстых сенсорных нервных волокон ведут к снижению или потере глубокой чувствительности. Кроме того, отмечается ослабление сухожильных рефлексов и замедление скорости передачи нервного импульса. При сенсорной полинейропатии больные часто отмечают онемение, чувство покалывания, иногда ощущение наличия инородного тела в области стоп.
Острая болевая нейропатия представляет собой разновидность дистальной сенсорной полинейропатии и характеризуется наличием выраженного болевого синдрома. Пациенты предъявляют жалобы на чувство жжения, колющие, режущие боли в области стоп, часто можно обнаружить гиперестезию (повышенная чувствительность к тактильным раздражителям), аллодинию (резкие болезненные ощущения, вызываемые обычными тактильными раздражителями, например прикосновением), наличие симптома простыни. Для болевого синдрома типично усиление в покое (особенно в ночное время) и ослабление днем, при физической нагрузке. Сон, как правило, нарушен из-за выраженности болевого синдрома. Пациенты часто вынуждены принимать большие дозы обезболивающих препаратов, седативных и снотворных средств. В большинстве случаев при неврологическом обследовании обнаруживается умеренное или незначительное снижение температурной чувствительности при сохранении глубоких сухожильных рефлексов, вибрационной и тактильной чувствительности, а также нормальной скорости проведения импульса по нерву. Острая болевая полинейропатия обычно развивается при декомпенсации сахарного диабета, ее течение в значительной степени улучшается при достижении компенсации углеводного обмена. Следует, однако, отметить, что быстрое снижение показателей гликемии зачастую может спровоцировать ее манифестацию.
Поражение моторных (двигательных) нервных волокон бывает, как правило, умеренным и характерно в основном для дистальных отделов нижних конечностей. При этом развивается атрофия мелких мышц стопы, происходит перераспределение тонуса между сгибателями и разгибателями пальцев, что выражается в атрофии межкостных мышц, развитии молоточкообразной деформации пальцев стоп. Вторичные осложнения диабетической полинейропатии представляют наибольшую угрозу; основным из них является развитие синдрома диабетической стопы. Снижение периферической чувствительности повышает риск развития язвенных дефектов стоп в 7 раз.
Вегетативная (висцеральная) нейропатия. Довольно часто при сахарном диабете наблюдается поражение вегетативной нервной системы. Так, при впервые выявленном сахарном диабете 2-го типа частота развития той или иной формы вегетативной нейропатии достигает 40 %. При 10-летней длительности сахарного диабета 2-го типа признаки дисфункции парасимпатического отдела вегетативной нервной системы отмечаются у 65 % пациентов. Комбинированное поражение парасимпатического и симпатического отделов обнаруживается в 15,2 % случаев. Основным фактором, способствующим развитию и прогрессированию автономной нейропатии, является хроническая гипергликемия.
Клинические характеристики вегетативной (автономной) полинейропатии
Кардиальная форма
Гастроинтестинальная форма
Урогенитальная форма
Респираторные нарушения
Нарушения терморегуляции
Нарушение работы потовых желез (судомоторная нейропатия — гипер-/ангидроз конечностей, гипергидроз лица, шеи, верхней части туловища, вызванный приемом пищи, ночная потливость, не связанная с гипогликемией)
Вазомоторные нарушения (вазоконстрикция/вазодилатация, нейропатические отеки)
Нарушение зрачковых реакций (расширение зрачка, ослабление реакции на средства, расширяющие зрачок)
Нейроэндокринные нарушения
Нарушение распознавания гипогликемии (нарушение регуляции выброса контринсулярных гормонов)
Нарушение секреции панкреатических пептидов, соматостатина, мотилина, гастрина
Снижение высвобождения норадреналина (индуцированное ортостазом/физическими нагрузками)
Повышение уровня предсердного натрийуретического гормона
Наиболее опасными являются кардиальная вегетативная нейропатия (безболевой острый инфаркт миокарда, синдром внезапной смерти) и поражение периферических вегетативных нервных волокон, приводящее к атрофическим изменениям кожи нижних конечностей, нарушениям микроциркуляции, остеоартропатии, способствующим развитию синдрома диабетической стопы и последующей ампутации.
Проксимальная моторная нейропатия встречается менее часто и требует дифференциальной диагностики с миопатическим синдромом, поскольку основой проксимальной моторной нейропатии является развитие феморальной нейропатии или сакральной плексопатии, главное клиническое проявление которых — амиотрофия. Амиотрофия характерна для мужчин, страдающих сахарным диабетом 2-го типа. Пик заболеваемости приходится на 50–60 лет, причем эта форма часто сопровождается значительной потерей массы тела и декомпенсацией сахарного диабета. Пациенты обычно предъявляют жалобы на боли в области бедренных мышц (симметричные и асимметричные), мышечную слабость, атрофию мышц бедренной группы, затруднение при вставании со стула и подъеме по лестнице.
Среди мононейропатий наиболее характерны краниальные мононейропатии. Чаще других поражается глазодвигательный нерв. При этом отмечается нарушение движения глазного яблока, опущение века, часто присутствует болевая симптоматика (фронтальные и/или периорбитальные боли с последующим развитием диплопии). Также могут поражаться отводящий нерв (нарушение отведения глазного яблока латерально) и лицевой (так называемый паралич Белла). Развитие краниальных мононейропатий сопутствует декомпенсации сахарного диабета. Как правило, при компенсации сахарного диабета они самостоятельно разрешаются в течение 2–3 месяцев. Помимо краниальных мононейропатий выделяют торакоабдоминальную и компрессионные (так называемые туннельные) мононейропатии.
Торакоабдоминальная нейропатия (радикулопатия) представляет собой довольно редкое осложнение сахарного диабета, развивающееся исключительно у лиц пожилого возраста. В основе патогенеза радикулопатии лежит окклюзия vasa nervorum. Торакоабдоминальная нейропатия проявляется болевым синдромом и выпадением чувствительности в определенном дерматоме, что свидетельствует о поражении соответствующего корешка спинного мозга. В данной ситуации важно проведение дифференциальной диагностики с висцеральными болями, в частности с кардиалгиями. Для торакоабдоминальной нейропатии характерны четкая локализация болевого синдрома и нарушение чувствительности в пределах пораженного дерматома. При этой форме диабетической нейропатии возможно также поражение моторных нейронов, которое выражается в локальной слабости мышц передней брюшной стенки.
Компрессионные мононейропатии встречаются у больных СД значительно чаще, чем в общей популяции. Наиболее характерным является развитие карпального (компрессия n.medianus) и тарзального (компрессия n.tibialis) туннельных синдромов, реже встречается локтевой туннельный синдром (компрессия
Синдром тарзального канала — вторая по частоте развития форма туннельной нейропатии — обусловлен компрессией большеберцового нерва. Ведущий клинический симптом — боль в области подошвы и пальцах стопы во время ходьбы или преимущественно в ночное время. Довольно часто, особенно у пациентов с избыточной массой тела, встречается нейропатия латерального кожного нерва бедра, известная также как meralgia paraesthetica. Клиническая картина сводится к онемению, чувству жжения, реже анальгезии в зоне иннервации (передненаружная поверхность средней трети бедра); симптоматика ослабевает при сгибании бедра. Снижение массы тела способствует ослаблению натяжения нерва и исчезновению клинических проявлений данного синдрома.
Основой лечения туннельных нейропатий является достижение компенсации сахарного диабета. При сохранении симптоматики показано местное введение глюкокортикоидов.
Диагностика полинейропатий и их генеза
Алгоритм диагностики включает следующие этапы:
Неврологический диагноз является прежде всего синдромальным. Устанавливается по преобладанию клинических признаков (сенсорные, моторные, вегетативные) и по распределению поражения (симметричное — асимметричное, проксимальное — дистальное). Важен также характер течения заболевания (острое, подострое, хроническое). Эти положения важны как для предположения об этиологии, так и для адекватной терапии.
В диагностике важное значение приобретает дифференциация аксональных и демиелинизирующих полинейропатий (аксонопатий и миелинопатий). Это имеет значение как для адекватного лечения, так и для прогноза.
Дифференциально-диагностические критерии основываются на следующих положениях:
— электронейромиографические критерии: резкое снижение скорости проведения импульса по нерву и снижение амплитуды М-ответа при миелинопатиях в отличие от незначительного снижения скорости проведения импульса и неизмененной амплитуды М-ответа при аксонопатиях;
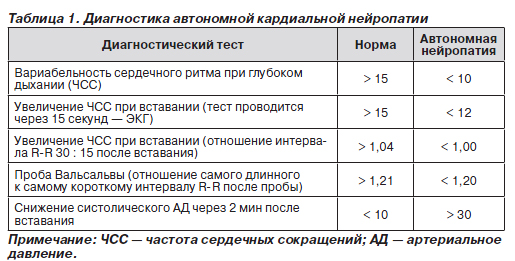
Особо хотелось бы обратить внимание на необходимость обследования на предмет вегетативно-висцеральной нейропатии всех больных сахарным диабетом. Это связано с риском развития кардиальной нейропатии, приводящей к аритмии, а также внезапной смерти. Для диагностики кардиальной нейропатии необходимо проведение ряда диагностических тестов (табл. 1).
Принципы терапии
При лечении соматогенно обусловленных нейропатий необходимо придерживаться следующих принципов:
1. Этиологическая терапия, направленная на лечение основного заболевания, вызвавшего поражение периферических нервов.
2. Патогенетическая терапия, направленная на коррекцию основных механизмов, приводящих к развитию нейропатий. Учитывая все механизмы патогенеза, целесообразно использование антиоксидантов (наиболее целесообразным является применение с этой целью препаратов альфа-липоевой кислоты, таких как Эспа-липон, Тиоктацид). Внедрение в практику препаратов альфа-липоевой кислоты стало новым этапом в лечении прежде всего диабетической нейропатии, так как оказалось, что они обладают кроме антиоксидантного инсулиноподобным эффектом. Кроме того, альфа-липоевая кислота способствует восстановлению оболочки нервного волокна при миелинопатиях и соответственно восстановлению проводимости импульса по нервному волокну. Пациентам с диабетической нейропатией Эспа-липон назначается в дозе 600–1200 мг/сутки в/в капельно на 100–200 мл физраствора в течение 2–4 недель, а затем рекомендуется переход на таблетированный прием Эспа-липона по 600 мг/сутки в течение 1–2 месяцев.
Второе направление — улучшение гемодинамики в структурах нервной системы (в том числе микроциркуляции), способствующее уменьшению гипоксии и нормализации энергетического метаболизма. С этой целью целесообразным является использование препарата актовегин, применение которого наиболее актуальным становится при диабетических нейропатиях. Это связано с тем, что механизм действия актовегина заключается не только в оптимизации энергетического метаболизма и улучшении микроциркуляции, но и в инсулиноподобном действии, способствующем снижению уровня гликемии. Существуют различные схемы назначения актовегина при нейропатиях. В остром периоде независимо от генеза актовегин применяется в виде внутривенно-капельных введений 10% раствора 5–10 раз (индивидуально) до уменьшения клинических симптомов, затем перорально по 200 мг дважды в сутки в течение месяца. При диабетической нейропатии рекомендовано применение актовегина внутрь по 600 мг (по 1 таблетке трижды в сутки) или внутривенно-капельно (1000–2000 мг в сутки) до заметного уменьшения выраженности клинических симптомов и возрастания скорости проведения импульса, затем внутрь по 200 мг трижды в сутки в течение 2–3 месяцев. Через 3 недели после лечения отмечается увеличение скорости проведения импульса по нервным волокнам, а также амплитуды на электромиограмме. В каждом конкретном случае доза актовегина может быть индивидуальной.
3. Симптоматическая терапия, основу которой составляет коррекция болевого синдрома, особенно актуальна при диабетической нейропатии. Лечение нейропатической боли представляет собой трудную задачу. Для купирования нейропатической боли в настоящее время применяются местные анестетики (блокатор быстрых натриевых каналов — лидокаин), опиоидные анальгетики (так как простые анальгетики и нестероидные противовоспалительные препараты менее эффективны), антиконвульсанты. Ранее наиболее широко с этой целью использовались карбамазепины, при назначении которых следует помнить о необходимости контроля картины крови, показателей печеночных ферментов. На сегодняшний день более перспективным считается габапентин. Препарат крайне редко вызывает побочные реакции, необходимо лишь помнить о снижении дозы у пожилых пациентов в связи с замедлением выведения препарата из организма. Его эффективность при разных формах нейропатического синдрома подтверждена в рандомизированных двойных слепых плацебо-контролируемых исследованиях. В комплексном лечении болевого синдрома могут использоваться также антидепрессанты, прежде всего трициклические. При этом необходимо помнить о том, что трициклические антидепрессанты не следует назначать при вегетативно-висцеральных (кардиальных) нейропатиях, сердечно-сосудистой недостаточности, нарушениях внутрисердечной проводимости, обструктивных заболеваниях мочеполового тракта, ортостатической гипотензии, глаукоме. Сочетание антидепрессантов с габапентином усиливает эффект терапии.
4. Восстановительная терапия включает в себя препараты, способствующие ремиелинизации: препараты альфа-липоевой кислоты (Эспа-липон и др.); витамины группы В (нейробион, неуробекс и др.); антихолинэстеразные препараты, улучшающие проведение нервного импульса.
1. Болевые синдромы в неврологической практике / Под ред. А.М. Вейна. — М., 2001. — 265 с.
2. Данилов А.Б. // Клиническая фармакология и терапия. — 2004. — № 4. — С. 57-60.
3. Демиденко Т.Д., Ермакова Н.Г. Основы реабилитации неврологических больных. — СПб.: Фолиант, 2004. — 304 с.
4. Дубенко Е.Г. Применение актовегина и инстенона при заболеваниях периферической нервной системы // Актовегин в неврологии. — М., 2002. — С. 165-166.
5. Ефимов А., Зуева Н., Скробонская Н. Диабетическая невропатия // Ліки України. — 2005. — № 4. — С. 37-40.
6. Маньковский Н.Б. Оптимизация медикаментозного лечения диабетической нейропатии // Здоров''я України. — 2007. — № 8. — С. 58.
7. Новикова О.В. Невропатическая боль: основные аспекты патогенеза и лечения (обзор) // Міжнародний неврологічний журнал. — 2006. — № 5. — С. 120-122.
8. Anand P., Terenghi G., Warner G. et al. The role of endogenous nerve growth factor in human diabetic neuropathy // Nature Med. — 1996. — 2. — 703-7.
9. Diabetes Control and Complications Trial (DCCT) Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus // N. Engl. J. Med. — 1993. — 329. — 977-86.
10. Thomas P.K. Classification, differential diagnosis, and staging of diabetic peripheral neuropathy // Diabetes. — 1997. — 46(suppl. 2). — S54-7.
11. Toyry J.P., Niskanen L.K., Mantysaari M.J. et al. Occurrence predictors and clinical significance of autonomic neuropathy in NIDDM: Ten year follow-up from diagnosis // Diabetes. — 1996. — 45. — 308-15.
12. Ziegler D. Alpha-lipoic acid in the treatment of diabetic polyneuropathy in
