Газета «Новости медицины и фармации» Гастроэнтерология (304) 2009 (тематический номер)
Вернуться к номеру
Оптимізація лікування гастроезофагеального рефлюксу при хронічному панкреатиті
Авторы: Н.Б. Губергріц, І.В. Василенко, О.М. Агібалов, П.Г. Фоменко, О.О. Голубова, А.А. Ачкасова, Донецький національний медичний університет ім. М. Горького, Центральна міська клінічна лікарня № 1 м. Донецька, Україна
Версия для печати
Хвороби органів травлення належать до патології, при якій довготривалий латентний перебіг зумовлює певні труднощі в їх діагностиці і своєчасному призначенні лікування на ранній стадії. За даними вітчизняної та зарубіжної літератури, кількість хворих із цими захворюваннями продовжує зростати [50, 52].
Хвороби підшлункової залози (ПЗ) за своєю поширеністю, складністю діагностики та недостатньою ефективністю терапії займають особливе місце серед проблем гастроентерології [18, 33, 34, 54, 56, 86, 89]. Панкреатити, в тому числі хронічний панкреатит (ХП), за поширеністю, зростанням захворюваності, тимчасовою втратою працездатності та через інвалідизацію є важливою соціальною та економічною проблемою сучасної медицини [72, 81]. За останні 30 років відзначено загальносвітову тенденцію до підвищення рівня захворюваності на гострий і хронічний панкреатит більше ніж у 2 рази [12, 37, 57, 66, 84].
У розвинутих країнах панкреатити помітно «помолодшали»: середній вік з моменту встановлення діагнозу знизився з 50 до 39 років, серед захворілих на 30 % збільшилася частка жінок [17, 28]; ХП почали діагностувати у дітей і підлітків [19, 35]. Первинна інвалідизація хворих сягає 15 % [76].
Проблема хвороб ПЗ дуже актуальна і в нашій країні. В останні роки простежується низка характерних особливостей, таких як зростання кількості випадків захворювань з первинно хронічним перебігом і частими загостреннями, «помолодшання» хворих, висока частота поєднання патології, випадків медикаментозної резистентності та ін. За останнє десятиліття показники поширеності хвороб ПЗ і захворюваності на них значно підвищилися, а їх велика питома вага в загальній структурі хвороб органів травлення (10,5 %) визначає клінічну і соціальну значимість. Слід підкреслити, що смертність та інвалідизація від цієї патології в Україні займає друге місце після цирозу печінки [13, 15, 50].
Важливими в клінічному і соціальному плані є такі особливості ХП, як прогресуючий перебіг із поступовим зростанням зовнішньосекреторної недостатності ПЗ і розвитком трофологічної недостатності, персистенція болю і диспептичного синдрому, необхідність дотримання дієти, постійного, аж до довічного приймання ферментних препаратів [2, 28, 36, 39, 42, 41, 45].
ХП характеризується значним порушенням якості життя [8]. Під час рецидивуючого перебігу ХП в 30 % випадків розвиваються ранні ускладнення, летальність при цьому досягає 5,1 % [51, 57, 88, 92].
Летальність після первинного встановлення діагнозу ХП становить до 20 % протягом перших 10 років і понад 50 % — через 20 років [16, 23, 51, 61, 79]. 15–20 % хворих на ХП гинуть від ускладнень, що пов''язані з атаками панкреатиту, інші — внаслідок вторинних порушень травлення й інфекційних ускладнень [14, 27, 100].
Доведено, що ХП — передракове захворювання [83]. Так, двадцятирічний анамнез у хворого на ХП підвищує ризик розвитку раку ПЗ в 5 разів [61, 73, 74, 75, 77, 97], причому аналіз статистичних даних в США виявив, що паралельно зі зростанням захворюваності на ХП відмічено збільшення смертності від раку ПЗ в 3 рази [62, 82].
Чимало у проблемі ХП до цих пір є невирішеного. Зокрема, великі труднощі для практичного лікаря являє собою курація хворих з поєднанням ХП й інших внутрішніх хвороб [67]. Вважається, що поєднана патологія є наслідком впливу урбанізації, надмірної індустріалізації, забруднення довкілля ксенобіотиками, рукотворних змін клімату, поглиблення соціального розшарування суспільства, безпрецедентної інтенсивності міграційних процесів, нездорового способу життя [44, 55, 58, 65].
Гастроезофагеальна рефлюксна хвороба (ГЕРХ) — також одне з найпоширеніших серйозних захворювань органів травлення, здатне, як і ХП, значно погіршити якість життя хворих через прогресування. ГЕРХ призводить до розвитку небезпечних ускладнень, у тому числі стравоходу Барретта, а пізніше й аденокарциноми стравоходу [8, 60]. ГЕРХ у загальній популяції зустрічається в 20,0 % випадків і має тенденцію до зростання поширеності [6, 7, 9].
Поєднання ХП із ГЕРХ здається нам абсолютно закономірним, заснованим на патогенезі обох захворювань. Механізми, що призводять до розвитку комбінації ХП і гастроезофагеального рефлюксу (ГЕР), описані в наших минулих публікаціях [25]. У хворих на ХП розвивається зовнішньосекреторна недостатність ПЗ різного ступеня. При недостатності ПЗ будь-якого ступеня внаслідок дефіциту панкреатичних ферментів хімус затримується в дуоденальному просвіті, щоб гідроліз нутрієнтів досяг необхідного ступеня. Тобто, дефіцит ферментів ПЗ при легкій панкреатичній недостатності компенсується подовженням часу перебування хімусу в дванадцятипалій кишці (ДПК). За більш тривалий період часу хімус усе ж таки отримує необхідну кількість ферментів ПЗ, і гідроліз нутрієнтів відбувається повною мірою, але за рахунок дуоденостазу. Дуоденостаз, у свою чергу, неминуче призводить до дуоденальної гіпертензії. Якщо у пацієнта має місце помірна або тяжка зовнішньосекреторна недостатність ПЗ, то дуоденостаз і дуоденальна гіпертензія стають більш вираженими і не можуть бути компенсованими власними можливостями панкреатичної секреції, а тільки призначенням ферментних препаратів [20]. Зрозуміло, що через тривалий дуоденостаз страждає слизова ДПК, зменшується продукція секретину і холецистокініну цієї слизової, що призводить до ще більш вираженого зниження панкреатичної секреції [5, 29]. Дуоденальна гіпертензія спочатку є компенсованою, тобто прихованою, потім трансформується і стає ізольованою, коли підвищений тиск у просвіті ДПК компенсується розтягуванням її стінок і не поширюється через воротар у шлунок. Однак під час переходу дуоденальної гіпертензії у другу — субкомпенсовану — стадію підвищений тиск ДПК «шукає виходу» і «скидається» у шлунок. Результатом цього «скидання» є рефлюкс-гастрит. Дальшим етапом «скидання» підвищеного тиску в просвіті шлунка і ДПК є розвиток гастроезофагеального або дуоденогастроезофагеального рефлюксів. Отже, при панкреатичній недостатності формується своєрідна вторинна або симптоматична ГЕРХ. Можливе «скидання» підвищеного тиску з ДПК не тільки у шлунок і стравохід, але й через фатерів сосок у холедох і вірсунгову протоку. Дуоденобіліарний і дуоденопанкреатичний рефлюкси надзвичайно небезпечні через формування лізолецитину при контакті дуоденального вмісту з лецитином жовчі та через активацію ентерокіназою панкреатичних ферментів усередині ПЗ.
Можливий і зворотний хід подій, коли у пацієнта має місце первинна ГЕРХ. Як відомо, ГЕРХ є кислотозалежним захворюванням, тобто, як правило, супроводжується підвищеною шлунковою секрецією. При цьому відбувається закисання просвіту не тільки стравоходу, але й ДПК [80]. Результатом є надлишкова секретинова стимуляція ПЗ, тобто її постійне «підстьобування», що рано чи пізно призводить до так званого реактивного, а потім і до повноцінного ХП [20, 67]. Закисання дуоденального просвіту і само по собі сприяє преципітації жовчних кислот, а отже, заважає реалізації дії панкреатичної ліпази (ліпаза тільки сумісно з жовчними кислотами може повноцінно гідролізувати жири) [20, 40]. Це механізм формування вторинної (гастрогенної) панкреатичної недостатності через підвищення шлункової секреції. Закисання просвіту ДПК, особливо якщо це поєднується з інфекцією Helicobacter pylori, викликає дуоденіт, до складу якого входить і набряк фатерова соска, тобто папіліт. Папіліт — загроза для ПЗ, бо за наявності набряклого фатерова соска легко порушується відтік панкреатичного секрету [31]. Це ще один патогенетичний шлях формування ХП і подальшої панкреатичної недостатності. Надалі — той самий дуоденостаз і той самий механізм розвитку вторинної ГЕРХ [12, 30, 49].
Слід урахувати і ще одну ланку замкненого патогенетичного кола зв''язку між ХП і кислотозалежними захворюваннями. Через виражену зовнішньосекреторну недостатність ПЗ у хворих на ХП знижується продукція панкреатичних бікарбонатів, що, у свою чергу, призводить до посилення закисання дуоденального просвіту і підсилення таких механізмів, що провокують збільшення вираженості ХП.
Безумовно, лікування поєднання ХП і ГЕРХ потребує призначення двох принципових препаратів: антисекреторного і ферментного. Антисекреторний препарат буде «бити» одночасно по кількох ланках патогенезу поєднаної патології. Ферментний препарат повинен бути обов''язково як високоактивним, так і мати надійну кислотостійку оболонку або містити кислотостійкі ферменти, щоби вони не «згоріли» в умовах підвищеної шлункової секреції.
Вважаємо важливим вказати на необхідність диференційованої терапії ГЕР, що розвивається при гіперферментемічному і гіпоферментному панкреатитах. Для визначення патогенетично-функціонального варіанта ХП необхідно враховувати таке. При пошкодженні ацинарних клітин ферменти, що знаходяться в них, потрапляють в інтерстиціальну рідину, потім у лімфу, кров, а пізніше з''являються в сечі. Панкреатичні ферменти проникають у кров також із секреторних ходів і проток ПЗ. Крім того, відбувається всмоктування ферментів у проксимальних відділах тонкої кишки. Тобто підвищення рівня панкреатичних ферментів у крові й сечі може бути пов''язане з деструкцією ацинарних клітин (аутоліз через гострий панкреатит, атаку ХП, травми, кісти ПЗ, розпад пухлини та ін.) або з підвищенням внутрішньопротокового тиску (обструктивний панкреатит, перешкода відтоку секрету пухлиною, каменем та ін.). Такі захворювання ПЖ називають гіперферментемічними, оскільки вони супроводжуються феноменом «відхилення» ферментів у кров. Цей термін заснований на тому, що при зростанні активності ферментів у крові (сечі) вони, як правило, в меншій кількості потрапляють у ДПК, тобто «відхиляються» від звичайного шляху екскреції. Іноді замість терміну «гіперферментемічний» застосовують спрощений (хоча він не є, точно кажучи, правильним) термін «гіперферментний панкреатит». При муковісцидозі, великих пухлинах, кістах ПЗ, пізніх стадіях ХП, коли деструкція паренхіми є мінімальною, але домінує зменшення кількості або атрофія ацинарної тканини, настає декомпенсація екзокринної функції органа, і вона знижується — зменшується продукція ферментів і їх рівень у крові та дуоденальному вмісті. Такі захворювання називають гіпоферментними.
Кінець кінцем, саме зрозуміння того, яке захворювання у пацієнта — гіперферментемічний або гіпоферментний панкреатит, і визначає вибір лікувальної тактики. Слід відзначити: ми виходили з того, що панкреатит — єдине захворювання, яке має лише дві фази свого перебігу: гострий панкреатит, загострення ХП (гіперферментемічна фаза), потім пізні стадії ХП (гіпоферментна фаза). Саме такий підхід прийнятий у світовій літературі.
ГЕР розвивається переважно при гіпоферментному ХП, бо саме в цьому випадку формується дуоденостаз через зовнішньосекреторну недостатність ПЗ (див. вище). Призначення традиційних для ГЕРХ інгібіторів протонної помпи (ІПП) за цих умов недоцільне з кількох точок зору. ІПП значно пригнічують шлункову секрецію і, отже, суттєво гальмують секретинову стимуляцію зовнішньої секреції ПЗ. Але при гіпоферментному панкреатиті ця секреція знаходиться на низькому рівні і зниження її ще більшою мірою неминуче призведе до посилення проявів зовнішньосекреторної недостатності ПЗ. Звичайно, можна збільшити дозу креону, але, на наш погляд, хворі на гіпоферментні панкреатити вже початково потребують адекватних, тобто достатніх у кожній конкретній ситуації доз креону, і йти шляхом посилення одного з серйозних проявів ХП із подальшою спробою лікування цього посилення недоцільно. Імовірно, більш обгрунтованим було б призначення такого засобу, який би не призводив до зростання панкреатичної недостатності й забезпечував лікування ГЕР і пов''язаного з ним езофагіту, не впливаючи істотно на панкреатичну секрецію. Це перший аргумент проти ІПП при гіпоферментному ХП.
Другий аргумент. При зниженій панкреатичній секреції легко розвивається синдром надлишкового бактеріального росту, бо через зовнішньосекреторну недостатність ПЗ зменшується активність її ферментів у дуоденальному просвіті та знижується бактерицидність кишкового вмісту. Одним із небажаних явищ, що характерні для терапії ІПП, є синдром надлишкового бактеріального росту через значне гальмування кислотної продукції у шлунку і різке зниження бактерицидної здатності шлункового соку [47].
Третій аргумент. Панкреатичні ферменти зберігають свою активність у досить вузьких межах рН: трипсин — 7,8–8,0, ліпаза — 5,5–7,5, амілаза — 5,8–6,2 [24]. Зрозуміло, що при лікуванні ІПП рівень рН може не відповідати вказаним вище значенням. Це означає, що у хворих з панкреатичною недостатністю власні панкреатичні ферменти (а їх уже мало) не зможуть реалізувати свою дію.
Четвертий аргумент. Через тривалу терапію ІПП можливий розвиток остеопорозу і виникнення переломів шийки стегна, особливо у пацієнтів похилого віку [78]. У той же час остеопороз є одним із проявів панкреатичної недостатності. При гіпоферментних ХП можуть розвиватися патологічні переломи [64]. Логічно передбачити, що тривале призначення ІПП при гіпоферментному панкреатиті може сприяти посиленню змін кісток і збільшенню ймовірності патологічного перелому.
П''ятий аргумент. Для тяжкої панкреатичної недостатності характерно зниження неспецифічної резистентності організму хворих і підвищення ризику розвитку різноманітних бактеріальних і вірусних захворювань. Так, доведено високий ризик розвитку пневмонії [46]. У той же час цей ризик підвищений і при тривалому безперервному застосуванні ІПП [96].
Усі ці аргументи примушують привернути увагу до препарату Гавіскон, що позбавлений вказаних вище недоліків і є патогенетично обгрунтованим для лікування ГЕР у хворих на гіпоферментний ХП.
Основний компонент цього препарату — альгінат натрію. Альгінати можливо отримати з більш як 300 видів бурих водоростей, структурними елементами клітинних стінок яких вони є (Laminaria hyperborean, Macrocystis pyrifera, Asco-phyllum nodosum и др.) [47]. Різні морські водорості здавна застосовували не тільки в їжу, але й для лікування і профілактики багатьох захворювань. Виявилося, що основна корисна складова цих водоростей — альгінова кислота, шо була відкрита англійським хіміком T.C. Stanford у 1881 р. як побічний продукт при отриманні з них йоду [101].
Альгінові кислоти (від лат. alga — морська трава, водорість) — це полісахариди, молекули яких побудовані з залишків b-D-мануронової и a-L-гулуронової кислот, що знаходяться в піранозній формі і пов''язані в лінійні ланцюги глікозидними зв''язками [53]. Співвідношення між мономерами змінюється в широких межах залежно від джерела; розподіл мономерів уздовж ланцюга має блочний характер, причому є блоки таких типів: монотонні послідовності залишків b-D-мануронової або a-L-гулуронової кислоти і ділянки з більш або менш регулярним чергуванням залишків обох кислот [47].
Блоки, побудовані з полімануронової кислоти, надають в''язкості альгінатним розчинам; блоки гулуронової кислоти відповідні за силу гелю і специфічне зв''язування двовалентних іонів металів. Від співвідношення мономерів і їх розподілу в середині ланцюгів залежить структура альгінатів. Альгінати являють собою аморфні безколірні або слабко забарвлені речовини з молекулярною масою 35 000–1 500 000. Погано розчиняються у холодній воді (при набуханні можуть поглинати 200–300-кратну кількість води), розчинні в гарячій воді й розчинах лугів; при підкисленні розчини утворюють гелі [47].
Механізм дії альгінатів абсолютно відрізняється від такого традиційних антацидів. Застосування альгінатів засноване на формуванні ними структури гелю і доданні в''язкості рідким розчинам [95]. Після приймання всередину в кислому середовищі шлунка натрію альгінат переходить у стан, подібний до гелю. Другий активний інгредієнт калію бікарбонат за наявності соляної кислоти шлункового соку перетворюється у вуглекислоту, яку абсорбує преципітат гелю, обертаючи її на піну, що плаває на поверхні вмісту шлунка, як пліт (рафт) на воді. Високу міцність шару гелю додають поперечні зв''язки альгінату з іонами кальцію, що утворюються з карбонату кальцію (агент, який «зшиває») [59].
Утворений рафт є міцним, в''язким, з низькою щільністю, здатним утримуватися на поверхні шлункового вмісту. Ці властивості забезпечують рафту стійкість до висхідного тиску рефлюктату і фізично перешкоджають його зворотному закиданню в стравохід. Але навіть при ГЕР альгінатна маса, що потрапила в стравохід, не викликає подразнення його стінок, а справляє лікувальну дію за рахунок значення рН, близького до нейтрального, і антацидних складових [59].
Рафт залишається на поверхні шлункового вмісту доти, поки не буде евакуйований разом із ним зі шлунка. Позитивним моментом є те, що шар гелю не впливає ні на евакуацію хімусу зі шлунка, ні на рН шлункового вмісту, який знаходиться під ним, тобто не перешкоджає нормальним фізіологічним процесам у шлунку, ефективний за наявності не тільки кислих, але й лужних рефлюксів. Потрапляючи в кишечник, альгінати проявляють пребіотичні властивості, будучи живильним середовищем для кишкової мікрофлори. Крім того, мають слабку осмотичну послаблюючу дію за рахунок затримки всмоктування води у шлунку [59].
Альгінові кислоти й альгінати мають низку властивостей, на підставі яких їх застосовують у медицині: іонообмінні якості, що лежать в основі захисту організму від солей важких металів; протирадіаційна дія, що базується на специфічній дії солей альгінової кислоти на мембрани клітин крові, слизові оболонки шлунка (СОШ) і кишечника, внаслідок чого різко зростає їх стійкість до шкідливих факторів, здатність елімінувати радіонукліди; протиалергічні й імуномодулюючі властивості, пов''язані зі здатністю сорбувати імунні комплекси, імуноглобулін Е, стимулювати секрецію імуноглобуліну А; здатність відновлювати функціональну активність макрофагів, що забезпечує їх антимікробну, протигрибкову і противірусну активність; виражений регенераційний і цитопротекторний ефект для пошкоджених тканин; антирефлюксна дія; висока сорбційна активність; позитивна метаболічна дія, направлена на нормалізацію жирового і вуглеводного обміну; пребіотичні властивості; прокінетична дія, що відновлює і стимулює перистальтику шлунка, кишечника і жовчовивідних проток; обволікаюча дія за рахунок розбухання в просвіті травної трубки, що приводить до послаблення або повного пригнічення патологічних рефлексів зі слизової оболонки; слабка осмотична послаблююча дія за рахунок затримки всмоктування води в шлунку [1]. На основі альгінатів створені препарати Гавіскон і Гавіскон форте, що різняться кількісним умістом окремих компонентів.
Гавіскон форте діє швидко, як правило, протягом кількох секунд після приймання. Показано, що препарат полегшує симптоми у 57 % пацієнтів протягом 10 хвилин після приймання і у 93 % — протягом 20 хвилин [87]. Однак якщо за швидкістю початку дії альгінати порівнянні з традиційними антацидами, то за часом полегшення симптомів печії значно переважають їх. Це пов''язано з тим, що рафт може залишатися у шлунку кілька годин, що створює умови фізіологічного спокою слизової оболонки стравохіду (СОС) [59].
Численними дослідженнями доведено безпечність Гавіскону, можливість його застосування в дітей із 6 років, у вагітних [87].
Ефективність Гавіскону в лікуванні ГЕРХ була безумовно доведена низкою досліджень [1, 4, 63, 87].
Хоча Гавіскон патогенетично обгрунтований для лікування ГЕР при гіпоферментних панкреатитах, у доступній літературі нам вдалося знайти лише одну роботу з цього приводу [48]. Ми вважаємо Гавіскон оптимальним препаратом для лікування вказаної вище категорії пацієнтів. Наша думка заснована на таких властивостях альгінатів [1]:
У зв''язку з відсутністю доказових досліджень ефективності Гавіскону при гіпоферментних ХП ми оцінили результати лікування в клініці внутрішньої медицини № 1 Донецького національного медичного університету ім. М. Горького.
Мета дослідження — оцінити ефективність Гавіскону форте в лікуванні ГЕР у хворих на гіпоферментний ХП.
Матеріали і методи
Під нашим спостереженням перебували 108 хворих на ХП у стадії загострення (за МКХ-10 код К86.1) у поєднанні з ГЕРХ (К21.0). Серед обстежених нами хворих було 64 (59,3 %) жінки та 44 (40,7 %) чоловіки. Вік хворих — від 35 до 63 років, однак переважали пацієнти віком понад 40 років (89 хворих — 82,4 %).
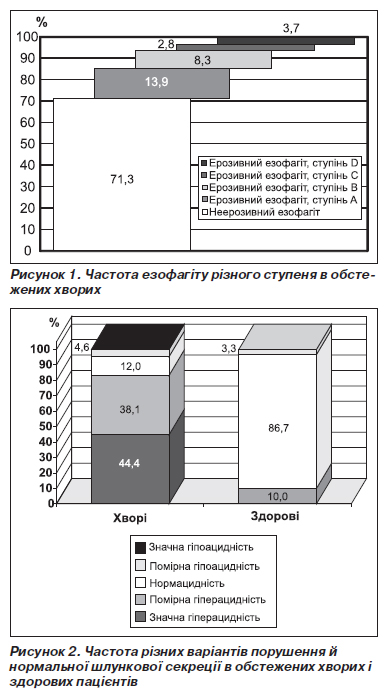
У всіх хворих мала місце супутня ГЕРХ із пептичним езофагітом. У 77 (71,3 %) хворих езофагіт був неерозивним, у 27 (25,0 %) — ерозивним, у 4 (3,7 %) хворих — ерозивно-виразковим. Стравохід Барретта виявлений у 5 (4,6 %) хворих. Грижу стравохідного отвору діафрагми діагностовано у 30 (27,8 %) хворих.
Ми обстежили також контрольну групу з 30 практично здорових пацієнтів. Їх вік становив від 38 до 63 років. До контрольної групи увійшли 18 (60,0 %) жінок і 12 (40,0 %) чоловіків. Тобто стать і вік практично здорових людей були порівнянні зі статтю та віком хворих.
Обстеження наших хворих складалося насамперед з аналізу скарг, анамнезу, об''єктивних даних, а також із проведення загальних аналізів крові й сечі, копроскопії, біохімічного дослідження крові, сечі й дуоденального вмісту, сонографії та ультразвукової гістографії ПЗ, фіброезофагогастродуоденоскопії (ФЕГДС) із біопсією слизової стравоходу й шлунка, внутрішньостравохідної та внутрішньошлункової рН-метрії, оцінки якості життя пацієнтів. Крім того, виконували радіоімунні та імуноферментні дослідження, антропометрію.
Для оцінки скарг хворих і результатів об''єктивного дослідження (хворобливості при пальпації) ми застосовували показник середнього ступеня тяжкості (ССТ). Для обчислення цього показника спочатку оцінювали інтенсивність болю й інших проявів поєднаної патології згідно зі шкалою: 0 балів — скарги відсутні; 1 бал — скарги мінімальні; 2 бали — скарги помірні; 3 бали — скарги виражені або дуже виражені. Після цього за формулою 1 розраховували ССТ:
![]()
Вивчали активність панкреатичних ферментів у крові: α-амілази, панкреатичної ізоамілази (Р-ізоамілази), ліпази. Показники α-амілази й Р-ізоамілази вивчали за допомогою наборів Lachema (Чехія) на біохімічному аналізаторі Vitalab Flexor-2000 (Нідерланди). Для вивчення активності ліпази крові застосовували набори Sentinell (Італія), дослідження проводили на тому самому біохімічному аналізаторі. У сечі досліджували активність α-амілази, Р-ізоамілази натще, а показники α-амілази — ще й через 30 і 60 хвилин після приймання стандартного сніданку, що складався зі
Для оцінки зовнішньосекреторної функції ПЗ застосовували копроскопію, визначення фекальної панкреатичної еластази-1. Так, фекальний еластазний тест виконували до лікування в стаціонарі й після нього з використанням наборів Schebo (Німеччина) на імуноферментному аналізаторі Sanofi (Франція) [69, 70].
Усім хворим до лікування й після нього проводили сонографію ПЗ, а також ультразвукову гістографію в ділянці голівки залози з аналізом показників L, N, Kgst [20], використовуючи апарат ALOKA SSD-630 (Японія).
При надходженні в клініку всім хворим та після закінчення лікування пацієнтам, які мали ерозивний або ерозивно-виразковий езофагіт, стравохід Барретта, проводили ФЕГДС за допомогою ендоскопа Olympus GIF Q10 (Японія). При цьому звертали увагу на наявність набряку, гіперемії, ерозій, виразок слизової стравоходу, шлунка та ДПК, а також на тонус кардіального сфінктера, на наявність гастроезофагеального та дуоденогастрального рефлюксів, грижі стравохідного отвору діафрагми. До лікування хворим виконували біопсію слизової оболонки стравоходу. Для оцінки морфологічних змін СОС тканинні зрізи фарбували гематоксиліном та еозином, проводили фарбування муцину за допомогою PAS-реакції. За необхідності виконували біопсію слизової оболонки шлунка в антральному, фундальному відділах, проводили гістологічне дослідження біоптатів. Однак гістологічне дослідження слизової шлунка проводилося тільки для підтвердження діагнозу гастродуоденіту, тоді як результати вивчення СОС аналізували як для підтвердження діагнозу езофагіту, так і для виявлення особливостей змін цієї слизової у хворих із поєднаною патологією. Перегляд та фотографування препаратів виконувалися на мікроскопі Olympus BX-40 (Японія).
Усім хворим до лікування проводили базальну топографічну внутрішньошлункову рН-метрію та внутрішньостравохідне добове рН-моніторування за допомогою автономного ацидогастрометра «Гастроскан-24» (Росія). Базальна топографічна внутрішньошлункова рН-метрія надала можливість визначити стан кислотоутворюючої функції шлунка та орієнтовну площу кислотоутворення в шлунку. Дані внутрішньостравохідного рН-моніторування дозволили нам оцінити загальний час із рН у стравоході менше 4, загальну кількість ГЕР за добу, кількість рефлюксів тривалістю понад 5 хвилин, найбільшу тривалість рефлюксу. Оцінку кислотоутворюючої функції шлунка проводили за найменшим значенням рН, якому відповідав найбільший стан ацидності, тому що зв''язок між результатами рН-метрії та станом кислотоутворюючої функції шлунка зворотний. При цьому найменше значення рН розподіляли на 6 функціональних інтервалів: анацидність (рН 7,0–8,0); значна гіпоацидність (рН 3,6–6,9); помірна гіпоацидність (рН 2,3–3,5); нормацидність (рН 1,6–2,2); помірна гіперацидність (рН 1,3–1,5); значна гіперацидність (рН 0,9–1,2). За топографією ацидність розподіляли на мінімальну, селективну, абсолютну, субтотальну й тотальну [26, 32, 43].
При надходженні до стаціонару хворим проводили класичний сечовинний дихальний тест для діагностики хелікобактеріозу. Якщо тест виявлявся позитивним, то пацієнта до дослідження не включали, щоб уникнути впливу Helicobacter pylori на шлункову секрецію та гістологічну картину слизової оболонки шлунка.
Якість життя оцінювали за допомогою питальника SF-36 [11, 21, 22, 38, 71, 90, 93] до лікування в клініці й після нього та за рік після амбулаторного спостереження.
Хворих після виписки з клініки спостерігали протягом року, після чого оцінювали не тільки якість життя, але й частоту загострень ХП, а також виконували ФЕГДС (тільки тим хворим, у яких при надходженні в клініку були виявлені ерозії, виразки стравоходу та/або стравохід Барретта), обчислювали індекс маси тіла.
При статистичній обробці матеріалу обчислювалися середня арифметична (М), її помилка (m), середнє квадратичне відхилення (s). Вірогідність відмінностей середніх величин двох вибірок оцінювали на підставі t-критерію Стьюдента з урахуванням його параметрів, прийнятих у медико-біологічних дослідженнях. Статистична обробка отриманих даних виконувалася на комп''ютері ІВМ РС Pentium III з використанням стандартного пакета програми Microsoft Exсеl.
Усім хворим призначили дієту № 5п за М.І. Певзнером, а також заборонили приймання алкоголю.
Залежно від варіанта лікування пацієнти були розподілені на 2 групи: основну групу і групу порівняння. До групи порівняння увійшли 52 пацієнта, які отримували тільки базисну терапію. Пацієнти основної групи (56 хворих) у складі базисного лікування отримували креон, доза якого залежала від ступеня зовнішньосекреторної недостатності ПЗ, Гавіскон форте по 1 чайній ложці через 10 хвилин після їжі 3–4 рази на день 30 днів.
Базисна терапія, яку отримували хворі основної групи й пацієнти групи порівняння, включала гастрокінетики (мотиліум), селективний спазмолітик (дуспаталін), інфузійну терапію (реосорбілакт), а за необхідності лікування доповнювали антибактеріальними засобами (зинацефом і/або метронідазолом) та анальгетиками (анальгіном, баралгіном та ін.). Усі препарати базисної групи призначали в загальноприйнятих дозах.
Як ферментний препарат хворі групи порівняння отримували панкреатин по 2 таблетки 3 рази на день (а хворі основної групи, як було зазначено вище, — креон), як антисекреторний засіб — омепразол 40 мг/добу (хворі основної групи ІПП не отримували).
Результати
З огляду на те, що в усіх обстежених мала місце ГЕРХ, зміни стравоходу при ендоскопії були виявлені у всіх хворих (пацієнти з ендоскопічно негативною ГЕРХ у дослідження не включалися). У всіх хворих виявлені гіперемія й набряк СОС, що були більш значними в нижній третині. У 77 (71,3 %) хворих езофагіт був неерозивним; у 27 (25,0 %) хворих виявлені ерозії СОС; у 4 (3,7 %) хворих — і виразка, і ерозії цієї слизової. Ендоскопічно стравохід Барретта був запідозрений у 5 (4,6 %) хворих, причому цей діагноз підтверджений гістологічно. При ендоскопії зяяння кардії було виявлено в 76 (70,4 %) хворих. У 30 (27,8 %) хворих визначався пролапс СОШ, що було кваліфіковано як наявність діафрагмальної грижі. Отримані дані відповідають клінічним проявам поєднаної патології. Так, усіх хворих турбувала печія, а в 56,5 % випадків хворі відзначали відрижку кислим. У 38 (35,2 %) хворих при ендо-
скопії реєструвався дуоденогастральний рефлюкс. Можливо припустити, що у зв''язку з наявністю в хворих ГЕРХ у низці випадків цей рефлюкс був не тільки дуоденогастральним, але й дуоденогастроезофагеальним. Наше припущення підтверджується тим, що під час ендоскопії в 23 (21,3 %) хворих у стравоході визначався вміст, забарвлений жовчю.
Серед 31 (28,7 %) хворого з ерозивними й ерозивно-виразковими змінами СОС у 15 (48,4 %) хворих було діагностовано ерозивний езофагіт ступеня А, в 9 (29,0 %) хворих — ступеня В, в 3 (9,7 %) хворих — ступеня С, в 4 (12,9 %) хворих — ступеня D за Лос-Анджелеською класифікацією (рис. 1) [10].
Ендоскопічно гіперемія й набряк слизової оболонки ДПК визначалися в тих же 87 хворих, у яких були виявлені набряк і гіперемія СОШ, що дало підставу встановити цим хворим діагноз хронічного гастродуоденіту (підтверджений гістологічно). У 10 (9,3 %) хворих мали місце поствиразкові рубці та/або рубцева деформація луковиці ДПК, причому в усіх цих пацієнтів були анамнестичні вказівки на пептичну дуоденальну виразку. Атрофічні зміни слизової оболонки ДПК спостерігалися ще рідше, ніж такі ж зміни СОШ, — у 5 (4,6 %) хворих.
Результати ФЕГДС свідчать про те, що майже у третини пацієнтів із поєднаною патологією езофагіт був ерозивним або ерозивно-виразковим. Крім того, у хворих у більше ніж 35,0 % випадків мав місце дуоденогастральний рефлюкс, у понад 80,0 % випадків — гастродуоденіт. У той же час атрофічні зміни СОШ і слизової оболонки ДПК розвиваються рідко.
За даними добового рН-монітору-вання стравоходу, загальний час із рН у стравоході менше 4 склав 12,7 ± 2,1 % (у контрольній групі — 4,1 ± 1,3 %;
За даними базальної топографічної рН-метрії шлунка, гіперацидність мала місце в 89 (82,4 %) хворих, нормацидність — в 13 (12,0 %) хворих, гіпоацидність — в 6 (5,6 %) хворих. Анацидність не була зареєстрована в жодному випадку. Серед хворих, у яких шлункова секреція була підвищеною, значна гіперацидність виявлена в 48 (53,9 %) хворих, помірна — в 41 (46,1 %) хворого. Серед хворих із зниженою шлунковою секрецією 5 (83,3 %) мали помірну гіпоацидність і тільки 1 (16,7 %) — значну гіпоацидність (рис. 2).
 У контрольній групі нормацидність була виявлена в 26 (86,7 %) практично здорових пацієнтів, помірна гіперацидність — в 3 (10,0 %), помірна гіпоацидність — в 1 (3,3 %) практично здорового пацієнта (рис. 2).
У контрольній групі нормацидність була виявлена в 26 (86,7 %) практично здорових пацієнтів, помірна гіперацидність — в 3 (10,0 %), помірна гіпоацидність — в 1 (3,3 %) практично здорового пацієнта (рис. 2).
Отже, для хворих на ХП у поєднанні з ГЕРХ характерною є гіперацидність, причому переважає значна гіперацидність.
При вивченні зони (площі) гіперацидності виявилося, що у хворих із поєднаними захворюваннями визначаються не тільки нижчі значення рН шлунка, ніж у здорових, але й збільшена площа гіперацидності. Тотальна гіперацидність мала місце в 7 (7,9 %) хворих, субтотальна — в 10 (11,2 %) хворих, абсолютна — в 23 (25,8 %) хворих, селективна — в 40 (45,0 %) хворих, мінімальна — в 9 (10,1 %) хворих серед усіх пацієнтів, які мали гіперацидність (рис. 3).
У двох практично здорових пацієнтів було виявлено селективну гіперацидність і в одного — мінімальну.
У хворих із неерозивним езофагітом гістологічне дослідження виявило ознаки хронічного запалення з проліферацією епітелію, акантозом його, незначну вогнищеву інфільтрацію, переважно лімфоцитарну та поодинокі лімфоцити, гістіоцити (рис. 4).
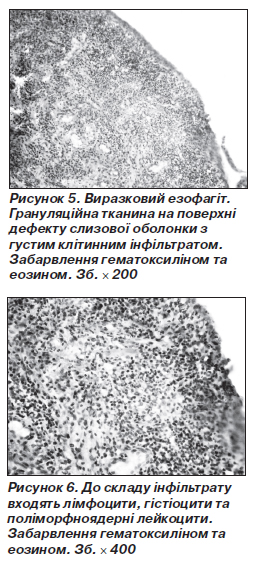
У випадках виразок стравоходу спостерігалися дефекти слизової оболонки з наявністю ексудату з великою кількістю поліморфноядерних лейкоцитів на поверхні дефекту, а також серед грануляційної тканини у дні виразки, де в інфільтраті знайшли чимало лімфоцитів (рис. 5, 6).
Скупчення поліморфноядерних лейкоцитів є доказом загострення процесу, тоді як ріст волокнистої сполучної тканини є проявом хронічності перебігу виразки. У трьох випадках спостерігалася часткова епітелізація виразок, коли з їх одного боку на поверхню грануляційної або молодої волокнистої сполучної тканини наповзав пласт тонкого епітелію з наявністю мітозів у клітинах, збільшенням в них ядерно-цитоплазматичного відношення, що свідчить про незрілість епітелію. Отже, хронічний перебіг виразки інколи супроводжувався загоєнням її з наповзанням на дно дефекту молодого, з ознаками регенерації, епітелію.
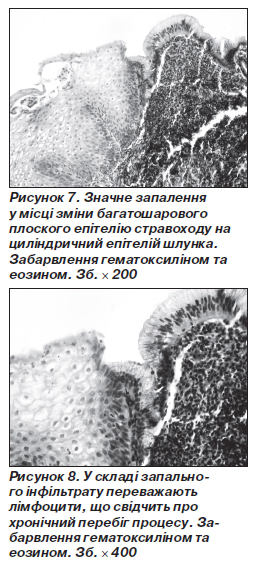
Чергування пошкодження СОС при рефлюксі шлункового вмісту, або вмісту ДПК з процесами регенерації, загоєння виразки створюють умови для виникнення стравоходу Барретта. Наявність циліндричного епітелію, що знаходиться в дистальній частині стравоходу вище нижнього сфінктера, називається стравоходом Барретта [98]. Є багато клінічних та експериментальних доказів, що ці зміни — результат утворення виразки з подальшою реепітелізацією циліндричним епітелієм замість багатошарового плоского неороговілого епітелію [91], тобто мова йде про метаплазії епітелію. Циліндричний епітелій більш пристосований до дії шлункового або кишкового секрету при одночасному гастроезофагеальному та дуоденогастральному рефлюксі, тому в стовбурових клітинах слизової оболонки виникають фенотипічні зміни й формування кишкового епітелію з бокалоподібними клітинами [99] або шлункового епітелію [85]. Стравохід Барретта зустрічається при ГЕР приблизно у 10 % таких хворих із виразками [68].
У біоптатах досліджуваних хворих мала місце зміна СОС на СОШ (рис. 7, 8), в якій теж зустрічалося значне запалення, навіть із формуванням лімфоїдних фолікулів. Стравохід Барретта діагностовано у 5 (4,6 %) хворих.
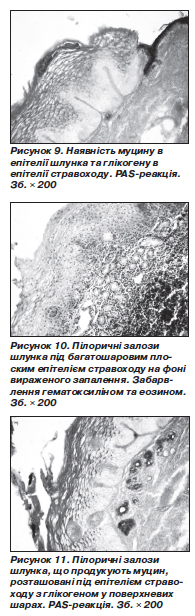
PAS-реакція виявляла накопичення муцину в циліндричному епітелії шлунка та гранул глікогену в багатошаровому епітелії стравоходу (рис. 9).
Інколи СОШ у стравоході зберігала не тільки покривно-ямковий, а й залозистий епітелій. Шлункові залози, що мають структуру і функцію пілоричних залоз, були розташовані й під епітелієм стравоходу, зберігаючи свої морфологічні й функціональні ознаки (рис. 10, 11).
За даними літератури, можлива регресія змін, що характеризують стравохід Барретта, після антирефлюксної терапії [94].
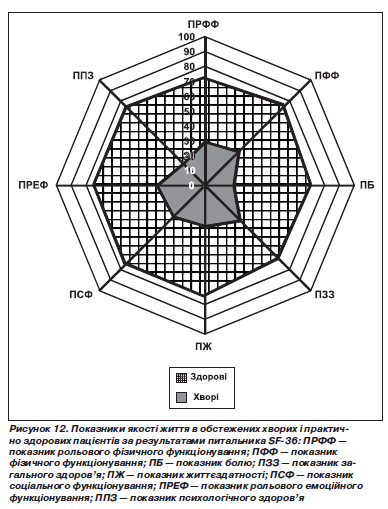
Для оцінки якості життя обстежених хворих ми використовували питальник SF-36. Результати вивчення якості життя наведені на рис. 12.
 У пацієнтів із поєднаною патологією при надходженні в клініку виявилися вірогідно зниженими всі показники, що стосуються характеристики фізичного здоров''я. Найбільш зменшеним був показник болю. У хворих він становив 19,5 ± 2,8 бала (у здорових — 72,2 ± 1,9 бала, p < 0,05). Значно зниженим був також показ-
У пацієнтів із поєднаною патологією при надходженні в клініку виявилися вірогідно зниженими всі показники, що стосуються характеристики фізичного здоров''я. Найбільш зменшеним був показник болю. У хворих він становив 19,5 ± 2,8 бала (у здорових — 72,2 ± 1,9 бала, p < 0,05). Значно зниженим був також показ-
ник загального здоров''я. У пацієнтів цей показник виявився зменшеним до 33,2 ± 1,8 бала, в контрольній групі — 70,2 ± 0,8 бала (p < 0,05). Показник фізичного функціонування у хворих був знижений до 32,4 ± 2,1 бала, показник рольового фізичного функціонування — до 29,5 ± 2,3 бала, тоді як у здорових ці показники становили відповідно 75,7 ± 2,1 і 71,8 ± 2,8 бала (в обох випадках p < 0,05).
Серед показників, що характеризують психічне здоров''я, найбільш зниженим був показник життєздатності. У пацієнтів із поєднаними захворюваннями цей показник становив усього 27,3 ± 1,2 бала, в контрольній групі — 74,8 ± 2,4 бала (p < 0,05). Дійсно, у наших хворих мали місце прояви астенізації, канцерофобії, емоційної лабільності, іпохондрії, депресії, що, ймовірно, вплинули на показник життєздатності та на інші показники психічного здоров''я за шкалою SF-36. Однак вивчення психосоматичних порушень не було нашим завданням. Висловлене вище припущення підтверджується також зниженням показника психологічного здоров''я, що в обстежених хворих склав 20,7 ± 0,9 бала (у контрольній групі — 73,5 ± 1,6 бала, p < 0,05). Хворі нерідко висловлювали думки про неможливість продовження роботи на колишньому робочому місці, про складності щодо самообслуговування, виконання простих побутових дій. Це, ймовірно, позначилося на зниженні показників соціального функціонування й рольового емоційного функціонування, що в пацієнтів були знижені до 29,5 ± 1,7 і до 32,0 ± 2,0 бала (у контрольній групі — відповідно 74,5 ± 1,8 та 73,7 ± 2,1 бала; p < 0,05).
Отже, у хворих на ХП на фоні ГЕРХ були вірогідно знижені показники якості життя, що характеризують і фізичне, і психічне здоров''я.
 В основній групі біль у животі зник у 26 (46,4 %) хворих, зменшився в 20 (35,7 %) пацієнтів, залишився незмінним у 8 (14,3 %) хворих і посилився у 2 (3,6 %). ССТ абдомінального болю перед випискою зі стаціонару становив 1,26. У групі порівняння абдомінальний біль після лікування в клініці зник у 18 (34,6 %) хворих, зменшився в 16 (30,8 %) пацієнтів, залишився незмінним у 14 (26,9 %) хворих, підсилився в 4 (7,7 %). ССТ абдомінального болю після стаціонарного лікування в цій групі знизився до 1,64. Отже, частота зникнення або зменшення болю в животі після основного варіанта лікування була в 1,26 раза більшою, ніж у групі порівняння. Навпаки, частота випадків, коли інтенсивність абдомінального болю залишалася колишньою або навіть підсилювалася, після лікування в основній групі була в 1,93 раза меншою, ніж після проведення лікування омепразолом і панкреатином. Крім того, ССТ болю в животі до моменту виписки з клініки в групі порівняння був в 1,30 раза вищим, ніж в основній групі.
В основній групі біль у животі зник у 26 (46,4 %) хворих, зменшився в 20 (35,7 %) пацієнтів, залишився незмінним у 8 (14,3 %) хворих і посилився у 2 (3,6 %). ССТ абдомінального болю перед випискою зі стаціонару становив 1,26. У групі порівняння абдомінальний біль після лікування в клініці зник у 18 (34,6 %) хворих, зменшився в 16 (30,8 %) пацієнтів, залишився незмінним у 14 (26,9 %) хворих, підсилився в 4 (7,7 %). ССТ абдомінального болю після стаціонарного лікування в цій групі знизився до 1,64. Отже, частота зникнення або зменшення болю в животі після основного варіанта лікування була в 1,26 раза більшою, ніж у групі порівняння. Навпаки, частота випадків, коли інтенсивність абдомінального болю залишалася колишньою або навіть підсилювалася, після лікування в основній групі була в 1,93 раза меншою, ніж після проведення лікування омепразолом і панкреатином. Крім того, ССТ болю в животі до моменту виписки з клініки в групі порівняння був в 1,30 раза вищим, ніж в основній групі.
Окремо ми проаналізували ті випадки, коли після проведеного лікування в спеціалізованому стаціонарі біль у животі підсилювався. У всіх таких пацієнтів причиною посилення больового синдрому було порушення дієти або навіть приймання алкоголю. Хоча такі ситуації відбувалися з подібною частотою у хворих обох груп, але частота посилення болю в основній групі була в 2,14 раза нижчою, ніж у групі порівняння. Отже, ефект лікування з включенням Гавіскону та креону виявився стійкішим навіть при впливі провокуючих факторів. Стійкість результатів терапії в основній групі становила 96,4 %, у групі порівняння — 92,3 %, тобто була в 1,04 раза нижчою.
Диспептичні явища, у тому числі печія, зникли в 30 (53,6 %) хворих основної групи, зменшилися в 22 (39,2 %) хворих цієї групи, залишилися незмінними в 3 (5,4 %) хворих, підсилилися в 1 (1,8 %) хворого. ССТ диспептичних проявів після стаціонарного лікування у хворих основної групи становив 1,09. У групі порівняння диспептичні явища після лікування в клініці зникли в 21 (40,4 %) хворого, зменшилися в 19 (36,5 %) пацієнтів, залишилися незмінними в 9 (17,3 %) хворих, підсилилися в 3 (5,8 %) хворих. ССТ диспептичних проявів після лікування в цій групі знизився до 1,38, тобто ССТ диспепсії після терапії з включенням Гавіскону та креону був в 1,27 раза нижчим, ніж після лікування омепразолом і панкреатином. Частота зникнення й зменшення диспептичних явищ після лікування в основній групі була в 1,21 раза вищою, ніж у групі порівняння. І навпаки, частота посилення диспептичних явищ і збереження їх після виписки зі стаціонару в основній групі була в 3,21 раза меншою, ніж у групі порівняння. Перед випискою зі стаціонару нормальне випорожнення було в 29 (51,8 %) хворих основної групи і в 17 (32,7 %) хворих групи порівняння. Отже, нормальне випорожнення після лікування в основній групі було в 1,58 раза частішим, ніж у групі порівняння.
ССТ астеноневротичних проявів після лікування у хворих основної групи становив 0,40, а у хворих групи порівняння — 0,72, тобто вираженість астенії після традиційного лікування була в 1,80 раза вищою, ніж після запропонованої нами терапії.
При надходженні в клініку та розподілі хворих на групи 3 пацієнти, які мали клінічні прояви тяжкої зовнішньосекреторної недостатності ПЗ, були включені до основної групи, а інші 3 хворі — до групи порівняння. Слід зазначити, що після закінчення стаціонарного лікування у всіх 3 хворих, які увійшли до основної групи, скарги, обумовлені зниженням екзокринної функції ПЗ, зникли, що свідчить про достатню компенсацію панкреатичної недостатності креоном. У групі порівняння перед випискою зі стаціонару відповідні скарги зникли тільки в 1 пацієнта, а в інших 2 зберігалися, хоча ступінь їх трохи зменшився. Тобто ми змогли вже на етапі аналізу скарг винести попереднє судження про більшу ефективність Креону як засобу замісної терапії у хворих на ХП у поєднанні з ГЕРХ.
Що стосується проявів ендокринної недостатності ПЗ, то вони зникли під впливом цукрознижуючої терапії в усіх хворих, які пред''являли відповідні скарги при надходженні в клініку. Це пояснюється тим, що хворим із цукровим діабетом незалежно від того, до якої групи вони були віднесені, призначалися цукрознижуючі препарати для досягнення компенсації захворювання. Аналогічно динаміці клінічних проявів ендокринної недостатності ПЗ подібними були результати терапії у двох групах хворих щодо алергійних проявів та інтоксикації. Хворі обох груп рівною мірою, за необхідності, отримували протиалергійну, дезінтоксикаційну терапію й антибактеріальні засоби.
ССТ пальпаторної хворобливості в проекції ПЗ після лікування в основній групі становив 1,32, у групі порівняння — 1,67, тобто в останній групі він був в 1,40 раза вищим.
Отже, клінічна ефективність лікування з включенням Гавіскону та креону виявилася істотно вищою, ніж терапія з використанням омепразолу й панкреатину.
За даними копроскопії при надходженні пацієнтів у стаціонар, стеаторея визначалася тільки в 6 (5,6 %) хворих (по 3 пацієнти в кожній групі). Це пов''язане з тим, що стеаторея є ознакою тяжкої панкреатичної недостатності. Після лікування в жодного хворого основної групи не виникало стеатореї, але вона зберігалася у 2 (3,8 %) хворих групи порівняння. Амілорея до лікування була виявлена в 3 (5,4 %) хворих основної групи та в 2 (3,8 %) хворих групи порівняння, після лікування вона не визначалася в жодного хворого основної групи, але зберігалася в 2 хворих, які отримували омепразол і панкреатин.
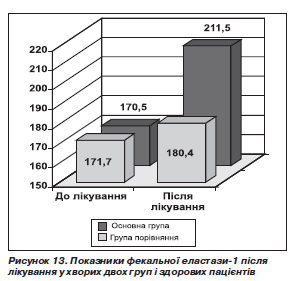
До лікування середній показник фекальної панкреатичної еластази-1 в основній групі становив 170,5 ± 9,7 мкг/г, після лікування — 211,5 ± 9,4 мкг/г (p < 0,05). У групі порівняння відповідні показники: 171,7 ± 10,9 і 180,4 ± 12,6 мкг/г (p > 0,05) (рис. 13). Відтак, лікування з включенням Гавіскону та креону сприяло істотному поліпшенню зовнішньосекреторної функції ПЗ, тоді як терапія омепразолом і панкреатином викликала лише невірогідну тенденцію до поліпшення цієї функції. Подібна різниця у впливі на функціональний стан ПЗ, імовірно, пояснюється тим, що Гавіскон не пригнічує функцію ПЗ порівняно з омепразолом. Це й забезпечує більш виражене поліпшення панкреатичної секреції при включенні в терапію Гавіскону. Слід зазначити, що підвищення показника фекальної еластази-1 в обох групах пацієнтів відбувалося у хворих з легкою панкреатичною недостатністю, тоді як при наявності помірної і тяжкої недостатності поліпшення показника ми не спостерігали. Тобто, ймовірно, лише у пацієнтів із поєднаними захворюваннями з легким зниженням зовнішньосекреторної функції ПЗ можливо вірогідне поліпшення цієї функції під впливом лікування.
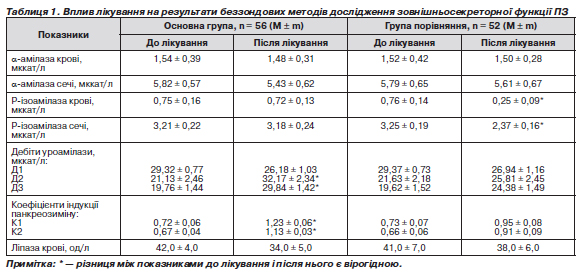
Динаміка активності панкреатичних ферментів у крові й сечі під впливом двох варіантів лікування подана в табл. 1. Показники α-амілази крові й сечі у хворих обох груп до лікування не мали вірогідних відмінностей від цих показників у практично здорових пацієнтів, що є достатньо характерним для ХП [12]. Зрозуміло, що під впливом лікування вірогідного зниження початково нормальних показників α-амілази не відбувалося. Активність панкреатоспецифічного ферменту — Р-ізоамілази — до лікування була зниженою як у крові, так і в сечі у хворих обох груп, що ще раз підтверджує наявність саме гіпоферментного ХП. Під впливом терапії з включенням Гавіскону та креону активність Р-ізоамілази крові й сечі вірогідно не змінилася. У групі порівняння спостерігалося вірогідне зниження рівня Р-ізоамілази крові. Активність Р-ізоамілази сечі також істотно знижувалася. Активність ліпази крові істотно не змінювалася під впливом обох варіантів лікування, тому що до початку терапії показники були нормальними (табл. 1).
Д1 у хворих обох груп до лікування не мав істотних відмінностей від даних у практично здорових пацієнтів; у процесі терапії цей показник вірогідно не змінювався в обох групах. Що стосується дебіту уроамілази й коефіцієнту індукції панкреозиміну через 30 хвилин після приймання стандартного сніданку, то вони до лікування були знижені в пацієнтів двох груп. В обстежених хворих при надходженні в клініку не було виявлено непрямих ознак порушення відтоку панкреатичного секрету. Це виявлялося в тому, що показник Д2 був більшим, ніж Д3, а К1 — більшим, ніж К2. Під впливом основного варіанта лікування вдалося досягти вірогідного підвищення Д2 і К1, причому правильні співвідношення між Д2 і Д3, К1 і К2 зберігалися. У хворих основної групи після лікування всі дебіти уроамілази й коефіцієнти індукції ендогенного панкреозиміну від норми вірогідно не відрізнялися (табл. 1). Ці результати свідчать про те, що Гавіскон не пригнічує зовнішньої секреції ПЗ, а разом із Креоном ефективно створює «функціональний спокій» ПЗ, сприяє поліпшенню її функціонального стану.
У групі порівняння під впливом лікування Д2 і К1 мали лише невірогідну тенденцію до підвищення. У цій групі Д2 і К1 до моменту виписки хворих із клініки залишалися вірогідно зменшеними, але все-таки співвідношення між дебітами уроамілази й коефіцієнтами індукції панкреозиміну зберігалися нормальними. Отримані в групі порівняння дані свідчать про меншу ефективність омепразолу та панкреатину у створенні «функціонального спокою» ПЗ.
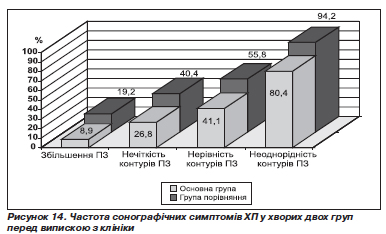
Частота структурних змін ПЗ після лікування у хворих на ХП у стадії загострення в поєднанні з ГЕРХ наведена на рис. 14. Під впливом обох варіантів лікування зменшилася частота зустрічальності збільшення всієї ПЗ або її частини. Так, при надходженні в клініку ПЗ була збільшена в 35 (32,4 %) хворих, 18 із них увійшли до основної групи, 17 — до групи порівняння. Після лікування ПЗ або її частини залишилися збільшеними в 5 (8,9 %) хворих, які отримували запропоновану нами терапію, та в 10 (19,2 %) хворих групи порівняння. Нечіткість контурів ПЗ після стаціонарного лікування виявлена в 15 (26,8 %) хворих основної групи і в 21 (40,4 %) хворого групи порівняння. Нерівність контурів ПЗ перед випискою зі стаціонару визначалася в 23 (41,1 %) хворих, які отримували Гавіскон та креон, і у 29 (55,8 %) хворих, які отримували традиційне лікування. Неоднорідність структури ПЗ виявилася більш стійким до терапії сонографічним симптомом. Після проведеної терапії ця ознака виявлялася в 45 (80,4 %) хворих основної групи і в 49 (94,2 %) хворих групи порівняння.
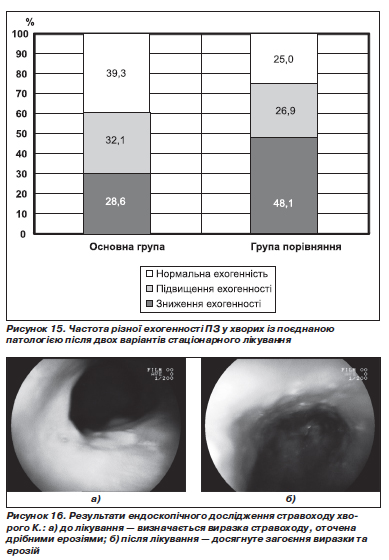
Під впливом основного варіанта лікування рідше, ніж у групі порівняння, стало визначатися зниження ехогенності ПЗ: відповідно в 16 (28,6 %) і 25 (48,1 %) хворих (рис. 15).
Тяжистість тканини ПЗ після лікування було виявлено в 36 (64,3 %) хворих основної групи і в 35 (67,3 %) хворих групи порівняння.
Розширення вірсунгової протоки після лікування визначалося в 4 (7,1 %) хворих основної групи і в 5 (9,6 %) хворих групи порівняння. Тобто цей симптом зник тільки в 2 хворих основної групи, у яких він визначався при надходженні в клініку. Імовірно, це є результатом ефективності дуспаталіну, що селективно спазмолітично діє на сфінктер Одді. Однак дуспаталін отримували хворі обох груп, а розширення вірсунгової протоки зникло тільки у 2 пацієнтів основної групи. Отже, можна припустити, що під впливом лікування з включенням Гавіскону та креону відбулося зменшення вираженості панкреатиту й поліпшення відтоку панкреатичного секрету. Все-таки в переважної частини хворих обох груп розширення вірсунгової протоки при виконанні ультразвукового дослідження ПЗ перед випискою з клініки зберігалося, тому що цей симптом частіше розвивається при виражених органічних перешкодах відтоку соку ПЗ (папілостенозі та ін.), що не можуть бути усунені медикаментозними засобами.
Псевдокісти й кальцифікати ПЗ після лікування визначалися з тією же частотою, що й при надходженні в стаціонар. Так, в основній групі вони були виявлені відповідно в 9 (16,1 %) і 17 (30,4 %) хворих, а в групі порівняння — у 8 (15,4 %) і 15 (28,8 %) хворих.
Отже, під впливом основного варіанта лікування стали рідше, ніж під впливом традиційної терапії, визначатися збільшення ПЗ або її частини, нечіткість і нерівність контурів, зниження ехогенності ПЗ. Перевага лікування з включенням Гавіскону та креону відбилася також у збільшенні частоти нормалізації ехогенності ПЗ.
За результатами ультразвукової гістографії в ділянці голівки ПЗ у хворих із поєднаною патологією в основній групі вдалося досягти вірогідного підвищення: L — до 19,8 ± 0,6, N — до 15,49 ± 0,29 %, Kgst — до 123,6 ± 10,8 (p < 0,05 порівняно з першим дослідженням). Суттєва динаміка показників ультразвукової гістограми відповідає зменшенню частоти зустрічальності зниженої ехогенності й неоднорідності тканини ПЗ у хворих із поєднаною патологією, які входили до основної групи. У групі порівняння перераховані вище показники мали лише невірогідну тенденцію до підвищення.
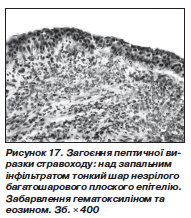
Повторну ФЕГДС виконували тільки хворим, у яких при надходженні в клініку було діагностовано ерозивний або ерозивно-виразковий езофагіт та стравохід Барретта. До лікування ерозивний езофагіт було діагностовано у 27 хворих, а ерозивно-виразковий — у 4 хворих. До основної групи увійшли 19 (33,9 %) хворих з ерозивним і 2 (3,6 %) хворі з ерозивно-виразковим езофагітом, а до групи порівняння — відповідно 18 (34,6 %) і 2 (3,8 %) хворих. Після лікування ерозивний езофагіт був виявлений у 4 (7,1 %) хворих основної групи й у 9 (17,3 %) хворих групи порівняння; ерозивно-виразковий езофагіт — тільки в 1 (1,9 %) хворого групи порівняння. У 2 (3,6 %) хворих основної групи й у 1 (1,9 %) хворого групи порівняння, у яких при надходженні в клініку діагностовано ерозивно-виразковий езофагіт, вдалося досягти загоєння виразок і ерозій (рис. 16).
У результаті основного варіанта лікування загоєння виразок і ерозій досягнуто в 17 (30,6 %) хворих, у групі порівняння — в 10 (19,2 %) хворих. Отже, основний варіант терапії виявився в 1,59 раза ефективнішим щодо лікування ерозій і виразок при пептичному езофагіті у хворих із поєднаною патологією, ніж традиційне лікування.
Стравохід Барретта був виявлений у 5 хворих при надходженні в клініку. При контрольній ендоскопії після стаціонарного лікування прогресування змін СОС не виявлено в жодному випадку.
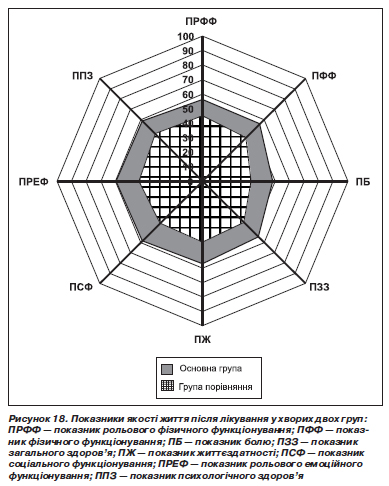
У всіх випадках ерозивно-виразкових змін, що було діагностовано до лікування, а також у випадках стравоходу Барретта виконувалася біопсія СОС до лікування і після нього. Приклад результатів гістологічного дослідження у випадку загоєння пептичної виразки стравоходу у хворого основної групи подано на рис. 17.
 Лікування з використанням Гавіскону та креону мало переваги не тільки в клінічному, функціональному, сонографічному відношенні, у впливі на ерозивно-виразкові зміни стравоходу, але й на відносне поліпшення якості життя хворих (рис. 18).
Лікування з використанням Гавіскону та креону мало переваги не тільки в клінічному, функціональному, сонографічному відношенні, у впливі на ерозивно-виразкові зміни стравоходу, але й на відносне поліпшення якості життя хворих (рис. 18).
Так, після лікування у хворих основної групи показник болю становив 48,3 ± 2,5 бала, у хворих групи порівняння — 33,4 ± 1,9 бала (p < 0,05). Показник загального здоров''я становив відповідно 54,5 ± 1,9 і 40,4 ± 2,1 бала (p < 0,05). Показник фізичного функціонування після запропонованого нами варіанта лікування підвищився до 55,7 ± 2,0 бала, після традиційної терапії — до 42,4 ± 1,5 бала (p < 0,05). Показник рольового фізичного функціонування після лікування в основній групі — 56,3 ± 2,3 бала, у групі порівняння — 44,9 ± 2,7 бала (p < 0,05).
Показники психічного здоров''я також значимо покращилися у хворих основної групи. Показник життєздатності після лікування в основній групі — 56,8 ± 1,9 бала, у групі порівняння — 42,1 ± 2,3 бала (p < 0,05). Показник психологічного здоров''я після основного варіанта лікування становив 58,4 ± 2,2 бала, після традиційної терапії — 46,1 ± 2,6 ба-ла (p < 0,05). Показники соціального функціонування й рольового емоційного функціонування підвищилися в основній групі — 58,5 ± 2,1 та 59,6 ± 2,5 ба-ла. У групі порівняння ці показники після лікування становили 41,3 ± 2,4 та 43,8 ± 2,6 бала (p < 0,05).
Отже, всі показники якості життя після лікування у хворих основної групи були істотно вищими, ніж у хворих групи порівняння.
Висновки
1. У хворих на гіпоферментний ХП у стадії загострення в поєднанні з ГЕРХ у всіх випадках ендоскопічно визначається пептичний езофагіт: в 71,3 % випадків — неерозивний, в 25,0 % випадків — ерозивний і в 3,7 % випадків — ерозивно-виразковий. Стравохід Барретта розвивається в 4,6 % випадків. Грижа стравохідного отвору діафрагми має місце в 27,8 % випадків, дуоденогастральний рефлюкс — в 35,0 % випадків. У пацієнтів із поєднаними захворюваннями переважає гіперацидність, що виявляється в 82,4 % випадків, причому частіше гіперацидність значна, селективна.
2. У хворих на ХП на фоні ГЕРХ вірогідно знижені показники якості життя, що характеризують як фізичне, так і психічне здоров''я.
3. Включення Гавіскону та креону в комплексне лікування поєднаної патології сприяє тому, що частота зникнення або зменшення болю в животі є в 1,26 раза більшою, а вираженість диспепсії стає в 1,27 раза нижчою, ніж після традиційного лікування. Запропонована нами терапія сприяє більш суттєвому поліпшенню зовнішньосекреторної функції ПЗ. Лікування з використанням Гавіскону та креону є в 1,59 раза ефективнішим щодо ерозій та виразок стравоходу, вірогідно кращим, ніж загальноприйнята терапія, а також впливає на сонографічну картину ПЗ, якість життя хворих.