Газета «Новости медицины и фармации» Гастроэнтерология (304) 2009 (тематический номер)
Вернуться к номеру
Влияние высоких доз урсодезоксихолевой кислоты на уровень трансаминаз у пациентов с гепатитом С
Авторы: Shuichi Sato, Tatsuya Miyake, Hiroshi Tobita, Naoki Oshima, Junichi Ishine, Takuya Hanaoka, Yuji Amano, Yoshikazu Kinoshita, Shimane University, School of Medicine, Izumo, Shimane, Япония
Версия для печати
Современное лечение хронического вирусного гепатита С основано на применении пегилированного интерферона в виде монотерапии или в комбинации с другими противовирусными средствами, такими как рибавирин или ингибиторы протеаз. Однако было показано, что подобное лечение является недостаточно эффективным у всех пациентов с 1-м генотипом вируса гепатита С (ВГС) и высоким содержанием данного вируса в организме, а также у всех пациентов с циррозом печени [1–4]. Урсодезоксихолевая кислота (УДХК) была обнаружена Hammarsten в
Для того чтобы оценить эффективность УДХК в дозе 900 мг/день при лечении ХГС, в настоящем исследовании увеличивали дозу данного препарата с 600 до 900 мг/день. В качестве первичной конечной точки исследования было выбрано изменение уровня АЛТ.
Материалы и методы исследования
Пациенты
С января по декабрь
Методы
За пациентами наблюдали в течение 4 недель, после чего доза УДХК (Urso®, Mitsubishi Tanabe Pharma Corp., Осака, Япония) была увеличена с 600 до 900 мг/день. В качестве первичной конечной точки, отражающей функцию печени, оценивали плазменный уровень АЛТ, в качестве вторичных конечных точек — АСТ и ГГТП. Величину данных показателей определяли по традиционным методикам. Образцы крови забирали во время периода наблюдения и на 0, 4, 8 и 24-й неделе после начала терапии. В этих точках времени были измерены плазменные уровни АЛТ, АСТ, ГГТП, альбумина и общего билирубина, было подсчитано количество тромбоцитов. Каждую 12-ю неделю или на 24-й неделе выполняли скрининг с помощью компьютерной томографии или ультрасонографии на предмет наличия ГЦК. Комплайенс к приему УДХК и развитие осложнений оценивали путем опроса пациентов или на основании данных из их дневников.
Статистический анализ
Достоверность изменений в концентрации АСТ, АЛТ, ГГТП, общего билирубина, альбумина и количестве тромбоцитов оценивали с помощью парного t-критерия Стьюдента. Различия считали значимыми при p < 0,05.
Результаты
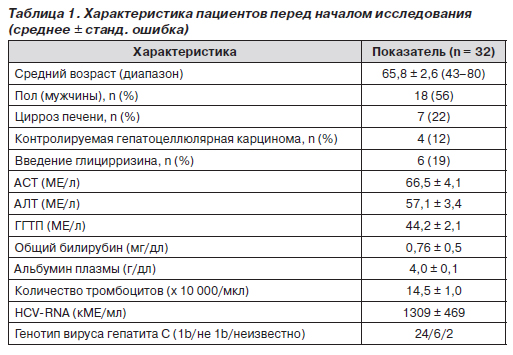
В общей сложности в исследование было включено 32 пациента. Их характеристика представлена в табл. 1. Из 7 пациентов с циррозом печени 5 соответствовало классу А, 2 — классу В по шкале Child. У 3 пациентов, имевших в анамнезе ГЦК, динамическая компьютерная томография подтвердила полное выздоровление после выполнения транскатетерной эмболизации артерий и/или чрескожной радиочастотной абляции за 24 недели или более до начала настоящего исследования. Комплайенс при лечении УДХК составил более 95 %.
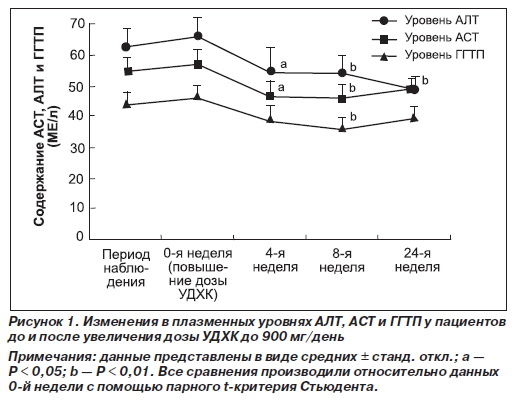
Изменение уровней АСТ, АЛТ и ГГТП при увеличении дозы УДХК
Плазменные уровни АЛТ, АСТ и ГГТП до и после назначения 900 мг/день УДХК представлены на рис. 1. Видно, что после назначения УДХК в этой дозировке уровень всех трех показателей в плазме крови значительно снижался на 4, 8 и 24-й неделях. Так, к 8-й неделе по сравнению с исходным уровнем снижение АЛТ составило 14,3 МЕ/л (22,1 %), АСТ — 10,5 МЕ/л (19,1 %), ГГТП — 9,8 МЕ/л (22,1 %).
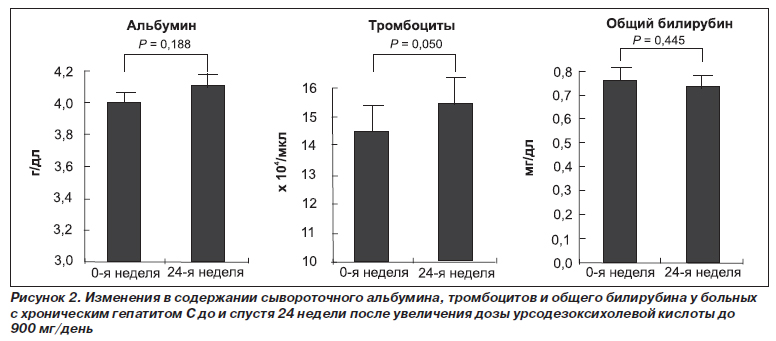
Изменение содержания в плазме альбумина, общего билирубина и количества тромбоцитов
К 24-й неделе лечения УДХК в дозе 900 мг/день плазменный уровень альбумина изменился с 4,0 до 4,1 г/дл, общего билирубина — с 0,76 до 0,73 г/дл, количество тромбоцитов — с 145 000/мкл до 154 000/мкл. Все наблюдаемые различия не достигали статистической значимости (р ≥ 0,05, рис. 2). Плазменный уровень HCV-RNA не менялся во время исследования.
Безопасность
Во время лечения УДХК в дозе 900 мг/день наблюдалось 3 случая осложнений (9,4 %): у 2 пациентов развилась диарея легкой степени, у 1 — ощущение дискомфорта в полости рта. Ни одно из этих осложнений не влияло на комплайенс к лечению УДХК. Спустя 24 недели после лечения повышенной дозой УДХК у 1 больного наблюдался рецидив ГЦК. Однако это заболевание было полностью излечено с помощью чрескожной радиочастотной абляции.
Обсуждение
Результаты настоящего исследования свидетельствуют о том, что повышение дозы УДХК с 600 до 900 мг/день приводило к улучшению биохимических показателей — АСТ, АЛТ и ГГТП — начиная с 1–2-й недели данного режима терапии. Причем значения биохимических показателей продолжали улучшаться вплоть до 24-й недели лечения повышенными дозами УДХК. Кроме того, на фоне проводимой терапии наблюдалась тенденция к увеличению количества тромбоцитов. Следовательно, полученные результаты показывают, что УДХК в дозе 900 мг/день может улучшать показатели функции печени у пациентов с хроническим гепатитом С, принимавших до этого УДХК в дозе 600 мг/день. В рамках настоящего исследования частота осложнений от проводимой терапии была ниже, чем в ранее выполненных работах [15–18]. Это, возможно, связано с тем, что пациенты, принявшие участие в настоящем исследовании, уже получали УДХК, что позволило им быстро адаптироваться к более высокой дозе данного препарата.
При естественном течении ХГС пациенты с нормальными плазменными уровнями аминотрансфераз склонны к более медленному прогрессированию фиброза и более низкой частоте развития ГЦК. Rino и соавт. [19] показали, что, в соответствии с данными многофакторного анализа, режим терапии (высокие или низкие дозы), направленной на снижение показателей, и уровень АЛТ являются наиболее важными факторами, связанными со снижением риска развития ГЦК у пациентов с ВГС-связанным циррозом класса А по классификации Child при наблюдении свыше 10 лет. Кроме того, в одном из предыдущих исследований было показано, что после операции по поводу ГЦК рецидивы наблюдались чаще среди тех пациентов, у которых были более высокие плазменные уровни АЛТ — выше 80 МЕ/л [20]. В исследовании IHIT (Подавление гепатокарциногенеза интерферонотерапией) было обнаружено, что риск развития ГЦК после лечения интерфероном, в ходе которого не была достигнута вирологическая ремиссия, сильно зависит от уровня АЛТ. В этой же работе было показано, что отношение шансов развития ГЦК у больных со стойкой вирологической ремиссией было таким же, как и у больных со стойкой ремиссией биохимических показателей [21]. Следовательно, высокие дозы УДХК в потенциале могут снижать риск развития и рецидивов ГЦК посредством снижения плазменного уровня АЛТ.
Противовоспалительный механизм УДХК связывают со снижением цитотоксичности гидрофобных желчных кислот, стимуляцией гепатобилиарной секреции, подавлением NF-kB-зависимой транскрипции путем связывания с глюкокортикоидным рецептором и снижением индуцированной провоспалительными цитокинами транскрипции фосфолипазы А2 [22–28].
Длительные эффекты от применения УДХК у пациентов с ХГС до конца не выяснены [29]. Изменения в гистологии печени при лечении УДХК могут оставаться неясными при коротких периодах наблюдения. В настоящем исследовании увеличение дозы УДХК до 900 мг/день в течение 24 недель влекло за собой тенденцию к увеличению содержания тромбоцитов. Как известно, у больных с ВГС-связанными хроническими заболеваниями печени количество тромбоцитов в крови отражает гистологическую картину печени. В частности, при низком содержании тромбоцитов следует предполагать прогрессирование печеночного фиброза [30–33]. Учитывая приведенные данные, в будущем предстоит изучить влияние УДХК на гистологическую картину печени.
Таким образом, пероральный прием повышенной дозы — 900 мг/день — урсодезоксихолевой кислоты, несмотря на отсутствие противовирусного эффекта, оказывает положительное влияние на снижение активности хронического гепатита и цирроза.
Впервые опубликовано в World Journal of Gastroenterology,
2009 June 14. — 15(22). — 2782-2786.
1. Sarrazin C., Rouzier R., Wagner F., Forestier N., Larrey D., Gupta S.K., Hussain M., Shah A., Cutler D., Zhang J., Zeuzem S. SCH
2. Hadziyannis S.J., Sette H. Jr, Morgan T.R., Balan V., Diago M., Marcellin P., Ramadori G., Bodenheimer H. Jr, Bernstein D., Rizzetto M., Zeuzem S., Pockros P.J., Lin A., Ackrill A.M. Peginterferon-alpha-2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose // Ann. Intern. Med. — 2004. — 140. — 346-355.
3. Kieffer T.L., Sarrazin C., Miller J.S., Welker M.W., Forestier N., Reesink H.W., Kwong A.D., Zeuzem S. Telaprevir and pegylated interferon-alpha-2a inhibit wild-type and resistant genotype 1 hepatitis C virus replication in patients // Hepatology. — 2007. — 46. — 631-639.
4. Poynard T., McHutchison J., Manns M., Trepo C., Lindsay K., Goodman Z., Ling M.H., Albrecht J. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C // Gastroenterology. — 2002. — 122. — 1303-1313.
5. Poupon R., Serfaty L. Ursodeoxycholic acid in chronic hepatitis C // Gut. — 2007. — 56. — 1652-1653.
6. Bateson M.C., Ross P.E., Diffey B.L. Ursodeoxycholic acid in primary biliary cirrhosis // Lancet. — 1989. — 1. — 898-899.
7. Oka H., Toda G., Ikeda Y., Hashimoto N., Hasumura Y., Kamimura T., Ohta Y., Tsuji T., Hattori N., Namihisa T. A multi-center double-blind controlled trial of ursodeoxycholic acid for primary biliary cirrhosis // Gastroenterol. Jpn. — 1990. — 25. — 774-780.
8. Crosignani A., Podda M., Battezza-ti P.M., Bertolini E., Zuin M., Watson D., Setchell K.D. Changes in bile acid composition in patients with primary biliary cirrhosis induced by ursodeoxycholic acid administration // Hepatology. — 1991. — 14. — 1000-1007.
9. Poupon R.E., Poupon R., Balkau B. Ursodiol for the longterm treatment of primary biliary cirrhosis. The UDCA-PBC Study Group // N. Engl. J. Med. — 1994. — 330. — 1342-1347.
10. Heathcote E.J., Cauch-Dudek K., Walker V., Bailey R.J., Blendis L.M.,
11. Lindor K.D., Therneau T.M., Jorgen-sen R.A., Malinchoc M., Dickson E.R. Effects of ursodeoxycholic acid on survival in pati-ents with primary biliary cirrhosis // Gastroenterology. — 1996. — 110. — 1515-1518.
12. Jackson H., Solaymani-Dodaran M., Card T.R., Aithal G.P., Logan R., West J. Influence of ursodeoxycholic acid on the mortality and malignancy associated with primary biliary cirrhosis: a population-based cohort study // Hepatology. — 2007. — 46. — 1131-1137.
13. Chazouilleres O., Poupon R., Capron J.P., Metman E.H., Dhumeaux D., Amouretti M., Couzigou P., Labayle D., Trinchet J.C. Ursodeoxycholic acid for primary sclerosing cholangitis // J. Hepatol. — 1990. — 11. — 120-123.
14. Nakagawa S., Makino I., Ishizaki T., Dohi I. Dissolution of cholesterol gallstones by ursodeoxycholic acid // Lancet. — 1977. — 2. — 367-369.
15. Takano S., Ito Y.,
16. Omata M., Yoshida H., Toyota J., Tomita E., Nishiguchi S., Hayashi N., Iino S., Makino I., Okita K., Toda G., Tanikawa K., Kumada H. A large-scale, multicentre, double-blind trial of ursodeoxycholic acid in patients with chronic hepatitis C // Gut. — 2007. — 56. — 1747-1753.
17. Olsson R., Boberg K.M., de Muckadell O.S., Lindgren S., Hultcrantz R., Folvik G., Bell H., Gangsoy-Kristiansen M., Matre J., Rydning A., Wikman O., Danielsson A., Sandberg-Gertzen H., Ung K.A., Eriksson A., Loof L., Prytz H., Marschall H.U., Broome U. High-dose ursodeoxycholic acid in primary sclerosing cholangitis: a 5-year multicenter, randomized, controlled study // Gastroenterology. — 2005. — 129. — 1464-1472.
18. Lirussi F., Beccarello A., Bortolato L., Morselli-Labate A.M., Crovatto M., Ceselli S., Santini G., Crepaldi G. Long-term treatment of chronic hepatitis C with ursodeoxycholic acid: influence of HCV genotypes and severity of liver disease // Liver. — 1999. — 19. — 381-388.
19. Rino Y., Tarao K., Morinaga S., Ohkawa S., Miyakawa K., Hirokawa S., Masaki T., Tarao N., Yukawa N., Saeki H., Takanashi Y., Imada T. Reduction therapy of alanine aminotransferase levels prevent HCC development in patients with HCV-associated cirrhosis // Anticancer Res. — 2006. — 26. — 2221-2226.
20. Tarao K., Takemiya S., Tamai S., Sugimasa Y., Ohkawa S., Akaike M., TanabeH., Shimizu A., Yoshida M., Kakita A. Relationship between the recurrence of hepatocellular carcinoma (HCC) and serum alanine aminotransferase levels in hepatectomized patients with hepatitis C virusassociated cirrhosis and HCC // Cancer. — 1997. — 79. — 688-694.
21. Yoshida H., Shiratori Y., Moriyama M., Arakawa Y., Ide T., Sata M., Inoue O., Yano M., Tanaka M., Fujiyama S., Nishiguchi S., Kuroki T., Imazeki F., Yokosuka O., Kinoyama S., Yamada G., Omata M. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy // Ann. Intern. Med. — 1999. — 131. — 174-181.
22. Miura T., Ouchida R., Yoshikawa N., Okamoto K., Makino Y., Nakamura T., Morimoto C., Makino I., Tanaka H. Functional modulation of the glucocorticoid receptor and suppression of NF-kappaB-dependent transcription by ursodeoxycholic acid // J. Biol. Chem. — 2001. — 276. — 47371-47378.
23. Park I.H., Kim M.K., Kim S.U. Ursodeoxycholic acid prevents apoptosis of mouse sensory neurons induced by cisplatin by reducing P53 accumulation // Biochem. Biophys. Res. Commun. — 2008. — 377. — 1025-1030.
24. Rodrigues C.M., Fan G., Ma X., Kren B.T., Steer C.J. A novel role for ursodeoxycholic acid in inhibiting apoptosis by modulating mitochondrial membrane perturbation // J. Clin. Invest. — 1998. — 101. — 2790-2799.
25. Tanaka H., Makino I. Ursodeoxycholic acid-dependent activation of the glucocorticoid receptor // Biochem. Biophys. Res. Commun. — 1992. — 188. — 942-948.
26. Ikegami T., Matsuzaki Y., Fukushima S., Shoda J., Olivier J.L., Bouscarel B., Tanaka N. Suppressive effect of ursodeoxycholic acid on type IIA phospholipase A2 expression in HepG2 cells // Hepatology. — 2005. — 41. — 896-905.
27. Kano M., Shoda J., Irimura T., Ueda T., Iwasaki R., Urasaki T., Kawauchi Y., Asano T., Matsuzaki Y., Tanaka N. Effects of long-term ursodeoxycholate administration on expression levels of secretory low-molecular-weight phospholipases A2 and mucin genes in gallbladders and biliary composition in patients with multiple cholesterol stones // Hepatology. — 1998. — 28. — 302-313.
28. Yoshikawa M., Tsujii T., Matsumura K., Yamao J., Matsumura Y., Kubo R., Fukui H., Ishizaka S. Immunomodulatory effects of ursodeoxycholic acid on immune responses // Hepatology. — 1992. — 16. — 358-364.
29. Attili A.F., Rusticali A., Varriale M., Carli L., Repice A.M., Callea F. The effect of ursodeoxycholic acid on serum enzymes and liver histology in patients with chronic active hepatitis. A 12-month double-blind, placebo-controlled trial // J. Hepatol. — 1994. — 20. — 315-320.
30. Shiratori Y., Omata M. Predictors of the efficacy of interferon therapy for patients with chronic hepatitis C before and during therapy: how does this modify the treatment course? // J. Gastroenterol. Hepatol. — 2000. — 15, Suppl. — E141-E151.
31. Giannini E., Borro P., Botta F., Fumagalli A., Malfatti F., Podesta E., Romagnoli P., Testa E., Chiarbonello B., Polegato S., Mamone M., Testa R. Serum thrombopoietin levels are linked to liver function in untreated patients with hepatitis C virus-related chronic hepatitis // J. Hepatol. — 2002. — 37. — 572-577.
32. Macias J., Giron-Gonzalez J.A., Gonzalez-Serrano M., Merino D., Cano P., Mira J.A., Arizcorreta-Yarza A., Ruiz-Morales J., Lomas-Cabeza J.M., Garcia-Garcia J.A., Corzo J.E., Pineda J.A. Prediction of liver fibrosis in human immunodeficiency virus/hepatitis C virus coinfected patients by simple noninvasive indexes // Gut. — 2006. — 55. — 409-414.
33. Shaheen A.A., Myers R.P. Diagnostic accuracy of the aspartate aminotransferase-to-platelet ratio index for the prediction of hepatitis C-related fibrosis: a systematic review // Hepatology. — 2007. — 46. — 912-921.