Газета «Новости медицины и фармации» Гастроэнтерология (304) 2009 (тематический номер)
Вернуться к номеру
Аномалии толстой кишки
Авторы: Н.Б. Губергриц, Г.М. Лукашевич, П.Г. Фоменко, Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Аномалии толстой кишки, ее ротации и фиксации
Варианты аномалий кишечника в зависимости от клинических проявлений
Проявления пороков развития кишечника (ПРК) могут быть различными. В зависимости от наиболее вероятных и ярких клинических проявлений ПРК разделяют на несколько групп: очевидные при первичном осмотре; проявляющиеся преимущественно кишечной непроходимостью; ПРК, при которых доминирующий симптом — кишечное кровотечение; ПРК, признаком которых является обнаружение объемного образования в брюшной полости; ПРК с преобладанием в клинике диареи; ПРК, протекающие с болями в животе; ПРК, главным симптомом которых является потеря белка с калом (табл. 1).
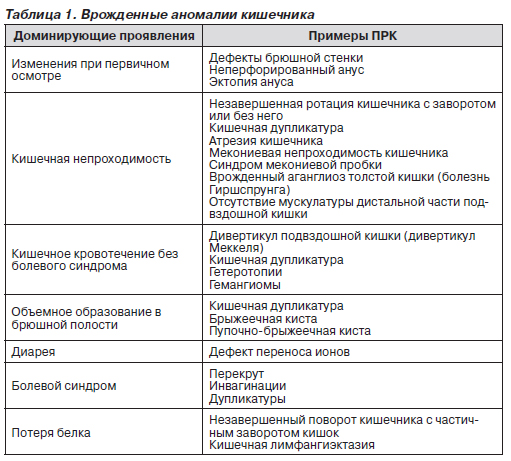
Некоторые аномалии выявляются уже при осмотре младенца. Так, дефекты брюшной стенки очевидны при рождении. Большинство аноректальных врожденных пороков, например неперфорированный анус, выявляются при первичном осмотре. Если анальное отверстие имеет адекватный диаметр для прохождения кала, то диагноз других аномалий ставится позже, когда ребенок становится старше и развиваются различные клинические проявления (запоры, боли, кровотечения и др.).
Симптомы непроходимости кишечника у новорожденных включают рвоту желчью, вздутие живота, неотхождение мекония и желтуху. Отхождение мекония не исключает наличия у новорожденного высокой кишечной непроходимости. Необходимо тщательно проанализировать возможные причины рвоты желчью у ребенка из-за возможности перемежающейся непроходимости, связанной с периодически возникающим и самостоятельно разрешающимся заворотом кишок. У пациентов с высокой кишечной непроходимостью возможно развитие негемолитической гипербилирубинемии со значительным преобладанием непрямого билирубина (это нехарактерно для дистальной кишечной непроходимости). Предполагают, что развитие желтухи обусловлено повышенной энтерогепатической циркуляцией билирубина и снижением активности глюкоронилтрансферазы.
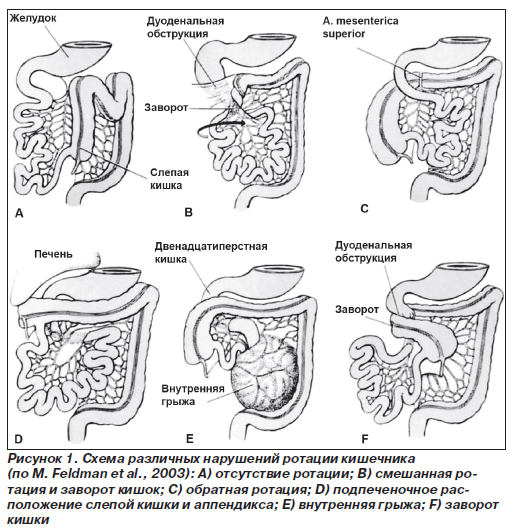
Обследование и лечение пациентов с очевидной кишечной непроходимостью должны проводиться одновременно. Для поддержания у младенца нормальной температуры и гомеостаза следует проводить интенсивную терапию. Аспирация желудочного содержимого помогает уменьшить метеоризм. Обзорная рентгенограмма брюшной полости в горизонтальном и вертикальном положении выявляет чаши Клойбера, кальцификаты в органах брюшной полости, мекониевые пробки. Рентген-исследование с контрастом помогает выявить место закупорки — в толстой или тонкой кишке — и оценить наличие, вариант и степень нарушения ротации кишечника (рис. 1).
При подозрении на возможную перфорацию кишечника вместо бария применяют водорастворимые контрасты. Гиперосмотическая клизма с контрастом может служить как диагностическим, так и терапевтическим средством у больных с мекониевой пробкой или мекониевой непроходимостью кишечника. Если исследование подтверждает нарушение ротации кишечника, то необходимо провести рентген-исследование с контрастированием per os для определения расположения связки Трейца.
Аномалии с доминированием других клинических проявлений представлены в табл. 1.
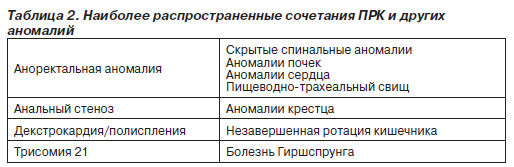
Важно учитывать, что многие ПРК сочетаются друг с другом и с другими аномалиями, т.е. при выявлении одной аномалии следует обследовать пациента для возможного обнаружения другой аномалии (табл. 2).
Варианты аномалий кишечника в зависимости от типа ПРК
Дефекты брюшной стенки (эмбриональная грыжа и гастрошизис). Частота эмбриональной грыжи составляет около 2,5 случая на 10 тыс. новорожденных, а гастрошизиса — 1 случай на 10 тыс. новорожденных в целом, но может достигать 7 и более случаев на 10 тыс. новорожденных у матерей моложе 20 лет.
Эмбриональная грыжа представляет собой выпячивание органов брюшной полости, иногда и печени, в месте прикрепления пуповины. Как правило, размер дефекта брюшной стенки не превышает
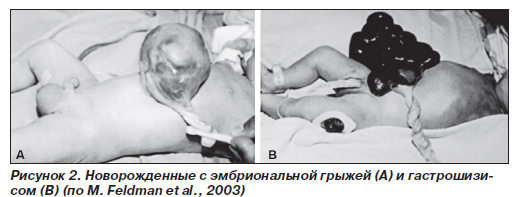
Гастрошизис является следствием горизонтального (поперечного) дефекта брюшной стенки в области пупка. Кишечник, не защищенный мембранозным мешком или его рудиментом, имеет аномалии, причем его поверхность матовая, а стенка утолщена из-за воздействия амниотической жидкости (рис. 2). Другие органы брюшной полости, забрюшинного пространства и таза, в том числе мочевой пузырь, почки, яичники, матка, могут находиться среди петель эвентированного кишечника. Пуповина прикреплена нормально. Приблизительно в четверти случаев у пациентов с гастрошизисом имелись другие врожденные дефекты, включая агенезию желчного пузыря и почек.
Хирургическое устранение этих дефектов проводят в первый же день жизни. Для того чтобы определить, сможет ли брюшная полость вместить выпячивающиеся внутренние органы, необходимы тщательная клиническая оценка и практический опыт. Одноразовое закрытие раны осуществляют в половине случаев, во второй половине необходимо постепенное восстановление нормальной топографии органов брюшной полости. Во время и после оперативного лечения возможно развитие некротического энтероколита, перфорации кишечника или его некроза, а также осложнений, связанных с продолжительным парентеральным питанием.
Аномалии ротации и фиксации. Между шестой и десятой неделями беременности кишечник выпячивается в пуповину и поворачивается, возвращаясь в брюшную полость и устойчиво фиксируя основание брыжейки. Частота аномалий ротации составляет около 1 %, у новорожденных мужского пола встречается в 2 раза чаще. Выделяют 3 механизма в патогенезе нарушений ротации кишечника: нарушения внутриутробного поворота кишечника, развития и фиксации отдельных сегментов кишки. Наиболее выражены аномалии положения кишки при полном обратном расположении органов брюшной полости, когда желудок, нисходящая и сигмовидная кишка, селезенка находятся справа, а слепая, восходящая кишка и печень — слева. При частичном верхнем обратном расположении органов брюшной полости аномалия ограничивается ненормальным поворотом желудка и двенадцатиперстной кишки, а при нижнем варианте аномалии наблюдается обратное расположение тонкой и толстой кишки. Обратное расположение органов брюшной полости (полное или частичное) входит в триаду Kartagener (бронхоэктазы — хронический синусит с полипами носовых ходов — обратное расположение органов брюшной полости).
Аномалии ротации и фиксации кишечника заключаются в отсутствии ротации, ее незавершенности, обратной ротации и неправильном прикреплении брыжейки (рис. 1).
Отсутствие поворота (нонротация) обусловлено остановкой I стадии нормальной ротации кишечника в самом ее начале. Как следствие, кишечник «подвешен» на узкой дорсальной брыжейке, которая является общей для тонкой и толстой кишки; тонкая кишка лежит справа, а толстая кишка — слева в брюшной полости (рис. 1). Несмотря на отсутствие связок, препятствующих прохождению содержимого, кишечник может перекручиваться вдоль своей продольной оси. В связи с этим возможны завороты кишечника, причем точкой вращения всегда является корень брыжейки с верхней брыжеечной артерией и веной. Заворот обычно охватывает всю тонкую кишку, слепую кишку и начальную часть восходящей кишки. Нонротация встречается с частотой в 0,2 %. Левостороннее положение слепой кишки вызывает большие сложности в диагностике острого аппендицита. Дефект зачастую сопровождается другими аномалиями, например эмбриональной грыжей, гастрошизисом, дуоденальной атрезией и/или стенозом, дивертикулом подвздошной кишки, билиарной атрезией, кольцевидной поджелудочной железой и неперфорированным анусом. Отсутствие вращения пупочной петли наблюдается только в сочетании с врожденной пупочной грыжей.
Остановка ротации кишечника на II стадии (мальротация) проявляется тремя изменениями. Слепая кишка поворачивается и фиксируется, но двенадцатиперстная кишка этого не делает, что ведет к ее ущемлению связками (пучки Ледда) (рис. 1). Менее распространен случай, когда слепая и двенадцатиперстная кишка поворачиваются в противоположных направлениях, вызывая блокаду толстой кишки вследствие компрессии извне верхними брыжеечными сосудами (рис. 1), или же дуоденальная петля поворачивается в обратном направлении при нормальной ротации слепой кишки, заключая тем самым тонкую кишку в ее брыжейку с формированием внутренней грыжи (рис. 1).
При нарушениях III стадии ротации кишечника дуоденальная петля поворачивается в правильном направлении и фиксируется, но этого не происходит со слепой кишкой, что приводит к отсутствию надежной фиксации слепой и восходящей кишки. Слепая кишка слабо зафиксирована и расположена высоко в правом верхнем квадранте с дефектными связками или без них (рис. 1). Высокое положение слепой кишки (Coecum altum congenitum) создает большие трудности в диагностике и лечении аппендицита. При таком расположении слепой кишки она также является подвижной, при этом формируется синдром подвижной слепой кишки (Coecum mobile).
Общая брыжейка. Общая брыжейка обычно является следствием неполной ротации. Для нее характерно отсутствие соединений между восходящей частью брыжейки толстой кишки и задней брюшной стенкой. Восходящая кишка располагается вдоль задней стенки правой половины брюшной полости, не будучи прикрепленной к ней. Частично соединенная с брыжейкой толстой кишки слепая кишка и терминальный отдел подвздошной кишки могут свободно перемещаться в брюшной полости (А.И. Парфенов, 2002).
Избыточная подвижность кишечных сегментов в случае общей брыжейки благоприятствует заворотам тонкой и толстой кишки (илеоцекальный заворот). Эта форма аномалии фиксации является наиболее частой и встречается у 14 % детей грудного возраста.
Нарушения ротации нередко приводят к более или менее значительному сдавлению двенадцатиперстной кишки длинной ножкой брыжейки, что вызывает клиническую картину артериомезентериальной непроходимости или недостаточности.
Артериомезентериальная непроходимость может развиваться при нарушениях ротации, а также самостоятельно, если верхняя брыжеечная артерия ответвляется от аорты под чрезмерно острым углом и сдавливает двенадцатиперстную кишку в области нижней горизонтальной ее части (А.И. Парфенов, 2002).
Клиника. Клинические симптомы определяются тремя типами изменений кишки: сужением ее просвета (артериомезентериальной непроходимостью), заворотом кишечника, нарушением кровоснабжения кишки вследствие перекрута участка брыжейки. В типичных случаях клиника характеризуется острой, подострой или рецидивирующей кишечной непроходимостью. У 90 % пациентов с нарушениями ротации кишечника клинические проявления обнаруживаются в течение первых 2 месяцев жизни в виде симптомов кишечной непроходимости. У некоторых больных наблюдаются рвота желчью, выраженный метеоризм в сочетании с гипотонией, шоком и кровянистым стулом. У других больных клиника может быть менее выраженной и проявляться болями в животе, медленным увеличением массы тела, гипотрофией, диареей с синдромом мальабсорбции, запорами, раздражительностью, апатией, наличием свежей крови в испражнениях и периодической рвотой, отставанием в развитии. В редких случаях мальротация имеет место у нескольких членов семьи, что подтверждает наличие генетической предрасположенности. В легких случаях появление симптомов может задерживаться до второй, третьей или четвертой декады жизни.
Артериомезентериальная непроходимость может возникать остро, после обильной пищи. Возникает резкая боль в подложечной области, повторная рвота. Наблюдается асимметрия живота за счет выбухающего в подложечной области переполненного желудка. В отличие от острой кишечной непроходимости иного генеза при артериомезентериальной непроходимости состояние улучшается после принятия больным коленно-локтевого положения. В большинстве случаев отмечается быстрое прохождение желудочно-кишечного содержимого через дуоденоеюнальный изгиб с ликвидацией симптомов непроходимости.
Хронические формы артериомезентериальной непроходимости проявляются более или менее постоянными болями в эпигастральной области, уменьшающимися в коленно-локтевом положении (А.И. Парфенов, 2002).
Синдром подвижной слепой кишки характеризуется рецидивирующими болями в правой подвздошной области или внизу живота, зависящими от положения тела.
Причина появления этих симптомов кроется в нарушениях проходимости и кровоснабжения в илеоцекальной зоне вследствие эпизодических перекрутов восходящей толстой кишки. Анализ операционного и секционного материала позволяет в некоторых случаях выявлять признаки фиброзного периколита и неспецифического лимфаденита в удлиненной брыжейке этого отдела кишечника (А.И. Парфенов, 2002).
Диагностика синдрома подвижной слепой кишки представляет большие трудности. Больные могут в течение длительного времени безуспешно лечиться по поводу систематических болей в животе, ограничивающих трудоспособность. Между тем оперативное лечение приводит к выздоровлению.
Синдром Уилки (функциональная непроходимость дистальной трети двенадцатиперстной кишки, где она перекрещивается с верхней брыжеечной артерией) характеризуется интермиттирующей рвотой с примесью желчи, исхуданием, слабостью, вынуждающей больного соблюдать постельный режим; рвота прекращается и общее самочувствие улучшается, если больной лежит на спине. Рентгенологически наблюдается расширение желудка и проксимального отдела двенадцатиперстной кишки; резкая граница бария в начале дистальной трети двенадцатиперстной кишки, на месте, где последняя перекрещивается с верхней брыжеечной артерией (А.И. Парфенов, 2002).
Синдром Ледда — кишечная непроходимость, развивающаяся у больных с аномалиями ротации кишечника. Встречается преимущественно у детей. В клинической картине доминируют симптомы кишечной непроходимости (острой или рецидивирующей), которые вызываются заворотом тонкой кишки в сочетании с пережатием двенадцатиперстной кишки эмбриональными тяжами, идущими от париетальной брюшины сперва к слепой кишке и натягивающимися при завороте (А.И. Парфенов, 2002).
Диагностика. Диагноз нарушений ротации и фиксации кишечника устанавливается клинически и рентгенологически. Для диагностики артериомезентериальной непроходимости необходимо полипозиционное рентгенологическое исследование желудка, при котором выявляют расширение его, а также двенадцатиперстной кишки, задержку бария и его быстрое прохождение после принятия больным коленно-локтевого положения.
Лечение. Больные с острой кишечной непроходимостью нуждаются в интенсивной терапии и ургентном хирургическом вмешательстве. Если состояние больного позволяет, то для подтверждения предоперационного диагноза незавершенной ротации кишечника возможно проведение рентгенологического исследования. При оперативном лечении используют операцию Ледда. Для предупреждения рецидива заворота кишечника или перекручивания брыжейки производят фиксирование двенадцатиперстной и ободочной кишки к задней брюшной стенке.
В легких случаях артериомезентериальной непроходимости лечение может быть консервативным. Больному объясняют необходимость принятия пищи лежа на правом боку, а при появлении болей целесообразно принимать коленно-локтевое положение, спазмолитические средства. При выраженном болевом синдроме необходимо оперативное лечение (позадиободочная дуоденоеюностомия по Ледду; если такая операция невозможна, то накладывают впередиободочный дуоденоеюноанастомоз; рассечение связки Трейца обычно нецелесообразно).
Дупликатуры. Кишечная дупликатура является редким врожденным пороком с неясным патогенезом. Патологоанатомические исследования показали, что частота заболевания составляет 2 случая на 9000 детей. Дупликатуры представляют собой кистозные, трубчатые или дивертикулярные образования, расположенные на брыжеечной стороне кишки и, вероятно, появившиеся в результате нарушения формирования сосудов эмбрионального кишечника. Хотя дупликатуры чаще всего возникают в тощей и подвздошной кишке, они могут также появляться и в любом другом отделе кишечника. Полость дупликатуры обычно полностью отделена от полости нормальной кишки, но обе кишки имеют общую часть мышечной оболочки и сосудистой системы. Стенки дупликатур могут быть покрыты желудочной слизистой оболочкой различной степени эмбрионального созревания. Эта особенность позволяет выявить ряд нарушений методом радиоизотопной (меккелевой) сканограммы с помощью 99mTc.
Кишечные дупликатуры тонкой кишки, как правило, имеют клинические проявления (в отличие от дупликатур толстой кишки), которые появляются в первый год жизни в виде кишечной непроходимости и/или пальпируемого опухолевидного образования в брюшной полости. У взрослых больных могут наблюдаться аналогичные острые симптомы, а также кровотечения и малигнизация.
Диагностику проводят с помощью сонографии, сканирования или КТ брюшной полости.
Лечение включает хирургическую резекцию дупликатуры и прилегающего сегмента кишечника с наложением анастомоза «конец в конец».
Кишечная атрезия — полное врожденное прерывание просвета кишки, которое приводит к кишечной непроходимости. В тонкой кишке 50 % атрезий возникает в двенадцатиперстной кишке, 36 % — в тощей, 14 % — в подвздошной. Атрезии толстой кишки менее распространены и составляют не более 10 % от всех кишечных атрезий.
Частота кишечных атрезий варьирует от 1 случая на 330 до 1 случая на 1500 живых новорожденных. Изолированная атрезия тощей кишки чаще встречается у чернокожих младенцев, а также у новорожденных с низкой массой тела, у близнецов. На долю редкой разновидности атрезии тощей кишки в виде «яблочной кожуры» приходится менее 5 % всех атрезий. У пациентов с атрезией тонкой кишки встречаются и другие аномалии: кольцевидная поджелудочная железа, мальротация кишечника, эктопический анус, гастрошизисы, дупликатура подвздошной кишки и др. Приблизительно 10 % белых новорожденных с атрезиями тощей и подвздошной кишок страдают кистозным фиброзом. В литературе есть отдельные данные об атрезии тощей кишки, возникающей при приеме матерью во время беременности средства от головой боли Cаfegot или кокаина, а также в случае, если мать в период беременности страдала иммунодефицитом или была инфицирована вирусом краснухи.
Лечение включает резекцию участка кишки с атрезией с наложением анастомоза «конец в конец».
Аноректальные пороки развития. Гетеротопии в кишечнике. Опухолевые и опухолевидные пороки развития кишечника
Аноректальные пороки развития
Эпидемиология и этиология. Аноректальные пороки развития сравнительно широко распространены, их частота составляет 1 случай на 2–5 тыс. новорожденных. Эти пороки чаще встречаются у младенцев мужского, чем женского пола. Почти в половине случаев пороки развития кишечника возникают как изолированные аномалии, у остальных больных они сопровождаются другими генетическими дефектами. Наиболее частые сочетания нарушений обозначают аббревиатурами VATER или VACTERL (сочетания вертебральных, анальных, кардиальных, трахеальных, пищеводных, почечных аномалий и аномалий конечностей). В табл. 3 приведены данные о других аномалиях, наблюдаемых у больных с аноректальными ПРК. Этиология этих пороков развития не выяснена. Случаи сахарного диабета и приема лекарств, в том числе талидомида, фенитоина и тридиона, более характерны для матерей младенцев с аноректальными пороками развития, чем для матерей младенцев без таких пороков.
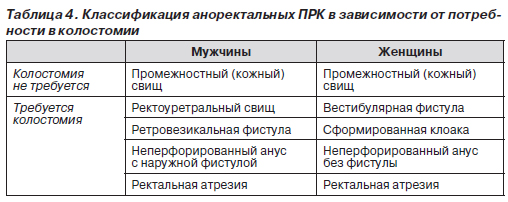
Классификация. Аноректальные ПРК классифицируются в зависимости от расположения окончания кишечника относительно мышц-леваторов, образующих диафрагму таза. Считается, что младенцы, у которых окончание толстой кишки проходит через леваторы, имеют так называемый низкий дефект развития, как правило, устраняемый с помощью местного хирургического вмешательства с хорошим исходом. В случае же, когда окончание толстой кишки расположено внутри или над мышцами-леваторами (высокий дефект развития), то данный ПРК обычно распространяется на мочевые пути (у мальчиков) и половые органы (у девочек), что затрудняет устранение аномалии хирургическим путем. В этих случаях используют различные оперативные вмешательства в зависимости от пола ребенка (табл. 4).
Функционирование анального сфинктера после хирургического вмешательства сильно зависит от того, сохранена ли его иннервация. Сохранение иннервации обусловлено сопутствующими аномалиями крестцового отдела позвоночника, спинного мозга, аномалиями центральной нервной системы.
Диагностика и лечение. В большинстве случаев аноректальные ПРК выявляют при рождении во время тщательного осмотра промежности. В качестве дополнительных методов применяют ректоскопию и сонографию.
Главными методами лечения ребенка с неперфорированным анусом являются декомпрессия кишечника методом орогастральной или назогастральной аспирации. Дальнейший вариант хирургического лечения зависит от наличия других аномалий. Для их выявления применяют сонографию и контрастирование фистул с последующим суточным ожиданием для определения их топографии. Если не обнаружены анальное отверстие, промежностная мембрана или фистула, то тогда усилия следует направить на определение месторасположения прямой кишки и любой фистулы. Большое значение также имеет выявление аномалий позвоночника, спинного мозга, сердца, других аномалий пищеварительного тракта. После тщательного обследования решается вопрос о варианте хирургического вмешательства.
Гетеротопии — дизонтогенетические дистопии эпителия из других органов, которые являются следствием нарушения его дифференциации в эмбриональном периоде.
В тонкой кишке встречаются гетеротопии желудочного эпителия (особенно в дивертикуле Меккеля), ткани поджелудочной железы. В толстой кишке гетеротопии встречаются редко. Вследствие секреции желудочным эпителием соляной кислоты и пепсиногена в месте его гетеротопии могут развиваться пептические язвы с кровотечением. Возможна малигнизация гетеротопий.
При развитии пептических язв лечение консервативное — противоязвенное. При склонности к кровотечениям или подозрении на малигнизацию лечение хирургическое — резекция кишки. В случае гетеротопии ткани поджелудочной железы обычно проводят динамическое наблюдение и лишь в случае изъязвления желательно оперативное лечение.
Опухолевидные и опухолевые ПРК
Гамартия (в переводе с греч. — «недостаток», «погрешность») — аномалия развития, заключающаяся в неправильном соотношении тканей в анатомических структурах или в появлении остатков зародышевых образований, отсутствующих в норме в зрелом организме. Образующееся из такой ткани опухолевидное образование — гамартома — возникает в результате нарушения эмбрионального развития органов и тканей, состоит из тех же компонентов, что и орган, где оно находится, но отличается их неправильным расположением и степенью дифференцировки. Нередко наблюдается бластоматозное перерождение гамартом (А.И. Парфенов, 2002).
Гамартома бруннеровых желез — гиперплазия, полипоидная пролиферация или аденома бруннеровых желез. Такие гамартомы чаще всего располагаются в двенадцатиперстной кишке.
Различают полиповидные гемангиомы тонкой и толстой кишки, множественные флебэктазии (в том числе телеангиэктазии Ослера), кавернозные гемангиомы и генерализованный гемангиоматоз.
Гемангиомы кишечника встречаются редко. Они составляют 0,3 % от всех опухолей желудочно-кишечного тракта.
Различают полиповидные гемангиомы тонкой и толстой кишки, множественные флебэктазии (в том числе телеангиэктазии Ослера), кавернозные гемангиомы и генерализованный гемангиоматоз. Полиповидные гемангиомы тонкой и толстой кишки могут приводить к обструкции, инвагинации, кишечным кровотечениям и хронической анемии. Около 30 % всех ангиоматозных повреждений протекают бессимптомно.
При множественных флебэктазиях речь идет о многочисленных «опухолях» голубоватого цвета величиной от 0,1 до
Телеангиэктазии Ослера. Эта болезнь описана англо-американским терапевтом W. Osler. Она характеризуется наличием множественных наследственных телеангиэктазий кожи и слизистых оболочек.
Геморрагические телеангиэктазии наследуются по аутосомно-доминантному типу. Распространенность телеангиэктазий достигает 15,6 на 100 тыс. населения. Изменения в белковом синтезе нарушают рост кровеносных сосудов. В результате образуются артериовенозные соустья между небольшими сосудами, которые ведут к образованию телеангиэктазий.
Телеангиэктазии локализуются чаще на губах и слизистой носа, но также и в других органах, в частности в стенках тонкой и толстой кишок. У большинства пациентов телеангиэктазии не вызывают клинических симптомов, но у 13 % больных могут возникать серьезные желудочно-кишечные кровотечения (А.И. Парфенов, 2002).
При кавернозных гемангиомах следует различать диффузно-инфильтративную и полиповидную формы. Поверхность кавернозной гемангиомы окрашена в голубоватый цвет, имеет мягко-эластическую консистенцию. Полипозная форма, как правило, бывает представлена солитарной опухолью. Она составляет примерно 15 % от всех ангиоматозных поражений желудочно-кишечного тракта. Клиническая картина кавернозной гемангиомы кишечника характеризуется кровотечениями, кишечной непроходимостью или повторными инвагинациями. Диффузно-инфильтративные кавернозные гемангиомы локализуются преимущественно в слизистой оболочке и постепенно распространяются на все слои кишки. Кавернозные гемангиомы находятся одинаково часто в тощей и подвздошной кишке, реже — в двенадцатиперстной кишке. По мере разрастания опухоли возможно появление клинических симптомов, в первую очередь кровотечений, затем симптомов непроходимости (А.И. Парфенов, 2002).
При генерализованном гемангиоматозе речь идет о кавернозных или капиллярных гемангиоматозных поражениях, частота их составляет от 2 до 12 % от всех гемангиом. Этот тип гемангиом характеризуется тяжелыми внутренними кровотечениями.
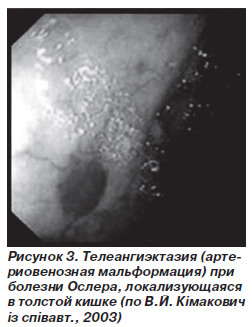 Основное место в диагностике гемангиом кишечника занимают эндоскопические методы (рис. 3). Основным клиническим проявлением большинства гемангиом являются кровотечения. При локализации гемангиом в тонкой кишке диагностика может быть очень трудной. Для поиска опухоли применяют селективную ангиографию основных ветвей брюшного отдела аорты, тотальную энтероскопию и радиоизотопные методы диагностики кровотечений.
Основное место в диагностике гемангиом кишечника занимают эндоскопические методы (рис. 3). Основным клиническим проявлением большинства гемангиом являются кровотечения. При локализации гемангиом в тонкой кишке диагностика может быть очень трудной. Для поиска опухоли применяют селективную ангиографию основных ветвей брюшного отдела аорты, тотальную энтероскопию и радиоизотопные методы диагностики кровотечений.
Красное пятно с нечеткими краями, которое бледнеет при надавливании, типично при болезни Ослера. Не следует проводить биопсию из-за риска кровотечения
Лечение главным образом хирургическое. При небольших флебэктазиях слизистой оболочки кишечника может применяться эндоскопическая электрокоагуляция опухоли.
Для остановки кровотечений из телеангиэктазий в желудочно-кишечном тракте применяют лазер, фармакологическую терапию эстроген-прогестероном.
Лимфангиоматозы кишечника — гамартоматозные полипообразные образования, которые большей частью распространяются вглубь стенки кишки.
Различают 3 формы лимфангиоматозных поражений кишечника (А.И. Парфенов, 2002):
Лимфангиомы встречаются исключительно редко, локализуются прежде всего в двенадцатиперстной кишке.
Первичная кишечная лимфангиэктазия (болезнь Вальдмана) — аномалия развития лимфатических сосудов в виде множественных кавернозных образований. Последние располагаются преимущественно в подслизистом слое. Лимфангиомы содержат густую лимфу с большим содержанием в ней лимфоцитов.
Лимфатические кисты — множественные кисты диаметром до
Клиническая картина характеризуется более или менее выраженной энтеропатией с потерей белка, отеками. В толстой кишке лимфангиэктазии располагаются редко и обычно являются эндоскопической находкой. При распространенной форме наблюдается стойкая, выраженная гипопротеинемия, резистентная к терапии. Отеки могут спонтанно уменьшаться и нарастать. При обструктивных изменениях лимфатических сосудов они могут быть асимметричными, а в тяжелых случаях присоединяется асцит и гидроторакс, вплоть до анасарки. Вследствие дефицита белка дети отстают в развитии и росте, у взрослых развивается атрофия мышечной системы, ногтевые фаланги приобретают вид «барабанных палочек». Боли в животе беспокоят редко. Часто появляются судороги из-за недостатка кальция. Последний, соединяясь с жирами в просвете кишки, не всасывается. У 80 % больных наблюдается хроническая диарея со стеатореей (А.И. Парфенов, 2002).
Диагноз устанавливают на основании рентгенологического и эндоскопического исследования кишечника с гистологическим исследованием слизистой оболочки. При первичной лимфангиэктазии и лимфангиомах слизистая оболочка кишки отечна, складки ее резко утолщены, стенка кишки может быть ригидной, слизистая оболочка рыхлая, пестрого вида за счет белесых пятен 1–2 мм диаметром. При гистологическом исследовании ворсинки слизистой оболочки тонкой кишки расширены из-за нарушения оттока лимфы и отека.
Для более точной топической диагностики пораженного кишечного сегмента применяют радиоизотопные, электрофоретические и иммунологические исследования кишечного сока, полученного из разных отделов тонкой или толстой кишки.
Лечение в основном симптоматическое. Для устранения гипопротеинемии применяют длительное внутривенное вливание белковосодержащих растворов, в первую очередь альбумина и γ-глобулина. Лечение проводят курсами 2–3 раза в год по 1 месяцу. Всем больным показаны препараты кальция, железа. Диета должна содержать повышенное количество белка (до 130 г/сут). Длинноцепочечные тугоплавкие жиры по возможности заменяются легкоусвояемыми среднецепочечными триглицеридами. У пациентов с первичной лимфангиэктазией в случаях, резистентных к консервативному лечению, может быть обсужден вопрос о резекции наиболее пораженных петель кишки (А.И. Парфенов, 2002).
Мега- и долихоколон
Удлинение ободочной кишки называют долихоколон, а расширение — мегаколон. В случае когда подобные изменения затрагивают только сигмовидный отдел ободочной кишки, используют термин «мега-/долихосигма».
Долихоколон — врожденное удлинение толстой кишки с недоразвитием нервного аппарата стенки, с последующим присоединением и прогрессированием органических изменений ее стенки и брыжейки вследствие поражения интрамуральных сплетений, нарушения функции и развития воспалительных процессов (Н.И. Царев, 1981). Ряд исследователей считают, что долихоколон может быть только врожденной патологией. Другие авторы полагают, что долихоколон может быть и приобретенным состоянием с самыми разнообразными причинами. Например, описаны случаи, когда злоупотребление клизмами и слабительными приводило к удлинению толстой кишки; долихоколон в пожилом возрасте связывают с нарушением обменных процессов в стенке толстой кишки (М.Ф. Осипенко, 2005). Я.С. Циммерман считает, что врожденная долихосигма способствует запорам, а запоры — развитию долихосигмы вследствие формирования механических препятствий для продвижения содержимого по кишке из-за ее атонии и «извилистости». В результате возникает порочный круг (Я.С. Циммерман, 1999).
При сохранении нормального диаметра просвета и при отсутствии изменений мышечного слоя удлинение толстой кишки и ее брыжейки не сопровождается нарушениями функции кишечника. При хорошей пропульсивной функции долихоколон и долихосигма не имеют клинических проявлений. При нарушении моторики кишечника развиваются метеоризм, боли в животе, запоры. При осмотре обращает на себя внимание вздутие живота, при пальпации — болезненность отрезков толстой кишки, особенно сигмовидной.
Диагноз устанавливают при ирригоскопии или колоноскопии. Пассаж по кишечнику оценивают с помощью рентгеноконстрастных или изотопных маркеров.
Лечение направлено на ликвидацию запоров. Редко при упорных длительных запорах проводят хирургическое лечение (резекцию удлиненной части кишки).
Мегаколон и мегаректум — это описательные термины, которые не содержат никаких намеков на этиологию или патофизиологию заболевания. Они употребляются, когда на рентгенограмме диаметр ректосигмоидного отдела или нисходящей кишки превышает
Классификация. Ниже приведена классификация мегаколонов по этиологии (M. Feldman et al., 2003):
Врожденный мегаколон (болезнь Гиршспрунга)
Приобретенный мегаколон (в результате запоров)
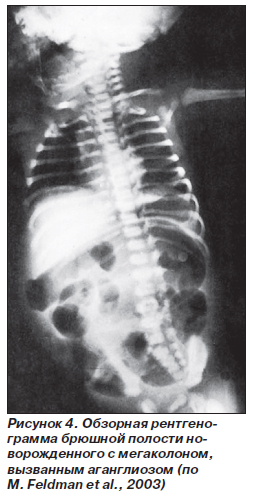 Врожденный мегаколон — это термин, часто применяемый к болезни Гиршспрунга, при которой расширение ободочной кишки (рис. 4) происходит вследствие функциональной непроходимости (обычно прямой кишки), вызванной врожденным отсутствием интрамуральных нервных сплетений (аганглиоз). Аганглиоз приводит к сужению сегмента в дистальных отделах толстой кишки, т.е. этот сегмент не способен к расслаблению. Болезнь Гиршспрунга может сопутствовать многим нарушениям, таким как множественная эндокринная неоплазия типа IIb. Варианты болезни Гиршспрунга могут сочетаться с иными врожденными нейромышечными аномалиями и целым спектром других заболеваний, включая витилиго, синдром Ваарденбурга, возникающий вследствие автономной денервации, такой как гипоганглиоз и нейрокишечная дисплазия. Даже синдром Шагаса, приобретенный внутриутробно, может привести к развитию заболевания, подобного болезни Гиршспрунга. Фактически исследования животных позволяют предположить, что аганглиоз, который возникает при болезни Гиршспрунга, может быть вызван не одним, а несколькими генетическими аномалиями, которые обусловливают возникновение клинических проявлений заболевания. В настоящее время доказано, что в большинстве случаев мегаколоны имеют врожденный характер.
Врожденный мегаколон — это термин, часто применяемый к болезни Гиршспрунга, при которой расширение ободочной кишки (рис. 4) происходит вследствие функциональной непроходимости (обычно прямой кишки), вызванной врожденным отсутствием интрамуральных нервных сплетений (аганглиоз). Аганглиоз приводит к сужению сегмента в дистальных отделах толстой кишки, т.е. этот сегмент не способен к расслаблению. Болезнь Гиршспрунга может сопутствовать многим нарушениям, таким как множественная эндокринная неоплазия типа IIb. Варианты болезни Гиршспрунга могут сочетаться с иными врожденными нейромышечными аномалиями и целым спектром других заболеваний, включая витилиго, синдром Ваарденбурга, возникающий вследствие автономной денервации, такой как гипоганглиоз и нейрокишечная дисплазия. Даже синдром Шагаса, приобретенный внутриутробно, может привести к развитию заболевания, подобного болезни Гиршспрунга. Фактически исследования животных позволяют предположить, что аганглиоз, который возникает при болезни Гиршспрунга, может быть вызван не одним, а несколькими генетическими аномалиями, которые обусловливают возникновение клинических проявлений заболевания. В настоящее время доказано, что в большинстве случаев мегаколоны имеют врожденный характер.
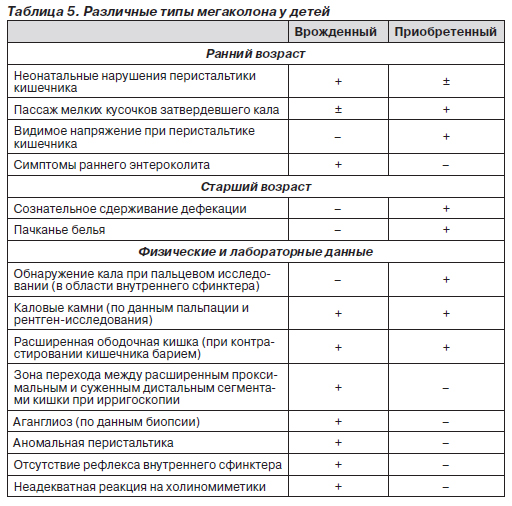
Приобретенный мегаколон может провоцироваться запорами, возникшими по различным причинам. Вывод о наличии приобретенного мегаколона можно сделать в том случае, если расширение ободочной кишки не наблюдалось при проводившихся ранее осмотрах. Дифференциальная диагностика между врожденным и приобретенным мегаколоном затруднена вследствие возможности гистологических изменений типа гипоганглиоза, гиперганглиоза и гипоплазии ганглиев мышц кишечника у пациентов с приобретенным мегаколоном. Наиболее частой причиной возникновения приобретенного мегаколона являются атонические запоры, которые встречаются как в молодом, так и в пожилом возрасте. У детей эту форму мегаколона легко спутать с врожденным расширением толстой кишки (болезнью Гиршспрунга) (табл. 5).
Ободочная кишка способна расширяться, а значит, возможно формирование приобретенного мегаколона; самым ярким подтверждением этого является синдром Огилви. Как будет показано ниже, даже в отсутствие механической кишечной непроходимости ободочная кишка может расширяться иногда до пугающих размеров. Доказательством того, что расширение является типичной патофизиологической реакцией толстой кишки, служит также синдром токсического мегаколона. Если ранее считалось, что расширение ободочной кишки наблюдается только при неспецифическом язвенном колите, то теперь стало ясно, что болезнь Крона, амебный колит, псевдомембранозный колит и специфические инфекционные колиты также могут вызвать это опасное осложнение.
Предложены две модели патогенеза мегаколона. Одна гипотеза предполагает, что в основе мегаколона лежат мутации генов, кодирующих продукцию эндотелина-3 или экспрессию рецепторов к эндотелину В, и что незрелая дифференцировка нервных клеток-предшественников приводит к истощению их фонда еще до того, как кишка будет полностью колонизирована. Вторая модель также связывает развитие мегаколона с мутациями генов, определяющих продукцию нейротрофического фактора дифференцировки глиальных клеток. Предполагают, что при дефиците этого фактора предшественники нервных клеток не дифференцируются должным образом. В обоих случаях в конце концов кишка лишается ганглиев.
Болезнь Гиршспрунга (врожденный мегаколон)
Патогенез. Считается, что аганглиоз толстой кишки возникает вследствие остановки каудальной миграции клеток нервных отростков (клеток, которые должны развиться в интрамуральные нервные сплетения кишки). Это приводит к нейронной дисплазии, гипоганглиозу и сегментарному аганглиозу. Обычно аганглиозный сегмент находится в прямой и/или сигмовидной кишках; реже этот сегмент очень короткий и локализуется только в зоне анального сфинктера. Аганглиозный сегмент постоянно находится в состоянии спазма, что приводит к супрастенотическому расширению в проксимальной части кишки. Аганглиозный сегмент большей длины встречается примерно у 20 % больных. Случаи распространения такого сегмента на всю ободочную кишку встречаются нечасто, а более проксимальное распространение аганглиоза на всю тонкую кишку наблюдается еще реже. Таким образом, отличительным признаком при диагностике болезни Гиршспрунга является исчезновение ганглиоцитов из нервных сплетений мышечной оболочки и подслизистой основы кишечника, о чем свидетельствуют данные аспирационной или прицельной биопсии. Пассаж содержимого кишки над аганглиозным сегментом задерживается. Хотя более длинные аганглиозные сегменты дают более яркую картину заболевания, состояние некоторых больных с короткими аганглиозными сегментами также может прогрессивно ухудшаться.
При морфологическом исследовании обнаруживают отсутствие ганглиоцитов в суженном сегменте кишки и на протяжении 1–5 см расширенного сегмента. Структура нервных волокон также аномальна — они гипертрофированы, формируются множественные утолщенные пучки. Для выявления этих морфологических изменений используют окраску на ацетилхолинэстеразу. Адренергическая иннервация расширенного сегмента обычно снижена. Предполагают, что одной из главных причин неспособности гладких мышц аганглиозного сегмента к расслаблению является недостаток NO и вазоактивного интестинального пептида в нервных волокнах.
Наиболее характерным функциональным нарушением является то, что аганглиозный сегмент не способен расслабиться в ответ на повышение давления в прямой кишке. У здорового человека ректальный рефлекс почти всегда явно выражен. При болезни Гиршспрунга сфинктер не только не расслабляется, но в некоторых случаях может возникнуть еще большее его сжатие. Аганглиозный сегмент не способен к расслаблению и после введения холиномиметиков.
Для аганглиозного сегмента характерно также аномальное строение внеклеточной матрицы, что обусловлено генетическим дефектом.
Частота болезни Гиршспрунга — 1 случай на 5000 живых новорожденных, причем заболевание может быть спорадическим или семейным. При семейном заболевании вариант наследования может быть аутосомно-доминантным или рецессивным; пенетрантность относительно низкая — около 30 %.
Сочетания врожденного аганглиоза толстой кишки с синдромом Дауна встречается в 10 раз чаще, чем это могло бы быть при случайном совпадении. Кроме того, болезнь Гиршспрунга сочетается с гидроцефалией, вентрикулярным септальным дефектом, кистозными аномалиями почки, ее агенезией, крипторхизмом, дивертикулом мочевого пузыря, неперфорированным анусом, дивертикулом Меккеля, недоразвитием матки, полипозом толстой кишки, эпендимомой четвертого желудочка и др. В патогенезе болезни Гиршспрунга участвуют мутации четырех генов: рецепторного гена тирозинкиназы, гена нейротрофического фактора, гена рецепторов эндотелина В и эндотелина-3. Кроме того, было также установлено, что онкоген RET вызывает болезнь Гиршспрунга, синдром полиэндокринной неоплазии типа IIb и спорадический медуллярный рак щитовидной железы. Следовательно, при выявлении болезни Гиршспрунга необходимо проводить скрининг на эти опухоли.
Очевидна также и тесная клинико-патогенетическая связь болезни Гиршспрунга с нейронной кишечной дисплазией.
Клиника. Болезнь Гиршспрунга проявляется почти сразу же после рождения, когда младенец (у мальчиков заболевание возникает в 5 раз чаще) выделяет небольшое количество мекония, но при этом его живот остается значительно увеличенным. Пальцевое исследование прямой кишки, введение ректальной трубки или назначение клизмы небольшого объема могут вызвать стремительное отхождение фекалий, приводящее к явному облегчению, но, к сожалению, это облегчение лишь временное. Симптомы частичной кишечной непроходимости рецидивируют и сопровождаются упорной рвотой и вздутием живота. Примерно у 20 % больных наблюдается стойкая диарея, вызванная псевдомембранозным энтероколитом.
Позже симптомы становятся менее яркими, исчезают проявления кишечной непроходимости. В большинстве случаев имеют место упорные запоры. У пациентов могут развиваться анемия, гипотрофия и даже гипопротеинемия как следствие энтеропатии с потерей белка; снижается резистентность к инфекциям. Хотя у большинства детей основные симптомы возникают еще на первом месяце жизни, аганглиоз с поражением очень короткого сегмента толстой кишки может проявиться лишь через несколько месяцев.
Диагностика. Болезнь Гиршспрунга у новорожденных следует дифференцировать с другими причинами кишечной непроходимости, такими как кишечная атрезия и неперфорированный анус. По достижении детьми более старшего возраста у них постепенно развивается еще и приобретенный (вторичный) мегаколон. Диагностировать врожденный мегаколон (болезнь Гиршспрунга) сразу после окончания периода новорожденности обычно нетрудно, и доступные сейчас диагностические методы позволяют правильно поставить диагноз примерно в 75 % случаев. Недержание кала не характерно для болезни Гиршспрунга. В тяжелых случаях брюшная стенка растягивается так, что усиливается венозный рисунок, а крупные фекальные конгломераты и камни пальпируются в нисходящей и сигмовидной кишке. При этом ампула прямой кишки пустая, что подтверждается пальцевым исследованием.
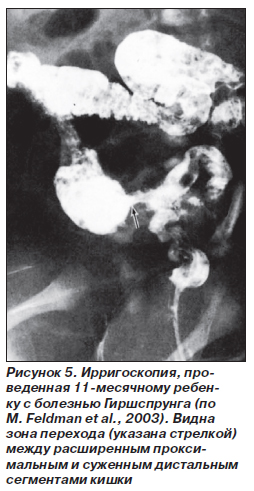
Ирригоскопия подтверждает диагноз, если четко определяется характерный переход от суженного дистального ректального или ректосигмоидного сегмента к расширенной проксимальной ободочной кишке (рис. 5) Этот симптом обычно лучше виден в боковой проекции; однако если аганглиозный сегмент очень короткий, то суженный сегмент на рентгенограмме не виден. Для больных с приобретенным мегаколоном недержание кала — обычное явление, расширение кишки достигает ануса, а суженная зона отсутствует.
 При проктосигмоидоскопии выявляют нормальную, но пустую прямую кишку. Расширенный проксимальный сегмент толстой кишки, если он находится в зоне видимости эндоскопа, легко проходим, но в нем находятся фекалии; иногда могут быть обнаружены стеркоральные язвы, вызванные каловыми конкрементами. Таким образом, основными симптомами болезни Гиршспрунга при эндоскопии являются пустой нижний сегмент кишки и отсутствие органической непроходимости. В сомнительных случаях для постановки диагноза проводят биопсию материала, взятого по всей толщине ткани прямой кишки. Наличие нормального количества ганглиоцитов исключает болезнь Гиршспрунга, тогда как отсутствие ганглиев подтверждает диагноз. Аспирационную биопсию, которая является удовлетворительным методом диагностики во многих случаях, следует применять первой, так как она выполняется легко и не требует анестезии. Иммуногистохимические методы могут помочь в обнаружении морфологических аномалий, которые проявляются в обилии гиперплазированных аксонов при отсутствии ганглиев.
При проктосигмоидоскопии выявляют нормальную, но пустую прямую кишку. Расширенный проксимальный сегмент толстой кишки, если он находится в зоне видимости эндоскопа, легко проходим, но в нем находятся фекалии; иногда могут быть обнаружены стеркоральные язвы, вызванные каловыми конкрементами. Таким образом, основными симптомами болезни Гиршспрунга при эндоскопии являются пустой нижний сегмент кишки и отсутствие органической непроходимости. В сомнительных случаях для постановки диагноза проводят биопсию материала, взятого по всей толщине ткани прямой кишки. Наличие нормального количества ганглиоцитов исключает болезнь Гиршспрунга, тогда как отсутствие ганглиев подтверждает диагноз. Аспирационную биопсию, которая является удовлетворительным методом диагностики во многих случаях, следует применять первой, так как она выполняется легко и не требует анестезии. Иммуногистохимические методы могут помочь в обнаружении морфологических аномалий, которые проявляются в обилии гиперплазированных аксонов при отсутствии ганглиев.
При коротком аганглиозном сегменте его сложно диагностировать при рентген-исследовании, а также можно пропустить при биопсии. В этих случаях проводят специальный тест на выявление ответной реакции анального сфинктера на растяжение прямой кишки. В отличие от здоровых людей и больных с приобретенным мегаколоном внутренний анальный сфинктер у пациентов с врожденным аганглиозом не может расслабиться (и даже сжимается) после растяжения прямой кишки.
Диагностирование болезни Гиршспрунга часто проводится поэтапно. После поверхностной аспирационной биопсии, выполняемой амбулаторно, обычно проводят более глубокие биопсии слизистого и мышечного слоев толстой кишки с анестезией. Младенцы и дети с нарушением ректального рефлекса и в связи с этим с подозрением на болезнь Гиршспрунга подвергаются сначала аспирационной биопсии. Если биопсия показывает наличие ганглиев, то диагноз болезни Гиршспрунга снимается. Если при биопсии не обнаруживают ганглии, но выявляют гиперплазированные нервные стволы, то диагноз болезни Гиршспрунга подтверждается. Если же не находят не только ганглии, но и гиперплазированные нервные стволы, то следующим этапом диагностики является глубокая биопсия мышечной ткани прямой кишки под общим наркозом; полученное подслизистое нервное сплетение должно быть исследовано на наличие ганглиев. Пренатальный диагноз непроходимости толстой кишки, предположительно вызванной болезнью Гиршспрунга, можно поставить, применяя сонографию.
Лечение. Как только диагноз болезни Гиршспрунга подтвержден, следует решить вопрос об оперативном вмешательстве. Иногда проводят предварительную декомпрессию толстой кишки наложением колостомы для того, чтобы облегчить симптомы копростаза.
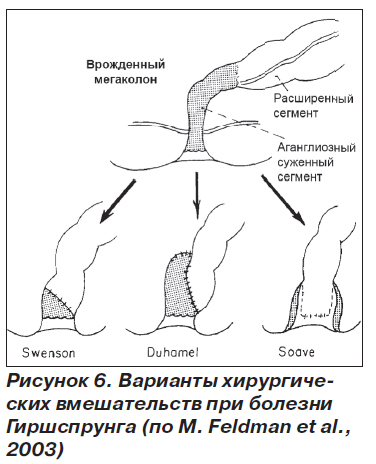
Главными целями хирургического вмешательства следует считать обеспечение у пациента регулярной дефекации, поддержание нормального функционирования сфинктера без ущерба для сексуальной потенции. Для устранения непроходимости и удаления аганглиозного сегмента применяют различные варианты оперативных вмешательств (рис. 6). Обычно удается достичь стойких хороших результатов, но все же приблизительно 12 % больных имеют резидуальные симптомы в виде пачканья белья калом.
Варианты врожденного мегаколона (болезни Гиршспрунга). Спектр проявлений болезни Гиршспрунга значительно расширился с момента ее первоначального описания. Пациенты с типичной клинической картиной могут иметь ультракороткий сегмент кишки, пораженный аганглиозом, затрагивающим только внутренний анальный сфинктер. Морфологически подтвердить диагноз может быть довольно затруднительно, поэтому такие больные нуждаются в физиологическом тестировании (в оценке ректального рефлекса). Болезнь Гиршспрунга все чаще диагностируется у взрослых пациентов. Клинические, физиологические и морфологические проявления болезни у взрослых обычно сходны с признаками легкой формы заболевания, которое диагностируется в раннем возрасте. Таким образом, врожденный мегаколон (болезнь Гиршспрунга) следует разделить на классическую форму заболевания; болезнь, поражающую короткий сегмент кишки, ультракороткий сегмент и другие варианты (см. выше). Возможны также варианты заболевания с легкой, неполной клинической картиной.
Приобретенный мегаколон и мегаректум
Наилучшим доказательством того, что мегаколон у пациента приобретенный, является рентгенографическое свидетельство, что ранее толстая кишка этого же пациента не была расширена. К сожалению, такая информация не всегда доступна, поэтому мегаколон считается приобретенным, если не удается обнаружить каких-либо врожденных аномалий (аганглиоз, атрезия или стриктура) или если запоры появились позже, чем в младенческом возрасте. При постановке диагноза приобретенного мегаколона следует выяснить его причину (см. выше).
Представляет определенный интерес терминология. Мегаколон означает расширение толстой кишки, которое вызвано не механической причиной. В этом случае прямая кишка имеет нормальные размеры. Мегаректум предполагает, что ректальный резервуар увеличен, иногда значительно. Возможно сочетание мегаколона и мегаректума, в то же время не все пациенты с мегаректумом страдают мегаколоном, и наоборот. Поэтому важно точно установить диагноз, т.к. применяемые терапевтические и хирургические методы лечения различаются в зависимости от того, какая кишка поражена. Приобретенный мегаректум и приобретенный мегаколон, строго говоря, являются различными заболеваниями. Важно также отметить, что эти термины не относятся к удлинению толстой кишки (долихоколон), которое часто определяется у пациентов с хроническими запорами, но возможно и без них.
Этиология. Хотя точная причина, провоцирующая возникновение приобретенных мегаколона и мегаректума, неизвестна, ни один из сегментов ободочной кишки не является аганглиозным. Это положение является принципиальным, своеобразной чертой, разграничивающей врожденную и приобретенную формы болезни. Хотя миопатия пищеварительного тракта может быть причиной мегаколона, но у больных с этой патологией не всегда нарушается перистальтическая активность желудка и тонкой кишки. С другой стороны, больные с хронической псевдообструкцией пищеварительного тракта, в том числе желудка и тонкой кишки, могут иметь замедленную перистальтику, но зачастую не имеют расширения толстой и прямой кишки.
Клиника. Если болезнь Гиршспрунга в основном поражает мальчиков, приобретенный мегаколон встречается одинаково часто у мужчин и женщин. Общее состояние пациентов с мегаколоном значительно лучше, чем у больных с болезнью Гиршспрунга.
Среди взрослых больных с мегаколоном и мегаректумом можно выделить две группы в зависимости от сроков начала клинических проявлений. Больные одной группы начинают страдать от запоров в раннем детстве (обычно до достижения возраста 1 года). У пациентов другой группы симптомы развиваются после 10 лет или даже у взрослых. В первой группе запоры, пачканье фекалиями белья появляются в раннем детстве; во второй группе доминируют запоры и абдоминальные боли, но пачканья белья не отмечается. Если у пациентов симптомы начали проявляться с раннего детства, приобретенный мегаколон считается органическим, потому что болезнь часто начинается в младенчестве, в семье нередко отмечаются подобные заболевания, соответствующая психопатология (подобная изменениям психики при синдроме раздраженной кишки) отсутствует. С другой стороны, хронический приобретенный мегаколон, проявления которого начинаются позже, может иногда возникнуть при негативизме ребенка из-за сдерживания им акта дефекации в тот период, когда его приучают пользоваться горшком или туалетом.
Доминирующим симптомом обеих форм мегаколона являются запоры; могут проходить целые недели между самостоятельными дефекациями. У некоторых пациентов фекальные массы, спрессованные в прямой кишке, легко пальпируются в нижней части живота. Твердая масса экскрементов располагается, иногда довольно долгое время, сразу над аноректальным кольцом. Эта масса, в свою очередь, приводит к широкому раскрытию ануса, так как функция внутреннего анального сфинктера подавляется хроническим расширением прямой кишки. У некоторых пациентов с мегаректумом недержание кала (вследствие переполнения прямой кишки), а совсем не запор, может быть доминирующим симптомом.
Диагностика. Сложность состоит не столько в диагностике, сколько в дифференциальной диагностике врожденного и приобретенного мегаколона. Жалоб, анамнеза и данных физического исследования обычно недостаточно для проведения такой дифференциальной диагностики. Необходимы рентгенологическое и эндоскопическое исследования (табл. 5). Для постановки диагноза мегаколона предлагают измерять ширину кишки на уровне верхнего края входа в таз. Среди здоровых ширина ободочной кишки на этом уровне варьирует в пределах 2,4–6,0 см. У больных с мегаколоном эти размеры больше — 6,9–14,7 см. Таким образом, диагноз «мегаколон» ставят, если диаметр кишки на уровне верхнего края входа в таз
Манометрические данные аноректальной области позволяют оценить наличие ректального рефлекса, что также помогает дифференциальной диагностике приобретенного и врожденного мегаколона. Наличие сохраненного рефлекса свидетельствует о присутствии неповрежденных ганглиев, т.е. об отсутствии болезни Гиршспрунга. Однако если такой рефлекс отсутствует, это еще не говорит о том, что пациент страдает болезнью Гиршспрунга. Иногда рефлекс трудно выявить, так как функция внутреннего анального сфинктера хронически тормозится плотными фекальными массами. Если рефлекс отсутствует, а переполнения кишки фекалиями не наблюдается, следует провести биопсию мышечной стенки прямой кишки над аноректальным кольцом. У пациентов с диффузным мегаколоном обычно имеет место задержка пассажа от ободочной кишки к прямой. С другой стороны, пациенты с мегаколоном или мегаректумом, у которых пассаж фекальных масс не нарушен, страдают неосложненными запорами и не нуждаются в хирургическом лечении. Пассаж содержимого по ободочной и прямой кишке удобно оценивать с помощью введения рентгеноконтрастной метки. Пациент проглатывает одинаковое количество рентгеноконтрастных меток в одно и то же время дня на протяжении трех дней подряд, причем каждый день метки имеют различную форму. Затем делают обзорные рентгенограммы брюшной полости в то же время суток на четвертый и седьмой день. При сравнении результатов с нормой можно легко сделать вывод о состоянии пассажа по толстой кишке у конкретного пациента, а если пассаж замедлен, то можно оценить, в каком именно сегменте толстой кишки это происходит. Если продвижение содержимого по кишке замедленно, то делают вывод о запорах, но не о мегаколоне или мегаректуме, т.к. запоры могут быть вызваны и другими многочисленными причинами. Данные о кишечном пассаже можно также уточнить с помощью радиосцинтиграфии с использованием гамма-камеры.
Лечение. Целью медикаментозного лечения мегаколона или мегаректума является достижение своевременного освобождения кишки от кала и профилактика кишечной непроходимости. При необходимости освобождения кишки от каловых конкрементов иногда применяют даже мануальный способ под анестезией, используют очистительные клизмы. Назначают слабительные средства, причем, как правило, не удается обойтись без солевых слабительных, но следует избегать приема раздражающих слабительных средств. Пациентам следует вырабатывать рефлекс на дефекацию после приема пищи.
Если медикаментозное лечение неэффективно, то применяют хирургические вмешательства. Выбор варианта операции зависит от точного диагноза и состояния моторики кишки. Например, для пациентов с мегаколоном и медленным пассажем содержимого по кишке рекомендуют илеостомию или наложение илеоанального анастомоза в зависимости от возраста пациента, его образа жизни и телосложения. Но следует учитывать, что после наложения илеоректального анастомоза у некоторых пациентов сохраняются запоры, особенно если не были устранены нарушения функции тазового дна. После наложения илеоанального анастомоза у пациентов обычно восстанавливается реакция ануса на раздражение, и они нормально контролируют механизм опорожнения кишечника. Илеостомия больше применяется у людей старшего возраста.
Для пациентов с мегаколоном, но с нормальным диаметром прямой кишки и с нормальным механизмом дефекации операцией выбора считают илеоректостомию, в том числе у больных пожилого возраста. Пациенты с мегаректумом, толстой кишкой нормального диаметра и нарушениями механизма дефекации подлежат операции Duhamel (рис. 6) или операции наложения толстокишечно-анального анастомоза. В последнем случае выполняется резекция всей расширенной прямой кишки и удается избежать формирования каловых конкрементов в культе этой кишки, которые часто образуются у пациентов после операции Duhamel.
Острый мегаколон является осложнением тяжелых воспалительных заболеваний кишечника и инфекционных колитов. Иногда острый мегаколон развивается у больных без предшествующего явного заболевания толстой кишки или механической кишечной непроходимости. В этом случае идет речь о псевдообструкции толстой кишки (синдром Огилви). Причинами острого мегаколона могут также быть травма, операции на органах брюшной полости или таза, метаболические нарушения (гипокалиемия) или неврологические заболевания.
Патогенез. Точная причина острой псевдообструкции толстой кишки неизвестна. Однако большинство пациентов указывают на выполненные накануне хирургические вмешательства или на травмы. Как бы то ни было, синдром Огилви — идеальный пример расширения толстой кишки при отсутствии механических препятствий пассажу. Повышенная готовность толстой кишки к расширению в ответ на физиологические и фармакологические стимулы — основа патогенеза данного расстройства.
Клиника. Типичным пациентом с синдромом Огилви является человек пожилого возраста, который находится в состоянии реконвалесценции после хирургического вмешательства, выполненного за несколько дней, и который уже принимает пищу per os. Живот у него значительно вздут, дыхание становится затрудненным, но признаков перитонита не наблюдается и лейкоцитоза нет (по крайней мере на раннем этапе заболевания). Обзорная рентгенография брюшной полости выявляет значительное растяжение толстой кишки из-за скопления газов. Обычно тонкая кишка не видна. Диаметр слепой кишки на этом этапе болезни — 9–10 см.
Лечение. Прием пищи per os следует отменить, жидкость вводить парентерально, необходимо установить назогастральный зонд. Далее назначается клизма с водорастворимым контрастом, чтобы исключить механическую кишечную непроходимость и подтвердить псевдообструкцию. При подтверждении диагноза применяют ректальную декомпрессионную трубку и клизму, корригируют электролитные нарушения (гипокалиемию). При недостаточности эффективности лечения назначают цизаприд, эритромицин, неостигмин. Неостигмин вводят в дозе 2,5 мг внутривенно в течение 1–3 мин. В это время пациент должен быть подключен к электрокардиографическому монитору, необходимо подготовить атропин. Неостигмин подействует через 2–20 минут. Схему можно повторять последовательно до трех раз, до достижения положительного результата.
В дальнейшем при неэффективности описанного лечения и диаметре слепой кишки более
1. Парфенов А.И. Энтерология.— М.: Триада-Х, 2002.— 744 с.
2. Feldman M., Friedman L.S., Sleisenger M.H. Sleisenger and Fordtran''s Gastrointestinal and Liver Disease. — Philadelphia : W.B. Saunders, 2003. — 2336 p.
3. Діагностична і лікувальна ендоскопія травного каналу / В.Й. Кімакович, В.В. Грубнік, Ю.А. Мельниченко, І.М. Тумак. — Львів : Видавництво Мс, 2003. — 208 с.
4. Осипенко М.Ф. Мега- и долихоколон: клинические проявления, факторы риска, патогенез, диагностика // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2005. — № 4. — С. 74-81.
5. Царев Н.И. Удлиненная толстая кишка как хроническое заболевание // Вестн. хирургии. — 1981. — № 9. — С. 58-63.
6. Циммерман Я.С. Хронический запор. Диарея. — Пермь: ПГМА, 1999. — 120 с.