Газета «Новости медицины и фармации» Гастроэнтерология (304) 2009 (тематический номер)
Вернуться к номеру
Аномалии развития печени
Авторы: Н.С. Кабанец, В.В. Галалу, Донецкий национальный медицинский университет им. М. Горького
Версия для печати
В последние годы врачи все чаще стали сталкиваться с различными очаговыми образованиями печени и аномалиями ее развития. Благодаря расширению использования и улучшению качества методов обследования часто выявляют патологию печени. Многие из этих случайных находок являются аномалиями развития печени. В литературе, доступной практическому врачу, информации об этих изменениях незаслуженно мало. Чтобы понять причины происходящих изменений, необходимо вернуться к самому началу развития этого органа.
Эмбриология печени
Зачаток печени появляется в середине третьей недели как вырост эндодермального эпителия из дистального конца кишечной трубки. Этот вырост — печеночный дивертикул, или печеночная почка — состоит из быстро пролиферирующих клеток, которые проходят сквозь поперечную перегородку (мезодермальная пластинка между перикардиальной полостью и стволом желточного мешка).
В то время, когда печеночные клетки пронизывают перегородку между печеночной почкой и первичной кишкой, формируется желчный проток. Маленький вентральный отросток, сформированный желчным протоком, дает начало желчному пузырю и желчно-пузырному протоку. Дальше эпителиальные печеночные тяжи перемешиваются с аллантоисом и пупочными венами, формируя печеночные синусоиды. Печеночные тяжи дифференцируются в паренхиму (печеночные клетки) и формируют выстилку билиарных протоков. Гематопоэтические клетки, клетки Купфера и клетки соединительной ткани берут начало из мезодермы поперечной перегородки.
Когда печеночные клетки полностью проникли в поперечную перегородку, орган выпячивается каудально в абдоминальную полость, мезодерма поперечной перегородки лежит между печенью и первичной кишкой, и печень, вентральная абдоминальная стенка выстилаются «пленкой», формируя в дальнейшем малый сальник и серповидную связку. Вместе они формируют перитонеальное соединение между первичной кишкой и вентральной абдоминальной стенкой и известны как вентральный мезогастрий.
Мезодерма поверхности печени дифференцируется в висцеральную брюшину, за исключением краниальной поверхности. В этой области печень остается соединенной с остальной частью поперечной перегородкой. Эта часть перегородки, которая состоит из плотной мезодермы, будет формировать центральное сухожилие диафрагмы. Поверхность печени, которая контактирует с будущей диафрагмой, никогда не покрывается брюшиной, это обнаженная область печени.
На 10-й неделе развития масса печени составляет приблизительно 10 % от всей массы тела. Отчасти это может быть обусловлено большим количеством синусоидов, другой важный фактор — это гематопоэтическая функция. Большие скопления пролиферирующих клеток, которые продуцируют эритроциты и лейкоциты, находятся между печеночными клетками и стенками сосудов. Активность их постепенно снижается на протяжении последних 2 месяцев внутриматочной жизни, и при рождении остаются только единичные кроветворные островки. Масса печени тогда составляет только 5 % от общей массы тела.
Другая важная функция печени формируется приблизительно на 12-й неделе, когда желчь вырабатывается гепатоцитами. В это время желчный пузырь и пузырный проток уже сформированы, пузырный проток соединяется с печеночным, образуя желчный проток, и желчь может попадать в желудочно-кишечный тракт.
Молекулярная регуляция печеночной индукции
Эндодерма первичной кишки имеет возможность экспрессировать печень-специфические гены и дифференцироваться в печеночную ткань. Однако эта экспрессия блокирована факторами, вырабатывающимися окружающими тканями, включая эктодерму, несердечную мезодерму и частично нотохорду. Действие этих ингибиторов блокируется в будущей печеночной области фактором роста фибробластов, который вырабатывается сердечной мезодермой. Таким образом, сердечная мезодерма «дает приказ» эндодерме кишечной трубки экспрессировать печень-специфические гены, подавляя ингибиторный фактор этих генов. Как только такой «приказ» получен, клетки в области печени дифференцируются как в гепатоциты, так и в билиарные зачатки; процесс частично регулируется ядерными транскрипционными факторами гепатоцитов (HNF-3 и -4).
Во внутриутробном периоде печень занимает более половины брюшной полости. Относительная масса печени у новорожденного составляет 4,5–5,0 % массы тела. В постнатальном периоде относительная масса печени уменьшается в 2 раза. В среднем масса печени мужчины равна
Форма, размеры и положение печени во все возрастные периоды изменчивы. В детском возрасте печень более подвижна, так как ее задняя поверхность на большем протяжении покрыта брюшиной. При удлинении связок, удерживающих печень, может происходить ее опущение. Это обычно имеет место при общем птозе внутренних органов.
Аномалии развития печени многочисленны и разнообразны.
Аномалии внутрипеченочных желчных ходов
Агенезия (аплазия) внутрипеченочных желчных ходов — в перипортальных прослойках соединительной ткани отсутствуют желчные протоки. Иногда количество междольковых протоков лишь уменьшено и составляет менее 0,4 на портальную триаду. Это редкая врожденная патология печени, встречающаяся в перинатальном периоде; так же, как и атрезия непеченочных желчных протоков, приводит к прогрессирующей холестатической желтухе и билиарному циррозу печени.
Этиология и патогенез остаются не ясными. Предполагают, что имеет место вторичное поражение внутрипеченочных желчных ходов при внутриутробном и неонатальном вирусном гепатите с их деструкцией и исчезновением (Е.Н. Тер-Григорова, 1967). Однако не исключена возможность истинной агенезии, особенно в случаях тотального или почти тотального отсутствия желчных протоков.
При этом печень бывает черновато-зеленоватого (оливкового) цвета, увеличенной, плотной, с мелкозернистой поверхностью. Желтуха резко выражена, кал ахоличный, моча темная. На коже и серозных листках — геморрагии. Диагноз можно поставить только после гистологического исследования. В портальных трактах в области триад полностью отсутствуют желчные протоки — агенезия, видны только кровеносные сосуды или количество протоков значительно уменьшено — гипоплазия.
При явлениях тяжелого застоя желчи с переполнением ею желчных капилляров печеночные балки хорошо дифференцированы, клеточные инфильтраты в паренхиме отсутствуют, разрастания междольковой и перипортальной соединительной ткани нет. Это является доказательством истинного порока развития. В дальнейшем холестаз в желчных капиллярах приводит к некрозу и атрофии гепатоцитов, возникают клеточные инфильтраты, происходят разрастание соединительной ткани, регенераторные изменения с характерной для цирроза структурной перестройкой.
Прогноз неблагоприятный. Смерть наступает от цирроза печени или интеркуррентного заболевания.
Синдром Алажиля занимает одно из лидирующих мест среди причин неонатального холестаза, встречается с частотой 1 : 70000 новорожденных. Большое количество публикаций свидетельствует о широком распространении этого синдрома в различных странах мира. В литературе подробно описаны 199 больных (K.M. Emerick et al., 1999). Синдром Алажиля (артериопеченочная дисплазия) включает сочетание не менее трех из пяти основных признаков: хронический холестаз, сердечно-сосудистые дефекты, аномалии позвоночника, дефекты глаз, характерные черепно-лицевые признаки.
Синдром Алажиля имеет аутосомно-доминантный тип наследования. Генный дефект связан с частичной делецией короткого плеча 20-й хромосомы [20р11–12], где локализуется ген Jagged1 (JAG1). Это изменение в небольшом проценте случаев (3,6 %) верифицируется с помощью цитогенетического исследования. Однако в последние годы в связи с применением молекулярно-генетических методов диагностики мутаций гена Jagged1 верификация патологических мутаций достигается уже примерно в 70 % случаев.
В основе изменений со стороны печени при синдроме Алажиля лежит врожденная гипоплазия внутрипеченочных желчных протоков, степень выраженности которой может широко варьировать и определять как время появления первых клинических симптомов, так и прогноз заболевания. Гипоплазия внутрипеченочных желчных протоков затрудняет отток желчи, что приводит к накоплению ее компонентов в клетках печени. Желчные кислоты по мере достижения определенной — критичной — внутриклеточной концентрации становятся токсичными для гепатоцитов, способствуя их разрушению. Описанные изменения особенно выражены в течение первых 3–6 месяцев жизни, что связано с достоверно более высоким уровнем синтеза желчи в этом возрасте по сравнению с более старшими детьми. Повышенное содержание компонентов желчи в системном кровотоке способствует развитию мучительного кожного зуда, значительно нарушающего качество жизни больных. С другой стороны, недостаточное поступление желчи в кишечник приводит к нарушению процессов всасывания, в том числе жирорастворимых витаминов.
Клинические и лабораторные проявления. Синдром внутрипеченочного холестаза появляется в периоде новорожденности, реже в течение первых месяцев жизни. Отмечаются желтуха с зеленоватым оттенком, увеличение печени, непостоянная ахолия стула, темный цвет мочи. Результаты лабораторных исследований показывают повышение маркеров холестаза в крови (прямая фракция билирубина, щелочная фосфатаза, γ-глутамилтранспептидаза, холестерин, β-липопротеиды, желчные кислоты) и умеренное повышение ферментов цитолиза (АЛТ, АСТ). В дальнейшем, к 4–6 месяцам жизни, характерно исчезновение желтухи, снижение билирубина, нормализация цвета стула и мочи. Однако появляется кожный зуд, который в дальнейшем усиливается и становится ведущим клиническим симптомом заболевания, тогда как другие проявления имеют перемежающийся характер. По мере прогрессирования заболевания отмечаются также отставание детей в физическом развитии и признаки дефицита жирорастворимых витаминов (рахитические изменения и остеопения, мышечная гипотония, сухость кожи и слизистых, тусклость и ломкость ногтей и волос, офтальмоплегия, петехиальная сыпь и/или кровотечения из слизистых). Морфологическое исследование биоптата печени выявляет гипоплазию внутрипеченочных желчных протоков. С гистологической точки зрения под гипоплазией следует понимать снижение отношения количества внутрипеченочных желчных протоков к количеству портальных трактов менее 0,9. У больных с синдромом Алажиля этот коэффициент, как правило, варьирует от 0 до 0,4. У большинства больных изменения со стороны печени являются ведущими проявлениями заболевания, тогда как аномалии и/или пороки других органов и систем могут иметь лишь диагностическое значение. В свою очередь, изолированные изменения со стороны печени следует расценивать как несиндромальную форму гипоплазии внутрипеченочных желчных протоков.
Лечение. Этиопатогенетическое лечение данного синдрома отсутствует. При формировании цирроза печени и отсутствии грубых пороков сердца или почек единственным радикальным методом лечения является трансплантация печени.
Прогноз заболевания определяется степенью гипоплазии внутрипеченочных желчных протоков, а также значимостью пороков других органов, и прежде всего сердца. При легком варианте течения возможно длительное сохранение, иногда в течение многих лет, минимальных клинико-лабораторных проявлений, не нарушающих значительно качество жизни ребенка и затем взрослого. Тяжелое течение характеризуется постепенным прогрессированием заболевания с развитием ювенильного цирроза печени. Катамнез больных с синдромом Алажиля после пересадки печени в течение 10–15 лет свидетельствует о высокой эффективности этого метода лечения и отсутствии рецидивов заболевания.
Аномалии печени
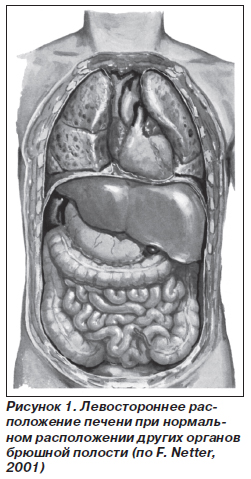
Различают аномалии положения печени, ее формы и смешанные аномалии. К аномалиям положения относятся очень редкие случаи расположения печени в левом подреберье при обычном положении остальных органов брюшной полости (рис. 1).
Агенезия (аплазия) печени встречается редко. Известны аплазии одной из долей печени.
Гепатомегалия — необычно крупная, гипертрофированная печень.
Гипоплазия отдельных долей печени — левая доля чаще подвергается изменению. Она резко уплощена, внутреннее строение ее нетипично для печени — преобладает соединительная ткань.
Гипоплазия печени — недоразвитие всего органа. Весьма редкая аномалия.
Дистопия печени — положение слева при полном или частичном обратном расположении внутренних органов.
Добавочная доля печени (син.: печень добавочная) обычно имеет вид отдельного островка печеночной ткани или конгломерата островков. В литературе ДДП чаще всего описывают вместе с эктопией печеночной ткани (ЭПТ). Встречается в брюшной полости вблизи печени, соединена с печенью сосудисто-секреторной или тканевой ножкой. Описано наддиафрагмальное, внутриплевральное расположение добавочной доли печени, соединенной с основной массой органа ножкой, проходящей через маленькое отверстие в диафрагме и содержащей артерию, вену и желчный проток. В подавляющем большинстве случаев ДДП не имеет клинических проявлений и выявляется случайно при ультразвуковом исследовании или во время операции. Клинические симптомы возникают лишь при перекруте ДДП или сдавлении ею близлежащих анатомических образований. ЭПТ отличается от ДДП отсутствием сосудисто-секреторной связи с печенью.
Удельный вес ДДП среди всех заболеваний печени невысок. Несмотря на чрезвычайную редкость, Y. Collan et al. в 1978 году распределили все известные варианты ДДП и ЭПТ на 4 основные группы:
Локализация ДДП и ЭПТ
В литературе нами обнаружено описание следующих локализаций ЭПТ и ДДП: на триангулярной связке печени; в селезенке, желчном пузыре, надпочечнике, желудочно-печеночной связке, поджелудочной железе; в грудной полости, в полости перикарда, пупочной ямке, сальнике и ретроперитонеальном пространстве. Описан случай, когда ДДП на длинной сосудисто-секреторной ножке достигала входа в малый таз. Заслуживает внимания случай, при котором кровоснабжение внутриплеврально расположенной ДДП осуществлялось от правой легочной артерии. Этот порок развития сочетался с агенезией правого легкого. Другой редкий случай описан G. Johnstone: ДДП являлась содержимым грыжевого мешка передней брюшной стенки.
Клинические проявления ДДП и ЭПТ
Как было отмечено ранее, в большинстве случаев ДДП и ЭПТ не имеют клинических проявлений. По данным литературы, могут встречаться следующие симптомы: частые рвоты; острая боль в эпигастральной области; пальпируемая опухоль; периодические боли в животе наряду с ухудшением функции печени, что может послужить основанием для выполнения операции при ДДП. ДДП может симулировать клинику другого заболевания, приводя к диагностическим ошибкам.
Кисты печени
Проблема диагностики и лечебно-тактических действий при объемных образованиях брюшной полости и забрюшинного пространства остается нерешенной. Кисты печени встречаются примерно у 0,8 % населения, а по данным аутопсии частота невыявленных непаразитарных кист печени достигает 1,86 %. У женщин кисты встречаются в 3–5 раз чаще, чем у мужчин, проявляются в период между 30 и 50 годами жизни. Кисты делят на истинные и ложные. Согласно современным патогенетическим подходам, истинные кисты в печени возникают из аберрантных желчных ходов, т.е. во время эмбрионального развития не происходит подключения к системе желчных путей отдельных внутридольковых и междольковых желчных ходов; отсутствие инволюции этих ходов является причиной развития кист печени. Врожденные кисты изнутри выстланы кубическим или цилиндрическим эпителием.
Различают несколько видов врожденных кист печени:
А. Киста печени солитарная — обычно происходит из правой доли печени, располагаясь на ее нижней поверхности.
Чаще она свободно лежит на поверхности или имеет ножку, на которой свисает в брюшную полость, реже – располагается в толще ткани.
Выделяют:
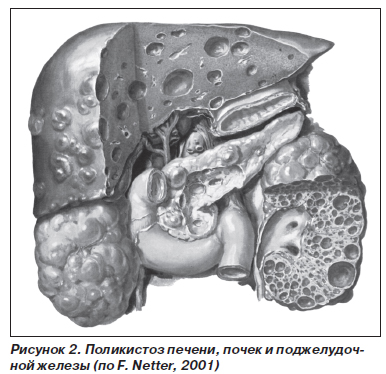
Б. Поликистоз печени (син.: печень кистозная, кисты печени множественные) — обнаруживается множество кист, размеры которых варьируют в широких пределах. Часто сочетается с поликистозом почек и поджелудочной железы (рис. 2). Печень увеличена в размерах, плотная за счет фиброза, развивающегося вокруг кист. Поликистоз печени является врожденным, генетически детерминированным заболеванием. Более чем у половины больных поликистоз печени сочетается с кистозными изменениями в почках, поджелудочной железе, легких.
Диагноз ставят на основании комплекса инструментальных исследований. Применяют те же методы, что и при других очаговых поражениях печени. При ультразвуковом исследовании солитарная киста выглядит как анэхогенное образование округлой или овальной формы с ровными четкими контурами. Для поликистоза печени характерны множественые анэхогенные округлой формы образования, локализующиеся в обеих долях печени. При компьютерной томографии солитарная киста печени выявляется в виде образования с четкими контурами низкой рентгеновской плотности.
В ряде случаев довольно трудно дифференцировать непаразитарную кисту печени с эхинококковой. В этих случаях весьма ценными являются серологические пробы на эхинококкоз.
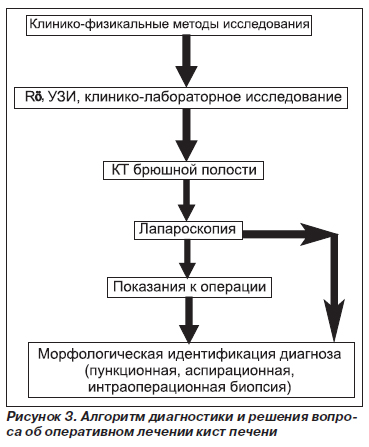
Этапы обследования при объемных образованиях печени представлены на рис. 3.
При поликистозе печени и реальной угрозе развития печеночной недостаточности применяют операцию фенестрации кист — иссечение части стенок кист с последующей деструкцией их внутренних оболочек электроножом или расфокусированным лучом лазера. Целью операции являются уменьшение сдавления печеночной паренхимы кистами и предупреждение ее дальнейшей атрофии. Подобный тип операции может быть выполнен закрытым способом под контролем ультразвукового исследования (пункция кист с последующей склеротерапией) или лапароскопически (фенестрация). При использовании малоинвазивных методик частота послеоперационных осложнений и летальность приближается к нулю.
В. Кистофиброз печени (син.: фиброз печени врожденный, фиброхолангиокистоз) — соединительнотканная строма печени избыточно развита, паренхима гипоплазирована, выводные протоки кистозно расширены, внутриорганные разветвления воротной вены гипоплазированы, в результате чего развивается синдром внутрипеченочной формы портальной гипертензии. Имеются явления холангита.
Считается, что на развитие заболевания оказывают влияние генетически обусловленные факторы, которые приводят к деградации матричных белков соединительной ткани печени.
Фиброз печени врожденный — болезнь, проявляющаяся гепатоспленомегалией, портальной гипертензией при сохраненной функции печени. Наблюдается преимущественно у детей в период новорожденности и в раннем возрасте. Этиология не установлена. Имеет место более или менее распространенный портальный фиброз, который четко отделен от дольки; пограничный слой гепатоцитов остается совершенно нормальным. Архитектоника долек полностью сохранена, нет узлов регенерации и повреждения печеночных клеток, в дольках нет признаков холестаза.
Если есть подозрение на врожденный фиброз печени, то необходимо помнить, что его клинические проявления у 75 % больных возникают в возрасте 2–14 лет; у 15 % — в возрасте 15–25 лет; у 10 % — в возрасте 25 лет. Заболевание носит наследственный характер, поэтому у родственников пациента также можно выявить фиброз печени. Причинами врожденного фиброза печени являются: дефицит альфа1-антитрипсина; болезнь Вильсона — Коновалова; фруктоземия; галактоземия; гликогенозы (III, IV, VI, IX и X типов), гемохроматоз, тирозинемия, синдром Бадда — Киари.
Клиническая картина. Ранним клиническим проявлением является увеличение размеров живота (без асцита), наблюдаемое с первых месяцев жизни, иногда сопровождающееся неустойчивым стулом, что отражает нарушение ряда процессов пищеварения в связи с формированием портальной гипертензии. Нередко увеличение объема живота педиатрами ошибочно трактуется как проявление рахита. Наблюдается отставание в физическом развитии к дошкольному и школьному возрасту. Печень увеличена, плотность ее более выражена, чем при циррозе, «каменистая». Функциональные пробы печени без изменений. Портальная гипертензия может появляться в различном возрасте (от 6 месяцев до взрослого). С увеличением возраста присоединяется спленомегалия. Чем тяжелее процесс в печени, тем больше спленомегалия и тем раньше она возникает. У 39 % детей появляются пищеводно-желудочные кровотечения, наблюдаются расхождение пупочного кольца, выбухание умбиликальной вены — развитие коллатерального кровообращения при нарастании портальной гипертензии (синдром Крювелье — Боумгартена), у 36 % — асцит. Признаки кровотечения: рвота кровью, темный дегтеобразный стул — чаще возникают на фоне интеркуррентных заболеваний (ОРВИ), оперативного вмешательства или диуретической терапии. Симптомы печеночной недостаточности длительное время не выражены. Для выявления портальной гипертензии проводят рентгенографию пищевода с барием, спленоманометрию и спленопортографию (СПГ). Синдром портальной гипертензии подтверждается высокими цифрами внутрипортального давления; показатели гепато- и спленоманометрии колеблются от 300 до
Лабораторные исследования
Сывороточные аминотрансферазы не отражают тяжесть гистопатологических изменений в печени.
Протромбиновый индекс представляет собой отношение стандартного протромбинового времени к протромбиновому времени у обследуемого больного, выраженное в процентах. Референсные значения — 78–142 %. Диагностическая чувствительность метода составляет 89–95 %. Снижение протромбинового индекса может служить маркером дебюта фиброза или цирроза печени при ее хронических поражениях различной этиологии.
Существуют сывороточные маркеры фиброза печени. К ним относятся: гиалуроновая кислота, проколлаген III типа, N-терминальный пептид проколлагена III, ламинин, коллаген IV типа, матриксные металлопротеиназы 2 и 9, тканевые ингибиторы металлопротеиназ 1 и 2.
В основе диагностических тестов лежит выявление и установление степени выраженности фиброза. С этой целью используются методы выявления молекулярных соединений, участвующих в патофизиологии процесса образования и разрушения внеклеточного матрикса или являющихся активаторами фиброгенеза. Существуют маркеры фиброза печени, определение которых может быть значимым для установления степени выраженности фиброза, а также для оценки эффективности антифибротических препаратов. Большинство из них отражают фиброгенез, а не фибролиз.
Несмотря на удобство и неинвазивность исследования сывороточных маркеров фиброза, их широкое применение имеет ряд ограничений. Указанные маркеры отражают тканевой метаболизм в целом и не являются специфичными только для ткани печени. Кроме того, дисфункция синусоидального эпителия или нарушения билиарной экскреции могут изменять уровни маркеров фиброза.
Маркерами прогрессирования фиброза являются: повышение уровней коллагена IV, гиалуроновой кислоты, проколаген-III-пептида и тканевого ингибитора металлопротеиназы-1.
Маркерами стабильного течения фиброза являются: снижение в сыворотке крови коллагена IV и гиалуроновой кислоты.
Коллаген IV находится в базальной мембране печени и опосредует увеличение фиброзных депозитов в ней. Коллаген IV отражает степень активности заболевания. Поэтому этот показатель может быть маркером хронических заболеваний печени. Уровень коллагена IV в сыворотке коррелирует со степенью фиброза печени и растет по мере прогрессирования фиброза.
Гиалуроновая кислота продуцируется фибробластами и другими специализированными клетками соединительной ткани. Она играет структурную роль в соединительнотканном матриксе (протеогликан) и участвует в различных межклеточных взаимодействиях. Гиалуроновая кислота широко распространена в организме и может обнаруживаться в свободном виде в плазме или синовиальной жидкости.
Уровень гиалуроновой кислоты в сыворотке повышается при различных заболеваниях печени, характеризующихся фиброзом и циррозом, так как при этом снижается функция удаления гиалуроновой кислоты печенью и/или возрастает продукция гиалуроновой кислоты в период воспаления (стимуляции) печени. Уровень гиалуроновой кислоты прямо коррелирует со степенью повреждения печени.
Определение сывороточного уровня гиалуроновой кислоты позволяет проводить дифференциальную диагностику цирроза и других патологических процессов в печени, оценивать степень фиброза печени, мониторировать функцию печени. Уровень гиалуроновой кислоты отражает степень фиброза печени у пациентов с гепатитом С, а серийные определения гиалуроновой кислоты могут применяться для мониторинга лечения интерфероном альфа пациентов с гепатитом С. Аналогичная коррелляция установлена для пациентов с алкогольным циррозом печени и первичным билиарным циррозом.
Уровень гиалуроновой кислоты является также ранним маркером токсического повреждения печени такими веществами, как этанол, ацетаминофен, бактериальные липополисахариды, так как патологические изменения синусоидальных эндотелиальных клеток, происходящие под воздействием этих веществ, предшествуют патологическим изменениям в гепатоцитах.
Инструментальные методы обследования
Визуализирующие методы обследования (ультразвуковое и компьютерно-томографическое исследования) могут применяться для установления диагноза фиброза печени, однако их диагностическая информативность низкая.
Эластография — неинвазивная технология выявления (визуализации) неоднородности мягких тканей по их способности к сжатию и колебаниям.
В процессе эластографии на исследуемую ткань накладывают дополнительное давление. Из-за неодинаковой эластичности неоднородные элементы ткани сокращаются по-разному. Скорость распространения упругих волн определяется эластичностью печеночной ткани. Это позволяет выявлять патологически измененные участки в органах и тканях.
Косвенная инструментальная оценка выраженности фиброза посредством измерения эластичности печени с помощью аппарата «ФиброСкан» основана на генерации низкочастотных колебаний, передающихся на ткань печени. Принцип методики: использование колебаний низкой частоты для количественной оценки эластичности как показателя состояния печеночной ткани и процентного содержания в ней соединительной ткани. Существует положительная корреляция между результатами, полученными при эластографии и биопсии печени.
Фиброз печени можно диагностировать на основании результатов биопсии печени. Биопсия печени проводится только в специализированных лечебных учреждениях, требует специальной подготовки клинициста и патоморфолога. При проведении биопсии печени возможно развитие осложнений (до 3 % случаев).
Морфологическая диагностика фиброза печени по материалам пункционных биопсий часто бывает затруднена, поэтому можно использовать инцизионную краевую биопсию печени. В 15–35 % случаев при выполнении пункционной биопсии печени получают неизмененную ткань печени и в 1,5 % случаев — неинформативный материал.
Диагноз ставится на основании характерной клинической картины. Вспомогательным методом является биохимическое исследование крови. Важное значение имеют эхосканирование печени, эластография, сцинтиграфия, реогепатография, пункционная биопсия печени, лапароскопия.
Лечение в периоде декомпенсации функций печени стационарное, включает те же средства, что при обострении хронического гепатита, а также посиндромную терапию. При асците, отеках строго ограничивается натрий, назначаются пища с достаточным количеством калия, мочегонные средства, альбумин, препараты, останавливающие пищеводное, желудочное и кишечное кровотечение. Профилактика заболевания заключается в соблюдении режима, диеты, исключении приема токсических веществ, предупреждении заболеваний матери.
Опущение печени врожденное (гепатоптоз) — развивается вследствие слабости фиксирующего аппарата печени.
Спланхноптоз (греч. splanchna — внутренности, ptоsis — падение, опущение) — смещение органов брюшной полости вниз по сравнению с их нормальным положением. Может быть общим и частичным.
В возникновении спланхноптоза имеют значение ряд наследственных и конституциональных факторов: врожденные аномалии развития органов, ослабление соединительной ткани — связок, брыжеек, фиксирующих органы к задней брюшной стенке, низкое стояние диафрагмы, сужение нижней части грудной клетки, снижение тонуса брюшных мышц, резкое уменьшение поясничного лордоза и др.
Различают конституциональный и приобретенный спланхноптоз. Конституциональный спланхноптоз наблюдается чаще у женщин и высокорослых мужчин с астеническим телосложением и слаборазвитой мускулатурой. Приобретенный спланхноптоз развивается обычно у тучных лиц после быстрого похудания, эвакуации асцитической жидкости при длительно существующем асците, удаления больших новообразований (опухоли, кисты и др.), расположенных в брюшной полости, многократных родов и др.
Опущение печени встречается относительно редко и наблюдается главным образом у женщин при общем спланхноптозе. Вследствие значительной подвижности и смещения печени происходит деформация ее долей, возникают чувство тяжести в животе, боли в правом подреберье, иррадиирущие в плечо, лопатку, позвоночник. Значительное опущение печени проявляется нарушением портального кровообращения и свободного поступления желчи в кишечник.
Гепатоптоз, как правило, сочетается с опущением желчного пузыря и правого изгиба ободочной кишки. Диагностика этого состояния основывается на данных рентгеноконтрастного исследования больного в вертикальном положении, при котором выявляют опущение нижнего края печени, желчного пузыря и толстой кишки. При дифференциации гепатоптоза с истинным увеличением печени и вторичным ее смещением книзу вследствие объемного патологического процесса прибегают к радионуклидной диагностике, компьютерной томографии, исследованию с применением ультразвука.
Лечение спланхноптоза обычно консервативное — диетическое питание, общеукрепляющие мероприятия, физиотерапевтические процедуры, ношение бандажа. Важное значение в лечении имеет лечебная физическая культура, которая оказывает общеукрепляющее воздействие, способствует повышению тонуса мышечной системы, особенно мышц брюшной стенки и тазового дна. Положительный эффект дает комплекс специальных упражнений, включающий лечебную и утреннюю гигиеническую гимнастику (зарядку), а также пешеходные прогулки, плавание и др. Противопоказаны физические упражнения, вызывающие смещение органов брюшной полости (прыжки, бег, резкие наклоны туловища).
 Оперативное вмешательство производят при осложнениях — частичной или полной непроходимости кишечника, нарушении кровообращения в смещенных органах. Операция заключается в устранении осложнений, ликвидации смещения и фиксации (подшивании) органа (например, гепатопексия, нефропексия, колопексия).
Оперативное вмешательство производят при осложнениях — частичной или полной непроходимости кишечника, нарушении кровообращения в смещенных органах. Операция заключается в устранении осложнений, ликвидации смещения и фиксации (подшивании) органа (например, гепатопексия, нефропексия, колопексия).
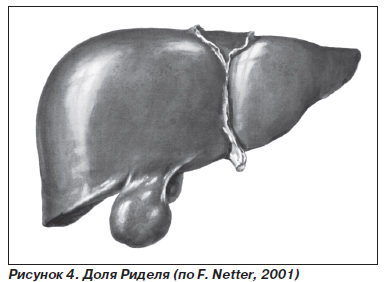
Разделение печени на доли неправильное (син.: нарушение лобуляции печени) – встречается довольно часто в виде образования дополнительных долей или многодольчатой печени. Описана «доля Риделя», представляющая собой удлиненный «язык» печеночной ткани, исходящий из края правой или квадратной доли печени (рис. 4).
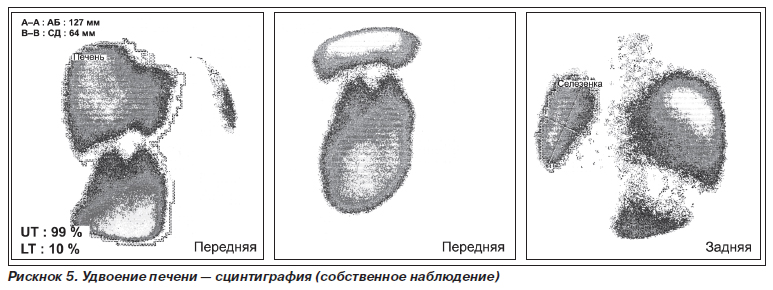
Удвоение печени — полное удвоение относится к казуистике. Возникновение такого порока объясняется наличием дополнительной закладки на вентральной поверхности будущей двенадцатиперстной кишки (рис. 5).