Газета «Новости медицины и фармации» Кардиология (305) 2009 (тематический номер)
Вернуться к номеру
Мужское здоровье после инфаркта миокарда: выбор оптимальной терапии
Авторы: М.Н. Долженко, профессор, Национальная медицинская академия последипломного
образования им. П.Л. Шупика, г. Киев
Версия для печати
Не является секретом тот факт, что во многих эпидемиологических исследованиях отмечена прямая связь между сексуальной активностью и длительностью жизни мужчин [1]. К сожалению, значительное число мужчин среднего и пожилого возраста имеют различные сердечно-сосудистые факторы риска и испытывают опасения по поводу безопасности сексуальной активности для их здоровья [2]. На бытовом уровне существует большое число различного рода заблуждений, согласно которым секс может нередко быть причиной инсульта, инфаркта миокарда (ИМ) или даже смерти. Поэтому вопросы «сердечно-сосудистой безопасности» сексуальной активности являются крайне важными для широкой аудитории врачей терапевтического профиля. Однако пациент с постинфарктным кардиосклерозом пожизненно вынужден принимать терапию, которая, как уже доказано во многих исследованиях, не всегда является безопасной с точки зрения развития эректильной дисфункции (ЭД). И образуется замкнутый круг.
Половая активность после инфаркта миокарда. Неужели все так безнадежно?
Известно, что даже сам по себе половой акт представляет существенную нагрузку для системы кровообращения мужчины. На пике обычной сексуальной активности (который обычно продолжается несколько минут) у здоровых мужчин частота сердечных сокращений (ЧСС) повышается до 120–130 в минуту, систолическое артериальное давление (АД) — до 150–180 мм рт.ст. [3, 4]. И естественно, если исходно эти параметры кровообращения нарушены, то их пиковые значения могут существенно возрастать. Невозможно при наличии выраженной коронарной и сердечной недостаточности увеличение сократительной активности сердца, что должно быть обеспечено резервом сократительной активности и приростом коронарного кровотока. В этих случаях возникает ишемия миокарда («немая» ишемия, стенокардия или даже ИМ), декомпенсация сердечной недостаточности (сердечная астма), повышается вероятность нарушений ритма сердца. Кроме того, следует учитывать потенциальную опасность транзиторной артериальной гипертензии для церебрального кровообращения (ишемия мозга).
В исследовании J.E. Muller и соавт. (1996) было установлено, что относительный риск развития ИМ во время полового акта и в последующие 2 часа в 2,5 раза, а у больных, ранее перенесших ИМ, почти в 3 раза выше, чем во время иной активности [5]. Расчеты этих исследователей показывают, что у практически здорового (без явной ишемической болезни сердца (ИБС)) 50-летнего мужчины вероятность развития ИМ во время полового акта составляет 1 % на протяжении года, или 1 шанс из миллиона на протяжении часа. Если такой мужчина выполняет половой акт один раз в неделю, то риск развития ИМ во время акта или в последующие 2 часа увеличивается всего до 1,01 % за год (2–3 шанса на миллион в час). Однако у мужчины того же возраста, столь же активного в сексуальном отношении, но уже перенесшего ИМ, исходная величина риска развития повторного ИМ составляет примерно 10 % за год, а во время половой активности и в последующие 2 часа риск возрастает до 10,1 %, т.е. он увеличивается с 10 до 20–30 шансов на миллион в час. По другим данным, риск возникновения ИМ после сексуальной активности у пациента с изолированным сердечно-сосудистым заболеванием (ССЗ) повышается до ~ 30 случаев на миллион/час в течение 2 часов после коитуса.
Половая активность после инфаркта миокарда. Что можно и чего нельзя?
Известно, что сексуальная активность в рамках устоявшихся партнерских отношений не является более стрессогенной для сердца, чем обычная физическая активность в течение дня. В исследовании ILISS было доказано, что развитие ИМ связано с физическими нагрузками менее чем в половине случаев [6].
Доказано, что физическая нагрузка во время сексуальной активности не так уж велика — она сопоставима с прогулкой на 1 милю за 20 мин или подъемом на 2 пролета лестницы (20 ступеней) за 10 с [7]. При этом максимальная частота сердечных сокращений во время коитуса значимо не отличается от ЧСС при повседневной активности и значительно меньше, чем ЧСС во время проведения нагрузочных тестов [8].
Результаты эпидемиологических исследований показывают, что при отсутствии ИМ в анамнезе абсолютный риск его развития во время сексуальной активности составляет только 2 случая на 1 млн мужчин. Что касается мужчин с постинфарктным кардиосклерозом, то, согласно результатам анкетирования 1774 пациентов, перенесших ИМ (в том числе 858 сексуально активных), абсолютное увеличение риска развития ИМ после или во время секса выявлено всего у 0,9 % пациентов. Относительный риск ИМ в течение 2 ч после сексуального контакта был равен 2,5 % и не увеличивался после этого временного периода. Этот риск был ниже у больных с регулярными физическими тренировками в анамнезе и не зависел от наличия или отсутствия предыдущего анамнеза ИБС [5].
Риск внезапной смерти во время коитуса повышается в случае внебрачной связи и обычно ассоциируется с наличием партнерши значительно более молодого возраста, а также с предшествующей обильной трапезой и употреблением алкоголя. В рамках же устоявшихся или семейных отношений сексуальная активность значимо не увеличивает риск развития ИМ. Наоборот, снижение или отсутствие сексуальной функции может влиять не только на качество жизни мужчины, но и, по-видимому, на ее продолжительность. Так, в 25-летнем исследовании, включавшем 270 мужчин и женщин в возрасте 60–94 года, показано, что частота половых актов положительно коррелирует с продолжительностью жизни мужчин [9]. В шведском исследовании в течение 5 лет наблюдались 128 женатых мужчин; согласно полученным результатам, более высокая летальность ассоциировалась с ранним прекращением сексуальной жизни. В проводившемся в Уэльсе исследовании, включавшем 918 мужчин в возрасте 45–59 лет, летальность за 10 лет наблюдения была статистически выше среди мужчин с низкой сексуальной активностью (менее 1 раза в месяц) по сравнению с мужчинами, имевшими оргазм 2 раза в неделю и чаще [10].
Каков механизм развития эректильной дисфункции у пациента, перенесшего инфаркт миокарда?
Эрекция — сложный нейроваскулярный процесс, включающий повышение артериального кровотока и снижение венозного, согласованное с расслаблением гладких мышц кавернозного тела. Известна ключевая роль оксида азота (NO) в физиологии эрекции [11]. Накопленные данные говорят о том, что NO, вырабатываемый в ответ на вегетативную стимуляцию пениса, действует местно как нейротрансмиттер неадренергических нехолинергических нервов. NO повышает внутриклеточное накопление циклического гуанозин-монофосфата (цГМФ), что приводит к расслаблению гладкомышечных клеток кавернозного тела. Расслабление трабекулярных лейомиоцитов уменьшает напряжение синусов, что делает возможным быстрое наполнение их венозной кровью и расширение. Кроме того, сжимаются сплетения вен под белковой оболочкой, вследствие чего уменьшается венозный отток. Оксид азота в физиологии мужской сексуальной функции играет роль главного модулятора эрекции [12].
В свою очередь, NO вызывает повышение уровня цГМФ, который обусловливает расслабление гладких мышц кровеносных сосудов полового члена, что в итоге приводит к увеличению притока крови и возникновению эрекции. Обратный процесс — детумисценция — происходит в результате расщепления цГМФ в кавернозных телах под действием фермента фосфодиэстеразы 5-го типа [13]. Помимо монооксида азота, развитию ЭД существенно способствует возникающее усиление свободнорадикального процесса и перекисного окисления в тканях полового члена [13].
О пользе мужских гормонов после инфаркта миокарда
Следует отметить, что, в соответствии с последними данными, одним из механизмов развития ЭД у больных после ИМ является то, что у пациентов с острым ИМ содержание тестостерона значимо ниже, чем у пациентов без ИМ. При этом падение тестостерона ассоциировано с повышением активности ингибитора активатора плазминогена (PAI-I) и снижением уровня тканевого активатора плазминогена [51]. Патогенетически данное явление можно объяснить тем, что имеется взаимосвязь между эндогенными половыми стероидами и прогрессированием атеросклероза. Так, по данным M. Muller, A.W. Van den Beld et al., среди 195 одиноких мужчин, у которых дважды, с интервалом в 4 года, измеряли толщину интимо-медиального комплекса (ТИМ) сонных артерий, на фоне увеличения данного показателя отмечался сниженный уровень общего, свободного тестостерона и эстрадиола. Было выяснено, что концентрация свободного тестостерона находится в обратном соотношении с увеличением ТИМ сонной артерии. Необходимо отметить, что эти соотношения не зависели от антропометрических показателей, уровня АД, холестерина, курения, наличия сахарного диабета. Таким образом, было показано, что низкий уровень свободного тестостерона является независимым фактором риска развития атеросклероза [52].
В исследовании W. Barud et al. выявлена значимая (p < 0,01) положительная корреляция между уровнем тестостерона и холестерина ЛПВП и достоверная отрицательная взаимосвязь уровня эстрадиола и общего холестерина. Это позволило предположить, что низкая концентрация тестостерона может играть роль в патогенезе атеросклероза [53]. В
Роль mutually reinforcing triad — взаимно потенцирующей триады в жизни мужчины
F. Montorsi и соавт. из 300 больных с острыми загрудинными болями и ангиографически подтвержденным поражением коронарных артерий ЭД выявили у 147 (49 %) [14]. A. Greenstein и соавт. отметили корреляцию между тяжестью ЭД и поражением коронарных артерий: при поражении одной артерии отмечали более частые и более полные эрекции по сравнению с пациентами, у которых имело место поражение двух коронарных артерий [15].
В метаанализе нескольких крупных исследований продемонстрировано, что основные факторы риска ССЗ вносят большой вклад в развитие ЭД. Так, увеличение концентрации общего холестерина на 1 ммоль/л повышает риск развития ЭД на 32 %, повышение артериального давления (АД) на
По мнению некоторых авторов, выявление ЭД может свидетельствовать о наличии у пациента латентной формы сахарного диабета (СД), артериальной гипертензии (АГ) и ишемической болезни сердца, что позволяет рассматривать явную ЭД как вероятный предиктор скрыто протекающего сосудистого поражения сердца и артериальной гипертензии, так как диаметр артерий, кровоснабжающих половой член, намного меньше диаметра коронарных артерий, и поэтому ЭД может служить ранним предвестником сердечно-сосудистых заболеваний, а по степени ее тяжести можно судить о прогрессировании ИБС. Greenstein и соавт. выявили корреляцию между тяжестью ЭД и числом пораженных коронарных артерий: больные с поражением одной артерии отмечали более частые и более ригидные эрекции по сравнению с пациентами, у которых имело место поражение 2 и 3 коронарных артерий. Более частое выявление ЭД у больных ИБС объясняют наличием общих факторов риска, поскольку половой член является сосудистым органом и сосудистые факторы риска занимают важное место как при возникновении ИБС, так и при развитии ЭД [15]. Из сосудистых факторов риска доказательно коррелирует с распространенностью ЭД артериальная гипертензия [16].
Как влияет депрессивное состояние после острого инфаркта миокарда на развитие эректильной дисфункции?
К сожалению, изменение стиля жизни больного после развития заболеваний сердечно-сосудистой системы в итоге приводит к ЭД. Тревога или страх — одни из наиболее важных психологических последствий ИМ [17, 18] часто препятствуют полной реабилитации после сердечно-сосудистых заболеваний [5] и ведут к неспособности восстановления сексуальной активности пациентом [5, 19, 20]. Острый инфаркт миокарда и любое последующее хирургическое вмешательство (например, перкутанная трансторакальная коронарная ангиопластика) также могут влиять на психологическое состояние пациента относительно восстановления его ЭД [21].
Доказано, что у 42 % мужчин после первичного ИМ и у 55 % после повторного ИМ при поступлении в блок интенсивной терапии было диагностировано тревожное расстройство [22]. В соответствующих группах у 58 и 37 % была диагностирована депрессия [22]. К сожалению, у партнеров пациентов также может развиваться тревожное расстройство по поводу возможности развития повторного ИМ во время сексуальной активности [23], что, в свою очередь, приводит к дисгармонии в отношениях и сложности прерывания этого психологического порочного круга.
В то же время известно, что от 9 до 34 % пациентов, которые были сексуально активны до ОИМ, не смогли восстановить активность в последующем [19]. У 35–70 % пациентов с ОИМ наблюдалось снижение частоты сексуальных контактов, а также снижение качества сексуального удовлетворения по сравнению с уровнем до ОИМ [19, 20].
Каковы особенности лечения мужчин после инфаркта миокарда?
Итак, мы приходим к выводу, что сексуальная активность необходима как для выживаемости больных после ИМ, так и для увеличения общей продолжительности жизни мужчин. Но больной с постинфарктным кардиосклерозом обязан пожизненно принимать ряд медикаментов, которые зачастую обладают негативным влиянием на эректильную функцию (ЭФ). Как поступать в данном случае? Не секрет, что больные читают (и правильно делают) инструкции к препаратам, и если там будет сказано об отрицательном влиянии на сексуальную активность, то поверьте, в лучшем случае пациент попросит ваш комментарий в отношении данной побочной реакции, в худшем случае просто перестанет принимать препарат. Какие препараты должен принимать больной после ИМ?
Антитромбоцитарная терапия. Данных в отношении воздейстия на эректильную функцию ни для аспирина, ни для клопидогреля доказано не было.
Гиполипидемическая терапия. К сожалению, при возрастающем количестве положительных эффектов гиполипидемической терапии имеются определенные проблемы, связанные с их воздействием на эректильную функцию. Так, доказано, что нарушения потенции достоверно чаще встречаются среди пациентов, получавших гиполипидемические средства (12 % по сравнению с 5,6 % в контрольной группе, р = 0,0029) [24]. Давно известно отрицательное влияние фибратов на мужскую половую функцию, влияние статинов только изучается.
С одной стороны, по последним данным R. Shiri и соавт. (2007), не было выявлено риска развития ЭД у пациентов, получающих статинотерапию [46]. Однако еще в 1997 году были задокументированы случаи данного феномена при назначении статинов [12]. Например, назначение симвастатина вызвало импотенцию у пяти мужчин с ИБС, сексуальная функция восстанавливалась в течение 1 недели после отмены симвастатина. Австралийский комитет по побочным эффектам препаратов доложил о 42 случаях ЭД, вызванной симвастатином и развившейся в течение 27 месяцев от начала лечения, причем в 35 случаях симвастатин был единственным препаратом, который принимали больные [13]. Во французском исследовании по принципу case/non case было опрошено 110 865 человек, которые принимали статины. У 4 % больных развилась ЭД в течение 62 дней от начала приема лекарства. 1,1 % были озабочены возможным возникновением ЭД. У тех, кто не принимал статины, ЭД развилась статистически реже — в 0,4 % случаев (р < 0,0001). В 56,9 % случаев развития ЭД наблюдалось восстановление эректильной функции после отмены статинов и возобновление после повторного назначения у 5 пациентов. Следует отметить, что в данном исследовании больные принимали как симвастатин, так и аторвастатин и розувастатин [36].
Возможно, статины могут ухудшать ЭФ вследствие того, что они взаимодействуют через систему P450 с другими препаратами, которые могут вызывать ЭД [12]. После назначения статинов эта взаимосвязь усиливалась до 38 % (r = 0,62) и можно было определить три ключевые переменные, ассоциированные с ЭД: возраст, сахарный диабет и курение. Также до сих пор не ясна взаимосвязь антигипертензивных препаратов и ЭД [18, 19], поскольку в качестве монотерапии ингибиторы АПФ и антагонисты рецепторов ангиотензина ІІ улучшали эректильную функцию [17, 20, 21]. Однако в другом исследовании у 101 мужчины с АГ было выявлено 26 % случаев импотенции, 70 % из которых ассоциировалось именно с приемом ингибиторов АПФ [22]. В исследовании с медикаментозной терапией и анкетированием у 634 пациентов с СД и ЭД и 2525 без таковых был показан подобный парадоксальный эффект ингибиторов АПФ (RR 1,47), а также бета-блокаторов (RR 1,54), когда данные были проанализированы с поправкой на прочие медикаменты, включая статины, нитраты и дигоксин [18]. Эти данные позволяют предположить, что лекарственные взаимодействия препаратов кардиоваскулярной группы в плане ЭД являются довольно сложными и могут зависеть как от выраженности атеросклеротического процесса, так и от назначаемых медикаментов. Это также может быть верным для пациентов с изолированной гиперхолестеринемией [14, 23].
Как следует относиться к подобным сообщениям? Во-первых, одной из причин развития ЭД является эндотелиальная дисфункция, и именно статины обладают позитивным воздействием на эндотелий и процессы атерогенеза, а значит, патогенетически и на ЭД. А во-вторых, необходимо определиться, какая прогностически неблагоприятная патология превалирует у пациента в данный момент, т.е. по какой причине пациент скорее всего может умереть или остаться инвалидом. Понятно, что при наличии риска реинфаркта или смерти в ближайшем будущем вопрос о том, назначать или нет статины, уже отпадает сам собой. Конечно, назначать, и в данном случае пожизненно. Но врач может варьировать сочетание назначения статинов и других препаратов, необходимых при данной нозологии, таких как селективные бета-адреноблокаторы, блокаторы рецепоторов ангиотензина II порядка, которые повышают эректильную функцию.
Бета-адреноблокаторы. К сожалению, следует отметить, что при обязательном назначении после ИМ бета-адреноблокаторов у пациентов развивается такой побочный эффект, как ЭД. Так, по данным S. Wassertheil-Smoller et al. (1991), полученным в многоцентровом рандомизированном плацебо-контролируемом исследовании TAIM, связанные с эрекцией проблемы выявлялись у 11 % пациентов, получавших в течение 6 мес. атенолол, и у 21 % пациентов, получавших в течение 6 мес. хлорталидон [37].
В описанном выше исследовании в журнале «Drug safety» (2009) было показано, что бета-адреноблокаторы ухудшали эректильную функцию [36].
В другом многоцентровом двойном слепом рандомизированном плацебо-контролируемом исследовании TOMHS приняли участие 557 мужчин в возрасте 45–69 лет. Пациенты получали плацебо или одно из пяти лекарственных средств (ацебутолол, амлодипин, хлорталидон, доксазозин или эналаприл). Половая функция оценивалась при беседе с врачом изначально и затем ежегодно в течение исследования. Изначально 14,4 % мужчин сообщили о проблемах с половой функцией; у 12,2 % мужчин были проблемы с возникновением и/или поддержанием эрекции, коррелировавшие с возрастом, систолическим АД и предыдущей гипотензивной терапией. Через 24 и 48 мес. наблюдения частота ЭД составила 9,5 и 14,7 % соответственно и коррелировала с типом гипотензивной терапии. Пациенты, получавшие хлорталидон, сообщили о достоверно более высокой частоте ЭД через 24 мес. по сравнению с группой, получавшей плацебо (17,1 против 8,1 %, р = 0,025). Однако через 48 мес. частота ЭД оказалась почти одинаковой в обеих группах; различия в группах пациентов, получавших плацебо и хлорталидон, были недостоверными. Наиболее низкая частота ЭД отмечена при приеме доксазозина, но и здесь не получено достоверных отличий от группы плацебо. Частота ЭД для ацебутолола, амлодипина и эналаприла была такая же, как в группе плацебо. Во многих случаях ЭД не требовала отмены медикаментозной терапии. Исчезновение ЭД среди мужчин, имевших эти проблемы изначально, отмечалось во всех группах, но наиболее выражена эта тенденция была среди пациентов, принимавших доксазозин [38].
Пропранолол оказывает негативный эффект на эректильную функцию мужчин в дозе, превышающей 120 мг/день. Бета-1-селективные блокаторы, такие как атенолол, оказывают меньший негативный эффект (но также дозозависимый) по сравнению с пропранололом.
Атенолол в дозе 50–100 мг/день значительно ухудшает способность пациентов поддерживать эрекцию. В двойном слепом параллельном исследовании атенолол снижал сексуальную активность в большей степени, чем целипролол. Негативное влияние атенолола на эректильную функцию превышает таковое других классов, например лизиноприла и валсартана [39]. Однако в исследовании TAIM эректильная дисфункция была более частой у больных, принимавших атенолол 50 мг в день, по сравнению с пациентами группы плацебо (11 против 3 %), но это отличие не было статистически достоверным [37]. К сожалению, атенолол часто назначают в дозе 100 мг/день, которая вызывает ЭД [39]. Точный механизм ЭД вследствие приема бета-блокаторов неизвестен. Негативное влияние бета-блокаторов на сексуальную активность может быть связано с вмешательством в функцию адренергической системы, которая вовлечена в интегративную фазу эрекции и эякуляции. Согласно последним данным, вызываемая бета-блокаторами периферическая вазоконстрикция не объясняет влияния на эректильную функцию. Фармакотерапия ответственна за ЭД примерно в одном из четырех случаев. Как правило, при отмене препарата или его замене эректильная функция быстро восстанавливается [41]. Замена бета-блокатора на небиволол привела к достоверному улучшению эректильной функции пациентов.
При выборе терапии следует также учитывать, что не все бета-адреноблокаторы могут негативно влиять на сексуальную функцию мужчин. D. Franzen et al. (2001) на основании результатов анкетирования 65 пациентов, страдающих ИБС, показано, что терапия метопрололом в течение 4 мес. не оказывает заметного влияния на сексуальную активность мужчин [42]. Другой препарат (бисопролол), по данным С.Р. Broekman et al. (1992), также не ухудшал половую функцию мужчин [43]. Следует отметить, что небиволол вызывает эндотелийзависимую релаксацию, ранее подавляемую оголенным эндотелием и ингибиторами NO и повышает эректильную функцию [8, 18, 19].
Ингибиторы АПФ и антагонисты кальция
На сегодняшний день нет указаний на способность антагонистов кальция и ингибиторов АПФ негативно влиять на мужскую половую функцию. При сравнении отрицательного влияния на половую функцию на фоне терапии лизиноприлом половая активность полностью восстановилась к концу 4 месяцев наблюдения, тогда как у больных, принимавших атенолол, не восстанавливалась до конца лечения. Процент больных, отметивших сексуальные расстройства, также был достоверно выше на фоне терапии атенололом по сравнению с группой лизиноприла (17 и 3 % соответственно) [38]. Хотя, по другим данным R. Shiri и соавт. (2007), риск развития ЭД был выше у пациентов, использующих блокаторы кальциевых каналов (RR = 1,6, 95% CI 1,0–2,4), неселективные бета-блокаторы (RR = 1,7, 95% CI 0,9–3,2) или диуретики (RR = 1,3, CI 0,7–2,4), по сравнению с мужчинами, которые не получали данные группы медицинских препаратов, ЭД не ассоциировалась с приемом селективных бета-адреноблокаторов, ингибиторов АПФ, гиполипидемической терапией [46].
Блокаторы ангиотензиновых рецепторов
Что касается антагонистов ангиотензиновых рецепторов, то в рандомизированном двойном слепом с перекрестным дизайном исследовании R. Fogari et al. (1999) на фоне приема валсартана отмечена тенденция к повышению сексуальной активности мужчин. В исследовании участвовали 94 мужчины в возрасте 40–49 лет с впервые выявленной артериальной гипертензией, ранее не лечившиеся. При приеме валсартана через месяц число половых актов в неделю снизилось с 2,1 до 1,6, но по истечении 16 недель показатель сексуальной активности составил 2,7 [47].
В другом исследовании пациенты получали валсартан 80–160 мг/сут. Артериальное давление уменьшилось со 158/94 до 136/82 мм рт.ст. в течение 6 месяцев (p < 0,001). Сексуальная функция пациентов была оценена до приема валсартана и через 6 месяцев с использованием Международного индекса способности к эрекции (МИСЭ), интернационально утвержденного анкетного опросника. Данная анкета оценивает соответствующие области мужской сексуальной функции, то есть способность к эрекции, оргазму, выраженность сексуального желания, чувство коитального удовлетворения и полного удовлетворения. Было оценено 75,4 % из общей группы пациентов (n = 3502) и 65,0 % подгруппы пациентов без предыдущей антигипертензивной терапии (n = 952), у которых была диагностирована эректильная дисфункция согласно анкетированию МИСЭ. Терапия валсартаном заметно уменьшала ЭД в этих группах от 53 и 45 % (p < 0,0001) соответственно. Улучшение эректильной функции было связано с весьма существенными улучшениями в отношении получения удовлетворения от оргазма и полного удовлетворения от сексуальной активности. Применение валсартана заметно увеличивало показатели анкет IIEF — от 5,64 ± 1,99 и 5,99 ± 2,03 (в группе без антигипертензивной терапии) до 6,82 ± 1,72 и 7,06 ± 1,68 (p < 0,0001) соответственно. Авторы исследования предполагают, что валсартан улучшает сексуальную функцию у мужчин. Аналогичные данные относительно лозартана получены J. Caro et al. (2001) [49].
Каков механизм позитивного влияния блокаторов ангиотензина II на сексуальную функцию?
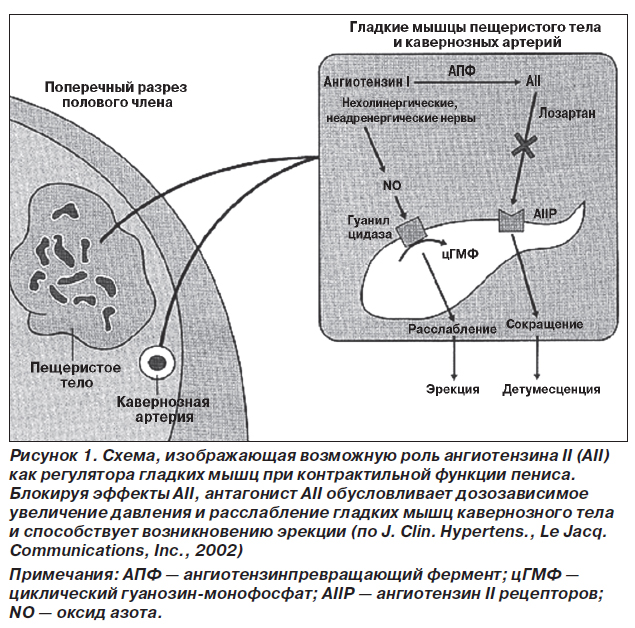
Известно, что эрекция происходит вследствие расслабляющего воздействия оксида азота в пенильных артериях. В данном процессе помимо монооксида азота также могут участвовать вазоактивный полипептид и простагландины. Следует отметить, что ангиотензин II был идентифицирован в эндотелиальных клетках сосудов и связках гладкой мускулатуры в пределах кавернозного тела, где его концентрация в 200 раз выше, чем в плазме, и в 10 раз выше, чем в аортальных или брыжеечных сосудах. Кавернозная ткань пениса синтезирует протеазу через локальный АПФ и спонтанно сохраняет ангиотензин II. Локальный АПФ может регулировать тонус гладкомышечных клеток с помощью паракринных желез посредством ангиотензина II, который, в свою очередь, стимулирует сокращение гладкомышечных клеток кавернозного тела и сосудов через рецепторы ангиотензина II. Этот контрактильный поток крови протекает через пенильные артерии и возвращается в венозное сплетение, что позволяет возникнуть эрекции. Этот механизм совпадает с полученными в исследовании данными, указывающими, что генотип DD (связанный с высоким распространением и содержанием в тканях АПФ) может представлять важный фактор риска развития эректильной дисфункции.
Потенциальная причастность ангиотензина II к регулированию эректильной функции показана в работах Kifor и соавт. с использованием модели эрекции на собаках. При интракавернозном введении ангиотензина II был получен эффект, подобный введению адреналина. Эрекция и расслабление пениса при введении ангиотензина II были дозозависимыми (рис. 1). Данное исследование показывает, что ангиотензин II может быть важным звеном в возникновении эрекции, что может быть использовано для улучшения сексуальной функции у пациентов мужского пола с артериальной гипертензией [50].
Таким образом, можно сделать вывод, что при возникающей проблеме эректильной дисфункции у мужчин после перенесенного ИМ в комплексную терапию больного можно включать блокатор рецепторов ангиотензина II валсартан как препарат, не только улучшающий эректильную функцию, но и, как доказано в исследовании VALIANT, позволяющий снизить риск смерти от любой причины на 25 % [27], что имеет большое значение для клинической практики.
В Украине валсартан существует под названием Вальсакор (KRKA, Словения). Начальная доза Вальсакора при остром ИМ составляет 20 мг 2 р/сут, а целевая — 160 мг 2 р/сут. При хорошей переносимости препарата необходимо стремиться к достижению целевой дозы, которая позволяет обеспечить максимальное снижение смертности и сердечно-сосудистой заболеваемости при повышении эректильных возможностей пациента.
1. United Nations department of economic and social affairs. Population division. World population prospects: the 2000 revision. No. EO1.XII.12. — New York: United Nations, 2001.
2. Feldman H.A., Goldstein I., Hatzichristou D.G. et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study // J. Urol. — 1994. — 151. — 54-61.
3. Jackson G. Sexual intercourse and stable angina pectoris // Am. J. Cardiol. — 2000. — 86. — 35-
4. Bohlen J.G., Held J.P., Sander-
son M.O., Patterson R.P. Heart rate, rate-pressure product, and oxygen uptake during four sexual activities // Arch. Intern. Med. — 1984. — 144. — 1745-48.
5. Muller J.E., Mittleman A., Maclure M., Sherwood J.B., Tofler G.H. Triggering myocardial infarction by sexual activity. Low absolute risk and prevention by regular physical exertion. Determinants of Myocardial Infarction Onset Study Investigators // JAMA. — 1996. — 275. — 1405-09.
6. Tofler G.H., Stone P.H., Maclure M. et al. // Am. J. Cardiol. — 1990. — 66. — 22-7.
7. Jackson G. // Am. J. Cardiol. — 2000. — 86 (2A). — 35F-
8. Drory Y., Shapira I., Fisman E.Z., Pines A. // Am. J. Cardiol. — 1995. — 75. — 835-7.
9. Palmore E.B. // Gerontologist. — 1982. — 22. — 513-8.
10. Davey Smith G., Frankel S., Yamell J. // BMJ. — 1997. — 315. — 1641-4.
11. Andersson K.E. Pharmacology of penile erection // Pharmacol. Rev. — 2001. — 53. — 417-50.
12. Bivalacqua T.J., Usta M.F., Champion H.C., Kadowitz P.I., Hellstrom W.J. Endothelial dysfunction in erectile dysfunction: role of the en-dothelium in erectile physiology and disease // J. Androl. — 2003. — 24(suppl. 6). — S17-37.
13. Cirino G., Sorrentino R., di Villa Bianca R. et al. Involvement of beta 3-adrenergic receptor activation via cyclic GMP- but not NO-depen-dent mechanisms in human corpus caverno-sum function // Proc. Natl. Acad. Sci USA. — 2003. — 100. — 5531-36.
14. Montorsi F., Briganti A., Salonia A. et al. Erectile dysfunction prevalence, time of onset and association with risk factors in 300 consecutive patients with acute chest pain and angiographically documented coronary artery disease // Eur. Urol. — 2003. — 44. — 360-5.
15. Greenstein A., Chen J., Miller H. et al. Does severity of ischemic coronary disease correlate with erectile function // Int. J. Impot. Res. — 1997. — Vol. 9. — P. 123-126.
16. Behr-Roussel D., Corny D., Mevel K. et al. Erectile dysfunction: an erarly marker for hypertension? // Am. J. Physiol. —
17. Crowe J.M., Runions J., Ebbesen L.S. et al. // Heart Lung. — 1996. — 25. — 98-107.
18. Wrześniewski K. // Psychother. Psychosom. — 1977. — 27. — 41-46.
19. Drory Y., Kravetz S., Florian V. et al. // Cardiology. — 1998. — 90. — 207-211.
20. Drory Y., Kravetz S., Weingarten M. // Am. J. Cardiol. — 2000. — 85. — 1283-1287.
21. Fitzgerald S.T., Becker D.M., Celentano D.D. et al. // Am. J. Cardiol. — 1989. — 64. — 1108-1112.
22. Cay E.L., Vetter N., Philip A.E. et al. // J. Psychosom. Res. — 1972. — 16. — 425-435.
23. Friedman S. // Am. J. Cardiol. — 2000. — 86(suppl). — 46F-
24. Bruckert E., Giral P., Heshmati H.M., Turpin G.J. // Clin. Pharm. Ther. — 1996. — 21. — 2. — 89-94.
25. Boyd I.W., Boyd I.W. // Ann. Pharmacother. — 1996. — 30. — 1199.
26. Saltzman E.A., Guay A.T., Jacobson J. Improvement in erectile function in men with organic erectile dysfunction by correction of elevated cholesterol levels: a clinical observation // J. Urol. — 2004. — 172. — 255-8.
27. Jackson G. Simvastatin and Impotence // Br. Med. J. — 1997. — 351. — 31.
28. Cruickshank J.M. What does the future hold for ACE inhibitors? // J. Hum. Hypertens. — 1991. — 5(Suppl. 2). — 41-7.
29. Blumentals W.A., Brown R.R., Gomez-Caminero A. Antihypertensive treatment and erectile dysfunction in a cohort of type II diabetes patients // Int. J. Impot. Res. — 2003. — 15. — 314-7.
30. Fogari R., Zoppi A. Effect of antihypertensive agents on quality of life in the elderly // Drugs Aging. — 2004. — 21. — 377-93.
31. Dusing R. Effect of the angiotensin ii antagonist valsartan on sexual function in hypertensive men // Blood Press Suppl. — 2003. — Suppl. 2. — 29-34.
32. Llisterri J.L., Lozano Vidal J.V., Aznar V.J. et al. Sexual dysfunction in hypertensive patients treated with losartan // Am. J. Med. Sci. — 2001. — 321. — 336-41.
33. Jensen J., Lendorf A., Stimpel H. et al. The prevalence and etiology of impotence in 101 male hypertensive outpatients // Am. J. Hypertens. — 1999. — 12. — 271-5.
34. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering therapy and of antioxidant vitamin supplementation in a wide range of patients at increased risk of coronary heart disease death: early safety and efficacy experience // Eur. Heart. J. — 1999. — 20. — 725-41.
35. Solomon H., Samarasinghe Y.P., Feher M.D. at al. Erectile Dysfunction and Statin Treatment in High Cardiovascular Risk Patients // Int. J. Clin. Pract. — 2006. — 60(2). — 141-145.
36. Do C., Huyghe E., Lapeyre-Mestre M. et al. Statins and Erectile Dysfunction: results of a Case/Non-case Study using the French Pharmacovigilance System Datebase // Drug safety. — 2009. — Vol. 32. — P. 591-597.
37. Wassertheil-Smoller S., Blaufox M.D., Oberman A.S. et al. The Trial of Antihypertensive Interventions and Management (TAIM) Study // Ann. Intern. Med. — 1991 September 15. — 115(6). — 497-497.
38. Mascioli S.R., Grimm R.H. Jr., Neaton J.D. et al. Characteristics of participants at baseline in the Treatment of Mild Hypertension Study (TOMHS) // Am. J. Cardiol. — 1990. — 66. — 32C-
39. Fogari R., Preti P., Derosa G. et al. Effect of antihypertensive treatment with valsartan or atenolol on sexual activity and plasma testosterone in hypertensive men // European Journal of Clinical Pharmacology. — 2002. — Vol. 58. — № 3.
40. ACP Issues Guidelines for Treatment of Erectile Dysfunction // Annals of Internal Medicine. — 2009 October 19.
41. Keene L.C., Davies P.H. Drug related erectile dysfunction // Adverse Drug React. Toxicol. Rev. — 1999. — 18. — 5-24.
42. Freis E.D. Current status of diuretics, β-blockers, α-blockers and α-, β-blockers in the treatment of hypertension // Med. Clin. North. Am. — 1997. — 81. — 1305-17.
43. Broekman C.P., Haensel S.M., Van de Ven L.L., Slob A.K. Bisoprolol and hypertension: effects on sexual functioning in men // J. Sex. Marital Ther. — 1992. — 29. — 325-31.
44. Anderson K. Erectile physiological and pathophysiological pathways involved in erectile dysfunction // J. Urol. — 2003. — 170. — 6-14.
45. Ritter J.M. Nebivolol: endothelium-mediated vasodilating effect // J. Cardiovasc. Pharmacol. — 2001. — 38(Suppl 3). — S13-6.
46. Cosentino F., Bonetti S., Rehorik R., Eto M., Werner-Felmayer G., Volpe M. et al. Nitric-oxide-mediated relaxations in saltinduced hypertension: effect of chronic beta1-selective receptor blockade // J. Hypertens. — 2002. — 20. — 421-8.
47. Shiri R., Koskimäki J., Häkkinen J. et al. Cardiovascular Drug Use and the Incidence of Erectile Dysfunction // Int. J. Impot. Res. — 2007. — 19(2). — 208-212.
48. Fogari R., Corradi I., Poletti L. et al. Sexual activity in hypertensive males treated with valsartan or carvedilol. A cross-over study // J. of Hypertension. — 1999. — 17 (Suppl. 3). — S 65.
49. Fogari R., Zoppi A., Corradi L. et al. Sexual function in hypertensive males treated with lisinopril or atenolol: a cross-over study // Am. J. Hyрertens. — 1998. — 11. — 1244-1247.
50. Caro J., Vidal J., Vicente J. et al. Sexual dysfunction in hypertensive patients treated with losartan // J. Med. Sci. — 2001. — 321. — 336-41.
51. Kifor I., Williams G.H., Vickers M.A. et al. Tissue angiotensin II as a modulator of erectile dysfunction. I. Angiotensin peptide content, secretion, and effects in the corpus cavernosum // J. Urol. — 1997. — 157(5). — 1920-1925.
52. Pfeffer M.A., McMurray J., Leizorovicz A. et al. Valsartan in acute myocardial infarction trial (VALIANT): rationale and design // Am. Heart. J. — 2000. — 140. — 727-750.
53. Pfeffer M.A., McMurray J.J., Velazquez E.J. et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both // N. Engl. J. Med. — 2003. — 349. — 1893-1906.
54. McMurray J., Solomon S., Pieper K., Reed S., Rouleau J., Velazquez E. et al. The Effect of Valsartan, Captopril or Both on Atherosclerotic Events After Acute Myocardial Infarction An Analysis of the Valsartan in Acute Myocardial Infarction (VALIANT) // J. Am. Coll. Cardiol. — 2006. — 47(4).