Газета «Новости медицины и фармации» Кардиология (305) 2009 (тематический номер)
Вернуться к номеру
Современные принципы диагностики и лечения артериальной гипертензии у подростков
Авторы: С.В. Попов, А.М. Гонцова, Кафедра семейной медицины Медицинского института Сумского государственного университета
Версия для печати
Артериальная гипертензия (АГ) является одним из наиболее широко распространенных заболеваний — встречается у 30 % взрослого населения. Течение АГ сопровождается развитием ряда осложнений, ведущих в конечном итоге к значительному ухудшению состояния здоровья и потере трудоспособности. Своевременная диагностика и терапия гипотензивными средствами должны помочь ограничить негативное влияние АГ на качество жизни пациента, однако указанная эффективность в значительной степени зависит от своевременного начала и использования эффективных препаратов [1, 2]. В последнее время все больше авторов указывают на вероятность формирования предикторов многих заболеваний, а также их самих в детском возрасте, что также справедливо и для АГ. Причем в таких случаях нередко уже в детском возрасте имеет место поражение органов-мишеней. Наиболее часто может развиваться гипертрофия левого желудочка, выявляющаяся у 38–41 % детей с АГ. Доказано, что даже незначительное увеличение артериального давления (АД) может оказывать отрицательный эффект на структуру и функцию сосудов даже при асимптомном течении заболевания [3, 4]. Все это указывает на крайнюю важность своевременной диагностики АГ и последующей эффективной терапии, на фоне которой возможно обратное развитие некоторых осложнений [5, 6].
Распространенность АГ в детском возрасте относительно невелика по сравнению с таковой у взрослых, в целом составляет от 2 до 3 %. Однако с возрастом распространенность АГ увеличивается: уже в школьном возрасте заболевание выявляется у 4,5 % детей [7, 8]. В то же время некоторые авторы приводят более значительные цифры: по их мнению, АГ может встречаться у 9–22 % детей [9]. Имеется несколько факторов, с которыми связывается повышенный риск эссенциальной гипертензии в детском возрасте. Так, на первом месте среди факторов риска находится избыточная масса тела, распространенность которой в детской популяции достигает 20 %, при этом частота гипертензии у этих пациентов достигает 10–30 % [7, 8, 10].
Среди критериев стратификации риска у детей и подростков с АГ принято выделять следующие факторы [17, 18]:
Диагностические критерии гипертензии определены достаточно ясно: увеличение систолического/диастолического АД ≥ 95-го перцентиля относительно пола, возраста и роста. Для точности диагностики АГ имеет значение применяющаяся методика измерений АД, среди которых предпочтительной является аускультативная с выявлением тонов Короткова [2, 9]. Использование осциллометрического метода, по данным некоторых авторов, может давать переоценку систолического давления на 4–5 мм рт.ст. Аппарат определяет среднее АД, далее, используя алгоритмы, различные для каждой фирмы-производителя, выполняется расчет систолического и диастолического АД. Поэтому в случае выявления АД выше 95-го перцентиля указанным способом необходимо подтверждать гипертензию аускультацией [2].
Для достоверной диагностики необходимо 3-кратное измерение АД с перерывами в 1–2 недели для исключения, в частности, эффекта «белого халата», который встречается у 44–53 % детей, у которых первичный скрининг выявил гипертензию [2, 7, 11]. Так, по данным J.M. Sorof еt al., при первом скриниг-тесте повышенное значение АД наблюдалось у 990 (19 %) из 5102 школьников. Второе обследование, проведенное через 1–2 недели, выявило увеличение АД у 56 % детей из отобранного контингента, что составило 9,5 % от всех школьников, продолжающих участие в эксперименте (4954 человека). Наконец, третий этап, также проведенный через указанный интервал времени, показал наличие гипертензии у 54 % исследуемых [8]. Таким образом, итоговая распространенность АГ у школьников составила 4,5 %, остальные случаи повышенного АД можно было отнести к эффекту «белого халата».
В клинической практике принято выделять лабильную, стабильную гипертензию и собственно гипертоническую болезнь. Маркерами первых двух служит в первую очередь индекс времени повышенного систолического артериального давления — 25–60 % и 60–100 % суточного/дневного профиля АД соответственно. Диагностика гипертонической болезни основывается на следующих критериях: возраст больного свыше 16 лет, более чем годичный стаж заболевания, вовлечение в патологический процесс органов-мишеней [9]. За рубежом при превышении АД 95-го перцентиля относительно соответствующего роста, возраста и пола диагностируют гипертензию 1-й степени, выше 99-го плюс
Для детского возраста наиболее характерна симптоматическая гипертензия, которая чаще всего связана с ренальной/реноваскулярной патологией (в 60–70 % случаев), реже — с заболеваниями сердечно-сосудистой и эндокринной систем. Первичная гипертензия в качестве основного диагноза у ребенка до 10 лет представляется скорее исключением. Однако у подростков эссенциальная гипертензия — главная причина повышенного АД, которая диагностируется у 85–95 % пациентов [2, 13].
В целом объем исследований при выявленной АГ может быть достаточно велик и дорогостоящ. Использование амбулаторного мониторинга АД (АМАД) в течение 24 часов позволяет исключить гипертензию, связанную с эффектом «белого халата», снижая, таким образом, затраты на диагностические мероприятия. Кроме того, суточный профиль АД дает возможность оценить эффективность применяемых лекарственных средств, развитие гипотензивных состояний. К тому же АМАД позволяет решать в определенной степени вопрос дифференциальной диагностики между первичной и вторичной гипертензией. Для последней считается характерным повышение САД ночью и ДАД днем [2, 8, 9, 14].
Таким образом, распространенность гипертензии в детском возрасте с тенденцией к прогрессирующему приросту по мере взросления создает очевидные предпосылки для своевременной диагностики и адекватной коррекции факторов риска сердечно-сосудистой патологии и оптимальной антигипертензивной терапии с целью профилактики осложнений.
В настоящее время вопросы лечения подростков и лиц молодого возраста с АГ находятся в стадии разработки. Наибольшее внимание уделяется немедикаментозным методам лечения. Считается, что показание к немедикаментозному лечению этой категории пациентов — выявление систолического и/или диастолического АД, равного или превышающего уровень 90 % (САД ≥
Основными методами немедикаментозного лечения являются мероприятия по снижению веса, физические упражнения и изменение режима и характера питания. Однако немедикаментозных методов лечения АГ часто оказывается недостаточно. В этих случаях, а также при выраженной АГ, то есть если цифры АД превышают 94 % или если имеются признаки поражения органов-мишеней, рекомендуется медикаментозная терапия.
Абсолютными показаниями к назначению лекарственных препаратов являются: симптоматическая гипертензия, поражение органов-мишеней (гипертрофия левого желудочка, ретинопатия, микроальбуминурия), вторичная гипертензия, персистирующая гипертензия на фоне неэффективности немедикаментозной терапии. К относительным показаниям для назначения медикаментозной терапии принадлежат: стойкая или ночная гипертензия, выявляемая при суточном мониторировании АД; наличие кардиоваскулярных факторов риска (курение, гиперлипидемия); гипертензия на фоне ожирения; наследственная гипертензия.
Однако недостаток доказательных данных, касающихся соотношения медикаментозных и немедикаментозных методов лечения, эффективности гипотензивных препаратов, а также возможных сроков их применения, создает сложности для проведения адекватной профилактики и лечения АГ.
Выбор препарата в подростковом и молодом возрасте должен осуществляться с учетом особенностей течения и степени тяжести АГ, наличия и выраженности факторов риска сердечно-сосудистых заболеваний, поражения органов-мишений, характера сопутствующих заболеваний (ожирения, сахарного диабета, нарушений вегетативной нервной регуляции, функционального состояния почек и др.), профиля переносимости и эффективности лекарственного средства, характера побочных эффектов, кратности приема в течение суток и стоимости препарата.
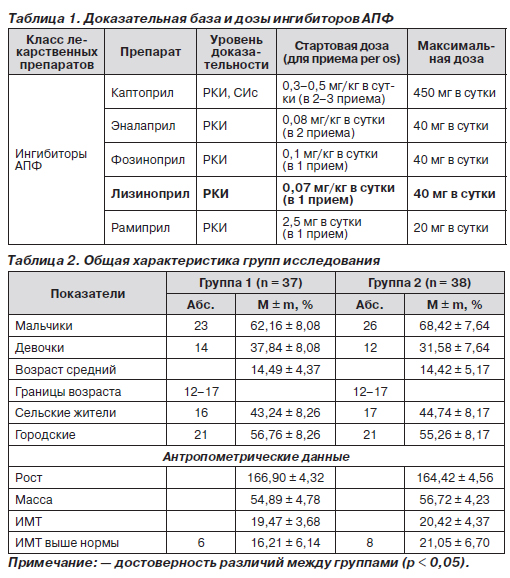
С целью минимизации риска развития побочных эффектов лечение начинают с минимальной дозы одного лекарственного препарата. Возможно увеличение дозировки, в дальнейшем принимается решение о замене препарата или применении комбинированной терапии, что зависит от таких факторов, как переносимость препарата, его гипотензивный эффект. Приоритет имеют препараты длительного действия, которые обеспечивают контроль АД в течение 24 часов при однократном приеме [20]. В настоящее время для длительного лечения артериальной гипертензии в разных возрастных группах применяются 5 основных классов гипотензивных препаратов: диуретики, β-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензинпревращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II [21].
В клинической практике основной группой препаратов для лечения АГ у детей и подростков являются ИАПФ, доля которых среди антигипертензивных препаратов составляет около 40 %. Это связано с тем, что ИАПФ обладают рядом преимуществ (сочетают высокую эффективность, доказанную многочисленными клиническими исследованиями, хорошую переносимость, оказывают влияние на механизмы прогрессирования сердечно-сосудистых осложнений, благоприятно сказываются на прогнозе при условии их длительного и регулярного применения). Важным является наличие рандомизированных клинических исследований, подтвердивших эффективность и безопасность применения отдельных препаратов из группы ИАПФ (каптоприл, эналаприл, лизиноприл) в детском возрасте. Наряду с этим ИАПФ являются высокоэффективными, безопасными препаратами, которые сочетают кардиопротекторное действие и положительное влияние на функцию почек.
В настоящее время на рынке Украины представлен целый ряд препаратов данного класса, которые обладают различной фармакодинамикой и имеют различные фармакокинетические характеристики, индивидуальные особенности переносимости и свою специфику фармакоэкономических показателей. В практике врача-педиатра очень часто встает вопрос выбора оптимального ИАПФ для лечения АГ. Поэтому целью настоящей работы было изучение сравнительной эффективности наиболее часто используемых в клинической практике ИАПФ — лизиноприла (Лоприл®) и эналаприла.
Материалы и методы
Нами были исследованы данные 75 детей в возрасте от 12 до 17 лет, находящихся на стационарном лечении в профильном отделении. Случайным образом они были разделены на 2 группы: группа 1 включала 37 пациентов, получавших Лоприл® (лизиноприл, Bosnalijek); группа 2 состояла из 38 детей, которым назначался эналаприл. Больные обеих групп не различались между собой по полу, возрасту, антропометрическим, анамнестическим данным (табл. 1).
Для исключения эффекта «белого халата» и гипертонической формы вегетососудистой дисфункции (ВСД) использовалось определение суточного профиля артериального давления. Величина индекса времени САД менее 25 % считалась характерной для ВСД [9].
Основными критериями отбора больных к назначению им медикаментозного лечения служили отнесение их к группе детей со стабильной гипертензией по указанным маркерам, а также суточный профиль АД. В группе 1 из 37 пациентов 28 имели индекс времени САД выше 60 %. В группе 2, соответственно, из 38 больных у 31 наблюдалось превышение аналогичного параметра более 60 %. Оставшиеся пациенты — 9 и 7 детей — имели показатели суточного профиля, соответствующие лабильной гипертензии. Однако все они имели длительность заболевания более 6 месяцев при использовании немедикаментозных способов лечения АГ, что позволило также отнести их к группе больных, нуждающихся во введении медикаментов [9].
Выбор препарата Лоприл® (лизиноприл, Bosnalijek) был обоснован следующими факторами:
Начальная доза лизиноприла составляла 0,07 мг/кг/сутки однократно, начальная доза эналаприла — 0,8 мг/кг/сутки 2-кратно с последующим повышением до эффективной [2, 5, 9]. Оценка эффективности действия препаратов проводилась в контрольные точки — через 3, 5 и 8 дней после начала терапии. Причина выбора контрольных точек через 2–3 дня заключалась в желании избежать воздействия на результаты случайных факторов, не связанных с медикаментозной терапией. Измерение АД проводилось ртутным манометром с помощью определения тонов Короткова. Рассчитывались средние значения систолического и диастолического давления 3-кратно в течение контрольного дня. Кроме того, была проведена оценка эффективности действия медикаментов по достижению САД больного 95-го перцентиля относительно возраста, пола и роста. Указанный параметр является основным критерием эффективности лекарственного средства при АГ, неосложненном ее варианте [2, 5]. В группах 1 и 2 определялось количество детей, у которых САД было ниже 95-го перцентиля на 3, 5 и 8-й дни от начала терапии.
Статистические расчеты включали определение средней доли, ее стандартной ошибки, вычисления критерия z с поправкой Йейтса.
Результаты и их обсуждение
Среди обследованных пациентов с АГ преобладали мальчики (табл. 2). Между группами гендерных различий зафиксировано не было. В целом в обследованном контингенте преобладали городские жители, хотя и ненамного (p > 0,05). Антропометрические данные (средние значения роста, массы тела, а также индекса массы тела) не имели значительных отличий в контрольной и основной группах исследования.
Изучение индекса массы тела показало его увеличение у 16,21 ± 6,14% пациентов группы 1 и у 21,05 ± 6,70 % группы 2. Эти цифры несколько меньше ожидаемых, поскольку распространенность избыточной массы тела в общей популяции составляет около 20 %.
Некоторые анамнестические данные представлены в табл. 3. Распространенность заболеваний сердечно-сосудистой системы (ССС) у родителей составила 62,16 % в группе 1 и 57,9 % в группе 2. Это соответствует литературным данным, авторы указывают частоту патологии ССС у родственников детей с АГ в пределах 50–86 %. Причем вероятность первичной АГ у родителей детей также с первичной гипертензией составляет 49 %, что соответствует нашим данным [5].
Кроме АГ, в семейном анамнезе выявлялись и другие характерные патологические состояния. У родителей больных детей с частотой 21–35 % отмечалось ожирение, в 18–21 % случаев — сахарный диабет. При выяснении возможных расстройств сна они были выявлены у 1/4–1/3 пациентов обеих групп. Обращала на себя внимание относительно низкая физическая активность детей. Регулярно занимались физкультурой и спортом только 24–28 % подростков. Наоборот, обучению или игре на компьютере более 2 часов в день уделяли время около половины респондентов. Значительное количество детей положительно отвечали на вопрос о курении — 64 и 60 % в группе 1 и 2 соответственно. Около 29 % детей группы 1 и 31 % группы 2 принимали алкогольные напитки. В целом анамнестические данные были характерными для первичной артериальной гипертензии, подтверждая правомочность диагноза.
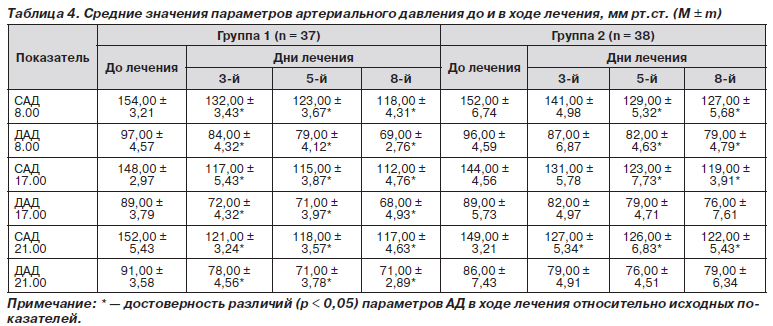
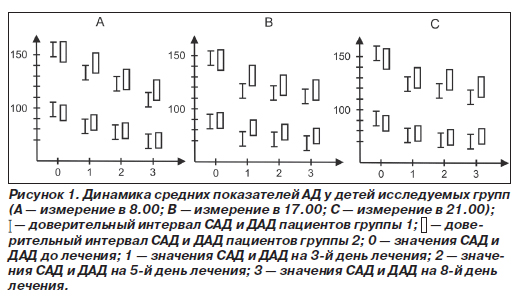
После начала терапии измерение артериального давления методом Короткова показало его снижение в обеих группах исследования (табл. 4). В то же время у пациентов основной группы, получавших Лоприл®, уже на 3-й день происходило достоверное снижение как САД, так ДАД во все часы обследования. У больных, которые принимали эналаприл, подобное уменьшение большинства показателей происходило только во второй контрольной точке — на 5-й день от начала лечения.
К 8-м суткам терапии более низкие параметры АД фиксировались у пациентов обеих групп. Таким образом, эффективность препарата Лоприл® проявлялась более ранним снижением показателей АД (рис. 1). Это подтверждалось сравнительным анализом достижения значений САД 95-го перцентиля относительно пола, возраста, роста (табл. 5).
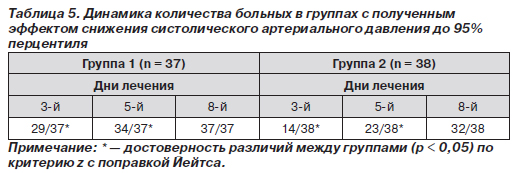
Анализ результатов демонстрирует, что в первую контрольную точку уже у 29 из 37 пациентов, получавших Лоприл®, происходило снижение САД до нормы, тогда как в контрольной группе это количество было достоверно ниже — у 14 из 38 (p < 0,05). На 5-й день лечения число детей группы 1 с полученным эффектом терапии возросло до 34 из 37. Это также было выше, чем у пациентов группы 2 (p < 0,05). К последней контрольной точке все больные, получавшие Лоприл®, отмечали снижение АД до нормативных значений. Наоборот, у 6 пациентов, которые принимали эналаприл, не было зафиксировано уменьшения АД, что потребовало коррекции терапии.
Выводы
Таким образом, применение лизиноприла позволило снизить АД до нормативных показателей у большинства пациентов уже на 3-й день терапии и на 100 % через 8 суток лечения. В группе больных, использовавших эналаприл, динамика снижения АД была менее выраженной. Переносимость препаратов в обеих группах была удовлетворительная (побочные эффекты в виде головокружения и гипотензии наблюдались у 2 пациентов (по одному в каждой из групп), а явления сухого кашля имели место только во второй группе у 2 пациентов). Однако в связи с незначительной выраженностью этих эффектов пациенты продолжили лечение в рамках своих групп с коррекцией суточной дозы препарата. Существенным преимуществом препарата Лоприл®, по оценкам респондентов, является возможность его приема один раз в сутки, что существенно облегчало процесс лечения. В обеих клинических группах не было отмечено отрицательного влияния на показатели липидного и углеводного обмена, а также состояние электролитов.
Таким образом, представленные данные свидетельствуют о том, что назначение препарата Лоприл® в качестве монотерапии при первичной АГ в детском возрасте имеет преимущества перед использованием иных ингибиторов ангиотензинпревращающего фермента благодаря более быстрому и полному достижению эффекта в виде снижения АД до нормативных значений, а также более благоприятному профилю переносимости.
Особенности фармакологических свойств препарата Лоприл® делают его приоритетным для лечения пациентов с сочетанием АГ и метаболического синдрома, ожирения, сахарного диабета, при нарушении функции почек и печени.
1. Hanevold C., Waller J., Daniels S. et. al. The Effects of Obesity, Gender, and Ethnic Group on Left Ventricular Hypertrophy and Geometry in Hypertensive Children: A Collaborative Study of the International Pediatric Hypertension Association // Pediatrics. — 2004. — Vol. 113, № 2. — S. 328-333.
2. High Blood Pressure in Children and Adolescents. The Fourth Report on the Diagnosis, Evaluation, and Treatment of National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents // Pediatrics. — 2004. — Vol. 114, № 2. — S. 555-576.
3. Belsha C.W., Wells T.G., McNiece K.L. et. al. Influence of diurnal blood pressure variations on target organ abnormalities in adolescents with mild essential hypertension // Am. J. Hypertens. — 1998. — № 11. — S. 410-417.
4. Sorof J.M., Alexandrov A.V., Cardwell G., Portman R.J. Carotid artery intimal-medial thickness and left ventricular hypertrophy in children with elevated blood pressure // Pediatrics. — 2003. — Vol. 111. — S. 61-66.
5. Luma G.B., Spiotta R.T. Hypertension in Children and Adolescents // Am. Fam. Physician. — 2006. — Vol. 73, № 9. — S. 1558-1568.
6. Barnes V.A., Treiber F.A., Davis H. Impact of transcendental meditation on cardiovascular function at rest and during acute stress in adolescents with high normal blood pressure // J. Psychosom. Res. — 2001. — Vol. 51. — S. 597-605.
7. Swartz S.J., Srivaths P.R., Croix B., Feig D.F. Cost-Effectiveness of Ambulatory Blood Pressure Monitoring in the Initial Evaluation of Hypertension in Children // Pediatrics. — 2008. — Vol. 122, № 6. — S. 1177-1181.
8. Sorof J.M., Lai D., Turner J. et. al. Overweight, Ethnicity, and the Prevalence of Hypertension in School-Aged Children // Pediatrics. — 2004. — Vol. 113, № 3. — S. 475-482.
9. Майданник В.Г., Хайтович М.В., Місюра Л.І. та ін. Діагностика та лікування первинної артеріальної гіпертензії у дітей і підлітків. Методичні рекомендації. — Київ, 2006. — 43 с.
10. Sorof J., Daniels S. Obesity hypertension in children: a problem of epidemic proportions // Hypertension. — 2002. — Vol. 40. — S. 441-447.
11. Sorof J.M., Portman R.J. White coat hypertension in children with elevated casual blood pressure // J. Pediatr. — 2000. — Vol. 137, № 4. — S. 493-497.
12. Sorof J.M., Urbina E.M., Cunningham R.J. et al. Screening for eligibility in the study of antihypertensive medication in children: experience from the Ziac Pediatric Hypertension Study // Am. J. Hypertens. — 2001. — Vol. 14. — S. 783-787.
13. Flynn J.T. Evaluation and management of hypertension in childhood // Prog. Pediatr. Cardiol. — 2001. — Vol. 12. — S. 177-188.
14. Flynn J.T. Differentiation Between Primary and Secondary Hypertension in Children Using Ambulatory Blood Pressure Monitoring // Pediatrics. — 2002. — Vol. 110, № 1. — S. 89-93.
15. Белоусов Ю.В. Гастроэнтерология детского возраста. — Харьков: Консул, 2000. — 257 с.
16. Баранов А.А., Климанская Е.В., Римарчук Г.В. Детская гастроэнтерология. Избранные главы. — М., 2002. — 592 с.
17. Jolliffe C.J., Janssen I. Distribution of lipoproteins by age and gender in adolescents // Circulation. — 2006. — 114. — 1056.
18. WHO. Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia. Report of a WHO/IDF Consultation. —
19. Zimmet P., Alberti K.G., Kaufman F., Tajima N., Silink M., Arslanian S., Wong G., Bennett P., Shaw J., Caprio S. IDF Consensus Group. The metabolic syndrome in children and adolescents — an IDF consensus report // Pediatr. Diabetes. — 2007. — 8(5). — 299-306.
20. Flynn J.T. Pharmacologic management of childhood hypertension // Am. J. Hypertens, — 2002. — 15 (2). — 30S-33S.
21. Mansoor G.A. Ambulatory blood pressure monitoring in clinical trials in Adults and Children // Am. J. Hypertens. —2002. — 15(2). — 38S-42S.