Газета «Новости медицины и фармации» 5(311) 2010
Вернуться к номеру
Откуда «растут ноги» у тяжелой астмы, или Напрасно забытые истины
Авторы: Б.М. Пухлик, д.м.н., профессор, главный внештатный аллерголог МЗ Украины, г. Винница
Версия для печати
В последнее десятилетие достаточно заметно просматривается тенденция к преуменьшению роли аллергенов как причины ряда аллергических заболеваний (АЗ). Особенно явно это видно на примере эволюции глобальной стратегии GINA, продвигающей современные технологии лечения бронхиальной астмы (БА), в несколько меньшей мере — на примерах эволюции стратегии лечения атопического и контактного дерматита, крапивниц. Все это, на наш взгляд, в большей мере отражает борьбу фармацевтических фирм за пациента, нежели истинное научно обоснованное представление о причинах и патогенезе АЗ. Попытаемся проиллюстрировать это нижеприведенными сведениями.
 Бронхиальная астма
Бронхиальная астма
История учения о бронхиальной астме (БА) изобилует различными гипотезами — от воспалительной, инфекционной, до патэргической, аллергической, однако направленность всех этих классификаций была, как правило, этиологической. Наиболее стойко закрепилось в нашей памяти деление БА на атопическую (неинфекционно-аллергическую) и инфекционно-аллергическую (А.Л. Адо), экзогенную, эндогенную и смешанную. Потом были период Г.Б. Федосеева (1990) и его многочисленные клинико-патогенетические варианты БА. Это говорит о том, что ученые, врачи пытались найти причину БА и воздействовать на нее, т.е. пытались найти этиотропные методы лечения. Кстати, классификация БА последнего пересмотра МКБ-10, подготовленная ВОЗ в 1992 г., сохраняет этиопатогенетическую группировку вариантов БА.
Классификация БА в соответствии с Международной классификацией болезней (МКБ) 10-го пересмотра
И лишь примерно 20–25 лет тому назад (что совпало с внедрением в практику селективных бронхолитических и ингаляционных глюкокортикостероидов — ИГКС) об этиологии, происхожении БА стали говорить все меньше, а больше — о градации по тяжести течения, потом — по контролируемости фармпрепаратами, и как итог — представление о БА стало все больше сближаться с представлением о хроническом обструктивном бронхите, теперь — ХОЗЛ (хроническое обструктивное заболевание легких). Понятно, почему: для бронхолитиков и ИГКС «безразлично», лежит ли в основе синдрома бронхоспазма эозинофильное или нейтрофильное воспаление, — они «работают» в обоих случаях (хотя и по-разному). В то же время это огромное заблуждение — не идентифицировать причину бронхоспазма, или удушья, или удушливого кашля или игнорировать то, что у детей свыше 90 % случаев БА имеет аллергическое происхождение (АБА), у взрослых — свыше 70 %. Сохраняя такой подход, мы сознательно откажемся от этиологического лечения БА, будем просто «эксплуатировать» заболевание, постоянно создавая и применяя все новые симптоматические препараты. Понятно, кому это выгодно.
Тяжелая БА
В последнее время особое внимание приковано к так называемой тяжелой астме (в литературе встречаются ее синонимы — «хроническая тяжелая», «резистентная к терапии», «трудно контролируемая», «рефрактерная», «гормонозависимая», «стероидорезистентная», «фатальная», «нестабильная»), которая плохо поддается лечению, не удается контролировать ее течение, регистрируется высокая смертность и пр. Для фармфирм особо важно то, что на тяжелую БА припадает значительная доля средств из «бюджета БА» в странах со страховой медициной. Для аллергологов же особо важным является то, что у значительной части подобных больных выявляется повышенный уровень общего IgE. Эти факты всплыли в основном потому, что появилась «ниша» для препарата ксолар, представляющего собой моноклональные антитела против свободного IgE.
Как указывают А.Г. Чучалин и Л.А. Горячкина (2009), в последней редакции Международных рекомендаций Глобальной инициативы по борьбе с астмой (GINA) изложены достаточно четкие критерии тяжести БА, а также современные представления о причинах развития и прогрессирования заболевания, среди которых важная роль отводится аллергической предрасположенности (атопии). С влиянием на механизмы аллергизации исследователи связывают надежды на улучшение контроля тяжелой атопической астмы. Данные эпидемиологических исследований не оставляют сомнений в том, что среди пациентов с тяжелой БА регистрируются самая высокая частота госпитализаций, незапланированных обращений за медицинской помощью и самый высокий риск развития фатального астматического приступа (C.M. Dolan с соавт., 2004). И хотя, по данным национальной программы по БА и программы ISAAC (1993–2006), больные с тяжелой БА составляют лишь около 5 % российской популяции астматиков, они потребляют значительную долю ресурсов здравоохранения, выделенных на эту проблему.
В действительности распространенность тяжелой БА недооценивается врачами. Эксперты ВОЗ называют цифру 20 % — такова доля тяжелой БА в Европе, при этом у 20 % больных заболевание не контролируется и обусловливает 80–85 % смертельных исходов по причине астмы (M. Masoli и соавт., 2004). Следует признать, что успешность ведения больных с тяжелым течением БА специалистами-пульмонологами оставляет желать лучшего не только в России. Имеющийся арсенал терапевтических средств не позволяет адекватно контролировать тяжелую астму даже в странах с высоким доходом на душу населения, о чем свидетельствуют результаты глобального исследования AIR. По данным N. Novak и других авторов, примерно 2/3 больных БА страдают аллергией, которая у этих же пациентов в большинстве случаев является основной причиной развития астмы. Доказано наличие прямой корреляционной связи между уровнем общего IgE и риском развития БА у взрослых. Еще в 1989 г. B. Burrows с соавт. на достаточно репрезентативной выборке пациентов — 2657 человек — показали, что с ростом концентрации сывороточного IgE неуклонно возрастает вероятность заболеть астмой. Положительный результат кожного теста на сенсибилизацию к одному и более из распространенных атмосферных аллергенов отмечен у более чем половины пациентов с тяжелой БА в исследовании Европейского общества по изучению механизмов тяжелой БА (ENFUMOSA, 2003) и у более чем 90 % больных в американском исследовании TENOR (2006). В своем наблюдении L. Fregonese и соавт. (2004) показали, что при фатальной БА увеличивается экспрессия рецепторов FceRI в собственной пластинке слизистой оболочки бронхов. Тогда как большая часть применяемых сегодня препаратов для лечения БА (как для неотложного лечения, так и для базисной терапии) фактически способна только устранять последствия уже развившихся эффектов воспалительных медиаторов, ксолар в первую очередь не допускает высвобождения этих медиаторов.
Н.П. Княжеская (2009) отметила, что под тяжелой бронхиальной астмой понимают БА, которую не удается контролировать, несмотря на проводимую терапию высокими дозами различных классов лекарственных средств, в том числе системными ГКС. Пациенты с тяжелой БА характеризуются персистирующей симптоматикой постоянной бронхиальной обструкции, часто переносят обострения, нередко резистентны к стероидотерапии. По данным D.C. Grootendorst и соавт. (2000), полисенсибилизацию к различным аллергенам имеют 73 % больных тяжелой БА, у которых заболевание дебютировало в молодом возрасте или в детстве, и около 30 % пациентов, у которых первые симптомы астмы появились в зрелом возрасте.
Что из вышеприведенного важно для аллергологов? А то, что все возвращается на круги своя. Мы получили еще одно подтверждение того, что БА — преимущественно аллергическое заболевание (АЗ). Значит, при ее диагностике нужно гораздо больше считаться с проблемой причинных аллергенов, а не причислять их к сонму многочисленных триггерных факторов. Разрабатывая стратегию и тактику лечения БА (еще до того, как она перейдет в разряд «тяжелых»), следует начинать с ее истоков: установления атопии, возможного атопического марша, предшествующих АЗ — аллергического ринита, атопического дерматита, иных гиперчувствительных состояний.
Вот в основном по каким причинам, совсем недавно, в принципе поддержав идею Института пульмонологии и фтизиатрии им. Ф.Г. Яновского о создании в Украине реестра больных БА, я столь критически отнесся не только к самой возможности его реального создания (кто, как и в какое время сможет заполнять столь непростую и громоздкую анкету?), но и к самой анкете (минимизирован ее сугубо аллергологический фрагмент). В ней, безусловно, существенное место должно быть отведено происхождению БА, особенно тяжелой. А поскольку в подавляющем большинстве случаев БА имеет аллергическое происхождение, то давайте возвращать астму в лоно аллергологии, отделять зерна от плевел, т.е. аллергическую БА от неаллергической, от ХОЗЛ, применяя абсолютно известные классические методы — анамнез, специфические тесты (кожные, провокационные, лабораторные тесты). Вряд ли кто-то оспорит высказывание А.Д. Адо о том, что астма многолика, т.е. является гетерогенным заболеванием.
К сожалению, далеко не все, в том числе и очень уважающие себя учреждения, сохранили эти несложные, но вполне надежные и информативные методы. Только располагая реальными для Украины диагностическими возможностями, расширив сферу больных БА, получающих бесплатное лечение (ситуация в различных регионах Украины в этом аспекте весьма разнолика), пульмонологи и аллергологи смогут искать реальные возможности создать реестр пока хотя бы для больных тяжелой БА. Сегодня же наши практические врачи, на которых мы хотим «возложить» эту неподъемную задачу, не в состоянии зарегистрировать более 1/10 реально существующих в стране больных БА (остальные АЗ регистрируются еще хуже). Да, кое-где за рубежом подобные реестры созданы, но сделано это потому, что в условиях страховой медицины, когда врач выписывает зарегистрированному больному бесплатно лекарственные средства (без визита к врачу и рецепта больной ничего не получит), он может «привязать его к себе», т.е. завести на него любую документацию. У нас же, когда 99 % больных приобретают ЛС самостоятельно, когда низкооплачиваемые врачи загружены сверх меры, рассчитывать на их «понимание» в смысле заполнения многостраничных анкет очень сложно. В какой-то мере это возврат к утраченной в нашей стране диспансеризации больных. Однако и в условиях нынешнего полуразрушенного здравоохранения, если удастся привлечь к этой важной проблеме какое-то финансирование (спонсорское или иное), шансы создать реестр для хотя бы известных больных тяжелой астмой могут появиться. Почеркиваю: известных, поскольку если представить себе, что в Украине есть примерно 3 млн больных БА (7 % от всего населения) и 20 % от этого числа составляют страдающие тяжелой БА, то речь идет об очень большом количестве больных (около 60 000 чел.). Если разделить это количество на, скажем, 300 аллергологов, которые есть в Украине, и умножить на минимум полчаса, необходимые для заполнения анкеты, получим время, которое «неподъемно» в условиях практического здравоохранения. Даже если в равной степени помогут пульмонологи. Но «надавив» на людей (технология, которая продолжает действовать со времен СССР), мы рискуем получить значительную долю халтуры или фальсификата.
Здесь я, как аллерголог, хочу напомнить читателю о том, что каких-нибудь 20 лет тому назад разделение БА на этиологические варианты (бытовая, эпидермальная, пыльцевая, нутритивная, грибковая, профессиональная), или, как мы сейчас именуем, фенотипы, воспринималось совершенно естественно. Аллергологи знали, что каждый из этих вариантов АБА имеет определенное клиническое течение, нюансы лечения, прогноза, качества жизни (раньше говорили в основном о трудоспособности). Не стану напоминать о многих известных подзабытых истинах (это можно найти в «старой» литературе), но подчеркну, что ничего из этого не исчезло и продолжает влиять на течение АБА у больных, как бы это не «заслонялось» современными теориями и стратегиями.
В качестве подтверждения вышесказанному я, в контексте одного из вариантов фенотипа АБА, приведу некоторые сведения о пищевой аллергии и обусловленной пищевыми аллергенами АБА (нутритивная БА), которая, будучи вовремя нераспознанной, становится тяжелой БА.
Пищевая аллергия (ПА)
Извращенные реакции на пищу, в том числе ПА, известны со времен античности. Так, Гиппократ (460–370 гг. до н.э.) впервые описал побочные реакции на коровье молоко в виде желудочно-кишечных и кожных симптомов. Гален (131–210 гг. н.э.) описал реакции гиперчувствительности на козье молоко. С XVII века резко возросло число наблюдений побочных реакций на коровье молоко, рыбу и яйца. В 1656 году французский врач Пьер Борель впервые предложил кожные пробы с яичным белком. В 1905 году в литературе были опубликованы работы по возникновению анафилактического шока при употреблении коровьего молока (Шлосман, Финкельштейн). В 1919 году Ч. Рике выпустил в свет монографию под названием «Пищевая анафилаксия». В начале 30-х годов XX века ПА была провозглашена как серьезная и самостоятельная проблема. В 1963 году Б. Халперн и Г. Ларгэ обратили особое внимание на особенности проницаемости слизистой оболочки кишечника детей раннего возраста и опубликовали труд о переходе через слизистые оболочки интактных пищевых белков. В 1967 году был открыт иммуноглобулин Е (Ishizaka, Johansson). В 1972 году описана иммунная система кишечника и предложен термин GALT (лимфоидная ткань, ассоциированная с кишечником). Все эти открытия во многом способствовали пониманию пищевой аллергии и расшифровке механизмов ее развития. Сегодня уже ясно, что пищевая непереносимость — это далеко не только пищевая аллергия (ПА). Она также включает перекрестные гиперчувствительные реакции на растительную пыльцу, ферментопатии, психогенные реакции на пищу, псевдоаллергические реакции, в основе которых лежит избыточное содержание аминов (гистамина, тирамина) в продуктах, заболевания желудочно-кишечного тракта, ложноаллергические реакции, обусловленные аллергенами, находящимися в пищевых продуктах, лекарственных препаратах, микрогрибах химических веществах (пищевые добавки, пестициды и пр.), а также неустановленные причины.
Л.В. Лусс (2006) указывает, что в клинической практике, как правило (и часто — совершенно ошибочно), диагноз «пищевая аллергия» ставится при наличии причинной связи между приемом пищи и развитием клинических симптомов ее непереносимости. В настоящее время хорошо известно, что механизмы непереносимости пищевых продуктов весьма разнообразны, реакции на пищу, имеющие аллергическую природу, встречаются значительно реже, чем считают многие врачи. Вероятно, по этой причине до сих пор отсутствуют точные статистические данные, относящиеся к распространенности истинной ПА (от 0,01 до 50 %). Среди людей с заболеваниями желудочно-кишечного тракта и гепатобилиарной системы распространенность аллергии к продуктам питания выше, чем среди лиц, не страдающих этой патологией (этот показатель колеблется от 5 до 50 % (А. Ногаллер, 1983)). Часто ПА развивается у людей, страдающих атопическими заболеваниями, в частности при поллинозе. По данным автора, аллергические реакции на пищевые продукты отмечаются у больных атопическим дерматитом — 48 % случаев, у больных поллинозом — 45 %, у больных БА и у больных аллергическим ринитом — 15 % случаев.
Согласно современным представлениям, ПА определяется как аллергическая реакция, развивающаяся на прием пищевого аллергена. Основу ПА составляют иммунологические механизмы, в связи с чем она рассматривается как иммунная форма пищевой непереносимости. Истинные аллергические реакции на пищевые продукты связаны с утратой иммунной системой (ИС) толерантности к пищевым аллергенам (АГ). У детей это чаще обусловлено функциональной незрелостью ИС, у взрослых — проникновением пищевых АГ через неиммунные и иммунные барьеры, что влечет за собой наработку к ним антител.
По оценкам специалистов, ПА страдают 20–40 % детей и 10 % взрослых. Постоянный ее рост объясняется изменением характера питания у населения различных стран, появлением новых технологий переработки пищевых продуктов, а также широким использованием пищевых добавок, красителей, консервантов, ароматизаторов, которые сами по себе могут быть причиной пищевой непереносимости, механизмы которой пока до конца не расшифрованы.
По данным научно-консультативного отделения ГНЦ — Института иммунологии ФУ «Медбиоэкстрем» при Минздраве России, на непереносимость пищевых продуктов указывают 65 % больных, страдающих АЗ. При этом истинные аллергические реакции на пищевые аллергены выявляются приблизительно у 35 % из них, а псевдоаллергические — у 65 %. По данным научно-консультативного отделения клиники ГНЦ — Института иммунологии МЗ РФ, истинная ПА как основное аллергическое заболевание в структуре всей аллергопатологии за последние 5 лет составляла до 5,5 %, реакции на примеси в составе пищевых продуктов — 0,9 %.
В норме пищевые продукты расщепляются до соединений, не обладающих сенсибилизирующими свойствами (аминокислоты и другие неантигенные структуры), а кишечная стенка является непроницаемой для нерасщепленных продуктов, которые обладают или могут обладать при определенных условиях сенсибилизирующей активностью или способностью вызывать псевдоаллергические реакции. Нормальное переваривание и всасывание пищевых продуктов обеспечивается состоянием нейроэндокринной системы, строением и функцией ЖКТ, гепатобилиарной системы, составом и объемом пищеварительных соков, составом микрофлоры кишечника, состоянием местного иммунитета слизистой кишечника (лимфоидная ткань, секреторные иммуноглобулины и т.д.) и другими факторами.
ПА может протекать по механизмам гиперчувствительности немедленного и замедленного типа. Наиболее изучена ПА, развивающаяся по механизмам первого типа (IgE-опосредованного). Для формирования ПА пищевой аллерген должен обладать способностью индуцировать функцию Т-хелперов и угнетать активность Т-супрессоров, что приводит к усилению продукции IgE. Кроме того, аллерген должен иметь не менее двух идентичных детерминант, отстоящих друг от друга, связывающих рецепторы на клетках-мишенях с последующим высвобождением медиаторов аллергии. Наряду с IgE-АТ существенное значение в механизме развития ПА имеют антитела класса IgG4, особенно при аллергии к молоку, яйцам, рыбе.
Иногда ПА может развиваться на некоторые пищевые добавки, особенно азокрасители (в частности, тартразин), в этом случае последние выполняют роль гаптенов и, образуя комплексы с протеином, например с сывороточным альбумином, становятся полноценными антигенами, на которые в организме вырабатываются специфические антитела. Возможно также развитие гиперчувствительности замедленного типа, проявляющейся в виде экземы, при употреблении пищевых продуктов, содержащих азокрасители, бензилгидроокситолуен, бутилгидроксианисол, хинин и др. В частности, установлено, что пищевые добавки могут индуцировать выработку МИФ-фактора, медиатора ГЗТ и провоцировать развитие замедленных аллергических реакций на пищевые продукты, содержащие эти добавки.
Практически той или иной степенью антигенности обладают все пищевые продукты. Антигенные свойства изучены более или менее полно у продуктов, вызывающих аллергию чаще других. Это молоко и молокопродукты, яйца, мясо, рыба, различная мука и крупы и пр. Исследования американских ученых показали, что в генезе ПА «виновны» главным образом 8 пищевых продуктов: яйца, арахис, молоко, соя, фундук, рыба, ракообразные, пшеница. Естественно, у жителей Украины подобный перечень продуктов будет другим (О.И. Ласица, В.В. Бережной (2001)) (табл. 1).
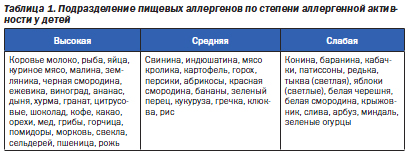
В США аллергия стоит на 6-м месте среди причин хронических заболеваний — ею страдают (по разным оценкам) от 9 до 16 % всех американцев. Это обходится здравоохранению США в 18 миллиардов долларов ежегодно. ПА встречается у 8 % детей в возрасте до 6 лет и у 1–2 % взрослых. Аллергия к арахису и лесным орехам — причина наиболее тяжелых реакций, ею страдают 3 миллиона американцев.
Как указывалось, псевдоаллергические реакции могут возникнуть при попадании в организм с пищей веществ, содержащих повышенное количество аминов (гистамина, тирамина) (табл. 2).
Проведенный нами анализ потребности в пищевых аллергенах для диагностики показал «отечественную» структуру пищевых аллергенов (табл. 3).
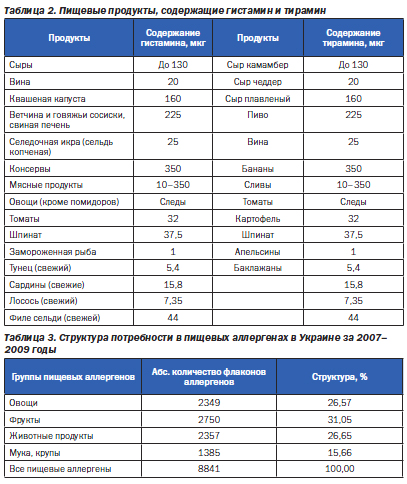
Если говорить о конкретных пищевых аллергенах, которые наиболее «популярны» в Украине, то (по убывающей) это белок яйца, казеин молока, желток яйца, кунжут, курица, томаты, говядина, свинина, яблоко.
Нутритивная (пищевая) бронхиальная астма (НБА)
По нашим данным, в структуре клинических проявлений ПА все респираторные проявления составляют 3–7 %. Большинство исследователей также придерживаются мнения, что роль пищевых аллергенов в развитии БА невелика. Есть данные, указывающие, что в структуре у 4–6 % детей БА связана с ПА. В большинстве случаев ПА у них остается нераспознанной. Среди пищевых аллергенов преобладают такие пищевые продукты, как коровье молоко, рыба, горошек, картофель. Употребление некоторых фруктов и овощей, имеющих антигенное сродство с пыльцевыми аллергенами, может быть причиной приступов затрудненного дыхания. У пациентов с повышенной чувствительностью к латексу употребление киви, авокадо, каштанов приводит к развитию симптомов этого заболевания.
Как сообщает Reuters Health (2003), ПА, особенно к арахисовым орехам, является важным фактором риска для тяжелой, представляющей угрозу для жизни БА. От тяжелых форм БА ежегодно погибают 5 маленьких британцев и около 200 американских детей. При тяжелых формах БА проявления ПА встречаются в 52,6 % случаев, а при менее тяжелых формах, не требующих искусственной вентиляции легких, — только в 10 %. Причем большинство случаев ПА у тяжелых астматиков — аллергия к арахисовым или к другим видам орехов. Как считает доктор Hugh A. Sampson из Нью-Йорка, гиподиагностика ПА при тяжелых формах БА — один из факторов неправильного и неполного ее лечения.
Астмогенное действие пищевых продуктов (которое может быть обусловлено как иммунными, так и неиммунными механизмами) наблюдается примерно у половины больных БА. Нутритивная астма (НБА) может сочетаться с другими проявлениями ПА: риносинуситом (в том числе полипозным), мигренью, дерматитами; часто протекает тяжело и плохо поддается лечению без элиминации пищевых аллергенов. Довольно сильными аллергенами являются коровье молоко, пшеничная мука, яйца, рыба, помидоры, картофель, цитрусовые плоды. Аллергенами могут быть остатки лекарственных препаратов в продуктах животноводства. Бронхоспазм могут вызвать пищевые красители и консерванты. Развитию ПА способствуют употребление алкоголя и острой пищи, однообразное питание, патологические процессы в желудочно-кишечном тракте, протекающие с ферментативной недостаточностью, нарушениями полостного и пристеночного пищеварения, повышенной проницаемостью слизистой оболочки кишечника.
При этом если неиммунные пищевые факторы ведут к бронхоспазму, который в будущем может и не повториться, то истинная ПА ведет к стойкой и плохо контролируемой современными лекарственными препаратами БА.
По некоторым данным, пищевые продукты являются непосредственной причиной развития приступа БА у 12–15 % больных, но пищевая сенсибилизация выявляется почти у всех. В детском возрасте первым проявлением ПА чаще всего является атопический дерматит. Постепенно на этом фоне формируется аллергическое поражение органов дыхания, в том числе БА. Дерматит предшествует заболеванию БА у 37 % детей. В то же время у 33 % больных с БА в процессе болезни отмечается появление атопического дерматита, возникает так называемый дермореспираторный синдром.
Джеймс и др. (2004) указывают, что в группе из 320 детей с атопическим дерматитом у 55 % имеет место БА. Пищевые агенты вызвали респираторные симптомы у 59 %, включая ринит, отек гортани, затрудненное дыхание и одышку. Желудочно-кишечные симптомы имели место у 41 % больных. Часто при БА недооценивают роль пищевой аллергии. Wraith (2007) также считает, что пищевая аллергия является очень важной причиной БА, но часто упускается из виду. Это важно, поскольку может вызвать серьезные симптомы астмы и высокий уровень смертности, несмотря на улучшение медикаментозной терапии. Нужно помнить, что обычное кожное тестирование с пищевыми аллергенами часто дает негативные результаты. Подобного мнения придерживаются Pelikan и Filipek. Они также считают, что роль пищевой аллергии у больных с БА все еще недооценивается врачами, поскольку соответствующей информации мало, выявить подобную связь не всегда удается. Многие зарубежные специалисты придерживаются мнения, что пациенты с ПА имеют самые стойкие к лечению формы БА.
Таким образом, как видно даже при поверхностном анализе одной из возможных причин формирования тяжелой БА — пищевой аллергии, существует ряд сугубо аллергических вариантов (фенотипов) БА, которые, будучи вовремя нераспознанными или недооцененными, формируют когорту больных с плохо контролируемым течением БА. Несложно показать, что подобная ситуация может сформироваться при неадекватном отношении к эпидермальной, грибковой, профессиональной БА и пр. Аллергологи прошлого сказали бы, что в этом нет ничего нового или неожиданного, однако нынешние специалисты ищут причину тяжелой БА среди иных причин, а ее лечение проводят, как правило, наращивания интенсивность небезопасной фармакотерапии. Нам бы хотелось хотя бы отчасти развеять «гипноз» современных зарубежных стратегий и постулатов в области БА. И основанием для этого должны послужить традиции и знания, переданные нам нашими отечественными предшественниками-аллергологами.
