Газета «Новости медицины и фармации» 6(312) 2010
Вернуться к номеру
Поглощающие свойства энтеросорбента Энтеросгель относительно основных антиретровирусных препаратов
Авторы: К.И. Бардахивская, В.Г. Николаев, Н.М. Гурина. Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, г. Киев
Версия для печати
Наличие широкого арсенала препаратов, активных в отношении ВИЧ, определило формирование нового подхода в лечении ВИЧ-инфекции — высокоактивной антиретровирусной терапии (ВААРТ), которая предусматривает назначение пациентам по крайней мере трех антиретровирусных (АРВ) препаратов. Применение ВААРТ позволило существенно уменьшить частоту развития наиболее тяжелых вторичных инфекционных заболеваний, что, в свою очередь, привело к снижению смертности от СПИДа в 7–8 раз [1].
Однако особенностью всех АРВ препаратов является их высокая токсичность [7]. В частности, большинство АРВ препаратов вызывают токсичные поражения печени, сопровождающиеся повышением уровня трансаминаз в плазме крови, развитием острых гепатитов, особенно у пациентов с хроническим гепатитом В и С. Это может вызывать необходимость приостановки или даже прекращения лечения ВИЧ-инфицированных [11, 17, 18, 21]. Некоторые препараты группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ, а также ингибиторы протеазы ВИЧ имеют нефротоксическое действие и могут привести к возникновению как острых, так и хронических заболеваний почек [12, 20].
Использование ВААРТ значительно продлевает продолжительность жизни ВИЧ-инфицированных и больных СПИДом, однако вызывает склонность пациентов к сердечно-сосудистым заболеваниям. Поскольку сам вирус может быть независимым фактором развития атеросклероза и поражения коронарных сосудов, при назначении ВААРТ целесообразно также учитывать особенности фармакодинамики АРВ препаратов для предотвращения развития инфаркта миокарда и других сердечных и метаболических осложнений у больных с мультисистемными заболеваниями [5, 8]. ВААРТ играет также важную роль в развитии оксидативного стресса [15, 16, 22] и осложнений, связанных с митохондриальной дисфункцией, — полинейропатии, миопатии, дислипидемии и липодистрофии [14].
Одним из наиболее частых и опасных симптомов у ВИЧ-инфицированных и больных СПИДом является диарея, которая, по различным данным, наблюдается у 50–90 % пациентов. Причиной диареи могут быть как вирусы, бактерии, грибковые и протозойные инфекции, так и сам ВИЧ, а также АРВ препараты, в частности ингибиторы протеазы ВИЧ [3, 4, 19]. Паразитарные инфекции определются у 30–35 % пациентов, и низкое содержание CD4 лимфоцитов в значительной степени связано именно с оппортунистичными инфекциями [6, 13]. У больных, которые получают ВААРТ, наличие хронической диареи в течение 6 недель существенно увеличивает раннюю смертность в сравнении с пациентами без диареи [6].
Для уменьшения токсичного действия АРВ препаратов и комплексного лечения диарейного синдрома используют различные средства. Так, применение пробиотиков, растворимых волокон и L-глутамина значительно уменьшает диарейный процесс у больных, которые получают ингибиторы протеазы ВИЧ [10]. Восстановленный глутатион, как наиболее сильный внутриклеточный антиоксидант, играет важную роль в детоксикации многих электрофильных компонентов и пероксида при лечении вирусных инфекций, в том числе и ВИЧ [9]. L-карнитин обнаруживает антиоксидантное, нейро- и кардиопротекторное, иммуномодулирующее действие при лечении осложнений ВААРТ у ВИЧ-инфицированных [14]. Применение кремнийорганического энтеросорбента Энтеросгель является эффективным средством для лечения диарейного синдрома у ВИЧ-инфицированных как на ранних, так и на поздних стадиях заболевания и сопровождается быстрой позитивной динамикой основных клинических симптомов [2].
Несмотря на значительные успехи в лечении ВИЧ-инфицированных и больных СПИДом, проблема детоксикации организма остается достаточно актуальной, поскольку ВААРТ предусматривает пожизненный прием АРВ препаратов.
Цель исследования: определение in vitro поглощающих свойств энтеросорбента Энтеросгель относительно основных АРВ препаратов в средах, которые отвечают кислотности желудочного (рН = 1,6) и поджелудочного (рН = 6,8) соков.
Материалы и методы
Объектом исследования был кремнийорганический энтеросорбент Энтеросгель, паста для перорального применения, производства ЗАО «Экологоохранная фирма «Креома-Фарм» (Киев, Украина), в сравнении с углеродным сорбционным материалом АУВМ. Учитывались показатели сорбции таких маркерных соединений, как витамин В12 (маркер веществ средней молекулярной массы, 1355 Да) и креатинин (низкомолекулярный маркер, 133 Да). Сорбционная активность относительно витамина В12 составляет для Энтеросгеля 3,85 мг/г, для АУВМ — 25,4 мг/г, относительно креатинина — 0,86 мг/г и 19,14 мг/г соответственно.
Для исследования поглощающих свойств Энтеросгеля относительно АРВ препаратов использовались следующие лекарственные средства: нуклеозидные ингибиторы обратной транскриптазы ВИЧ — стаг 30 (ставудин 30 мг в капсулах, «Гетеро Драгс Лимитед», Индия), гептавир-150 (ламивудин 150 мг в таблетках, покрытых оболочкой, «Гетеро Драгс Лимитед», Индия); ненуклеозидные ингибиторы обратной транскриптазы ВИЧ — эфервен (эфавиренц 200 мг в капсулах, «Ранбакси Лабораториз Лимитед», Индия), невимун (невирапин 200 мг в таблетках, «Ципла ЛТД», Мумбаи, Индия) и ингибитор протеазы ВИЧ калетра (лопинавир 133,3 мг/ритонавир 33,3 мг в мягких желатиновых капсулах, «Эббот Лабораториз ЛТД», Великобритания).
Величину адсорбции субстанций лекарственных препаратов определяли по разнице их концентрации в сорбате до и после контакта с сорбентом в статическом режиме. Время контакта составляло 2 часа. Сорбцию проводили в средах, которые отвечают кислотности желудочного (рН = 1,6) и поджелудочного (рН = 6,8) соков. Измерения концентрации субстанций в лекарственных препаратах проводили методом высокоактивной жидкостной хроматографии.
Статистическую обработку результатов проводили с использованием программы Microsoft Excel: рассчитывали среднее арифметическое (M) и среднюю квадратичную погрешность (m).
Результаты и их обсуждение
В результате проведенного исследования установлены поглощающие свойства энтеросорбента Энтеросгель (паста для перорального применения) относительно основных АРВ препаратов — ставудина, ламивудина, эфавиренца, невирапина и калетры (лопинавир/ритонавир). Данные по поглощению ставудина приведены в табл. 1.
Из табл. 1 видно, что сорбция ставудина Энтеросгелем в среде, которая отвечает кислотности желудочного (рН = 1,6) сока, отсутствует, а 1 г АУВМ поглощал более 25 мг препарата. В нейтральной среде Энтеросгель сорбировал незначительное количество ставудина — почти в 150 раз меньше, чем АУВМ.
В табл. 2 приведены результаты поглощения ламивудина. АУВМ достаточно активно сорбирует препарат в обеих средах, а показатели сорбции Энтеросгеля в 70–150 раз ниже. Следует отметить, что оба препарата группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ — ставудин и ламивудин — несколько больше поглощались в среде, которая отвечает кислотности поджелудочного сока.
В табл. 3–4 приведены данные по поглощению препаратов группы ненуклеозидных ингибиторов обратной транскриптазы ВИЧ — эфавиренца и невирапина.
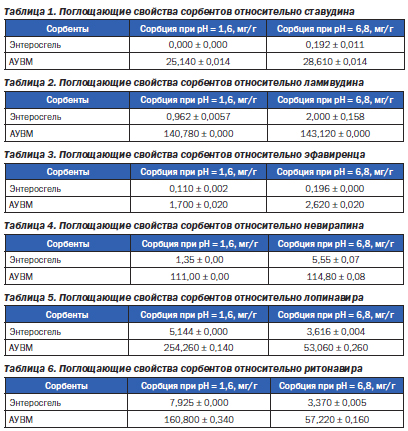
Как видно из табл. 3, оба сорбента достаточно слабо поглощали эфавиренц как в кислой, так и в нейтральной среде. Однако показатели сорбции АУВМ были в 13–15 раз выше, чем у Энтеросгеля. В кислой среде оба сорбента в 1,5 раза меньше поглощали эфавиренц.
Показатели сорбции невирапина (табл. 4) у энтеросорбента Энтеросгель в 4 раза ниже в кислой среде в сравнении с нейтральной, а у АУВМ — достаточно высокие в обеих средах. В нейтральной среде Энтеросгель поглощал невирапин в 20 раз, а в кислой — более чем в 80 раз слабее, чем АУВМ.
Таким образом, как и препараты группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ, препараты группы ненуклеозидных ингибиторов обратной транскриптазы ВИЧ — эфавиренц и невирапин — меньше поглощались в среде, которая отвечает кислотности желудочного сока.
В табл. 5–6 приведены показатели сорбции компонентов препарата группы ингибиторов протеазы ВИЧ калетры — лопинавира и ритонавира. Лопинавир является ингибитором ВИЧ-1 и ВИЧ-2 и обеспечивает антивирусное действие препарата, а ритонавир ингибирует в печени метаболизм лопинавира, опосредованный ферментом CYP3A, что приводит к повышению концентрации лопинавира в плазме крови.
По данным табл. 5, сорбция лопинавира энтеросорбентом Энтеросгель в кислой среде более чем в 50 раз, а в нейтральной — в 15 раз ниже, чем у АУВМ. В нейтральной среде поглощающая активность сорбентов также была ниже, чем в кислой: для Энтеросгеля — в 1,5 раза, а для АУВМ — в 4,5 раза.
Сорбция ритонавира сорбентами также была ниже в нейтральной среде: для Энтеросгеля — более чем в 2 раза, а для АУВМ — более чем в 2,5 раза (табл. 6). Поглощающая активность Энтеросгеля относительно ритонавира в кислой среде в 20 раз, а в нейтральной — в 17 раз ниже по сравнению с АУВМ.
Выводы
Препараты группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ — ставудин и ламивудин — практически не имеют сродства к Энтеросгелю и могут назначаться независимо от времени приема данного энтеросорбента.
Препарат группы ненуклеозидных ингибиторов обратной транскриптазы ВИЧ эфавиренц достаточно слабо поглощается кремнийорганическим и углеродным сорбентами, однако показатели сорбции для Энтеросгеля в 13–15 раз ниже, чем для АУВМ. Невирапин также значительно слабее (в 20–80 раз) поглощается энтеросорбентом Энтеросгель в среде, которая отвечает кислотности как желудочного, так и поджелудочного сока.
В отличие от препаратов групп нуклеозидных и ненуклеозидных ингибиторов обратной транскриптазы ВИЧ компоненты ингибитора протеазы ВИЧ калетры — лопинавир и ритонавир — меньше поглощаются в нейтральной среде. Показатели сорбции для Энтеросгеля относительно лопинавира и ритонавира значительно ниже (в 15–50 раз) по сравнению с АУВМ.
Таким образом, у кремнийорганического энтеросорбента Энтеросгель не обнаружено поглощающей активности относительно основных антиретровирусных препаратов, поэтому при необходимости Энтеросгель может назначаться пациентам с ВИЧ/СПИДом независимо от приема АРВ препаратов.
1. Кравченко А.В., Рафальский В.В. Антиретровирусные препараты // Клиническая микробиология и антимикробная химиотерапия. — 2003. — Т. 5, № 4. — С. 360-379.
2. Юрченко О.В., Федоренко С.В., Николаев В.Г., Харитонюк А.В., Рябоконь С.В. Применение энтеросорбента Энтеросгель в комплексном лечении ВИЧ-инфицированных больных // Современные инфекции. — 2008. — № 1. —
С. 87-93.
3. Al Anazi A.R. Gastrointestinal opportunistic infections in human immunodeficiency virus disease // Saudi. J. Gastroenterol. — 2009. — Vol. 15, № 2. — P. 95-99.
4. Boesecke C., Cooper D.A. Toxicity of HIV protease inhibitors: clinical considerations // Curr. Opin. HIV AIDS. — 2008. — Vol. 3, № 6. — P. 653-659.
5. Cabanelas N., Ferreira P., Roxo F. Cardiovascular complications of highly active antiretroviral therapy: case report // Rev. Port. Cardiol. — 2009. — Vol. 28, № 6. — P. 749-758.
6. Dillingham R.A., Pinkerton R., Leger P., Severe P., Guerrant R.L., Pape J.W., Fitzgerald D.W. High early mortality in patients with chronic acquired immunodeficiency syndrome diarrhea initiating antiretroviral therapy in Haiti: а case-control study// Am. J. Trop. Med. Hyg. — 2009. — Vol. 80, № 6. — P. 1060-1064.
7. Esser S., Helbig D., Hillen U., Dissemond J., Grabbe S. Side effects of HIV therapy // J. Dtsch. Dermatol. Ges. — 2007. — Vol. 5, № 9. — P. 745-754.
8. Farrugia P.M., Lucariello R., Coppola J.T. Human immunodeficiency virus and atherosclerosis // Cardiol. Rev. — 2009. — Vol. 17, № 5. — P. 211-215.
9. Fraternale A., Paoletti M.F., Casabianca A., Nencioni L., Garaci E., Palamara A.T., Magnani M. GSH and analogs in antiviral therapy // Mol. Aspects Med. — 2009. — № 1–2. — P. 99-110.
10. Heiser C.R., Ernst J.A., Barrett J.T., French N., Schutz M., Dube M.P. Probiotics, soluble fiber, and L-Glutamine (GLN) reduce nelfinavir (NFV) — or lopinavir/ritonavir (LPV/r) — related diarrhea // J. Int. Assoc. Physicians AIDS Care (Chic. III). — 2004. — Vol. 3, № 4. — P. 121-129.
11. Inductivo-Yu I., Bonacin M. I. Highly active antiretroviral therapy-induced liver injury // Curr. Drug Saf. — 2008. — Vol. 3, № 1. — P. 4-13.
12. Izzedine H., Harris M., Perazella M.A. The nephrotoxic effect of HAART // Nat. Rev. Nephrol. — 2009. — Vol. 5, № 10. — P. 563-573.
13. Kulkarni S.V., Kairon R., Sane S.S., Padmawar P.S., Kale V.A., Thakar M.R., Mehendale S.M., Risbud A.R. Opportunistic parasitic infections in HIV/AIDS patients presenting with diarrhea by the level of immunosuppression // Indian J. Med. Res. — 2009. — Vol. 130, № 1. — P. 63-66.
14. Llias I., Blackman M.R., Gold P.W., Alesci S. L-Carnitine and acetyl-L-carnitine in the treatment of complications associated with HIV infection and antiretroviral therapy // Mitochondrion. — 2004. — Vol. 4, № 2–3. — P. 163-168.
15. Mondal D., Pradhan L., Ali M., Agrawal K.C. HAART drugs induce oxidative stress in human endothelian cells and increase endothelian recruitment of mononuclear cells: exacerbation by inflammatory cytokines and amelioration by antioxidants // Cardiovasc. Toxicol. — 2004. — Vol. 4, № 3. — P. 287-302.
16. Ngondi J.L., Oben J., Forkah D.M., Etame L.H., Mbanya D. The effect of different combination therapies on oxidative stress markers in HIV infected patients in Cameroon // AIDS Res. Ther. — 2006. — № 22. — P. 3-19.
17. Nunez M. Hepatotoxicity of antiretrovirals: incidence, mechanisms and management // J. Hepatol. — 2006. — № 44 (suppl. 1). — P. 132-139.
18. Puoti M., Nasta P., Gatti F., Matti A., Prestini K., Biasi L., Carosi G. HIV-related liver disease: ARV drugs, coinfection, and other risk factors // J. Int. Assoc. AIDS Care (Chic. III). — 2009. — Vol. 8, № 1. — P. 30-42.
19. Pupulin A.R., Carvalho P.G., Nishi L., Nakamura C.V., Guilherme A.L. Enteropathogens relating to diarrhea in HIV patients on antiretroviral therapy // Rev. Soc. Bras. Med. Trop. — 2009. — Vol. 42, № 5. — P. 551-555.
20. Rho M., Perazella M.A. Nephrotoxicity associated with antiretroviral therapy in HIV-infected patients // Curr. Drug Saf. — 2007. — Vol. 2, № 2. — P. 147-154.
21. Salmon-Ceron D., Sogni P., Spiridon G., Taburet A.M. Antiretroviral agents in HIV-infected patients with cirrhosis // Presse Med. — 2005. — Vol. 4, № 34 (suppl. 10). — P. 45-52.
22. Shahar E., Pollack S., Kedem E., Hassoun G., Nagler R. Effect of HAART on salivary composition and oxidative profile in HIV-infected patients // Curr. HIV Res. — 2008. — Vol. 6, № 5. — P. 447-451.
