Газета «Новости медицины и фармации» Кардиология (314) 2010 (тематический номер)
Вернуться к номеру
Современные подходы к применению аспирина и тиенопиридиновых производных
Авторы: А.Э. Багрий, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней, общей практики и семейной медицины
Версия для печати
В настоящем сообщении нами предпринята попытка обсуждения одной из весьма насущных проблем сегодняшней кардиологии — применение антитромбоцитарных препаратов. Мы сочли уместным в начале работы кратко напомнить читателю о некоторых патофизиологических процессах, происходящих при тромбообразовании, далее рассматриваются позиции наиболее употребимых антитромбоцитарных средств — аспирина и тиенопиридиновых производных. Еще одна группа антитромбоцитарных препаратов — ингибиторы GP IIb/IIIa-рецепторов тромбоцитов — здесь нами не обсуждается. Изложение материала построено в форме ответов на вопросы, которые могли бы возникнуть в процессе дискуссии на рассматриваемую тему.
Как происходит формирование тромба? Повреждение эндотелия коронарных артерий с последующим формированием интракоронарного тромба является важнейшим элементом патогенеза как острых, так и хронических форм ишемической болезни сердца (ИБС). В соответствии с распространенной сейчас моделью (N. Mackman et al., 2007), в формировании внутрисосудистого (для обсуждаемых случаев — интракоронарного) тромба выделяют 4 этапа (приведены лишь основные процессы, детали либо рассматриваются ниже, либо не представлены):
1. Высвобождение тканевого фактора из места повреждения сосуда. При разрыве (изъязвлении) атеросклеротической бляшки происходит повреждение эндотелия сосуда; высвобождающийся при этом тканевой фактор вступает в контакт с кровью.
2. Каскадная активация факторов коагуляции. Образование тромбина. Образование фибрина. При контакте тканевого фактора с кровью быстро активируется каскад факторов коагуляции (последовательно — VII, VIIa, X, IX, Xa, IXa), что в конечном итоге приводит к образованию тромбина из протромбина. Тромбин, в свою очередь, стимулирует трансформацию фибриногена в фибрин. Образование нитей фибрина является необходимым элементом формирования тромба. Тромбин, кроме стимуляции образования фибрина, является мощным фактором активации, агрегации и адгезии тромбоцитов.
3. Адгезия, активация и агрегация тромбоцитов. Первичный тромбоцитарный тромб. В тромбоцитах, располагающихся вблизи места повреждения эндотелия, эти процессы начинаются очень быстро и происходят практически одновременно под влиянием высвободившегося тромбина. В процессе активации тромбоцитов увеличивается содержание в них кальция, что индуцирует активность их сократительных протеинов, приводит к изменениям формы тромбоцитов с появлением отростков, к значительному повышению подвижности, к увеличению площади поверхности и к активации рецепторного аппарата. Эти изменения способствуют агрегации тромбоцитов (присоединению их друг к другу), их адгезии (присоединению к структурам поврежденной сосудистой стенки), привлечению новых тромбоцитов из циркуляции и формированию первичного «свертка» — первичного тромбоцитарного тромба. Активация, агрегация и адгезия тромбоцитов являются взаимно поддерживающими и взаимно перекрещивающимися процессами, в ходе них тромбоциты высвобождают биологически активные субстанции, в еще большей степени усиливающие активность тромбоцитов, препятствующие лизису тромба (ингибитор активатора плазминогена — PAI-1), а также способствующие вазоконстрикции (тромбоксан А2).
4. Окончательное формирование фибрин-тромбоцитарного тромба. Дистальная эмболизация. Образующиеся под действием тромбина фибриновые нити формируют сетевидную структуру, укрепляющую исходно рыхлый первичный тромбоцитарный тромб. Тромб не является свободно плавающим, но прикреплен к участку, где имеется повреждение сосудистой стенки. Фрагменты тромба и тромбоцитарные агрегаты могут отделяться от основной его структуры и эмболизировать, стимулируя вазоконстрикцию и потенциально вызывая инфаркты вследствие окклюзии дистальных отделов микрососудистого русла.
Что представляет собой тканевой фактор? Это гликопротеин (GP) клеточной поверхности, который в больших количествах экспрессируется на поврежденных эндотелиальных клетках, а также в субэпителиальных структурах и в структурах атеросклеротических бляшек. Он может вступать во взаимодействие с кровью как будучи фиксированным в этих структурах, так и высвобождаясь в циркуляцию из поврежденной бляшки в виде микрочастиц. Взаимодействие тканевого фактора с VII фактором коагуляции является начальным этапом активации коагуляционного каскада.
Ряд препаратов действуют на рецепторы тромбоцитов. Что это такое? Рецепторы тромбоцитов представляют собой гликопротеины, расположенные на мембране тромбоцитов; при активации клетки и ее конформационных изменениях (с приобретением отростчатой формы) активируются и рецепторы; они непосредственно регулируют участие тромбоцита в реакциях дальнейшей активации, агрегации и адгезии. Выделяют несколько типов тромбоцитарных рецепторов (табл. 1). Блокирование некоторых из них составляет основу действия так называемых антитромбоцитарных препаратов. Антагонисты других типов рецепторов (например, таких, с которыми связываются коллаген, фактор Виллебранда, тромбоксан А2 (ТХА2)) пока не разработаны.
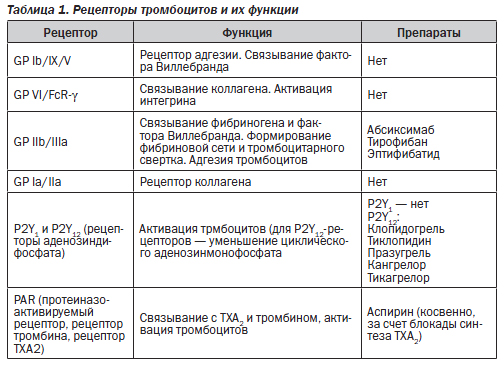
Какова роль аденозиндифосфата (АДФ)? АДФ высвобождается из тромбоцитов в процессе их активации и взаимодействует с двумя типами рецепторов на поверхности самих же тромбоцитов: P2Y1 и P2Y12. Активация P2Y1-рецепторов способствует изменениям формы тромбоцитов и активации GP IIb/IIIa-рецепторов, активация P2Y12-рецепторов поддерживает активность GP IIb/IIIa и выраженно стимулирует агрегацию тромбоцитов. Кроме этих эффектов АДФ способствует быстрой активации внутрисосудистого тканевого фактора. Препараты, блокирующие P2Y12-рецепторы, могут, таким образом, существенно уменьшать агрегацию тромбоцитов, но также оказывать прямые подавляющие эффекты на ранние этапы тромбообразования.
Аспирин
Какое место в клинической практике занимает аспирин? Аспирин является фундаментальным компонентом лечения больных самыми различными сосудистыми заболеваниями. Это почетное место обосновано его убедительно продемонстрированными значительными позитивными эффектами на прогноз. Так, метаанализы Antithrombotic Trialists'' Collaboration (2002): включивший 135 000 лиц из 283 рандомизированных контролируемых исследований (РКИ), и еще один (2009), включивший 112 000 лиц из 22 РКИ, подтвердили профилактические сердечно-сосудистые эффекты аспирина после перенесенного инфаркта миокарда (ИМ), при стабильной и нестабильной стенокардии, после аортокоронарного шунтирования (АКШ) и коронарного стентирования, после ишемического инсульта и транзиторной ишемической атаки, при поражениях периферических артерий; эффективность препарата при этих ситуациях была показана для лиц обоего пола. Аспирин также улучшает прогноз у больных с артериальной гипертензией (после достижения контроля артериального давления) и у лиц с сахарным диабетом. Он также может использоваться в части случаев при первичной профилактике сердечно-сосудистых заболеваний (т.е. у тех, кто их еще не имеет), но это касается лишь лиц с достаточно высоким сердечно-сосудистым риском. Основной проблемой при применении аспирина является сравнение относительной весомости его позитивных (снижение сердечно-сосудистого риска) и негативных эффектов (основу которых составляет желудочно-кишечная кровоточивость; значительно реже имеют место геморрагические инсульты). Если при вторичной профилактике сердечно-сосудистых заболеваний позитивные эффекты практически всегда многократно преобладают, то при первичной профилактике их преобладание становится ощутимым лишь у лиц группы высокого сердечно-сосудистого риска.
Каков механизм антитромбоцитарного действия аспирина? Аспирин (ацетилсалициловая кислота) необратимо ацетилирует фермент циклооксигеназу (ЦОГ) в тромбоцитах (в значительно большей степени изоформу ЦОГ-1 в сравнении с ЦОГ-2). Следствием ингибирования ЦОГ-1 является угнетение функции еще одного фермента — тромбоксансинтетазы и, в результате, уменьшение образования тромбоксана А2 (ТХА2, играющего важную роль в активации и агрегации тромбоцитов); кроме того, имеет место увеличение уровней антиагрегаторного простагландина PGI2 (простациклина). Суммарно эти эффекты реализуются в отчетливом уменьшении ТХА2-индуцируемой агрегации тромбоцитов. Следует отметить, что под влиянием аспирина механизмы активации тромбоцитов подавляются лишь частично; антитромбоцитарный эффект аспирина может быть нивелирован другими проагрегаторными стимулами, например, АДФ или тромбином. Это объясняет желательность использования комбинации антитромбоцитарных препаратов для более полного подавления агрегации тромбоцитов (что особенно актуально во время и после острых сосудистых поражений, таких как острый коронарный синдром (ОКС), стентирование). Аспирин блокирует ЦОГ-1 необратимо, на весь период их существования, т.е. на 8–10 дней. Поэтому его действие на тромбоциты длительное: тромбоциты не способны к синтезу новой ЦОГ-1, и, таким образом, восстановление активности тромбоцитарной ЦОГ-1 становится возможным лишь с образованием новых тромбоцитов в отсутствие контакта с аспирином.
Какие эффекты кроме антитромбоцитарного имеет аспирин? Наиболее важным в клиническом отношении среди таких эффектов является неблагоприятное влияние препарата на слизистую желудочно-кишечного тракта. Этот эффект, как и антитромбоцитарный, связан с ингибированием ЦОГ-1; он является не локальным, но системным (т.е. не зависит от пути введения аспирина — внутрь или парентерально). В сочетании с присущим аспирину антитромбоцитарным действием это повышает риск желудочно-кишечной кровоточивости. Так, желудочно-кишечные кровотечения, требующие госпитализации, возникают (по данным крупных регистров западных стран) у 2 из 1000 больных при лечении низкими дозами аспирина на протяжении 1 года. Риск кровоточивости зависит от дозы: считают, что частота желудочно-кишечных кровотечений удваивается при увеличении дозы аспирина от 75–100 мг/сут до около 200 мг/сут. Подчеркнем здесь еще раз, что в ситуациях вторичной профилактики польза от аспирина многократно превосходит риск кровотечений: так, у постинфарктных больных это соотношение (польза : риск) составляет около 100. Лекарственные формы с кишечной растворимостью или со щелочным буфером способны уменьшать частоту диспептических нарушений, но на риск развития язв, кровотечений и перфораций, по мнению экспертов ESC (2008), значимо не влияют.
Аспирин имеет и ряд других эффектов, которые упомянем здесь лишь кратко. Он ингибирует ЦОГ-1 в сосудистом эндотелии; уменьшает тромбоцитарно-нейтрофильные взаимодействия; оказывает локальные и системные противовоспалительные эффекты. Регулярное использование аспирина снижает риск развития колоректального рака, но только у лиц с гиперэкспрессией ЦОГ-2.
Как следует использовать аспирин при вторичной профилактике? Аспирин показан всем больным с имеющимися сердечно-сосудистыми поражениями атеросклеротической природы: он снижает риск развития сердечно-сосудистых осложнений примерно на 1/4. При хронической ишемической блокаде сердца (ИБС) у лиц, уже получающих β-адреноблокаторы, аспирин в дозе 75 мг/сут уменьшает риск ИМ и внезапной смерти на 34 % в сравнении с плацебо. Снижение риска также значительное для лиц с нестабильной стенокардией (46 %), после чрескожного коронарного вмешательства (ЧККВ) (53 %), у постинфарктных больных (25 %), у лиц после ишемических инсультов или транзиторных ишемических атак (22 %), у пациентов с поражениями периферических артерий (23 %).
Тиклопидин
Каково место тиклопидина в современном лечении ИБС? Различными авторами констатируется существенное сокращение его применения за последние годы, что связано с повсеместным утверждением точки зрения о явном превосходстве клопидогреля над тиклопидином (в первую очередь в отношении переносимости, особенно при длительном приеме). Тиклопидин, как и клопидогрель, является тиенопиридиновым дериватом, необратимо блокирующим связывание АДФ с Р2Y12-рецепторами тромбоцитов и уменьшающим агрегацию тромбоцитов. При сочетанном применении с аспирином тиклопидин обеспечивает дополнительное уменьшение агрегации тромбоцитов, что способствует уменьшению сердечно-сосудистого риска. Основные показания для использования тиклопидина сейчас:
1) состояния после коронарного стентирования в сочетании с аспирином (для тех, кто не переносит клопидогрель); 2) состояния после ишемического инсульта или транзиторной ишемической атаки для тех, кто не переносит аспирин; 3) ОКС без стентирования вместе с аспирином (для тех, кто не переносит клопидогрель). Первые два показания одобрены в США (FDA) и в странах Европы, третье — в странах Европы. В последние годы обсуждается возможность некоторого расширения применения тиклопидина за счет случаев, резистентных к клопидогрелю (L.H. Opie, B.J. Gersh, 2009). В начале применения тиклопидина для достижения максимального ингибирования агрегации тромбоцитов требуется 4–7 дней (при использовании стандартной дозы по 500 мг/сут в сочетании с аспирином). Более быстрый ответ может быть получен при применении нагрузочной дозы 500 мг (затем через 12 ч, как обычно — по 250 мг 2 р/сут). Период полувыведения препарата составляет 4–5 дней. Побочные эффекты тиклопидина включают нейтропению, нарушение функции печени, тромботическую тромбоцитопеническую пурпуру. Среди них наибольшее внимание (ввиду частоты развития, достигающей 2,4 %) привлекает нейтропения; наиболее частый период ее развития — первые 3 месяца приема препарата. Контроль развернутого анализа крови с лейкоцитарной формулой требуется до начала лечения, далее — каждые 2 недели до завершения 3 месяцев, потом — каждые 3 месяца.
Клопидогрель
Каково сейчас место клопидогреля в кардиологической практике? Клопидогрель в настоящее время является одним из стандартных, обязательных компонентов лечебной тактики при различных вариантах ОКС; он также находит широкое применение при процедурах коронарного стентирования и после их проведения. С учетом наличия весомой доказательной базы в отношении улучшения сердечно-сосудистого прогноза, а также хорошей переносимости, клопидогрель включен во все мировые и отечественные рекомендации по лечению указанных категорий больных. Его позиция в лечении этих пациентов выглядит столь прочной, что появление новых тиенопиридиновых производных (например, празугреля), вероятно, еще не очень скоро сможет привести к ее ослаблению.
Как действует клопидогрель? Как и тиклопидин, клопидогрель является тиенопиридиновым дериватом и необратимым ингибитором сязывания АДФ с Р2Y12-рецепторами тромбоцитов. Реализация этого эффекта приводит к уменьшению агрегации тромбоцитов, что в условиях острого коронарного повреждения (ОКС, стентирование) позволяет позитивно влиять на темп развития внутрисосудистого тромбозирования и тем самым оказывать благоприятный эффект на сердечно-сосудистый прогноз. В сравнении с тиклопидином клопидогрель гораздо лучше переносится, он также обеспечивает значимо более выраженные преимущества в отношении снижения сердечно-сосудистого риска (метаанализ D.L. Bhatt, 2002; L.H. Opie, B.J. Gersh, 2009), что и обеспечивает ему приоритетное место в лечении кардиологических больных.
Клопидогрель является пролекарством, требующим для своей активации процесса окисления in vivo печеночными и/или кишечными изоэнзимами цитохрома P450(CYP)3A4 и 2C19. При принятии внутрь единственной дозы 75 мг действие на тромбоциты начинается спустя несколько часов; для достижения устойчивого состояния ингибирования агрегации тромбоцитов требуется прием препарата в течение 3–7 дней. Скорость развития эффекта значительно увеличивается при использовании нагрузочных доз. Так, максимальное подавление агрегации тромбоцитов при применении нагрузочной дозы 300 мг клопидогреля достигается уже через 24–48 ч, а дозы 600 мг — через 2 ч. Обе нагрузочных дозы клопидогреля обеспечивают гораздо более быстрое наступление антитромбоцитарного эффекта в сравнении с нагрузочной дозой тиклопидина.
Существуют ли у клопидогреля плейотропные эффекты? В последние годы появились свидетельства возможного наличия у клопидогреля таких эффектов, не связанных с его основным действием. Механизмы развития этих дополнительных многообразных биологических эффектов клопидогреля и их клиническая значимость остаются во многом неясными. К числу таких (отчасти пока гипотетических) плейотропных действий клопидогреля относят (S. Iyengar, L.E. Rabbany, 2009): увеличение образования оксида азота (NO), уменьшение уровней С-реактивного белка, снижение экспрессии тканевого фактора, подавление образования тромбоцитарно-лейкоцитарных агрегатов и др.
На чем базируется важное место клопидогреля в лечении больных с сердечно-сосудистыми поражениями? Для клопидогреля имеется большой объем данных доказательной медицины по улучшению сердечно-сосудистого прогноза у различных категорий больных. Мы располагаем результатами целого ряда крупных РКИ, в которых назначался оригинальный клопидогрель, и эти исследования демонстрируют снижение сердечно-сосудистого риска при использовании клопидогреля у больных c ОКС без элевации сегмента ST как получавших, так и не получавших лечение с использованием ЧККВ (CURE, PCI-CURE, CURRENT); у больных c ОКС с элевацией сегмента ST, получавших и не получавших лечение с применением ЧККВ и/или тромболитических препаратов (CLARITY, COMMIT, CURRENT); у перенесших ишемические инсульты или транзиторные ишемические атаки (PROFESS); у имеющих хроническую ИБС (CAPRIE, подгруппы больных с высоким сердечно-сосудистым риском из исследования CHARISMA). Данные этих исследований составляют основу для выбора клопидогреля в качестве одного из ведущих подходов к антитромбоцитарной терапии у многих категорий больных с сердечно-сосудистыми поражениями.
Каковы показания к применению клопидогреля? Они включают (все утверждены FDA, США):
В каких дозах используется клопидогрель? Поскольку пациенты с ОКС, постинфарктные больные и лица после стентирования представляют группы очень высокого сердечно-сосудистого риска, при выборе препаратов для них следует говорить о желательности применения наиболее авторитетных препаратов каждой из необходимых групп (применительно к клопидогрелю вполне логично выбирать оригинальный препарат). Выбор дозы клопидогреля определяется клинической ситуацией: для больных с ОКС и/или стентированием используются нагрузочные дозы (кроме лиц в возрасте ≥ 75 лет), в остальных ситуациях (после ОКС, стентирования после ишемического инсульта, а также и в острых случаях у больных в возрасте ≥ 75 лет) применяется стандартная доза — 75 мг/сут. Нагрузочные дозы также варьируют: если при ОКС проведение ЧККВ не предполагается, то нагрузочная доза составляет 300 мг, в т.ч. при проведении тромболитической терапии; если же выполнение ЧККВ предполагается, то нагрузочная доза увеличивается до 600 мг (если больной ранее уже принял нагрузочную дозу 300 мг, то рекомендован ее повтор до достижения суточной дозы 600 мг). Между приемом нагрузочной дозы 600 мг клопидогреля и проведением ЧККВ нет необходимости в создании специального интервала времени (ранее некоторые исследователи обосновывали желательность 2-часового интервала для достижения максимального антитромбоцитарного эффекта препарата, но сейчас эта точка зрения категорически не поддерживается действующими на этот счет рекомендациями).
Говоря о дозах клопидогреля после ЧККВ, необходимо кратко упомянуть о завершившемся в 2009 г. масштабном РКИ CURRENT-OASIS 7. В это исследование вошли 25 087 больных с ОКС (как с элевацией сегмента ST, так и без нее), которым планировалось проведение первичной ЧККВ. В добавление к стандартной антитромбиновой и адъювантной терапии больные были дважды рандомизированы (разделение 2 х 2, так называемый факториальный протокол):
а) по режиму приема клопидогреля:
б) по режиму приема аспирина:
В этом исследовании не все больные (как предполагалось в его начале) получили лечение с ЧККВ (лишь 13 608). Остальные лечились медикаментозно. Для этих больных назначение более высоких нагрузочных и промежуточных (до 7 дней) доз клопидогреля, а также более высоких доз аспирина (до 30 дней) не приводило к существенному улучшению прогноза, вследствие чего для подобных лиц стратегия нагрузочной дозы 300 мг и далее — по 75 мг/сут будет оставаться неизменной. Для группы же из 13 608 больных, где выполнялось ЧККВ, более благоприятный эффект на прогноз при использовании более активной антитромбоцитарной терапии был достигнут. Так, частота первичной конечной точки, включавшей сердечно-сосудистую смертность + несмертельный ИМ + несмертельный инсульт, уменьшилась в сравнении с группой, где применялись обычные дозы препаратов, на 15 % (и на 21 % — при применении более высокой дозы аспирина); частота определенного стент-тромбоза снизилась соответственно на 42 % (и на 51 % — при применении более высокой дозы аспирина). Важно, что этот эффект был получен без существенного возрастания риска больших и смертельных кровотечений (тенденция к такому возрастанию отмечена, но она была статистически незначима). Следствием исследования CURRENT может быть принятие рекомендации по введению промежуточной повышенной поддерживающей дозы клопидогреля в течение первой недели после ЧККВ (по 150 мг/сут), однако пока еще эта рекомендация не вошла в число общепринятых.
Насколько длительным должно быть применение клопидогреля? В действующих рекомендациях продолжительность использования клопидогреля регламентируется по-разному для различных категорий пациентов. Для больных с ОКС, которые получали лишь медикаментозное лечение без ЧККВ (независимо от того, был ли использован тромболизис), этот срок составляет не менее 2 недель, желательно до 12 месяцев; для тех, кому был имплантирован непокрытый стент — не менее 1 месяца, желательно до 12 месяцев; для тех же, кому был имплантирован покрытый стент (независимо от его вида), — наиболее императивное показание — во всех случаях не менее 12 месяцев (но без установления четкой предельной границы).
Крайне важно более подробно рассмотреть вопрос о жесткой необходимости двойной антитромбоцитарной терапии (аспирин + клопидогрель) у больных после имплантации покрытого стента. Напомним, что имплантация таких стентов ассоциирована (в особенности при ОКС, но возможно также и при хронической ИБС) с увеличением риска внутристентового тромбообразования (что обозначается как «стент-тромбоз» и клинически сопровождается отчетливым ухудшением прогноза). Это связывают с тем (В.Е. Stähl et al., 2009), что высвобождающиеся из покрытого стента антипролиферативные препараты уменьшают скорость реэндотелизации, снижают темпы миграции эндотелиальных клеток, уменьшают привлечение эндотелиальных клеток-предшественников и увеличивают высвобождение тканевого фактора коагуляции. Все это делает чрезвычайно необходимым проведение особенно активной, длительной и непрерывной антитромбоцитарной терапии; важным является назначение клопидогреля. Этот вопрос настолько важен, что эксперты American Heart Association/American College of Cardiology (АНА/АСС) сочли необходимым создать специальные рекомендации о «Предотвращении преждевременной отмены двойной антитромбоцитарной терапии у больных со стентами в коронарных артериях» (2007). С учетом высокой значимости этого документа мы сочли возможным представить некоторые его положения:
«Перед имплантацией стента обсудить с больным необходимость двойной антитромбоцитарной терапии. Если ожидается, что больной не будет в течение 12 месяцев принимать тиенопиридин (клопидогрель) по экономическим или другим причинам, явно следует избегать имплантации покрытого стента.
Для кандидатов на ЧККВ, если известно, что им в течение ближайших 12 месяцев будут проводиться инвазивные или хирургические вмешательства, не следует рутинно имплантировать покрытые стенты.
Перед выпиской настойчиво разъяснять больному причины назначения клопидогреля и риск, связанный с его преждевременной отменой. Инструктировать об обязательности контакта с кардиологом в случае необходимости неожиданной отмены.
Плановые процедуры, при которых имеется высокий риск пери-/постоперационной кровоточивости, предпочтительно отсрочить до завершения соответствующего курса клопидогреля.
Если все же необходимость в преждевременной отмене клопидогреля возникнет, то аспирин необходимо продолжать, насколько возможно, и возобновить клопидогрель сразу, как только это станет возможно.
Страховщики и Конгресс США должны принять во внимание, что стоимость препарата (клопидогреля) не должна заставлять больного преждевременно прекращать его прием и тем самым подвергаться риску развития некурабельных катастрофических сердечно-сосудистых осложнений».
С учетом приведенных строгих рекомендаций не кажется удивительным стремление кардиологов продлить сроки применения клопидогреля за пределы 12 месяцев после имплантации покрытого стента. Работы на этот счет достаточно многочисленны (показательно, например, сообщение S. Schulz et al. (2009), в котором анализируется 4-летний непрерывный прием клопидогреля группой из 6800 больных, перенесших имплантацию покрытого стента), они демонстрируют достаточно хорошую переносимость клопидогреля при длительном применении. Однако эти работы носят обычно ретроспективный характер, не заменяют РКИ и в качестве базы для формирования новой редакции рекомендаций использованы быть не могут.
Почему следует отменять клопидогрель перед аортокоронарным шунтированием и каким образом это правильно сделать? Прием клопидогреля должен быть прекращен перед проведением АКШ для снижения риска геморрагических осложнений. Поскольку влияние клопидогреля на тромбоциты необратимое, а для образования около 50 % новых тромбоцитов требуется примерно 5 дней, то именно этот период времени (5 дней) принят в качестве стандартного для отмены клопидогреля перед АКШ. Подсчитано, что такая отмена позволяет значимо снизить риск серьезных кровотечений.
Нужно ли больному после АКШ принимать клопидогрель? Решение этого вопроса зависит от особенностей больного. Если у него имеются стандартные показания для приема клопидогреля (перенесенный ОКС давностью менее 12 месяцев, наличие имплантированного покрытого стента давностью до 12 месяцев), то прием клопидогреля может быть возобновлен после АКШ при отсутствии активной кровоточивости (и больной далее будет получать двойную антитромбоцитарную терапию, т.е. аспирин + клопидогрель). Если же больной таких показаний не имеет, то после АКШ ему следует проводить антитромбоцитарную терапию аспирином (лишь при его непереносимости — клопидогрелем). В 2009 г. завершилось РКИ CASCADE, в котором больные с хронической ИБС после АКШ получали либо аспирин, либо аспирин с клопидогрелем (гипотеза исследователей состояла в том, что добавление клопидогреля к аспирину может уменьшить риск развития окклюзии шунта). Различий между группами в частоте развития сердечно-сосудистых осложнений выявлено не было, но в группе двойной терапии повышался риск кровоточивости. С учетом этих данных проведение двойной антитромбцитарной терапии (аспирин + клопидогрель) всем больным после АКШ не рассматривается сейчас в качестве стандартного лечебного подхода.
Что такое резистентность к антитромбоцитарным препаратам и какова ее практическая значимость? Этот термин достаточно часто используется в современной кардиологической литературе, но остается нечетко определенным и весьма противоречивым. В каждом случае, когда предполагается сниженный ответ на действие антитромбоцитарных препаратов (резистентность), следует в первую очередь исключить нарушение приверженности больного к лечению. Ответ тромбоцитов на действие различных антитромбоцитарных препаратов (аспирина, тиенопиридиновых производных, ингибиторов GP IIb/IIIa-рецепторов тромбоцитов), по лабораторным данным, широко варьирует; такая вариабельность не представляет собой феномена «все или ничего» (с возможностью выделения «ответчиков» и «неответчиков»), но, скорее, проявляется разной степенью ответа. Причины такой вариабельности ответа разнообразны и недостаточно изучены, в части случаев они связаны с генетическими факторами (для клопидогреля, например, наличие генотипа цитохрома CYP2C19*2 ассоциировано с увеличением риска сердечно-сосудистой смерти, ИМ и инсульта в 1,53 раза, а для празугреля такая зависимость от этого генотипа отсутствует). Для аспирина обсуждаемые механизмы резистентности включают: полиморфизм рецепторов тромбоцитов, возможность активации тромбоцитов посредством других (не зависящих от циклооксигеназы-1) механизмов, повышение воспалительного ответа с увеличением экспрессии циклооксигеназы-2 и др. Данные о частоте выявления резистентности к антитромбоцитарным препаратам зависят от метода ее диагностики: для аспирина, тиклопидина и клопидогреля (как в нагрузочных дозах 300 и 600 мг, так и в стандартной поддерживающей дозе 75 мг) лабораторно выявляемое снижение подавляющего эффекта на агрегацию тромбоцитов регистрируется в 4–20 % наблюдений. Также выявляются случаи перекрестного снижения ответа тромбоцитов и на аспирин, и на клопидогрель (т.е. лабораторная резистентность к двойной антитромбоцитарной терапии). Распространенность клинически значимого снижения ответа тромбоцитов на антитромбоцитарные препараты остается неустановленной. Возможная связь лабораторно выявляемой резистентности тромбоцитов к действию антитромбоцитарных препаратов является предметом дискуссии. Для ситуаций с острым сосудистым повреждением (ОКС, стентирование) такая связь просматривается более отчетливо, для хронических (хроническая ИБС) — пока (?) неубедительна. В течение последнего времени представлены данные о том, что лабораторное выявление сниженного ответа на аспирин и тиенопиридиновые препараты может быть использовано при ОКС и стентировании для выявления лиц с повышенным риском развития сердечно-сосудистых осложнений. Так, продемонстрировано, что у больных со сниженным ответом тромбоцитов на аспирин или клопидогрель после имплантации покрытого стента отчетливо возрастает риск стент-тромбоза. В США и ряде других стран для определения чувствительности тромбоцитов к действию антитромбоцитарных препаратов уже внедрены коммерчески доступные тест-системы (например, система VerifyNow, раздельно для аспирина, клопидогреля и ингибиторов GP IIb/IIIa-рецепторов тромбоцитов). Представлены первые (пока предварительные, на нескольких сотнях больных; недавнее исследование POPular (США) — 1069 больных) данные об их способности идентифицировать лиц с высоким сердечно-сосудистым риском. Некоторые исследователи полагают возможным в таких ситуациях говорить о целесообразности изменения антитромбоцитарной тактики (например, о повышении доз аспирина или клопидогреля, о замене клопидогреля на празугрель и пр.). В то же время, пока официальная позиция по поводу использования определения резистентности к антитромбоцитарным препаратам для клинической практики остается более чем сдержанной. В 2009 г. Европейская рабочая группа по резистентности к антитромбоцитарным препаратам констатировала:
«1. В настоящее время отсутствуют данные крупных проспективных клинических исследований, которые бы показывали, что рутинное или даже спорадическое определение/мониторирование функции тромбоцитов в процессе лечения антитромбоцитарными препаратами, а также принятие на этой основе лечебных решений, ведут к получению каких-либо значимых клинических преимуществ. В отсутствие таких данных… какие-либо рекомендации на этот счет, даже в жизнеугрожающих ситуациях, являются преждевременными; на современном уровне знаний их фактически невозможно воплотить в практику.
2. Немедленным следствием возникновения предположения о «резистентности», по данным лабораторных тестов, должна быть оценка приверженности больного к приему соответствующих препаратов.
3. В академических центрах с опытом оценки функции тромбоцитов в отдельных случаях индивидуальный подбор дозы антитромбоцитарных препаратов на основании такой оценки является возможным… но эти действия должны рассматриваться лишь как исследовательские и не базирующиеся на доказательствах об эффективности (такого подхода)».
В последнее время в литературе появилась информация о нежелательности сочетания клопидогреля с ингибиторами протонной помпы (ИПП). Как поступать практикующему врачу? Взаимодействие ИПП продемонстрировано не только с клопидогрелем, но с различными тиенопиридиновыми производными. Это взаимодействие заключается (M.L. O''Donoghue et al., 2009) в снижении абсорбции принимаемых внутрь тиенопиридинов, а также (возможно) в изменении их активации, индуцируемой цитохромом Р450; оба этих фармакодинамических эффекта потенциально могут ослаблять влияние тиенопиридина на Р2Y12-рецепторы тромбоцитов и тем самым уменьшать антитромбоцитарное действие тиенопиридина. С учетом известной вариабельности ответа на различные антитромбоцитарные препараты этот эффект может представлять особую опасность для лиц, показывающих сниженный ответ на действие таких лекарственных средств. Следует однако, отметить, что точка зрения о том, что взаимодействие тиенопиридинов с ИПП выходит за рамки фармакодинамики в клиническую практику, поддерживается не всеми крупными кардиологами. В частности, приводятся данные ряда вполне представительных исследований (например, COGENT — 3627 больных, TRITON-TIMI 38 — 13 608 больных), в которых не было показано ослабления степени сердечно-сосудистой протекции при применении ИПП совместно с тиенопиридинами в сравнении с использованием тиенопиридинов без ИПП; важно, что риск желудочно-кишечных осложнений (суммарно — кровотечений, язвенных обструкций и перфораций) был ниже в группах, где использовались ИПП. Ряд авторов (M.L. O''Donoghue et al., 2009; D. Bhatt et al., 2009) высказывает точку зрения о том, что лишь для лиц с подтвержденным снижением ответа на тиенопиридины прием ИПП может быть нежелательным; либо же при назначении таким больным ИПП следовало бы применять те из них, которые с меньшей вероятностью будут взаимодействовать с тиенопиридинами (не омепразол и не эзомепразол). Несмотря на эти умеренные высказывания, регуляторными организациями Европы и США (соответственно EMEA и FDA) в 2009 г. принято следующее решение: «Информация для всех клопидогрель-содержащих лекарственных средств должна быть дополнена, с тем, чтобы не рекомендовать сопутствующее применение ИПП, кроме случаев, когда это абсолютно необходимо». Отмечается, что в качестве альтернативы ИПП следует использовать другие гастропротекторные препараты, однако нет указаний на то, какая из групп этих средств могла бы рассматриваться как предпочтительная.
Что представляют собой новые ингибиторы АДФ? За последние несколько лет активный поиск антитромбоцитарных средств, которые обладали бы более высокой скоростью начала действия и меньшей вариабельностью эффекта, чем клопидогрель, привел к появлению ряда новых препаратов, которые пока на отечественном фармацевтическом рынке не присутствуют (табл. 2). Более подробно говорить об этих препаратах заставляет то, что с ними уже проведен ряд масштабных РКИ; они в перспективе могут занять достаточно широкое место в кардиологической практике. Пока в действующих рекомендациях по ведению больных с ОКС они не представлены, однако празугрель уже одобрен FDA (США) для лечения больных с ОКС, которые будут подвергаться процедуре ЧККВ (после исследования TRITON-TIMI 38), а решения по тикагрелору (исследование PLATO) и кангрелору (исследование CHAMPION) пока рассматриваются.
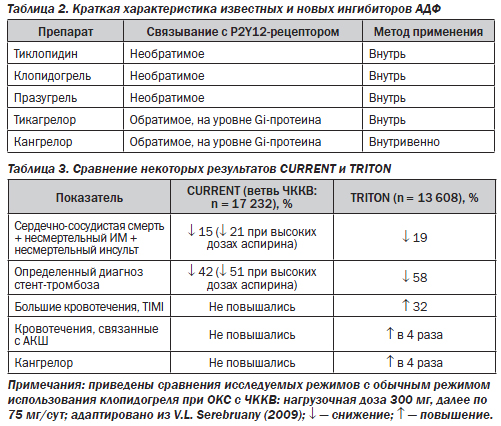
Представляется целесообразным кратко рассмотреть основные данные РКИ TRITON-TIMI 38 (празугрель против клопидогреля) и сопоставить их с результатами упоминавшегося ранее недавнего РКИ CURRENT-OASIS 7 (удвоенные нагрузочные и начальные дозы клопидогреля против его же обычных нагрузочных и поддерживающих доз). Категории включавшихся в исследования больных были сходными: это были лица с ОКС (как с элевацией, так и без элевации ST), которым планировалось проведение ЧККВ. В исследование TRITON-TIMI 38 вошли 13 608 больных, у которых в добавление к аспирину и иному стандартному лечению использовали либо празугрель в нагрузочной дозе 60 мг, далее по 10 мг/сут, либо клопидогрель в нагрузочной дозе 300 мг, далее по 75 мг/сут. Результат оказался в пользу празугреля: риск первичной конечной точки (сердечно-сосудистая смерть + несмертельный ИМ + несмертельный инсульт) был на 19 % ниже, р < 0,001. Этот позитивный эффект был достигнут ценой повышения риска кровоточивости: в группе празугреля частота больших кровотечений (по шкале TIMI) оказалась на 32 % выше, чем в группе клопидогреля, р = 0,03. При сравнении этих данных с подобными из РКИ CURRENT-OASIS 7 (табл. 3) отмечаем, что выигрыш празугреля в сравнении с клопидогрелем не кажется столь уж внушительным.
Резюмируя обсуждение новых ингибиторов АДФ, нельзя не признать их перспективность; результаты дополнительных РКИ (которые сейчас активно проводятся) позволят более точно указать на их место в лечебной практике.
