Газета «Новости медицины и фармации» Кардиология (314) 2010 (тематический номер)
Вернуться к номеру
Гострий коронарний синдром, ускладнений синдромом серцевої недостатності: предиктори несприятливих подій та сучасні алгоритми лікування
Авторы: Т.О. Ілащук, В.К. Тащук, Кафедра внутрішньої медицини, фізичної реабілітації та спортивної медицини Буковинського державного медичного університету, м. Чернівці
Версия для печати
При реєстрації високого рівня смертності від ішемічної хвороби серця (ІХС) в Україні поза стаціонарами відзначено низький рівень виявлення та діагностики гострих коронарних синдромів (ГКС) [1, 2]. Структура смертності в країнах Євросоюзу значно відрізняється від такої в Україні: смертність від хвороб системи кровообігу (ХСК) в європейських країнах становить 27,7 %, тоді як в Україні —
61,6 % [3]. Смертність населення від ІХС при ХСК традиційно посідає перше місце. В Україні в 2005 р. вона становила 66,6 % серед усього населення, у 1991 р. — 54,5 %. Цей показник серед працездатного населення незмінно складає 54,3–54,4 % [6], а це означає, що більше ніж у половині випадків смерті осіб працездатного віку при ХСК причиною є ІХС.
За статистичними даними, в Україні основною причиною виникнення патологічних станів, що призводять до смерті пацієнтів з ІХС навіть працездатного віку, є кардіосклероз. При цьому в структурі смертності в Україні частка смерті від ІХС в 4 рази більша, ніж у країнах європейської спільноти, у яких головними причинами смерті при ІХС є гострий інфаркт міокарда (ГІМ) й раптова серцева смерть (РСС), тромбоемболія легеневої артерії та серцева недостатність (СН), і, значно рідше, розрив аорти.
За поширеністю в структурі ХСК перше місце серед дорослих та підлітків посідає артеріальна гіпертензія (АГ) — 43,9 %, потім ІХС — 33,7 % і цереброваскулярні хвороби (ЦВХ) — 13,7 %. Показники захворюваності становили відповідно 40,9; 28,9 і 16,3 %.
На очікувану тривалість життя сьогодні впливає не рівень дитячої смертності, як це було в першій половині минулого століття, а смертність дорослого населення від неінфекційних хвороб. У першу чергу йдеться про ХСК, зокрема про ІХС, АГ та ЦВХ. Саме з цих причин Україна за показниками смертності посідає непрестижне перше місце серед країн європейської спільноти.
Щорічно від ХСК світ втрачає понад 14 мільйонів населення. Згідно з матеріалами доповіді робочої групи Європейського товариства кардіологів, помітне збільшення смертності та захворюваності на хвороби серця й судин спостерігається в країнах Центральної та Східної Європи. Зокрема, в Україні зареєстровано найвищі серед 30 країн Європи показники серцево-судинних хвороб у чоловіків і жінок, а також один із найвищих показників смертності від ІХС. Причому найістотніше (у 3–7 разів) перевищення зазначених показників в Україні, порівняно з більшістю європейських країн, спостерігається в молодих людей. Відповідно до даних Американської асоціації серця, смертність від серцево-судинних хвороб чоловіків віком від 37 до 47 років в Україні є чи не найвищою в світі.
Загалом на смертність населення від ІХС без АГ, з АГ (усі форми) і з цереброваскулярною патологією без супутньої АГ припадає при ХСК 88,2 % всіх випадків, а серед працездатного населення — 76,1 %.
В Україні за останні 5 років відмічається тенденція до зростання захворюваності на інфаркт міокарда (ІМ), смертності від цієї патології та її ускладнень. У цілому помирає близько 30–50 % хворих на ІМ, серед них більше половини — на догоспітальному етапі внаслідок РСС. Госпітальна летальність становить близько 10 %, а ще 5–10 % пацієнтів помирають упродовж наступного року.
На підставі даних літератури можна зробити висновок про те, що впродовж останніх років намітилася стійка тенденція до «помолодшання» ІМ. У віці до 40 років ця хвороба спостерігається з частотою 0,1–0,6 на 1 тис. чоловіків та 0,03–0,04 на 1 тис. жінок. Це становить 2–7 % випадків ІМ, що реєструються у віці до 65 років [8, 15]. У деяких розвинутих країнах на цю вікову групу припадає 4–8 % загальної структури захворюваності [9]. Насторожує також той факт, що останнім часом серед хворих на ІХС зросла кількість молодих жінок [15].
Основними факторами, що впливають на віддалений прогноз хворих, які перенесли ГІМ та були виписані зі стаціонару, вважають: тяжкість атеросклеротичного ураження вінцевих артерій (з наявністю спонтанно рецидивуючої або індукованої ішемії міокарда); стійке порушення скоротливої функції лівого шлуночка (ЛШ) та рецидивуючу аритмію [9].
Розвиток стійкої лівошлуночкової дисфункції призводить до того, що пацієнти потрапляють у групу високого ризику розвитку РСС. Показано, що смертність та ризик ішемічних ускладнень обернено пропорційні величині фракції викиду (ФВ) ЛШ. Більше того, прогностична цінність цього показника однакова при лікуванні ІМ з використанням тромболітиків або без них [7].
Зараз очевидно, що ГКС, а саме нестабільна стенокардія та ІМ, мають спільний анатомічний субстрат. Патологоанатомічні, ангіоскопічні та біологічні спостереження довели, що нестабільна стенокардія та ІМ характеризуються різними клінічними проявами, але мають однаковий патофізіологічний механізм: розрив атеросклеротичної бляшки або її ерозію з різним ступенем тромбозу чи емболії [2, 3].
Розроблено клінічні критерії, які дозволяють клініцисту приймати своєчасні рішення й обирати найкраще лікування, спираючись на стратифікацію ризику та патогенетичний підхід до втручання.
Раптова «втрата» більш або менш широкої ділянки серцевого м''яза призводить до розвитку дисфункції шлуночка, і, якщо хворий не помирає (що буває в 50 % випадків), дисфункція з часом, як правило, маніфестує симптомами СН [8]. У дослідженні TRACE у 40 % хворих, що перенесли ІМ, вже в перші дні захворювання відмічалась тяжка дисфункція ЛШ, причому в 65 % це був перший в житті інфаркт; у 74 % з них скоро розвинулася клінічна картина СН. Однак, за даними літератури, і ті 60 % пацієнтів, у яких на ранньому етапі захворювання не розвинулася міокардіальна дисфункція, не можуть вважати себе у безпеці. За широким ІМ слідують зміни серцевого м''яза, які отримали назву «ремоделювання серця». Цей феномен включає процеси, що залучають уражену ділянку та здорові зони міокарда, коли інфарктна зона «розтягується» і не в змозі протистояти збільшеному внутрішньошлуночковому тиску, а неуражені ділянки гіпертрофуються та дилатуються, щоб пристосуватися до нових умов функціонування.
Ще одним важливим фактором виникнення міокардіальної дисфункції у хворих на ІХС є порушення функції ендотелію коронарних судин, властиве цій патології. Доведено, що дисфункція ендотелію призводить до викиду цитокінів, кінінів, моноамінів й інших біологічно активних речовин, що відповідають за розвиток та прогресування СН: ендотелін-1, фактор некрозу пухлини, розлад ренін-ангіотензин-альдостеронової та симпатоадреналової систем. Окрім цього, ендотеліальна дисфункція у хворих на ІХС блокує міграцію попередників гладком''язих клітин та їх проліферацію в стінці судини, збільшує проникність стінки для ліпідів, що сприяє подальшому розвитку атеросклерозу та коронарного тромбозу, який, у свою чергу, викликає персистуючу ішемію міокарда та дисфункцію ЛШ.
Патологоанатомічні дослідження пацієнтів із ГКС дозволили виявити широкий спектр знахідок у міокарді, який постачається ураженою судиною. При нестабільній стенокардії міокард може залишатися незміненим або з різним ступенем вираженості некрозу. У деяких пацієнтів знаходять ділянки некрозу клітин у міокарді, появу яких пояснювали повторними епізодами емболізації. Серцеві тропоніни Т (ТнТ) або І (ТнІ) є найбільш чутливими та специфічними маркерами міокардіального некрозу, які стали методами вибору в обстеженні пацієнтів з підозрою на ГКС [4, 11]. Обмежені ділянки некрозу часто не вдається виявити рутинними вимірами рівнів креатинкінази (КК) або МВ-КК. Уміст цих ферментів може залишатися в межах або лише дещо вище верхньої межі норми. Підвищені рівні серцевого тропоніну за відсутності елевації МВ-КК позначають як «мінімальне ушкодження міокарда». Ця концепція має значні практичну цінність щодо несприятливого наслідку та вибору режиму терапії.
У більшості робіт, присвячених прогнозуванню перебігу ГІМ, автори надають велике значення клінічним особливостям захворювання, а виникаючі ускладнення розцінюють як прогностично несприятливу ознаку.
Відомо, що маркери системного запалення, активація яких пов''язана з нестабільністю атеросклеротичної бляшки, можуть використовуватися для оцінки госпітального перебігу ГІМ та віддаленого прогнозу [8, 10, 12]. За даними Глобального реєстру гострих коронарних подій (GRACE), оцінку рівня лейкоцитозу було проведено у понад 8 тис. хворих при госпіталізації з приводу ГІМ (у тому числі з зубцем Q) або нестабільної стенокардії та доведено, що велика кількість лейкоцитів (понад 10 х 109/л) у периферичній крові пов''язана з летальністю та розвитком СН упродовж 30 діб. При цьому також встановлено, що збільшення кількості лейкоцитів на 1 х 109/л супроводжується зростанням ризику смерті на 6 % та розвитку СН на 7 % у всіх вікових групах (як у чоловіків, так і в жінок). Результати численних досліджень свідчать про негативний вплив С-реактивного протеїну (СРП), туморнекротичного фактора (ТНФ-α), ІЛ та інших маркерів запалення на перебіг ГІМ у госпітальний період і на віддалені результати лікування цих хворих [13].
Є цілий ряд повідомлень про те, що факторами ризику в пацієнтів із ГІМ є підвищення рівнів фібриногену та СРП, але ці дані підтверджуються не в усіх дослідженнях. Наприклад, у дослідженні FRISC підвищення рівня фібриногену асоціювалося з підвищеним ризиком смерті при коротко- та довготерміновому спостереженні і/або підвищеним ризиком подальшого ГІМ. Прогностичне значення рівня фібриногену не залежало від даних електрокардіографії (ЕКГ) і рівнів тропоніну. Утім у дослідженні ТІМІ ІІІ гіперфібриногенемія асоціювалася з більшою кількістю ішемічних епізодів під час перебування пацієнтів у госпіталі; натомість не спостерігали зв''язку з випадками РСС або ГІМ під час 42-денного спостереження. Прогностичне значення зростання рівня СРП видається найбільшим у пацієнтів з ознаками ушкодження міокарда. У деяких дослідженнях підвищення концентрації СРП переважно пов''язане з ризиком смерті при тривалому спостереженні, на відміну від рівня фібриногену, який пов''язаний з ризиком подальшого виникнення ІМ і смертністю.
Рівні ТнТ і СРП корелюють з ризиком розвитку РСС при тривалому спостереженні та є незалежними факторами ризику, але їх ефекти є адитивними один до одного й до інших клінічних маркерів. Сильними предикторами смертності при коротко- і довготривалому спостереженні є підвищені рівні NT-proBNP та ІЛ-6 [11].
Підвищені рівні ІЛ-6 дозволяють також ідентифікувати пацієнтів з очікуваною найбільшою користю від ранньої інвазивної стратегії та довготривалого антитромботичного лікування. У пацієнтів з ГКС виявлено раннє підвищення вмісту розчинних внутрішньоклітинних молекул адгезії та ІЛ-6. Детальніше вивчення цих маркерів може забезпечити додаткову інформацію про патогенез ГКС.
Згідно з нашими даними щодо обстеження й аналізу 368 пацієнтів із ГІМ, за весь період спостереження (один рік) померло 123 (33,42 %) особи, зокрема 94 (25,54 %) хворих — упродовж 28 діб перебування в стаціонарі, а 29 (7,88 %) — за рік спостереження. Середня тривалість госпітального періоду в пацієнтів, які померли в стаціонарі, становила 4,9 ± 2,3 дня. Аналіз ЕКГ-змін показав, що у переважної частини цих хворих (76,59 %) зареєстровано ГІМ передньої локалізації й лише у 23,41 % пацієнтів — задньої. Серед пацієнтів, померлих у стаціонарі, у 62,76 % ІМ був повторним, у 37,24 % — виник вперше. Рецидивуючий перебіг спостерігався у 38,29 % хворих, а ознаки справжнього кардіогенного шоку — у 35,11 % осіб. Поєднання гострої СН і складних порушень ритму та провідності відмічалось у 52,13 % пацієнтів.
Статевий та віковий аналіз групи госпітальної летальності показав, що серед померлих пацієнтів переважали чоловіки (72,34 проти 27,66 % жінок), середній вік становив 67,24 ± 1,92 року.
Із метою створення прогностичних моделей ГІМ, перебіг якого ускладнився гострою лівошлуночковою недостатністю (ГЛШН), під час наступного етапу дослідження всіх пацієнтів розділено на дві групи: група І — пацієнти зі сприятливим перебігом ГІМ та група ІІ — пацієнти з летальним наслідком ГІМ. У всіх хворих оцінювали дані ЕКГ-досліджень, зміни показників гомеостазу та їх корелятивні взаємозв''язки.
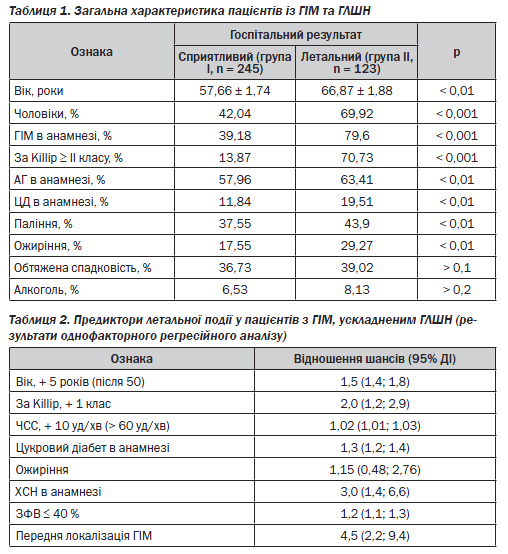
Загальна характеристика хворих І та ІІ груп наведена в табл. 1. Звертає на себе увагу той факт, що пацієнти з летальним наслідком були в середньому на 9 років старшими від пацієнтів зі сприятливим результатом захворювання. Серед них переважали чоловіки (р < 0,001). Окрім того, серед хворих групи ІІ значно частіше реєструвався повторний ГІМ (79,6 проти 39,19 % у групі І, р < 0,001). Ознаки ГЛШН ІІ–ІV класу за T. Killip з вірогідно більшою частотою реєструвалися у пацієнтів групи ІІ (р < 0,001). Наявність АГ та цукрового діабету в анамнезі також з вірогідно більшою частотою реєструвалася у хворих групи ІІ (р < 0,01). Аналіз поширеності факторів ризику серед пацієнтів обох груп показав вырогыдне переважання активного куріння (р < 0,01) та ожиріння (р < 0,001) також у пацієнтів групи ІІ.
Результати однофакторного регресійного аналізу вказують на те, що ризик виникнення летальної події збільшувався з віком: на кожні 5 років після 50 припадало збільшення ризику в 1,5 раза (табл. 2). Також ризик виникнення летальної події підвищувався вдвічі з кожним збільшенням класу ГЛШН за Killip; в 1,02 раза — при збільшенні частоти серцевих скорочень на 10 уд/хв після 60 уд/хв; в 1,3 раза — у пацієнтів з цукровим діабетом; в 1,15 раза — за наявності ожиріння; втричі — у пацієнтів з хронічною СН; в 1,2 раза — при реєстрації на 1-шу — 2-гу добу госпіталізації залишкової ФВ менше 40 % та в 4,5 раза — при передній локалізації ІМ.
Ми проаналізували, яким чином співвідносився вміст про- та протизапальних цитокінів у пацієнтів з ГІМ залежно від результату захворювання. Аналіз вмісту ІЛ-1α вказав на вірогідне його переважання у хворих групи ІІ (48,94 ± 7,05 проти 22,43 ± 3,41 пг/мл у групі І, р < 0,01). Рівень ІЛ-6 був також значно вищим у пацієнтів групи ІІ (51,63 ± 7,86 та 16,84 ± 3,94 пг/мл, р < 0,01), а рівень протизапального цитокіну ІЛ-10 був дещо нижчим у хворих групи ІІ порівняно з хворими групи І (2,45 ± 0,51 та 4,03 ± 0,73 пг/мл, р > 0,05). Таким чином, отримані нами дані цілком збігаються з результатами інших досліджень [11] і вказують на незаперечний внесок цитокінового каскаду в розвиток летальних подій у пацієнтів із ГІМ.
Погруповий аналіз рівнів туморнекротичного фактора α та неоптерину (НП) свідчить про вірогідне переважання обох цих показників у пацієнтів групи ІІ порівняно з групою І: 63,41 ± 3,78 та 43,1 ± 2,62 пг/мл для ТНФ-a (р < 0,01) і 24,28 ± 4,32 та 15,08 ± 1,76 нмоль/л для НП (р < 0,05).
За даними ряду досліджень [4], підвищення рівня ТнТ понад 2,8 мкг/л асоціюється зі зменшенням ФВ ЛШ нижче 40 %. В аналогічному дослідженні [11] доведено прямий зв''язок між ТнТ понад 2,98 мкг/л і ФВ менше 40 %. Збільшення ТнТ понад 0,01 мг/л можна вважати одним із маркерів несприятливого прогнозу захворювання. Разом із цим зростання рівня СРП понад 10 мг/л на фоні паралельного збільшення показника ТнТ розглядається як несприятливий прогностичний чинник щодо наступних змін показників, що характеризують скоротливість міокарда.
В інших дослідженнях доведено, що за стабільної стенокардії та ГКС рівень СРП може бути визнаний незалежним маркером прогнозу рецидивуючих несприятливих подій — РСС, ГІМ, рестенозування після черезшкірної ангіопластики (клас IIa, рівень доказовості В). Інші гострофазові реактанти та цитокіни можуть бути додатковими до рівня СРП (клас III, рівень доказовості C).
Отже, ми проаналізували, яким чином змінювалися рівні ТнІ та СРП у пацієнтів з ГІМ залежно від результату захворювання. Встановлено, що рівень ТнІ був значно вищим у пацієнтів групи ІІ порівняно з пацієнтами групи І (40,06 ± 5,13 та 27,31 ± 3,1 нг/мл, р < 0,05), рівень СРП також був вірогідно вищим у хворих групи ІІ (0,21 ± 0,03 проти 0,13 ± 0,02 мг/л у групі І, р < 0,05).
Дані літератури свідчать про те, що підвищений рівень СРП пов''язаний з погіршенням перфузії міокарда, вищою частотою ішемічних ускладнень, значним ризиком розвитку СН в постінфарктний період та з високим рівнем летальності. СРП активує систему комплементу, а кінцевим продуктом цього є комплекс, який атакує мембрану кардіоміоцитів і викликає порушення її функції зі зміною іонної проникності, підвищення внутрішньоклітинної концентрації кальцію та загибель клітин.
Отримані нами дані вказують на те, що рівень СРП був вірогідно вищим у пацієнтів з летальним наслідком ГІМ, ускладненого ГЛШН. Отже, можна зробити висновок про прогностично несприятливе значення збільшення рівня СРП у нашому дослідженні.
Результати однофакторного регресійного аналізу вказують на те, що ризик розвитку летальної події у пацієнтів з ГІМ та ГЛШН збільшувався зі зростанням рівнів СРП в 1,3 раза, ТНФ-α — в 2,4 раза, НП — в 2,6 раза, ІЛ-1α та ІЛ-6 — у 3,6 раза, ТнІ — у 3,2 раза.
Таким чином, можна зробити висновок, що старший вік пацієнтів, вищий клас ГЛШН, наявність цукрового діабету та СН в анамнезі, передня локалізація ІМ, куріння та ожиріння, залишкова ФВ менше 40 % є незалежними предикторами виникнення летальної події у пацієнтів з ГІМ. Окрім того, зростання рівнів прозапальних цитокінів (ІЛ-1α, ІЛ-6, ТНФ-α, НП, СРП) та ТнІ поряд із погіршенням вихідних даних ехокардіографії також сприяють зростанню ймовірності виникнення летальної події в даної категорії пацієнтів.
Лікування ГІМ продовжує зазнавати істотних змін. Належна практика повинна грунтуватися на вагомих доказах, отриманих у відповідно організованих клінічних дослідженнях. Використання β-адреноблокаторів (ББ) посідає чільне місце в серцево-судинному континуумі. При цьому, як зазначається в рекомендаціях Європейського товариства кардіологів 2004 року з використання ББ, механізм їх дії є різнобічним, нечітко визначеним і зі значними розбіжностями між окремими препаратами.
У значній кількості досліджень вивчалося внутрішньовенне введення ББ у гострій фазі ІМ з огляду на здатність цих засобів обмежувати зону некрозу, зменшувати частоту фатальних аритмій, послаблювати біль. За даними сукупного аналізу 28 досліджень, внутрішньовенна β-адреноблокада забезпечує абсолютне зменшення смертності через 7 діб з 4,3 до 3,7 %, що становить 6 врятованих життів на 1 тис. пролікованих пацієнтів. Ці дослідження здійснювалися до впровадження фібринолітичних засобів або виконання первинного перкутанного коронарного втручання (ПКВ). Проведено два рандомізованих дослідження внутрішньовенної блокади на фоні фібринолітиків. Але кількість подій була недостатньою, щоб робити певні висновки і в той же час визначити позитивний ефект такого підходу. Ретроспективний аналіз застосування атенололу в дослідженні GUSTO-I та систематичний огляд не свідчать на користь рутинного раннього внутрішньовенного застосування ББ. Частота використання β-адреноблокади в гострій фазі ІМ у багатьох країнах є надзвичайно низькою. Застосування внутрішньовенних ББ є особливо показаним за наявності тахікардії (коли немає проявів СН), відносної гіпертензії або у разі, коли після введення опіоїдів не проходить біль. Спочатку слід оцінити відповідь пацієнта на цю форму терапії шляхом використання короткодіючого препарату. Втім більшості пацієнтів достатньо пероральної β-адреноблокади. На більш пізніх стадіях захворювання застосування ББ є показаним та обов''язковим, особливо у пацієнтів з проявами СН. На сьогодні відомо, що суттєвий внесок у появу клінічних ознак СН вносить порушення діастолічної функції лівого шлуночка (ЛШ), лікування якої слід починати якомога раніше, до настання необоротних структурних змін міокарда та систолічної дисфункції [5]. Однак і досі немає одностайної думки про те, як лікувати діастолічну дисфункцію. Великі надії в цьому напрямку пов''язують з використанням ББ — препаратів, що стали суттєвим доповненням у лікуванні класичної систолічної дисфункції ЛШ. ББ необхідно призначати усім хворим (за винятком протипоказань та непереносимості) з проявами СН, зумовленими ішемічною хворобою серця (ІХС), які перебувають на підтримуючій терапії інгібіторами ангіотензинперетворювального ферменту (іАПФ) і діуретиками та мають стабільну гемодинаміку [14]. Результати таких класичних багатоцентрових досліджень, як US Сагvedilоl Неагt Failure Ргоgгаm (USСР, 1996), СІВІS II-ІІІ (1999–2003), МЕRІТ-НF (1999) та СОРЕRNIСUS (2001), що охопили загалом понад 10 тис. хворих, безапеляційно вказують на необхідність застосування ББ у вказаного контингенту пацієнтів. Застосування ББ, що вивчалися у зазначених дослідженнях (карведилол, бісопролол та ретардна форма метопрололу сукцинату), приводило до статистично високовірогідного зниження частоти летальних випадків за період спостереження — на 34–65 %, випадків раптової кардіальної смерті — на 41–56 % порівняно з пацієнтами, які приймали плацебо додатково до іАПФ та діуретика.
Про покращання клінічного перебігу СН також свідчило зниження ризику госпіталізації хворих на 20–35 %. Щодо інших ББ, то відповідно сплановані багатоцентрові дослідження їх впливу на прогноз життя хворих із СН або не проводилися (пропранолол, атенолол, бетаксолол, dl-соталол), або не продемонстрували вірогідного позитивного результату (буциндолол). Окрім збільшення тривалості життя хворих із СН та зниження ризику їх повторних госпіталізацій, зазначені ББ мають здатність покращувати при тривалому прийманні клінічний стан пацієнтів (знижують функціональний клас), зменшувати дилатацію та підвищувати загальну фракцію викиду (ЗФВ) ЛШ. Дані метааналізів відповідних досліджень продемонстрували, що за розрахунковим показником лікування із застосуванням карведилолу, бісопрололу та метопрололу СR/ХL протягом року має значну перевагу щодо запобігання кількості летальних випадків на 1 тис. хворих (71, 41 та 38 відповідно), а за здатністю покращувати ЗФВ ЛШ переважає метопролол СR/ХL.
Позитивний вплив β-α-адреноблокаторів пов''язують із неселективним характером β-адреноблокади та наявністю в них додаткових фармакологічних властивостей, в тому числі антиоксидантних. Крім того, для розвитку СН характерним є перерозподіл β-адренорецепторів від нормального співвідношення β1/β2/α у вигляді 70/20/10 до варіанта 50/25/25, що і спонукає до використання ББ. Окрім цього, карведилол може розглядатися як ББ вибору в пацієнтів із ЗФВ ЛШ ≤ 25 %, оскільки є єдиним представником зазначеного класу препаратів, що продемонстрував у спеціально спланованому великому дослідженні СОРЕRNIСUS (2001) здатність покращувати прогноз життя таких хворих. Терапевтична дія карведилолу при СН, окрім ефектів, зумовлених β-адреноблокадою, пов''язана також з його α1-антагоністичною активністю (периферична вазодилатація, пригнічення стимулів до гіпертрофії та аритмогенної активації міокарда, опосередкованих через α1-адренорецептори) та із здатністю пригнічувати активований у хворих із хронічною СН процес утворення у тканинах вільних радикалів за рахунок специфічного хімічного зв''язування останніх [17]. Карведилол залишається ББ, що продемонстрував здатність підвищувати ЗФВ ЛШ у хворих на ІХС із систолічною дисфункцією за рахунок відновлення функціонування гібернованих («відключених» внаслідок вираженої перманентної гіпоперфузії) зон міокарда (СHRISТМAS, 2002) [18]. Наступним етапом вивчення ефективності застосування ББ є аналіз досліджень CIBIS I–II–III. У дослідженні CIBIS ІІІ 1010 пацієнтів віком від 65 років із СН NYHA класу ІІ–ІІІ та ЗФВ ЛШ < 35 % були рандомізовані щодо терапії бісопрололом з наступним приєднанням еналаприлу або зворотної комбінації ліків. У пацієнтів, для яких початковим препаратом був бісопролол з наступним приєднанням еналаприлу, відмічено зниження ризику раптової смерті на 46 % протягом першого року порівняно з хворими, які отримували іАПФ як початкову монотерапію. Це дозволило R. Willenheimer у своїй доповіді на Європейському конгресі кардіологів запропонувати якнайшвидше рекомендувати бісопролол усім пацієнтам зі стабільною початковою СН. А дослідження CIBIS III створило концепцію «вільного вибору» початкової терапії СН бісопрололом та іАПФ відповідно рішення лікаря й особливостей пацієнта. У рандомізованих дослідженнях [16] ефективності тромболітичних препаратів порівняно з плацебо або одного фібринолітичного засобу порівняно з іншим взяли участь понад 150 тис. пацієнтів. В осіб, у яких після початку симптомів інфаркту минуло до 12 годин, переконливо доведений сприятливий вплив фібринолітичної терапії. Метааналіз Fibrinolytic Therapy Trialists свідчить, що у пацієнтів, які надходять протягом 6 годин після початку симптомів ІМ з елевацією сегмента ST або блокадою ніжки пучка Гіса, введення тромболітичних засобів дозволяє запобігти приблизно 30 смертельним випадкам на 1 тис. пролікованих осіб, а введення в проміжок часу від 7 до 12 год після початку симптомів — 20 смертельним випадкам на 1 тис. пацієнтів. Переконливих доказів ефективності тромболітичної терапії в більш пізні терміни (після 12 годин) немає. Дослідження ISIS-2 довело істотний додатковий ефект аспірину у зменшенні кількості летальних випадків з різних причин — близько 50 на 1 тис. пролікованих пацієнтів. Сприятливий ефект терапії спостерігався в усіх попередньо визначених підгрупах. Найбільший абсолютний ефект визначено в осіб з найвищим ступенем ризику, тоді як відносний ефект був подібним. У пацієнтів віком від 75 років, лікування яких здійснювалося впродовж 24 год, вплив на виживання був незначним і статистично невірогідним. Утім, коли тромболітична терапія здійснювалася впродовж 12 год після початку симптомів, рівень смертності вірогідно знизився на 26–29 %. Користь тромболітичної терапії є найбільшою, коли вона здійснюється в ранні терміни після початку симптомів. Аналіз досліджень із участю понад 6 тис. пацієнтів свідчить, що при проведенні догоспітального тромболізису рання смертність зменшувалася на 15–20 %. При затримці введення тромболітиків на кожну годину кількість смертельних випадків збільшувалася на 1,6 на 1 тис. пролікованих пацієнтів. За даними іншого метааналізу [12], більш виражене зменшення смертності спостерігалося у разі, коли лікування починалося протягом перших двох годин захворювання (44 проти 20 % при більш пізньому проведенні тромболізису). У багатьох дослідженнях вивчали ефективність гепарину під час або після фібринолізу, особливо разом із тканинним активатором плазміногену. Гепарин не сприяє поліпшенню негайного лізису згустка. Однак прохідність коронарної артерії (КА) через години-дні після тромболітичної терапії тканинним активатором плазміногену краща при одночасному застосуванні гепарину. Не виявлено відмінностей щодо прохідності в пацієнтів, яких лікували підшкірним чи внутрішньовенним введенням гепарину і стрептокінази. Тривале внутрішньовенне призначення гепарину не дозволяло запобігти реоклюзії після досягнення успішного коронарного фібринолізу, доведеного ангіографічним методом. Під час внутрішньовенної терапії гепарином необхідне ретельне моніторування показника активованого часткового тромбопластинового часу (АЧТЧ), величини якого понад 70 с асоціюються з більшою ймовірністю смерті, кровотечі та реінфаркту. Низькомолекулярний гепарин — це одна з фракцій стандартного гепарину. Він має низку теоретичних переваг порівняно зі стандартним гепарином. Серед них — краще запобігання новому утворенню тромбіну внаслідок більшого ступеня пригнічення фактора Xa, більш передбачувана кінетика, менше зв''язування з протеїнами, менша активація тромбоцитів, нижча частота виникнення тромбоцитопенії, відсутність необхідності контролю АЧТЧ. Низькомолекулярні гепарини вивчені у великих дослідженнях у пацієнтів з гострими коронарними синдромами без елевації сегмента ST, проте тільки нещодавно почали дослідження в комбінації з фібринолітичними засобами. Два раніше виконані клінічні дослідження дозволяють припустити, що дальтепарин порівняно з гепарином може зменшувати ризик оборотної ішемії та формування тромбів у шлуночках, хоча й за рахунок більшої частоти кровотеч. У трьох нещодавніх ангіографічних дослідженнях застосування еноксапарину або дальтепарину асоціювалося з тенденцією до зменшення ризику реоклюзії і/або більш пізнім збереженням прохідності інфарктзалежної судини. У першому великому дослідженні ASSENT-3 із застосуванням низькомолекулярного гепарину еноксапарину (30 мг внутрішньовенно болюсно і 1 мг/кг кожні 12 год) разом з тенектеплазою впродовж максимум 7 діб відмічалося зменшення ризику внутрішньогоспітального реінфаркту або внутрішньогоспітальної рефрактерної ішемії порівняно з гепарином. Збільшення частоти внутрішньочерепних кровотеч не спостерігалося. Відмічалося лише незначне збільшення кількості нецеребральних кровотеч порівняно з гепарином. Тенденція до зменшення смертності через 30 днів була на користь еноксапарину. В дослідженні ASSENT-3 PLUS догоспітальне призначення еноксапарину супроводжувалося істотним збільшенням ризику внутрішньочерепних кровотеч порівняно із застосуванням гепарину в пацієнтів віком від 75 років. Серед ПКВ, які здійснюються в перші години ГІМ, розрізняють первинне ПКВ у поєднанні з фармакологічною реперфузійною терапією та «ПКВ порятунку» після невдалої спроби фармакологічної реперфузії. Під терміном «первинне ПКВ» розуміють ангіопластику і/або стентування без попередньої або супутньої фібринолітичної терапії. Первинному ПКВ віддають перевагу, якщо його можна виконати впродовж 90 хв від моменту госпіталізації. У разі, коли пацієнти надходять до госпіталю, де немає умов для виконання катетеризації, слід здійснити ретельну індивідуалізовану оцінку потенційних переваг механічної реперфузії порівняно з ризиком, а також потенційними витратами часу на транспортування в найближчу лабораторію катетеризації серця. У дослідженні DANAMI-2 стратегію рутинного перевезення хворих у спеціалізований госпіталь для виконання первинної ПКВ порівнювали зі стратегією внутрішньогоспітального тромболізису. Перевезення хворих з територіальних госпіталів у центри інвазивної кардіології здійснювалося близько 3 год. У середньому термін транспортування становив менше 32 хв, а час від прибуття в територіальний госпіталь і до початку ПКВ — менше 2 год. Через 30 діб спостерігали вірогідне зменшення загальної кількості випадків смерті, реінфаркту та інсульту в пацієнтів, яких перевозили для здійснення первинної ПКВ (14,2 проти 8,5 %, р < 0,002), тоді як зменшення смертності було невірогідним (8,6 проти 6,5 %, р = 0,20) [7]. Первинне ПКВ ефективне для забезпечення та підтримання прохідності КА, що дозволяє уникати ризику кровотечі, характерного для фібринолітичної терапії [16]. Рандомізовані клінічні дослідження, в яких порівнювалися результати своєчасно виконаного первинного ПКВ і фібринолітичної терапії у відповідно оснащених центрах з великим обсягом процедур, свідчать про більш ефективне відновлення прохідності, менш часте виникнення реоклюзії, поліпшення ЗФВ ЛШ і кращі клінічні наслідки після виконання первинного ПКВ. Стратегія поєднання догоспітальної фармакологічної та механічної реперфузії може дати добрі результати, проте на сьогодні вона потребує додаткових доказових даних.
У рамках проведеного дослідження ми вивчали вплив негайної механічної реканалізації інфарктзалежної КА шляхом застосування черезшкірної коронарної ангіопластики у пацієнтів з ГІМ, ускладненим синдромом СН, на основні клініко-лабораторні та інструментальні показники, госпітальну та позагоспітальну летальність у даної категорії пацієнтів. Обстежених було розділено на дві групи залежно від ефективності проведеної ангіопластики. У групу І увійшли пацієнти з ефективною реваскуляризацією (58,93 % осіб), в групу ІІ — пацієнти, у яких ефективної реваскуляризації шляхом черезшкірної ангіопластики досягнути не вдалося, тому реперфузія відбувалася виключно за рахунок тромболізису (41,07 %).
Групи не мали відмінностей за віком, статтю, основними параметрами загального аналізу крові та показниками ехокардіографії (ЕхоКГ) на момент госпіталізації й ангіографічною характеристикою КА. За перший рік після перенесеного ГІМ померло 21,42 % пацієнтів, з них 14,28 % — під час перебування в стаціонарі, 7,14 % — упродовж наступного року спостереження. Аналіз летальності обох груп показав, що в групі І показник госпітальної летальності становив 5,35 %, за перший рік спостереження померло 1,78 % пацієнтів, таким чином, загальний показник летальності становив 7,13 %. Серед пацієнтів групи ІІ загальний показник летальності за рік після перенесеного ГІМ становив 14,29 %, з них 8,93 % припадало на госпітальну летальність, 5,36 % — на позагоспітальну. Отже, в групі пацієнтів з механічною реканалізацією та стентуванням інфарктзалежної КА показники летальності значно менші на всіх етапах порівняно з групою тромболізису, що дає підстави говорити про високу ефективність інтервенційних втручань в обраної категорії хворих. Частота виникнення повторного ГІМ упродовж першого року спостереження була теж значно нижчою у пацієнтів групи І порівняно з хворими групи ІІ — 3,57 та 7,14 % відповідно.
На наступному етапі ми проаналізували, яким чином змінювався вміст основного маркера некрозу міокарда — тропоніну І у пацієнтів обох груп на момент госпіталізації та на 10-й день ГІМ. Виявлено, що вихідний рівень ТнІ перевищував нормативні значення в обох групах, що свідчить про вираженість некротичного процесу в цієї категорії пацієнтів. На 30-й день ГІМ відмічався вірогідно вищий рівень ТнІ (р < 0,001) в осіб групи ІІ, що свідчить про більшу ефективність механічної реканалізації порівняно з тромболітичною терапією щодо зменшення рівня маркерів некрозу міокарда.
Важливим аспектом оцінки ефективності проведеного лікування є зіставлення змін показників ЕхоКГ у групах І і ІІ. Визначено, що в групі успішної механічної реканалізації інфарктзалежної КА відбувся вірогідний приріст кінцевого діастолічного об''єму (КДО) (+14,61 %, p < 0,01), невірогідні коливання кінцевого систолічного об''єму (КСО) (–5,12 %, p > 0,2), вірогідна позитивна динаміка ЗФВ ЛШ (+29,14 %, p < 0,001), в групі тромболітичної терапії гемодинамічний ефект був менш вираженим за змінами КДО(+5,84 %, p > 0,1) та КСО (–2,6 %, p > 0,5), відмічався вірогідний приріст ЗФВ ЛШ (+15,69 %, p < 0,01), але зміни були менш виражені порівняно з групою І. Отже, у пацієнтів з ГІМ, ускладненим синдромом СН, рання механічна реканалізація з наступним стентуванням інфарктзалежної КА є безпечним підходом, якому можна віддати перевагу перед консервативною стратегією ведення пацієнтів, оскільки це покращує показники скоротливої функції міокарда та зменшує кількість летальних випадків упродовж першого року спостереження. У результаті метааналізу 10 досліджень [14] з раннім внутрішньовенним введенням нітратів, виконаним у 2041 пацієнта, виявлено вірогідне зменшення смертності приблизно на одну третину. Але кожне з цих досліджень було невеликим за обсягом. Зареєстровано 329 смертельних випадків, і хоча результати виявилися високовірогідними, вони характеризувалися широкими довірчими інтервалами. У дослідженні GISSI-3 з участю 19 394 пацієнтів порівнювали стратегії застосування нітратів рутинно або в окремих пацієнтів з триваючою ішемією. При стандартизованому призначенні нітратів не спостерігалося вірогідного зменшення смертності. У дослідженні ISIS-4, у якому пероральний ізосорбід мононітрат призначали від початку захворювання протягом одного місяця, також не отримано доказів сприятливого впливу препарату. У дослідженні ESPRIM не доведена користь застосування молсидоміну, донора оксиду азоту. Отже, немає переконливих доказів доцільності застосування нітратів у початковій фазі ГІМ, рівень доказовості С — узгоджене рішення експертів, не підтверджене дослідженнями.
Чітко встановлено, що іАПФ необхідно призначати пацієнтам зі зниженою скоротливістю міокарда або тим, у яких на ранній фазі захворювання виникали прояви СН [14]. У дослідженнях GISSI-3 та ISIS-4 застосування іАПФ від першого дня захворювання незначно, але вірогідно зменшувало смертність протягом наступних 4–6 тижнів, чого не виявлено у дослідженні CONSENSUS II. Очевидно, це зумовлено випадковими факторами або раннім введенням препарату внутрішньовенно. Систематичний аналіз досліджень ефективності іАПФ у ранні терміни ІМ вказує на безпеку та добру переносимість цих засобів. Їх приймання асоціюється з невеликим, але вірогідним зменшенням смертності через 30 діб після початку захворювання, причому сприятливий ефект у більшості пацієнтів досягався протягом першого тижня. Нині існує загальна згода щодо початку застосування іАПФ протягом перших 24 год, якщо немає протипоказань. Утім зберігаються розбіжності думок щодо доцільності призначення іАПФ: чи усім пацієнтам, чи лише тим, які мають підвищений ступінь ризику. У декількох дослідженнях встановлено, що іАПФ зменшують смертність після перенесеного ГІМ зі зниженою ЗФВ ЛШ. У дослідження SAVE включали пацієнтів у середньому через 11 днів після гострої події. В усіх пацієнтів ЗФВ ЛШ становила менше 40 % при радіоізотопній вентрикулографії і не визначалася маніфестна ішемія при навантажувальному тесті. Протягом першого року не відмічався сприятливий вплив на виживаність, але в наступні 3–5 років смертність зменшилася на 19 % (з 24,6 до 20,4 %). Водночас навіть упродовж першого року спостерігалося менше випадків реінфарктів і виникнення СН.
Дані тривалих спостережень, здійснених після досліджень ефективності іАПФ у післяінфарктних пацієнтів, а також дані дослідження HOPE свідчать про користь призначення цих препаратів принаймні протягом 4–5 років, навіть коли немає дисфункції ЛШ. Досягнутий ефект може бути навіть більшим у пацієнтів з цукровим діабетом, які перенесли ІМ. Тривале призначення іАПФ після ІМ, подібно до аспірину і ББ, виправдане, якщо пацієнти добре переносять ці засоби. Блокада альдостерону призводить до зниження частоти виникнення летальних випадків, причиною яких була прогресуюча СН, та частоти раптової летальної події внаслідок серцево-судинних захворювань, а також частоти госпіталізації внаслідок серцевої патології у пацієнтів з тяжкою СН та систолічною дисфункцією ЛШ, які приймали іАПФ. Блокада альдостерону також запобігає ремоделюванню шлуночка та надмірному утворенню колагену в пацієнтів з дисфункцією ЛШ після ГІМ, впливає на ряд патофізіологічних механізмів, які, очевидно, є важливими для прогнозу в осіб з ГІМ. Для з''ясування ролі блокади альдостерону в зниженні летальності та частоти госпіталізації у пацієнтів з ГІМ, що ускладнився дисфункцією ЛШ, було проведено клінічне випробування з вивчення ефективності еплеренону та частоти виживаності пацієнтів з СН після ГІМ (EPHESUS). Під час дослідження було доведено, що лікування блокатором альдостерону та селективним блокатором мінералокортикоїдних рецепторів еплереноном призводить до зниження загальної летальності та летальності внаслідок серцево-судинної патології або госпіталізації з приводу серцево-судинних захворювань у пацієнтів з ГІМ, що ускладнився дисфункцією ЛШ та СН, на фоні оптимальної медикаментозної терапії.
Таким чином, аналіз багатоцентрових досліджень та отриманих власних результатів показав, що поряд із численними успіхами в лікуванні синдрому СН, що виник на фоні перенесеного ГІМ, ціла низка питань потребує подальшого вивчення з метою поліпшення стратегії госпітального та позагоспітального ведення такої категорії пацієнтів.
1. Абакумов Ю.Е., Васюк Ю.А., Захарова Т.Ю. и др. Прогноз раннего постинфарктного периода при осложненном течении инфаркта миокарда // Кардиология. — 1993. — Т. 3, № 2. — С. 27-30.
2. Амосова Е.Н. Клиническая кардиология. — К.: Здоров''я, 2002. — Т. 2. — 992 с.
3. Братусь В.В., Шумаков В.А., Талаева Т.В. Атеросклероз, ишемическая болезнь сердца. Острый коронарный синдром: патогенез, диагностика, клиника, лечение. — К.: Четверта хвиля, 2004. — 576 с.
4. Ватутин Н.Т., Калинкина Н.В., Демидова А.Л. и др. Значение определения сердечных тропонинов при повреждениях миокарда // Серце і судини. — 2005. — № 4. — С. 114-119.
5. Воронков Л.Г., Амосова К.М., Багрій А.Е. та співавт. Рекомендації Української асоціації кардіологів з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих // Український кардіологічний журнал. — 2006. — № 4. — С. 114-121.
6. Воронков Л.Г., Амосова К.М., Багрій А.Е. та співавт. Рекомендації Української асоціації кардіологів з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих // Український кардіологічний журнал. — 2006. — № 4. — С. 114-121.
7. Коваленко В.Н., Онищенко Е.В., Рябенко Д.В. Изучение выживаемости и функции риска смерти у пациентов с хронической сердечной недостаточностью различного генеза: результаты 5-летнего проспективного исследования // Укр. мед. часопис. — 2008. — № 4(66). — С. 32-36.
8. Пархоменко О.М., Гур''єва О.С., Шумаков О.В. та ін. Клініко-інструментальні маркери оцінки несприятливого перебігу госпітального періоду гострого інфаркту міокарда // Укр. кардіол. журн. — 2005. — № 6. — С. 10-18.
9. Сайгитов Р.Т., Глезер М.Г., Семенцов Д.П. и др. Прогнозирование госпитальных исходов при остром коронарном синдроме // Российский кардиологический журнал. — 2006. — № 2. — С. 42-49.
10. Armstrong E.J., Morrow D.A., Sabatine M.S. Inflammatory biomarkers in acute coronary syndromes. Part II: Acute-phase reactants and biomarkers of endothelial cell activation // Circulation. — 2006. — Vol. 113, № 7. — Р. e152-e155.
11. Ben-Dor I., Hasdai D., Behar S. et al. Prognostic implications of increased cardiac biomarkers and ST segment depression in non-ST elevation acute coronary syndromes: lessons from the acute coronary syndrome Israeli survey (ACSIS) // Heart. — 2006. — Vol. 92, № 4. — P. 547-548.
12. Biasucci L.M. Application to clinical and public health practice: clinical use of inflammatory markers in patients with cardiovascular diseases: a background paper // Circulation. — 2004. — Vol. 110. — Р. e560-e567.
13. Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. J. Heart. Fail. — 2008. — Vol. 10, № 10. — P. 933-989.
14. Hunt S.A., Abraham W.T., Chin M.H. et al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults // J. Am. Coll. Cardiol. — 2009. — Vol. 53, № 15.- P. e1-e90.
15. Kim J.K., Alley D., Seeman T. et al. Recent changes in cardiovascular risk factors among women and men // J. Womens Health. — 2006. — Vol. 15, № 6. — P. 734-746.
16. Massie B.M., Collins J.F., Ammon S.E. et al. for the WATCH Trial Investigators. Randomized Trial of Warfarin, Aspirin, and Clopidogrel in Patients With Chronic Heart Failure. The Warfarin and Antiplatelet Therapy in Chronic Heart Failure (WATCH) Trial // Circulation. — 2009. — Vol. 119, № 12. — P. 1616-1624.
17. Poole-Wilson P.A., Swedberg K., Cleland J.G. et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial // Lancet. — 2003. — Vol. 362, № 9377. — P. 7-13.
18. Willenheimer R. How to begin treatment in chronic heart failure? Results of CIBIS III // Eur. Heart J. — 2006. — Vol. 8, Suppl. C. — C43-C50.
