Газета «Новости медицины и фармации» Акушерство, гинекология, репродуктология (317) 2010 (тематический номер)
Вернуться к номеру
Пробиотическая терапия для коррекции микробиоценоза репродуктивного тракта перед родами
Авторы: И.Н. Кононова, Е.Г. Смирнова, Кафедра акушерства и гинекологии педиатрического факультета,
Уральская государственная медицинская академия, г. Екатеринбург, Россия
Версия для печати
Репродуктивное здоровье населения является интегративным показателем благополучия общества, от уровня которого зависит здоровье будущих поколений. В настоящее время современное общество столкнулось с демографической проблемой: увеличивается количество выкидышей, внутриутробного инфицирования новорожденных [1, 2]. В последнее десятилетие среди возбудителей гнойно-септических заболеваний возросла роль условно-патогенной микрофлоры. При внутриутробных инфекциях (ВУИ) и инфицировании плода и новорожденного заражение происходит в антенатальном периоде или в родах [2, 3].
Бактериальная внутриутробная инфекция развивается в основном вследствие проникновения восходящей инфекции из родовых путей, причем сначала возникает хориоамнионит, инфицируются околоплодные воды, а плод поражается вследствие заглатывания околоплодных вод или попадания их в дыхательные пути. Возможно инфицирование при прохождении плода через родовой канал, что характерно для бактериальной и урогенитальной инфекции [4, 5, 7].
Острые и негативные эмоции ожидания родов в виде проявлений «стресса ожидания», усиливающегося в конце беременности, могут быть причиной развития иммунных дисфункций различной степени [3, 4]. При возникновении психологической дезадаптации в этот период происходит истощение функциональных резервов иммунной системы в результате предшествующей клеточной мобилизации со стороны клеток лейкоцитарного пула [9]. В результате возникает дисбаланс во взаимоотношениях макро- и микроорганизмов, развитие дисбиотических нарушений репродуктивного тракта, колонизационной резистентности. Это обусловливает появление и развитие целого ряда патологических процессов в родовых путях и кишечнике у беременных, что, в свою очередь, влечет за собой нарушение микробиоценоза у плода, в элементах плодного пузыря и у новорожденного [4].
У беременных с нарушениями биоценоза репродуктивного тракта повышается риск преждевременных родов, роды чаще осложняются несвоевременным излитием околоплодных вод, развитием аномалий родовой деятельности, возникновением гипоксии плода. Легкая, мало- и даже бессимптомная инфекция у беременной может привести к выраженной недостаточности плаценты вплоть до гибели плода или тяжелой инвалидизации ребенка [5].
В норме среднее количество микроорганизмов во влагалищном секрете для аэробов и анаэробов составляет 105–106 КОЕ/мл. При этом преобладают пероксид-продуцирующие лактобациллы, обеспечивающие основной защитный механизм путем конкуренции с более патогенными микроорганизмами. У здоровых женщин аэробная флора превалирует над анаэробной в соотношении 10 : 1. Во время беременности происходит ряд физиологических изменений, которые могут оказать влияние на интерпретацию результатов иммунологических реакций и иммунологической функции организма. Это снижение уровня IgG на 20 % и повышение уровня IgD. Содержание IgA и IgM во время беременности не изменяется. Значительно повышается уровень комплемента, особенно С3 [4, 5].
Утрата вагинальных лактобацилл является основным фактором в каскаде изменений, приводящих к инфекционным осложнениям, поскольку основными патогенетическими свойствами лактобацилл являются: продукция перекиси водорода; высокая адгезивная способность по отношению к эпителиоцитам влагалища; выработка биосурфактанта, блокирующего адгезию патогенных бактерий [2].
Существующие традиционные методы медикаментозной терапии инфекций половой сферы с применением этиотропных антибактериальных препаратов в свою очередь вызывают синдром иммунологической недостаточности, характеризующийся нарушением гуморального и клеточного иммунитета, синтеза компонентов комплемента, отсутствием или снижением активности цитотоксических лимфоцитов и макрофагов. Результатами развития данного синдрома являются длительная персистенция возбудителя, частые рецидивы заболевания, возможности последующих заражений инфекционными агентами другой природы, поскольку восстановление иммунного статуса и нормализация микробиоценоза происходят в недостаточном объеме и темпе или не происходят вовсе. Терапия антибактериальными препаратами приводит к дестабилизации вагинальной экосистемы, вследствие чего происходит резкое снижение количественных и качественных характеристик нормальной синергидной микрофлоры, увеличение рН вагинального секрета, а следовательно, создаются условия для массового размножения условно-патогенной микрофлоры [3, 5].
Неудовлетворенность высоким уровнем материнской и перинатальной инфекционной патологии обусловила необходимость комплексного подхода к разработке новых методов коррекции микробиоценоза репродуктивного тракта беременных перед родами.
Цель: оценить влияние пробиотика Вагисан на восстановление микрофлоры репродуктивного тракта беременных перед родами.
Материалы и методы
Нами были обследованы 78 пациенток в сроке беременности от 35 до 37 недель. Обследование включало в себя сбор анамнеза, наблюдение течения беременности, послеродового периода, общеклиническое, бактериологическое и вирусологическое обследование, посев на микрофлору перед исследованием; бактериологическое обследование, посев на микрофлору после исследования. Оценка бактериологического исследования мазков на микрофлору проводилась по классификации Кира. Состояние плода определяли с помощью УЗИ, допплерометрии, кардиотокографии. Состояние новорожденного оценивалось по шкале Апгар сразу после родов и через 5 минут, определялись антропометрические показатели, выполнялся общий анализ крови. По результатам обследования были выделены 53 пациентки с нарушениями микробиоценоза репродуктивного тракта (промежуточный тип и дисбиоз влагалища), который характеризовался дефицитом лактобациллярной микрофлоры и отсутствием признаков воспаления. Пациентки были разделены на 2 группы: 1-я группа (28 пациенток) не получала терапию для коррекции нарушений биоценоза, 2-я группа (25 пациенток) получала пробиотик Вагисан 2 раза в день в течение 2 недель. Группу контроля составили 25 пациенток с нормоценозом репродуктивного тракта по данным бактериологического исследования.
Результаты и обсуждение
Возрастной состав во всех группах — от 21 до 36 лет. Количество повторнобеременных с отягощенным акушерско-гинекологическим анамнезом (хронические воспалительные заболевания гениталий, нарушение менструальной функции, бесплодие, невынашивание, преждевременные роды) в основных и контрольной группах составило 42,8; 48 и 64 % соответственно.
Результаты ультразвуковой фетометрии свидетельствовали о нормальном росте и развитии плодов в 1-й, 2-й и контрольной группах у 24 (85,7 %), 21 (84,0 %) и 23 (92,0 %) женщин соответственно, достоверных различий не выявлено (р < 0,05).
Пациентки всех обследованных нами групп имели различные акушерские осложнения во время настоящей беременности (ранний токсикоз, поздний гестоз, анемия, угроза прерывания беременности). Достоверных различий между показателями в обследуемых группах не выявлено.
Микробный пейзаж родовых путей беременных в 1-й и 2-й группах показал, что дисбиотический характер выявленных изменений заключался в резком угнетении резидентной микрофлоры влагалища и цервикального канала (лактобактерии) на фоне конкурентного замещения представителями факультативной условно-патогенной группы микроорганизмов (табл. 1).
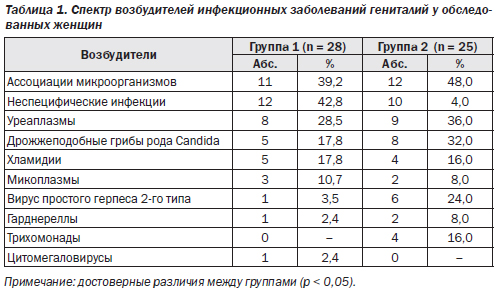
Спектр возбудителей был представлен ассоциациями микроорганизмов или неспецифическими видами инфекции, из моноинфекций чаще всего выявлялись уреаплазмы и дрожжеподобные грибы рода Candida, что свидетельствовало о нарушении микробиоценоза во влагалище и активации условно-патогенной микрофлоры.
Слизистая оболочка влагалища, заселенная множеством микроорганизмов, является местом хрупкого равновесия между местной бактериальной флорой и защитными силами организма. При ослаблении защитных сил организма вследствие чрезмерной пролиферации бактерий или при снижении общей и особенно местной иммунной защиты равновесие нарушается, что способствует развитию очага инфекции во влагалище [2, 3].
При этом отсутствовали признаки воспалительного процесса репродуктивного тракта, что может указывать на наличие компенсаторной стадии иммуносупрессии [4].
Пациентки 2-й группы с целью коррекции и восстановления лактобациллярной микрофлоры получали пробиотик Вагисан в сроке 35–36 недель беременности перорально 2 раза в день в течение 2 недель. Вагисан — пробиотик нового поколения, содержащий штаммы L.rhamnosus GR-1 и L.reuteri RC-14. Именно эти штаммы лактобацилл обладают наибольшей тропностью к эпителиоцитам влагалища.
После завершения терапии через 10–14 дней проведен анализ результатов клинико-микробиологического исследования (мазок из влагалища на степень чистоты и посев на флору). Выявлено, что у беременных, получавших Вагисан, произошло восстановление нормоценоза влагалища (заселение лактобациллами) в 80,0 % случаев. После терапии исчезли гарднереллы, дифтероиды, бактероиды. При бактериологическом исследовании роста микроорганизмов в аэробных и анаэробных условиях не определялось.
Механизмы воздействия могли быть частично связаны с губительным действием бактериоцинов, перекиси водорода и кислот, вырабатываемых GR-1, RC-14. Этот результат совпадает с данными зарубежных исследователей, продемонстрировавших, что Lactobacillus GR-1 может проникать сквозь урогенитальные патогенные биопленки в течение 1 часа, а биологическая поверхностно-активная смесь, выделяемая Lactobacillus RC-14, может подавлять рост и адгезию целого ряда урогенитальных патогенных микроорганизмов, в том числе Escherichia coli [6–8].
В ряде исследований показано, что пробиотические штаммы L.rhamnosus GR-1 и L.reuteri RC-14 при приеме per os колонизируют слизистую репродуктивного тракта ввиду определенных свойств данных видов лактобацилл: выработки поверхностно-активного вещества — биосурфактанта, который способствует связыванию коллагена и лактобацилл на поверхности вагинальных клеток; ингибирования адгезии патогенов урогенитального тракта, E.coli, Enterococcus faecalis, Klebsiella pneumoniae, Staphilococcus epidermidis, Gardnerella vaginalis, Streptococcus B, Candida albicans. Эти лактобациллы способны выживать при низком рН желудочного сока и желчных солей, при прохождении через кишечник, они могут проникать во влагалище без функциональной интервенции [6, 7].
По данным Мак-Крокена, пробиотические бактерии модулируют иммунитет хозяина с усилением неспецифического иммунитета и повышают, усиливая и опосредуя, ответные реакции на конкретные антигены или патогены [8].
Дети в этой группе родились без признаков ВУИ в 88,0 % случаев.
Результаты клинико-микробиологического исследования вагинального содержимого у женщин, не получавших пробиотик Вагисан, характеризовались отсутствием микрофлоры в 64 % случаев.
У обследованных беременных 1-й группы развились осложнения родов в 78,6 % случаев:
1) наиболее часто встречающимся осложнением родового акта (в 46,4 % случаев) в 1-й группе было преждевременное излитие околоплодных вод. Это согласуется с результатами исследований Schwartz и соавт., которые считают, что трансмуральный некроз плодных оболочек и воспалительные изменения в них вследствие наличия инфекции у женщины способствуют разрыву плодного пузыря и преждевременному излитию околоплодных вод;
2) мекониальный цвет вод, характеризующий гипоксию плода (10,7%);
3) аномалии родовой деятельности (53,6 %), из них слабость родовой деятельности наблюдалась в 21,4 % случаев;
4) травматизм мягких тканей родовых путей (46,4 %).
Безводный промежуток более 12 часов зафиксирован у 3 пациенток (10,7 %) из 1-й группы и 1 пациентки (4,0 %) из 2-й группы. Наличие длительного безводного промежутка является отягощающим фактором гнойно-септических осложнений матери и новорожденного, что подтверждается данными исследований.
В 1-й группе родились 60,7 % новорожденных с признаками гнойно-септических заболеваний.

Для выяснения наиболее значимых проявлений гнойно-септических заболеваний новорожденных был проведен корреляционный анализ клинических синдромов (рис. 1). При проведении корреляционного анализа клинических синдромов ВУИ новорожденных выявлено, что доминирующими проявлениями являются неврологические нарушения различной степени (сильная положительная корреляционная связь, р < 0,01), значимым проявлением ВУИ — внутриутробная интоксикация (положительная средняя корреляционная связь, р < 0,01) и оценка по Апгар в родовом зале (отрицательная средняя корреляционная связь, р < 0,01). Менее значимыми проявлениями ВУИ новорожденных являются заболевания легких и желудочно-кишечного тракта — средняя положительная корреляционная связь.
Выводы
Таким образом, проведенный анализ свидетельствует о благоприятном влиянии препарата Вагисан на восстановление физиологических параметров биоценоза влагалища. Применение пробиотика Вагисан в терапии нарушений микробиоценоза репродуктивного тракта беременных перед родами является достаточно эффективным (78,5 %), при его использовании быстро восстанавливается лактобациллярная микрофлора, препятствующая восхождению патогенов из оболочки прямой кишки во влагалище и укрепляющая неспецифический иммунитет, что делает окружающую среду менее чувствительной к организмам дисбиоза репродуктивного тракта. Препарат не оказывает отрицательного влияния на состояние беременной и плода. Учитывая наши данные, можно сказать, что Вагисан — уникальный пробиотик, восстанавливающий микрофлору кишечника и влагалища одновременно, не нанося вреда другим органам и системам, в связи с чем данный препарат целесообразно включать в комплекс коррекции репродуктивного тракта беременных перед родами.
1. Агаронян Н.Г., Орджоникидзе Н.В. Анализ акушерских и перинатальных исходов при внутриутробной инфекции // Материалы 1-го Международного семинара «Инфекции в акушерстве и перинатологии». Москва, апрель
2. Алиханова З.М., Каллаева А.Х. Пробиотики в комплексном лечении бактериальных кольпитов в период гестации // Материалы 1-го Международного семинара «Инфекции в акушерстве и перинатологии». Москва, апрель
3. Канайкин Д.П., Баскаков А.В., Крылов А.В. и др. Влияние адаптационного стресса на характер защитных реакций // Мед. иммунология. — 2001. — Т. 3, № 2. — С. 125.
4. Полетаев А.Б., Будыкина Т.С., Морозов С.Г., Абросимова А.А. Инфекция матери как причина патологии плода и новорожденного (профилактика нарушений с точки зрения иммунолога) // Аллергология и иммунология. — 2001. — Т. 2, № 1. — С. 110-116.
5. Тареева Т.Г. Перинатальные аспекты смешанной урогенитальной инфекции (патогенез, прогнозирование, профилактика): Дис... д-ра мед. наук. — М., 2000. — 34 с.
6. Reid G., Devillard E. Probiotics for mother and child // J. Clin. Gastroenterol. — 2004. — 38 (Suppl.). — 94-101.
7. Morelli L., Zonenenschain D., Del Piano M. et al. Utilization of the intestinal tract as a delivery system for urogenital probiotics // J. Clin. Gastroenterol. — 2004. — 38 (Suppl. 6). — 107-110.
8. Reid G., Hammond J.-A., Bruce A. W. et al. Effect of lactobacilli oral supplement on the vaginal microflora of antibiotic treated patients: randomized, placebo-controlled study // Nutraceut. Food. — 2003. — 8. — 145-148.
