Газета «Новости медицины и фармации» Акушерство, гинекология, репродуктология (317) 2010 (тематический номер)
Вернуться к номеру
Статеве дозрівання й підліткова вагітність
Авторы: Тереза О. Скролл. Кафедра акушерства й гінекології Університету медицини та стоматології Нью-Джерсі, Стратфорд (штат Нью-Джерсі)
Версия для печати
І. Вступ
Статеве дозрівання — це період життя, що характеризується досягненням зрілості гіпоталамічно-гіпофізарно-гонадної системи, прискореним фізичним зростанням і формуванням вторинних статевих ознак. Основний механізм, який зумовлює ці зміни, невідомий. Однак фізичні зміни є частиною складного змінювання, що відбувається в організмі. Завдяки бурхливому розвитку змінюються розмір і форма майже кожного тілесного параметру — обличчя стає більшим і помітно змінюється, серце, легені, внутрішні органи і репродуктивний шлях зростають за розміром, масою та об''ємом. Кістяк (довгі кістки, хребет), мускулатура, а в жінок жирова маса також збільшуються. Нарешті, дівчинка трансформується фізично у дорослу жінку за розміром, формою й складом свого тіла, зі зрілими вторинними статевими ознаками, і вона може стати сексуально активною й здатною до розмноження. Вік, у якому розпочинається бурхливе зростання, формуються груди (thelarche), вперше з''являється лобкове волосся (pubarche) і починається перша менструація (mеnarche), варіює майже на третину терміну препубертатного життя дівчинки.
II. Бурхливе статеве дозрівання
Бурхливе зростання, що відбувається протягом статевого дозрівання, заторкує всі кістякові й м''язові компоненти і, за невеликим винятком, наприклад мозку й вилочної залози, майже кожен інший орган і систему тіла [11]. Протягом пубертатного, або підліткового періоду бурхливого розвитку маса тіла зростає приблизно такими самими темпами, як і на ранній стадії розвитку та в дитинстві, тоді як збільшення росту (ступінь приросту висоти) є дещо повільнішим. За певними оцінками, підліткове лінійне зростання становить 15–20 % росту дорослого; наростання маси та об''єму кістяка — 50 % дорослої кістякової маси, а приріст маси тіла відповідає приблизно 50 % ідеальної дорослої ваги [1, 2].
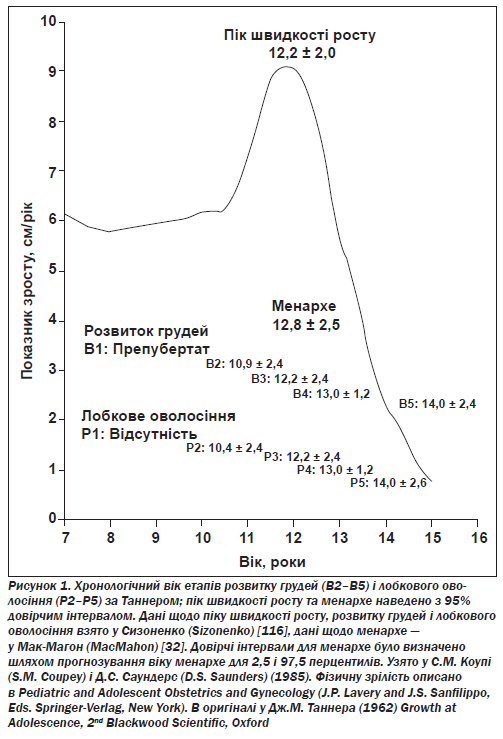
У підлітковому віці швидкі зміни в темпі зростання відбуваються в різний час у когортах осіб того самого віку, статі та етнічної приналежності. На відміну від інших періодів життя, підліткові роки позначені швидким прискоренням темпів росту (швидкість зростання) аж до досягнення максимуму (пікова швидкість збільшення росту). Досягнення пікової швидкості збільшення росту супроводжується уповільненням темпу зростання (гальмуванням) допоки, врешті-решт, не буде досягнуто зрілості, і тоді зростання припиняється (рис. 1) [32].
III. Лінійне зростання
У середньому бурхливе лінійне зростання в дівчат порівняно з хлопчиками менш інтенсивне і відбувається приблизно двома роками раніше [1]. Початок бурхливого збільшення висоти (вік зльоту) відзначається різким прискоренням швидкості збільшення росту. У здорової дівчинки з Європи та Сполучених Штатів, яка добре харчується, це відбувається раніше (середній вік 8,5–10,3 року), аніж це буває загалом, і розмах показників досить широкий (6–13 років) [3]. Пік бурхливого збільшення висоти припадає на вік ближче до дванадцяти років (10–14 років), у середньому приблизно на 8 см у рік (5–10 см/рік); лінійне зростання уповільнюється приблизно через два роки після того, як досягнуто піку бурхливого збільшення висоти [1, 3] (рис. 1).
Насправді, лінійне зростання — це комбінація змін довжин сегментів тіла і кістяку, кожна з яких має свою пікову швидкість, що є внеском до пікової швидкості збільшення росту, але може з нею і не збігатися в часі. Якщо вимірювати точними інтервалами, зростання не є безупинним процесом, а відзначається періодами застою (жодного зростання) і стрибку (швидке зростання), і тривалість та визначення кожного з них є дискусійними питаннями [4–6]
Бурхливе зростання прямує знизу нагору від стоп і захоплює спочатку нижні кінцівки. У кінцівках дистальне зростання передує проксимальному; наприклад, зростання долонь передує розвиткові передпліччя, а передпліччя передує розвиткові верхньої частини руки. Збільшення довжини ноги передує зростанню тулуба (вимірюється як висота при сидінні). Швидке досягнення максимальної ширини плечей і стегон відбуваються приблизно одночасно зі збільшенням висоти при сидінні. Розмір гомілки збільшується довше, ніж будь-який інший параметр, окрім росту хребетного стовпа [7]. Отже, дівчинка на початку статевого дозрівання матиме відносно довгі ноги з коротким тулубом, але врешті-решт тулуб відіграє важливу роль у її підлітковому зростанні.
Завершальна стадія розвитку тіла відбувається наприкінці підліткового бурхливого зростання після того, як наступає перша менструація (рис. 1). Лінійне зростання триває і після початку першої менструації, хоча й уповільнюється. Роше (Roche) і Девіла (Davila) [8] визначили 17,3 року як середній вік досягнення висоти дорослої людини, тобто 50 % молодих дівчат у їхньому дослідженні продовжували рости і після того. До 21 року кількість тих, хто ще росте, становить 10 %. Середній приріст висоти в період між першою менструацією і віком, коли ріст уже припинився, сягає 7,4 см (10-й процентиль 4,3 см, 90-й процентиль 10,7 см) у їхній вибірці. Фріш (Frisch) [9], Берклі (Berkley) і колеги [10] та Закаріас (Zacharias) і Ренд (Rand) [11] виявили такий самий приріст росту після початку першої менструації.
Чутливі системи вимірювання (прилад вимірювання висоти коліна) показують, що приблизно 50 % дівчат-підлітків продовжують рости ще шість років після початку першої менструації [12]. Більш традиційні системи вимірювання засвідчують сумірність збільшення росту й висоти при сидінні у молодих пуерторіканок і білих жінок, але менше лінійне зростання у темношкірих дівчат [12].
Пізнє підліткове зростання тулуба (зростання хребетного стовпа) триває в молодих дівчат навіть після досягнення кістякової зрілості (епіфізарне замикання кисті й зап''ястка) і становить у середньому 2,3 см після віку кістяка у 18 років (зрілість кістяка визначена за методом Грьоліха — Пайла (Greulich — Pyle)) [13]. Розвиток органів малого тазу триває впродовж пізнього підліткового періоду. У період початку першої менструації таз маленький і менш зрілий порівняно зі статурою, оскільки ще не досяг своїх дорослих розмірів. Після початку першої менструації зростання тулуба уповільнюється, а таз продовжує збільшуватися за розміром [14].
IV. Формування тіла
Маса тіла взагалі досягає максимуму швидкості зростання у рік пікової швидкості збільшення росту. Бурхливе зростання маси тіла, що у жінок досягає найвищого приросту у 7–9 кг на рік, за класичними дослідженнями Таннера (Tanner), включає збільшення кістякової тканини, сформованої у процесі збільшення висоти, збільшення ваги внутрішніх органів та набір м''язової і жирової маси [1, 3]. Жирова маса збільшується в дитинстві й упродовж підліткового віку як у хлопчиків, так і в дівчаток, однак статева відмінність в огрядності з''являється приблизно у період статевого дозрівання. Жирова маса в осіб жіночої статі швидко збільшується в пізньому дитинстві й упродовж усього пубертатного періоду приблизно вдвічі швидше, ніж в осіб чоловічої статі. У період максимального зростання особи жіночої статі набирають приблизно 2,8 кг жиру (1,4 кг/рік) порівняно з 1,5 кг (0,7 кг/рік) в осіб чоловічої статі [15]. До пізнього підліткового віку жирова маса в дівчат приблизно удвічі перевищує жирову масу в хлопців.
З іншого боку, хлопці в підлітковому віці переживають бурхливе зростання вільної від жиру маси приблизно удвічі більшої (14,3 кг вільної від жиру маси, що становить 7,2 кг/рік), ніж у дівчат (7,1 кг, що становить 3,5 кг/рік), що свідчить про ще одну статеву відмінність у підлітковому віці [1, 3]. Оскільки жирова маса швидше збільшується у дівчат-підлітків, а вільна від жиру маса — у хлопців-підлітків, жир становить значну частину маси тіла осіб жіночої статі (відсоток жирової маси тіла) порівняно з особами чоловічої статі; це також називається відносним ожирінням. У період пікової швидкості збільшення росту відносна жирова маса збільшується приблизно на 0,9 % на рік в осіб жіночої статі, тоді як в осіб чоловічої статі вона зменшується на 0,5 % на рік [3, 15]. Зміни у жировій масі також відбиваються на складках шкіри (підшкірний жир), що збільшуються в осіб жіночої статі і зменшуються в осіб чоловічої статі під час статевого дозрівання й бурхливого лінійного зростання [15].
У молодих дівчат відбуваються суттєві зміни у відкладанні жиру (внутрішнього проти підшкірного) та у розміщенні підшкірних жирових запасів (складки шкіри тулуба проти складок шкіри кінцівок), тільки-но сповільниться лінійне зростання. Зміни в співвідношенні підшкірного жиру до загальної жирової маси (підшкірний жир плюс внутрішній) свідчать про те, що жир накопичується при наближенні першої менструації, і більш за все накопичується жир внутрішній, аніж підшкірний [15]. У період початку першої менструації і після цього змінюється розміщення жирових запасів на тілі, пропорційно більше підшкірного жиру накопичується на тулубі порівняно з кінцівками [15]. Після першої менструації дівчата продовжують накопичувати жирову масу, як підшкірну, так і загальну. Огрядні дівчата є зразком розташування жирової маси в центральній частині тіла з відкладеннями, локалізованими насамперед на тулубі (верхня частина спини) [16]. Однак навіть при нормальній масі тіла під час статевого дозрівання протягом підліткового віку на тулубі накопичується більше жиру, ніж на кінцівках [17]. Надмірний приріст ваги в пізньому підлітковому віці змінює нормальний зразок підшкірного жирового накопичення, що приводить до більшого приросту жирових запасів у центральній частині тіла (тулубі) [17].
V. Біологічне дозрівання
Хоча події пубертатного періоду взаємопов''язані й відбуваються з достатньо однорідною послідовністю, хронологічний вік не є найкращим показником того, коли ці зміни почнуться або закінчаться. Дванадцятирічна дівчинка, наприклад, може бути статево незрілою та зовні дитиноподібною на початку свого бурхливого зростання, мати малорозвинені груди і лобкове волосся, або в неї можуть сформуватися дорослі вторинні статеві ознаки, початися менструація, і вона може бути майже цілком розвиненою. Отже, події пубертатного періоду в підлітковому віці краще характеризуються поняттям біологічного дозрівання.
А. Показники
Кілька показників використовуються для позначення прогресування біологічної зрілості й розвитку від дитини до дорослої особи. Вимірювання на основі розвитку вторинних статевих ознак і першої менструації найкорисніші у період статевої зрілості, тоді як за кістяковим, або кістковим віком можна оцінювати біологічну зрілість особи від раннього дитинства до підліткового віку. Оцінка кістякового віку однак є технічно складною процедурою, що потребує рентгенівських знімків кисті й зап''ястка. Статеве дозрівання можна визначити оглядом або з власного повідомлення; вік початку першої менструації можна отримати проспективно (у лонгітюдних серіях), ретроспективно або методом статус-кво (так/ні) серед досліджуваної сукупності.
1. Кістяковий вік
Кістяковий вік — це вимір ступеня розвитку кістяка. Традиційно цей вік визначають по кисті й зап''ястку (ліва сторона), яку вибирають через велику кількість кісток (N = 30) та епіфізів (N = 21), представлених кінцівкою, яка досить мала, щоб її можна було повністю побачити на рентгенівському знімку, ефективно закривши решту тіла, та ще досить мінлива, щоб надати інформацію щодо статусу всього кістяка [1]. Зрілість інших кістякових елементів (коліна, стегна, ліктя, стопи й плеча) визначають, але рідко використовують.
Кістки кисті та зап''ястка розвиваються від хряща до кістки через центри окостеніння. Окостеніння діафізу (стрижня) довгих кісток (ліктьової кістки й променевої) і коротких (п''ястка і фаланги) руки й зап''ястка майже завершується в утробі матері. Окостеніння епіфізу довгих кісток руки, зап''ястка та п''ястка або круглих кісток руки (голівчастої, кривої тригранної, півмісяцеподібної, кістки-трапеції, трапецієподібної сесамоїдної і горохоподібної) відбувається відразу по народженні або перед самим народженням. Кістки п''ястка збільшуються та зміна відбувається унікально для кожної кістки таким чином, що хрящ костеніє і набуває дорослої форми та контуру. Довгі й короткі кістки також характерно змінюються в своїх епіфізах і у відповідних діафізах тільки-но завершується наближення до замикання пластинки росту. У дорослому віці епіфіз та діафіз зливаються.
Кістки того чи іншого індивіда мають специфічні стадії розвитку, що відбуваються в передбачуваній послідовності. Ці стадії є основою для оцінки кістякового, або кісткового віку методом загальної оцінки (методом Грьоліха — Пайла) [18], що визначає статус цілої кисті й зап''ястка. За допомогою специфічного кісткового методу оцінки (метод Таннера — Вайтхауза (Tanner — Whitehousе) [19] досліджують і ранжирують за ступенем зрілості 20 визначених кісток кисті й зап''ястка та визначають кінцевий ступінь зрілості кожної із них (що позначається у балах за шкалою) за специфічними індикаторами зрілості кісток. Третій метод, що використовується для популяційних досліджень, включає визначення віку, в якому центри окостеніння кисті й зап''ястка вперше стають рентгенологічно видимими [20].
І метод Грьоліха — Пайла, і метод Таннера — Вайтхауза за кістяковим віком визначають хронологічний вік суб''єкта і його стать. При народженні кістяк дівчаток на кілька тижнів зріліший, ніж у хлопчиків; ця різниця впродовж дитинства досягає кількох місяців. У період статевого дозрівання дівчатка випереджають хлопчиків приблизно на два роки [1]; отже, у середньому підліток-дівчинка переживає пубертатні зміни раніше за часом. Вважається, що дівчина з кістяковим віком 12,5 року, а хронологічним віком 11 років має випереджуючий кістяковий розвиток, або рано дорослішає, тоді як у протилежному випадку (кістяковий вік 11 років, а хронологічний — 12,5) вважається, що вона запізнюється у кістяковому розвитку, або дорослішає пізно. Дівчина, яка має різницю кістякового віку й хронологічного віку в межах одного року (кістяковий вік 11,5 і хронологічний — 12), вважається такою, що має середню швидкість дорослішання з кістяковим віком, що хронологічно більш-менш є такий «як треба».
2. Вторинні статеві ознаки
Однією з перших ознак наближення статевої зрілості дитиноподібної дівчинки без грудей (стадія В1 за Таннером) чи без лобкового волосся (стадія Р1 за Таннером) є розвиток грудей (стадія В2 за Таннером), що супроводжується збільшенням діаметра ареоли навколо соска (рис. 2).
.jpg)
Груди й ареола продовжують збільшуватися, але ще не виокремлюються (стадія В3 за Таннером). Пізніше ареола й сосок випинатимуться над рівнем грудей (стадія В4 за Таннером). Коли груди стають дорослими, випинається лише сосок (стадія В5 за Таннером).
Аналогічно на малих статевих губах з''являється розсип тонкого лобкового волосся (стадія Р2 за Таннером) (рис. 3). Згодом лобкове волосся грубішає, темнішає, стає більш дротоподібним (стадія Р3 за Таннером) і формується в перевернутий трикутник, що охоплює промежину й венерин горбок (стадія Р4 за Таннером). Зрештою воно поширюється до стегон, як у дорослих (стадія Р5 за Таннером).

Розвиток грудей і ріст лобкового волосся, хоча й збігаються у часі, фактично не залежать одне від одного. У стадії В3, наприклад, багато з елементів розвиваються як і в стадії Р3 (33 %), інші — як у стадії Р1 (22 %), Р2 (28 %), Р4 (16 %) або Р5 (1 %) [21]. Так само сукупні дані опитування британських і швейцарських учасників лонгітюдних досліджень [3] демонструють, що у наймолодших дівчат перша менструація починається у стадіях В4 і Р4. Утім інші стадії розвитку грудей від В2 до В5 і стадії росту лобкового волосся від Р1 до Р5 також мають місце в період початку першої менструації [3].
Початок розвитку грудей при статевому дозріванні супроводжується збільшенням матки за довжиною, загальним діаметром і товщиною ендометрію. Збільшення дна матки випереджає ріст шийки, тим самим завершується оформлення органа у вигляді груші, що свідчить про початок статевого дозрівання та його розвиток [22].
Дані щодо статевої зрілості можна здобути фізичним оглядом або застосовуючи опитування підлітків через самозаповнення ними анкет. Дюк і колеги [23] повідомили про прийнятний рівень узгодженості між отриманими самим дослідником і через анкетування учасниць (43 білих дівчини-підлітки) оцінками стосовно стадій розвитку молочних залоз (каппа = 0,81) і лобкового волосся (каппа = 0,91). Найнштейн [24], досліджуючи ступінь вірогідності самооцінювання певних ознак у невеликій вибірці (22 дівчини-підлітки, серед яких були білі, темношкірі й іспаномовні), установлює, що узгодженість між оцінками самих дівчат і лікаря-педіатра стосовно точного визначення стадій розвитку молочних залоз і лобкового волосся становила відповідно 77 % (r = 0,87) і 73 % (r = 0,86); це співвідношення практично збігалося серед представниць різних расово-етнічних груп. Ці дослідження (обидва проведені на базі малих вибірок) дають підстави для висновку, що старші підлітки здатні досить точно оцінювати ступінь розвитку своїх вторинних статевих ознак. Однак питання потребує подальшого вивчення, особливо щодо етнічних меншин і молодших підлітків.
Перша менструація сигналізує про те, що в дівчини вже сформувалася репродуктивна здатність, і являє собою найкращий показник досягнення статевої зрілості [20]. Вік настання менархе (хоча він не настільки точно визначає хід процесу дозрівання, як максимальна швидкість росту, кістяковий вік чи стадії пубертатного розвитку) — єдиний індикатор, що не потребує проведення обстежень або лонгітудинального спостереження протягом усього підліткового періоду, і до того ж уможливлює ретроспективний збір вірогідних даних.
Бергстен-Брюсфорс [25] повідомляє про досить високу кореляцію (r = 0,81) між згаданими через чотири роки після менархе й зареєстрованими в медичній документації датами першої менструації у вибірці шведських дівчат (N = 339). Загалом 63 % респонденток змогли пригадати дату цієї події із точністю плюс-мінус три місяці. Аналогічно 59 % респонденток зі 101 дівчини (у складі когорти загальною чисельністю N = 567), в яких уже була перша менструація, назвали точну повну дату під час третього з щорічних контактів (середня тривалість інтервалу між подією й моментом пригадування становила 430 днів) [26].
Вік, в якому з''явилася перша менструація, може бути вірогідно пригаданий навіть десятиліття потому, хоча точної дати жінка зазвичай не пам''ятає. Деймон і Байєма [27], установивши повторний контакт із жінками, в яких вік настання менархе був зареєстрований 39 років тому, виявили, що 86 % респонденток змогли пригадати цей показник з точністю плюс-мінус один рік відносно фактичного віку. Через 34 роки 56 % зі 160 жінок, спостережуваних у рамках дослідження з вивчення менструального й репродуктивного аналізу, точно відтворили надану ними раніше відповідь щодо віку на момент менархе, а якщо враховувати й тих, хто помилився не більш ніж на рік, цей показник загалом сягає 90 %. Середній вік на момент менархе, обчислений на основі пригадування (12,67 ± 1,10 року), практично не відрізнявся від проспективно визначеного показника (12,68 ± 0,09 року). Порівняння згаданого 50-річними учасницями лонгітудинального дослідження (N = 91) і проспективно визначеного віку на момент менархе виявило значну кореляцію (r = 0,67); 84 % респонденток продемонстрували здатність пригадати це з точністю до одного року відносно фактичного віку. Конче потрібні дані щодо згадування першої менструації у представниць етнічних меншин, які можуть сприймати цю подію в зовсім іншому культуральному контексті.
Як і щодо кістякового віку, прийнятим є розподіл за віком, в якому з''являється перша менструація, на три групи, що відповідають ранньому (менархе в віці до 12 років), середньому (12,0–13,9 року) і пізньому (14 років або пізніше) статевому дозріванню [1]. Такий розподіл базується на середньому віці настання менархе в США та в Європі. У дівчат із раннім варіантом статевого дозрівання, класифікованих як такі на підставі віку при менархе, постійно спостерігаються також підвищений (порівняно з хронологічним) кістяковий вік протягом пубертатного періоду, а також прискорене проходження всіх стадій розвитку молочних залоз і оволосіння лобка [1, 3]. Досить добре описано взаємозв''язок між віком настання менархе й максимальною швидкістю росту. У разі раннього варіанта статевого дозрівання (перша менструація в віці до 12 років) швидкість росту досягає пікового показника приблизно за 8 місяців до менархе (десь у віці 10,3 року), у випадку середнього варіанта (перша менструація у 12,0–13,9 року) — приблизно роком пізніше (у віці 11,5 року), а в дівчат із пізнім варіантом дозрівання (менархе в 14 років або пізніше) — найпізніше від усіх [1, 3]. Крім того, для дівчат із раннім варіантом статевого дозрівання характерні різкіше підвищення інтенсивності росту й значніше збільшення зросту в період після менархе [1].
Кореляції між кістяковим віком, статевим дозріванням і віком настання менархе позитивні й перебувають у межах від 0,6 до 0,9. Це означає, що дівчина-підліток, яка демонструє підвищений рівень розвитку за одним із цих показників, найчастіше виявляється настільки ж розвинутою й за іншими. Взаємокореляції посилюються в міру прогресування пубертатних процесів, і якійсь глибинний фактор (неідентифікований, але найімовірніше гормональний) диференціює підлітків із ранніми, середніми й пізніми термінами настання подій, що відбивають хід статевого дозрівання. Однак якого-небудь одного індикатора, що сам по собі давав би змогу повністю охарактеризувати темпи статевого дозрівання в підлітковому віці, немає.
Вторинні статеві ознаки можна використовувати в комбінації із віком початку першої менструації, щоб визначити часові характеристики статевого дозрівання [30]. Стадія В2 за Таннером (набрякання грудей) часто є першою ознакою статевого дозрівання в осіб жіночої статі й приблизно один рік передує досягненню пікової швидкості збільшення зросту (рис. 1). Кореляція між віком досягнення пікової швидкості збільшення зросту та віком початку першої менструації є від помірної до високої (r = 0,7–0,9). У середньому перша менструація починається через 1,3 року після досягнення пікової швидкості збільшення зросту (діапазон 0,01–2,5 року) у дівчат із середнім варіантом статевого дозрівання. Кількість дівчат, у яких менструація почалася до досягнення пікової швидкості збільшення зросту, оцінена менш як один відсоток [3, 31].
Перша менструація звичайно починається наприкінці бурхливого зростання трохи більше року після того, як досягнуто пікової швидкості збільшення зросту [1] (рис. 1). Молоді жінки, які мали першу менструацію у віці 12,8 року, віці, середньому для Сполучених Штатів [32], імовірно, досягли пікової швидкості збільшення зросту приблизно у віці 11,5 року. Дівчинка, яка не досягла у своєму розвитку стадії В2 і яка не має менструації, є незрілою в статевому відношенні, і у неї ще не розпочався пубертатний період бурхливого лінійного збільшення зросту. Та дівчинка, яка досягла стадії В2 (принаймні), але ще не має менструації, вірогідно наближається до своєї пікової швидкості збільшення зросту. Молода дівчина, яка досягла стадії В2 (або вищої) і має менструації, імовірно вже досягла своєї пікової швидкості збільшення зросту та завершила більшу частину свого підліткового бурхливого розвитку [30].
Б. Фактори, що впливають на біологічне дозрівання
1. Етнічна приналежність
Існують суттєві етнічні відмінності в біологічному дозріванні в дівчат, включаючи кістяковий вік, статеве дозрівання та вік початку першої менструації. У молодих темношкірих дівчат із Сполучених Штатів менструації у середньому починаються раніше, ніж у білих. Так, у білих дівчаток у Північній Америці та Європі перша менструація починається в середньому у віці 12,8–13,2 року (розмах від 9 до 16 років), тоді як у темношкірих дівчаток у Сполучених Штатах середній вік початку першої менструації становить 12,5 року [1, 3, 32]. Це відповідає приблизно вдвічі збільшеній імовірності ранньої менструації (у віці молодше 12 років), якщо порівнювати темношкірих (21,3 %) і білих (11,6 %) дівчат [32]. В африканських дівчаток, які проживають у Африці, менструація починається відносно пізно (у середньому в 13–13,4 року), навіть якщо вони проживають у гарних умовах [20]. Таке явище, як кістякове окостеніння, хоча є прискореним у африканських дітей при народженні [1], зустрічається рідше у тому середовищі.
Отримано небагато надійних даних щодо груп латиноамериканського походження в Сполучених Штатах, але в кубинських дівчаток, за даними національної статистики з Куби, середній вік початку першої менструації становить 12,9 року, так само як у американських білих дівчат [33]. В єдиному опублікованому дослідженні зазначено, що середній вік початку першої менструації у пуерто-ріканських дівчаток близький до віку темношкірих дівчаток із тієї самої вибірки [34]. Згідно з Евелетом (Eveleth) і Таннером [20], у заможних аргентинських, бразильських, чилійських і венесуельських дівчаток європейського походження перша менструація в середньому розпочинається раніше (12,0–12,6 року). У мексиканських сільських дівчаток зі штату Оаксака (Оахаса) менструація починається пізно (середній вік 14,3 року), тоді як у мешканок міст або дівчаток середнього класу з Мехіко цей вік збігається з віком білих американських і європейських дівчат (середній вік 12,3–12,8 року). Хоча оцінка, ймовірно, помилково збільшена через часткове виключення дівчат із раннім варіантом статевого дозрівання, американські дівчатка мексиканського походження, включені до іспаномовного NHANES (Національне дослідження здоров''я та харчування), досягли стадії В4 за Таннером (стадія розвитку грудей, коли в багатьох дівчат починається менструація) в середньому віці 13,8 року [35]. На відміну від цього, американські дівчатка мексиканського походження, яких включили у дослідження харчування у десяти штатах, мали першу менструацію в середньому у віці 12,7 року [3].
У дівчаток азійського походження, які живуть у Каліфорнії, перша менструація починається в середньому у віці 13,2 року [20], тоді як у японських дівчаток — жительок Бразилії — трохи раніше (у середньому в 12,9 року) [20]. Дівчатка з заможних сімей із Гонконгу та Сінгапуру починають менструювати кількома місяцями раніше (середній вік початку першої менструації 12,4–12,7 року). Найпізніший зареєстрований вік початку першої менструації мали дівчата з племені Бунді (Bundi), які живуть в горах у Новій Гвінеї (у середньому в 18 років) [20].
Етнічна відмінність віку початку першої менструації між білими і темношкірими дівчатами із Сполучених Штатів відбивається на двох корельованих між собою подіях — прискореному кістяковому окостенінні та більш ранньому розвитку вторинних статевих ознак. У темношкірих американських дітей раніше з''являються центри окостеніння кисті й зап''ястка — у перший рік життя й аж до семи років [36, 37]. Прискорений розвиток кістяка спостерігається в темношкірих дітей обох статей. Однак це прискорення більш притаманне жіночій статі, аніж чоловічій; темношкірі дівчатка випереджають білих більш як на 0,5 стандартного відхилення (SDU) незважаючи на нижчий соціально-економічний статус. Роч (Roche) [38] повідомив, що середній кістяковий вік (за методом Грьоліха — Пайла) темношкірих дівчаток віком 6–11 років звичайно перевищує їхній хронологічний вік, так само вони випереджають у розвитку білих дівчаток. За винятком восьмирічного віку, в якому немає жодної відмінності, прогресування в кістяковому віці коливається від +0,7 місяця до +2,7 місяця для темношкірих дівчаток упродовж досліджуваного вікового інтервалу.
Розбіжності в часі появи вторинних статевих ознак також свідчать про передчасне дозрівання темношкірих дівчат. Гарлан (Harlan) і колеги [39] порівнювали стадії розвитку грудей і лобкового волосся за Таннером у білих і темношкірих дівчаток віком 12–17 років, включених у дослідження NHANES III. Оскільки дівчатка молодше 12 років не включалися до дослідження, інформація щодо стадій Таннера 4 і 5 є найзначущішою для етнічного порівняння. Наприклад, у хронологічному віці 12 років менше білих дівчаток (14,2 %) мали розвинені груди (стадія В5 за Таннером) порівняно з темношкірими дівчатками (30,5 %). Це також стосується й лобкового волосся; кількість дівчат із дорослим типом оволосіння (стадія Р5 за Таннером) серед темношкірих (28,2 %) була утричі більшою порівняно з білими дівчатами (9,2 %).
Герман-Гідденс (Hermann-Giddens) та колеги [40] надали відомості щодо більш як 17 000 дівчаток віком від 3 до 12 років, узяті з даних педіатричних клінік у 34 штатах і Пуерто-Рико. Підтверджуючи попередні повідомлення [41, 42], темношкірі дівчатка (порівняно з білими) мали більш розвинені груди або лобкове волосся (стадія 2 за Таннером) у кожному інтервалі хронологічного віку. У віці семи років, типовому віці для першого класу школи, спостерігалася трикратна різниця в кількості представниць кожної етнічної групи щодо стадії В2 або вище за Таннером (5 % білих і 15,4 % темношкірих дівчаток). У 8 років їхня кількість збільшилася до 10,5 % серед білих і 37,8 % серед темношкірих дівчаток. Етнічні розбіжності серед дівчаток на стадії Р2 (чи вище) за Таннером були також істотні й збігалися з раннім статевим дозріванням темношкірих дівчаток. Середній вік початку першої менструації, визначений за допомогою методу статус-кво (так/ні) і пробіт-аналізу (probit analysis), був очікуваним віком (12,88 року) для білих дівчаток, але ранішим за очікуваний (12,16 року) для темношкірих.
Ці дані були отримані під час прийому в кабінетах лікарів, а тому виникало питання, чи не привели цих дітей, особливо темношкірих, на огляд самі батьки, занепокоєні їхнім передчасним статевим розвитком. Крім того, дослідження обмежувалося лише дівчатками рано і своєчасно розвиненими, тобто в нього не включали тих, хто мав пізній варіант статевого розвитку (тих, у яких менструація почалася після 12 років). Приблизно у 27 % білих дівчаток і 26 % темношкірих перша менструація мала б початися в період між 13 і 17 роками [32]. Виключення цих осіб мало додатковий ефект помилкового зменшення середнього віку, у якому фізичний розвиток досягає стадій 2 і 3 за Таннером, так само як і середнього віку початку першої менструації.
2. Харчування й маса тіла
Уже давно спостерігається прискорення дитячого розвитку, що супроводжується швидким біологічним дозріванням і зменшенням віку початку першої менструації. У Європі упродовж минулих 150 років вік початку першої менструації зменшувався на період до трьох місяців на кожні десять років. Дані зі Сполучених Штатів також свідчать про поступове зменшення віку початку першої менструації, що є трохи меншим (приблизно два місяці на кожні десять років), а саме з 14,7 року наприкінці XIX сторіччя до 12,8 року наприкінці XX сторіччя [20, 43]. Точаться дискусії навколо питання, чи триватиме така тенденція в розвиненому світі й надалі. Відомо навіть про випадки зворотної тенденції у періоди депривації, наприклад у Німеччині після Першої світової війни [44]. Тривалі зміни в харчуванні й охороні здоров''я, на нашу думку, є причинами змін, що спостерігаються протягом сторіччя, оскільки ця тенденція розвивається одночасно з удосконаленням санітарно-гігієнічних умов, із задоволенням потреб у продуктах харчування й медичних послугах і зменшенням поширеності дитячих інфекційних хвороб та клінічних проявів розладів, спричинених поганим харчуванням, таких як цинга й пелагра [43, 44].
Гіпотеза щодо ролі харчування в тривалих змінах розглядає в основному вплив на розміри тіла і його склад. Рання перша менструація пов''язана зі збільшенням маси тіла та ожирінням [1]. Фріш (Frisch) вважає, що «критична маса тіла» є пусковим механізмом першої менструації [45]. У результаті прискореного росту діти досягають «критичної маси тіла» в ранньому хронологічному віці. Нині мало хто підтримує гіпотезу, що «маса тіла» або «жир» причинно пов''язані з першою менструацією. Однак причина, імовірно, певною мірою корелює з пубертатним розвитком, масою та складом тіла. Наприклад, у дівчат із регіонів, де хронічне недоїдання є ендемічним, спостерігаються зменшення маси тіла й зниження росту, перша менструація у них починається відносно пізно. У маленьких єгипетських селах середній вік початку першої менструації — 13,9 року, а в Індії (Гіпердабаді) (Hyperdabad) бідні сільські дівчатка починають менструювати в середньому в віці 14,6 року [20]. Дані щодо дівчаток зі штату Алабама, які погано харчуються, свідчать про те, що кістякове дозрівання й вік епіфізарного злиття довгих кісток у них запізнювалися порівняно з дівчатками з контрольної групи, які харчувалися добре [46]. Перша менструація в них починалася 24 місяцями пізніше (14,4 року) порівняно з дівчатками, які харчувалися добре (12,4 року). Оскільки й зростання, і біологічне дозрівання в них так само запізнювалися, недоїдання істотно не впливало на зріст у дорослому віці (менше 1 см). Барбадоські дівчатка, які споживали продукти бідні на протеїни або погано харчувалися в перший рік свого життя, мали затримку в появі вторинних статевих ознак (як грудей, так і лобкового волосся), що вважається наслідком недоїдання [47]. Наприклад, у віці 10 років тільки 25 % дівчаток із перенесеним клінічно вираженим недоїданням досягли стадії Р2 за Таннером порівняно з 46 % дівчаток без такого анамнезу; тільки у 40 % цих дівчаток перша менструація починалася до 15 років порівняно зі 100 % дівчаток із контрольної групи [47].
Бідні діти з країн, що розвиваються, демонструють певне «наздоганяння» ваги й лінійного зростання, коли вони є прийомними дітьми. Корейські діти, усиновлені американськими сім''ями в ранньому віці, наближуються за масою тіла і зростом до американських норм, порівняно з тими дітьми, яких усиновили в більш старшому віці [48]. Однак інші дослідження показали, що в дітей з субконтиненту Індії, усиновлених шведськими сім''ями, статеве дозрівання та вік початку першої менструації випереджають лінійне збільшення росту [49]. У прийомних дівчаток перша менструація настає в середньому в віці 11,6 року, принаймні роком раніше, ніж у дівчат з індійських привілейованих класів, і двома-трьома роками раніше, ніж у представниць нижчих соціальних класів. Рання менструація, у свою чергу, пов''язана зі зменшеним зростом при досягненні цими дітьми дорослого віку. Вони трохи вищі на зріст у дорослому віці (на 1 см), ніж менш привілейовані дівчатка, які проживають у Індії. Отже, якщо погане харчування затримує процеси росту й дозрівання, протилежне навпаки прискорює статевий розвиток. Вищий рівень життя, що передбачає належне харчування й охорону здоров''я, дуже прискорює дитяче зростання, але дитина не обов''язково досягає дорослої статури, і це може викликати дуже ранній початок пубертатного зростання й статевої зрілості.
Результати кількох досліджень підтверджують, що вегетаріанство [50] і вживання клітковини, що міститься в овочах і фруктах [51], або жиру [52] впливають на вік початку першої менструації. Дослідження на тваринах показали, що вживання жирів сприяє приросту маси, який відповідно зменшує вік менархе [53]. Оскільки характер харчування може позначатися на масі через накопичення жиру й вільної від жиру тканини, харчування може впливати на вік початку першої менструації як безпосередньо (гормональні зміни, пов''язані з харчуванням), так і опосередковано (формування тіла).
Дівчинка з раннім варіантом статевого дозрівання з будь-якої етнічної групи вирізняється багатьма біологічними характеристиками. Можливо, найочевиднішими з них є відмінності в зростанні й складі тіла. До початку першої менструації дівчатка з раннім варіантом статевого дозрівання є вищими на зріст і мають більшу вагу та індекс маси тіла, а також більше складок шкіри порівняно з дівчатками з пізнім варіантом статевого дозрівання [1, 52, 54]. На підтримку гормональної гіпотези Мерзеніч (Merzenich) [52] виявив незалежний вплив харчового жиру на вік початку першої менструації. Установлено вдвічі більший ризик ранньої менструації при вживанні (зі статистичною корекцією на особливості метаболізму) великої кількості жиру (найвищий квартиль); статистичне коректування щодо відсотку жиру тіла не зменшувало цього зв''язку.
Мосіан (Mosian) і колеги [54] досліджували кореляції ранньої менструації, використовуючи проспективно зібрані дані щодо дівчаток — учнів п''ятого класу франкомовного регіону Канади. Їжа дівчат із раннім варіантом статевого дозрівання (вік початку першої менструації 9,5–12,5 року) була калорійною, з високим умістом вуглеводів та жирів. Зважаючи на посилене харчування, дівчатка були вищими на зріст і важчими й мали вищий індекс маси тіла (вага/зріст2), більше складок шкіри і витрачали більше енергії порівняно з дівчатками з контрольної групи. Після статистичного коректування за вагою жодного впливу споживання продуктів харчування на ранню менструацію в цій сукупності не спостерігалося, що підтверджує гіпотезу про опосередкований вплив харчування на початок менструації (склад тіла). Маклар (Maclure) і колеги [55] не виявили жодного впливу складу їжі на вік початку першої менструації, але виявили сильний зв''язок між першою менструацією та складом тіла; вони інтерпретували ці дані як сумісні з гіпотезою, що їжа впливає на менструацію через зростання й розвиток.
3. Фізична активність
Дівчатка з раннім варіантом статевого дозрівання, можливо, витрачають більше енергії, що корелює з їхнім більшим розміром тіла й збільшеним запасом жиру [54], хоча в розрахунку на 1 кг вільної від жиру маси тіла їхні енерговитрати фактично можуть бути нижчі, ніж у дівчат з пізнім варіантом статевого дозрівання [56]. Дівчатка з раннім варіантом статевого дозрівання також, імовірно, менш активні фізично, ніж дівчатка з пізнім варіантом статевого дозрівання, і єдиним очікуваним наслідком зниження активності може бути прискорене нарощування жиру. Отже, енергетичний баланс (різниця між споживанням калорій і енерговитратами) може бути важливим фактором у період статевого дозрівання.
Повідомлялося, що в дівчат, які ведуть активний спосіб життя, займаються танцями або спортом, менструація починається пізніше порівняно з менш фізично активними. Моісан (Moisan) і колеги встановили зменшення в два рази ризику раннього початку менструацій у фізично активних дівчат із франкомовного регіону Канади [54]. Так само більша кількість годин у тиждень, витрачених на заняття спортом, корелює з пізнім початком менструацій, після статистичної корекції щодо споживання жиру і більшої жирової маси тіла, що часто є пов''язаними з більш раннім статевим дозріванням [52]. Маліна (Malina) та Бушар (Bouchard) [3] підсумували дані, які показали, наприклад, більш пізній середній вік початку першої менструації у дівчат-бігунок та дівчат-стрибунок (13,5–14,0 року), гімнасток (13,7–15 років), а також у представниць багатьох інших видів спорту. У балерин перша менструація починається в більш старшому віці. За повідомленням Уоррена (Warren) [57], у танцівниць балету (N = 15) перша менструація починається в середньому в 15,4 року проти 12,5 року в дівчаток того самого віку з контрольної групи. У танцівниць груди також розвиваються із запізненням, але не лобкове волосся; пубертатний розвиток у них пов''язаний із періодами зниження фізичної активності. Випадки аменореї, що спостерігалися у 85 % балерин, які мали менструацію, корелюють із підвищеною фізичною активністю. Подібно балеринам, спортсменки, особливо ті, що рано почали займатися спортом, також демонструють пізній початок першої менструації. У спортсменок, які почали тренуватися раніше, перша менструація почалася у 15,1 року проти 12,8 року в тих, які почали тренуватися вже після того, як почалася менструація [58].
Ці результати поставили питання про те, чи затримує фізична активність першу менструацію або чи зумовлене пізнє статеве дозрівання інтенсивними спортивними тренуваннями або танцями. Маліна (Malina) доводить, що балет і деякі види спорту (гімнастика, біг на відстань) так би мовити самі вибирають лінійну статуру, що пов''язана з пізнішим дозріванням [59]. З іншого боку, зв''язок між початком тренувань і віком початку першої менструації мав би підтверджувати причинний зв''язок між інтенсивною фізичною активністю й затримкою першої менструації, якщо взяти до уваги можливість впливу відволікаючих факторів (харчування, етнічної приналежності, спадковості). Наприклад, Фріш (Frisch) і колеги [58] зареєстрували (за відсутності контролю) менше споживання їжі спортсменками, які почали тренуватися до того, як почалася менструація. Порівняно з вибіркою дівчат, у яких вже була менструація, калорії (–22,5 %), білки (–22,8 %) і жири (–31,5%) — усе було значно зниженим у раціоні дівчат, які рано почали займатися спортом.
Маліна (Malina) [60] досліджував вік початку першої менструації у спортсменок та їхніх матерів і сестер і виявив, що, за даними анкетування, члени сімей, разом із самими спортсменками, зазначали пізній вік початку першої менструації. Хоча контрольна група неспортсменок та їхніх матерів і рідних сестер не досліджувалася, Маліна (Malina) продемонстрував, що кореляція дочка — матір (r = 0,25) і кореляція сестра — сестра (r = 0,44) щодо початку першої менструації відповідали кореляціям, наведеним в літературі. Цікаво, що в білих сім''ях кореляції дочка — матір були вищими, якщо і мати, і дочка були спортсменками (r = 0,44), аніж тоді, коли спортсменкою була лише дочка (r = 0,18). У загальній вибірці, так само як і серед білих жінок, спостерігалася зворотна тривала тенденція. Середній вік першої менструації був пізнішим у спортсменок (приблизно на півроку пізніше, ніж у сестер, і до трьох четвертих року пізніше, ніж у матерів).
У спортсменок, які напружено тренуються, склад тіла (жирові накопичення й вільна від жиру маса тіла) та вік початку менструації такі самі, як і в дівчат із анорексією [61]. Отже, можливо деякі спортсменки, особливо ті, які займаються видами спорту, де треба «контролювати вагу тіла», або де для досягнень необхідна оптимальна маса тіла, або де робиться акцент на тендітності, більш схильні до обмеження харчування або до розвитку розладів харчової поведінки [59]. Крайнощі полягають у тому, що обмеження в харчуванні, разом із вимогами програми тренувань, можуть потенційно спричинити зміни в масі й формуванні тіла, затримку початку менструації та інші менструальні проблеми.
4. Генетичні, сімейні та інші фактори
Окрім загальних етнічних розбіжностей, генетичні характеристики й фактори навколишнього оточення (їжа, соціально-економічний статус) впливають на перебіг біологічного дозрівання осіб жіночої статі. Явні докази генетичних факторів часових рамок статевого дозрівання надходять із досліджень близнюків. Так, у однояйцевих близнюків менструація наступає майже в один і той самий вік (у межах 2–3 місяців). Двояйцеві близнюки, навпаки, відрізняються за віком початку першої менструації у середньому на дев''ять місяців [62]. Розподіл за часом статевого дозрівання також обумовлюється генетично, оскільки в деяких дослідженнях спостерігається досить значна кореляція (r = 0,40) у віці початку менструації між матерями і доньками [1]. До того ж доньки мігрантів до Австралії із різних регіонів Європи зберігають свій відносний вік початку першої менструації незважаючи на переміщення до нового навколишнього середовища [63].
Розподіл за часом підліткового біологічного дозрівання залежить від соціально-економічних факторів і факторів навколишнього середовища. У країнах, що розвиваються, де спостерігається значний розрив між багатими і бідними, діти з вищих соціальних класів вищі на зріст, товстіші й зріліші порівняно з дітьми з нижчих класів, і міські дівчатка там розвиваються швидше, ніж сільські [1, 20]. Однак у розвинених країнах відмінності між соціальними класами менш очевидні. Крім того, дівчата-підлітки з нижчих соціальних класів огрядніші, тоді як їхні однолітки з вищим соціально-економічним статусом мають більший зріст, що здебільшого є результатом дієти та фізичних вправ. Ці зовнішні відмінності можуть пом''якшувати будь-які відмінності в статевому дозріванні, пов''язані із соціальним класом. Наприклад, у Сполучених Штатах сімейні доходи не корелюють із віком початку першої менструації [32]; у Швеції ні достаток, ні зайнятість батьків не прогнозують вік початку першої менструації [64]. Однак у Польщі й у Великій Британії освіта батьків та/або їхня зайнятість усе ще корелюють (слабо) з настанням першої менструації. Доньки освічених працівників — «білих комірців» або професіоналів починають менструювати трохи раніше, тобто приблизно на півроку раніше в Польщі й приблизно на 2 місяці раніше в Англії [3].
Розмір сім''ї також впливає на вік початку першої менструації, тоді як послідовність народження дітей у родині, на наш погляд, не впливає. Із зростанням кількості дітей у сім''ї зростає й вік, коли починається менструація. Наприклад, серед спортсменок розмір сім''ї корелює із збільшенням віку початку першої менструації (до 0,17 року серед білих спортсменок і до 0,21 року серед темношкірих) [65]. Однак оскільки не можна з певністю стверджувати, що спортсменки походять із сімей не з однією дитиною (не було жодної контрольної групи неспортсменок), залишається незрозумілим, чи не є розмір сім''ї фактором, що опосередковано впливає на кореляцію заняття спортом із пізнім початком першої менструації, чи він є незалежним фактором ризику. Підсумкові дані [3] свідчать про затримку першої менструації від 0,11 до 0,22 додаткового року на кожну додаткову дитину в сім''ї, хоча не завжди контролюються такі фактори, як характер харчування і етнічна приналежність. Інші фактори є рівноправними, однак затримка приблизно на 0,12 року на дитину означає, що в американської дівчинки, яка має п''ятьох рідних братів та сестер, перша менструація очікується шістьма місяцями пізніше, ніж у дівчинки без рідних братів та сестер.
Стрес — інший соціально-біологічний фактор ризику, що, ймовірно, прискорює статеве дозрівання. У дівчаток, які зростають у несприятливому середовищі — в умовах, де батьки розлучилися або конфліктують, — менструація починається приблизно на чотири місяці раніше. Психологи, які вивчають розвиток, висунули гіпотезу, що стрес призводить до передчасного відокремлення від рідної домівки, що прискорює раннє статеве дозрівання [66]. Результати перевірки цієї теорії досі залишаються негативними. Ані прояви дитячого стресу (енурез, нічні кошмари), ані контекстуальні стресогенні фактори (присутність батька в сім''ї, освіта батьків і статус їхньої зайнятості) не прогнозують вік початку першої менструації [67]. Також не виявлено, що стрес знижує інтенсивність обміну речовин і збільшує таким чином накопичення жирової маси, зумовлюючи тим самим ранній початок першої менструації [68].
В. Наслідки статевого дозрівання
Виявлено, що дівчата з раннім варіантом статевого дозрівання (менструація у віці 10–11 років) досягають пікової швидкості збільшення зросту приблизно за 8 місяців до початку першої менструації, тоді як дівчатка з середнім варіантом статевого дозрівання (перша менструація починається в віці 12 років) досягають пікової швидкості збільшення зросту роком пізніше (відповідно до хронологічного віку) [1]. Дівчата з раннім варіантом статевого дозрівання, яких класифікують на основі віку початку першої менструації, демонструють прискорення кістякового віку й швидке проходження стадій формування грудей і лобкового волосся [69], але це не підтверджено іншими дослідженнями [69а]. Фізичні зміни в розмірі й формі тіла відбуваються раніше за хронологічним віком у дівчат із раннім варіантом статевого дозрівання порівняно з іншими дівчатами.
1. Початок статевого життя
Гормональні зміни в підлітковому віці зумовлюють посилення лібідо в дівчат-підлітків. Статеві гормони також приводять до розвитку вторинних статевих ознак, що приваблюють одну стать до іншої. Період статевої привабливості, можливо, настає швидше в дівчат із раннім варіантом статевого дозрівання. Концентрація тестостерону корелює з періодом неконтактної статевої активності, а також із віком початку статевого життя для американських темношкірих і білих дівчат-підлітків [70]. Оскільки концентрація тестостерону приблизно подвоюється протягом пубертатного періоду, найбільшою вона є саме перед початком першої менструації. Вважається, що рівні тестостерону є високими і, таким чином, можуть збільшуватися швидше в дівчат із раннім варіантом статевого дозрівання [70].
Дівчата з раннім варіантом статевого дозрівання ймовірніше долучаються до участі в статевому акті в ранньому підлітковому віці (у віці тінейджерів). Соефер (Soefer) і колеги [71], використовуючи дані двох національних прогнозних досліджень (1971, 1976), вивчили взаємозв''язок між ранньою менструацією та початком статевої активності серед білих і темношкірих дівчат віком 15–19 років. Участь у доменструальному статевому контакті є малоймовірною; це відбувається менш як у 5 % темношкірих чи білих дівчат, яких досліджували. Дівчата з раннім варіантом статевого дозрівання мали дошлюбний статевий контакт раніше, ніж із середнім варіантом статевого дозрівання; в обох категоріях це відбувалося раніше, ніж у дівчат із пізнім варіантом статевого дозрівання. Наприклад, порівняння відносного ризику серед темношкірих дівчат є найразючіше відмінним у віці 12 і 13 років. Тринадцятирічних темношкірих дівчаток із групи дівчат із раннім початком менструацій (раніше 12 років), які практикували дошлюбний статевий контакт, було в 4,4 раза більше в 1971 році й у 3,3 раза більше в 1976 порівняно з темношкірими дівчатками з пізньою першою менструацією (14 років і старше). До 17 років відносні ризики були у всіх майже однакові. Тринадцятирічних білих дівчаток із групи дівчат із раннім початком менструацій, які практикували дошлюбний статевий контакт, було у 6,3 раза більше в 1971 році й у 5 разів більше в 1976 році, ніж білих дівчаток із групи дівчат із пізньою першою менструацією. Удрі (Udry) також повідомив про ранні сексуальні стосунки (у віці молодше 16 років) серед дівчат з раннім початком менструацій (раніше 12 років) [71а]. Забін (Zabin) [72] в 1981 році підтвердила це щодо темношкірих дівчаток із Балтімора. Незважаючи на повідомлення про вищий показник статевої активності у 1980-х роках, вона також знайшла суттєво більші ризики раннього статевого контакту серед дівчат із раннім варіантом статевого дозрівання. Наприклад, у віці 15 років сукупна ймовірність першого статевого контакту становила 55 %, якщо перша менструація почалася в віці 11 років або раніше, і 32 %, якщо менструації почалися в 14 років або пізніше. Інші підтвердили ці кореляції [73], поширивши їх на американських тінейджерів латиноамериканського походження [74] і на дівчат із країн, що розвиваються [75, 76].
2. Підліткова здатність до запліднення
Дівчата з раннім варіантом статевого дозрівання можуть мати інший гормональний профіль, ніж дівчата з пізнім варіантом статевого дозрівання, і в них може бути більшою здатність до запліднення в більш ранньому хронологічному віці. Статевим дозріванням керують нейроендокринні фактори, і на нього впливає автокринна й паракринна активність яєчників. Упродовж перших кількох місяців після початку першої менструації гіпоталамічно-гіпофізарно-оваріальна вісь є недозрілою, і фолікул, що розвивається, виділяє тільки естроген; позитивний зворотний зв''язок, щоб викликати овуляцію, розвивається пізніше. Це період так званої підліткової стерильності, хоча поняття послабленої здатності до запліднення, певно, було б більш прийнятним визначенням.
І вік першої менструації, і гінекологічний вік (період після першої менструації) корелюють із імовірністю овуляції у підлітків. Через шість місяців після початку першої менструації 40 % циклів у дівчат із раннім варіантом статевого дозрівання (молодше 12 років у першу менструацію) є овуляційними, на відміну від менше 20 % — у дівчат із середнім варіантом статевого дозрівання (12,0–12,9 року у першу менструацію) і дівчат із пізнім варіантом статевого дозрівання (13 років і старше в першу менструацію) [77]. Зі збільшенням кількості років, що минули після першої менструації, частка овуляційних циклів також зростає — від 15 % у перший рік після менархе до 80 % на шостий рік після неї [78]. Темпи також, імовірно, залежать від віку настання першої менструації. Через півтора року після менархе в дівчат із раннім варіантом статевого дозрівання 80 % циклів є овуляційними порівняно з 30 % в дівчат із середнім і 20 % — з пізнім варіантом статевого дозрівання. Час від першої менструації до моменту, коли половина всіх циклів є овуляційними, становить один рік у дівчат із раннім варіантом статевого дозрівання, 3 роки у дівчат із середнім варіантом статевого дозрівання і 4,5 року в дівчат із пізнім варіантом статевого дозрівання [77]. Дівчата з раннім варіантом статевого дозрівання, таким чином, є плідними в більш ранньому хронологічному й гінекологічному віці порівняно з дівчатами з більш пізнім варіантом статевого дозрівання.
В овуляційних циклах прогестерон протиставлений естрогену. Цикли, де дія естрогену не доповнюється дією прогестерону, типово є нерегулярними з мінливим об''ємом менструальної кровотечі. Овуляція корелює з різними показниками пубертатного розвитку, включаючи розвиток грудей і лобкового волосся. На стадії В1 за Таннером жодна з дівчат-підлітків (вік 13–16 років), яких досліджували Віхко (Vihko) і Аптер (Apter) [78], не мала овуляційних циклів. Кількість останніх помітно зростала в процесі розвитку. На стадіях В2–3 за Таннером 38 % дівчат мали овуляційні цикли; ця пропорція збільшилася до 44 % на стадії В4 (за Таннером) і до 57 % на стадії В5 за Таннером. Аналогічно не було жодної дівчинки-підлітка з овуляційними циклами на стадіях Р1 чи Р2 за Таннером, але 35 % дівчат на стадіях Р3–4 за Таннером і 60 % на стадії Р5 за Таннером мали овуляційні цикли.
3. Підліткова вагітність
Дівчата з бідних сімей і з ранньою першою менструацією більш ніж удвічі частіше вже мали статеві контакти в віці до 16 років і майже вдвічі частіше вагітніли, переривали вагітність і народжували дітей у віці до 18 років [71]. Отже, більш раннє статеве дозрівання, ймовірно, збільшує ризик підліткової вагітності.
Щороку в США майже 1 мільйон дівчат віком 19 років і молодше вагітніє, приблизно половина з них народжує [78b]. Показник підліткової народжуваності знизився від найвищого рівня в 1960 році (приблизно 90/1000) до 69,5/1000 у 1970 і 54,1/1000 у 1980 році, але у 1990 році він підвищився знову до 61,3 випадку на 1000 осіб. У 1990-х роках спостерігалося деяке коливання з року в рік із піком (63,5/1000) у 1991 році. У 1999 році показник підліткової народжуваності (55,6/1000) був трохи вищий за показники, що насправді склалися між роками 1976 (54,0/ 1000) і 1988 (54,3/1000) [78b]. Показник підліткової народжуваності знижувався, починаючи з пікового в 1991 році зі зменшенням приблизно на 5 % у період між двома останніми звітами (1995 і 1996); одночасно зменшувалися й показники підліткової вагітності [78b].
Є загальновизнаним, що жінки, які зростали в сприятливих соціальних і економічних умовах, частіше переривають вагітність, що настає в ранньому віці або яка є непередбачуваною, тоді як показники підліткової народжуваності найвищі серед дівчат із етнічних меншин, які проживають в несприятливих умовах.
У багатьох дослідженнях, де вивчалися результати вагітності, помічено, що в дівчат-підлітків, які народжують, перша менструація часто почалася в віці молодше 12 років [79, 80]. Так, у літературі, присвяченій дослідженню проблеми зачаття до першої менструації, є кілька повідомлень про це [81], тоді як відомо значно більше випадків запліднення дівчат-підлітків у наймолодшому гінекологічному віці (тобто впродовж двох чи трьох років після початку першої менструації [82, 83]).
А. Гінекологічний вік. 1977 року Златнік і Бурмейстер [84] увели поняття «гінекологічний вік», щоб відрізнити gravidas (вагітних жінок), які були фізіологічно незрілими, від тих, які такими не були. Своє пояснення вони мотивували відомими відмінностями початку й перебігу підліткового розвитку. Так само як існують ендокринологічні відмінності між підлітками й дорослими в менструальному циклі, також є наявні розбіжності між біологічно зрілими та незрілими підлітками. Ці розбіжності визначаються відповідно до гінекологічного віку.
Менструальні цикли в дівчат-підлітків характеризуються довшою фолікулярною фазою й коротшою лютеїновою фазою порівняно з менструальними циклами в дорослих жінок. У підлітковому циклі овуляція відбувається приблизно п''ятьма днями пізніше, ніж у дорослих [85]. Домінуючий фолікул відбирається пізно та залишається меншим упродовж усієї фолікулярної фази. Концентрація фолікулостимулюючого гормону (FSH) збільшується повільніше й раніше в циклі, концентрації прогестерону жовтого тіла — більш низькі і лютеїнові фази недорозвинені — усе це більш характерне для підлітків, аніж для дорослих. Упродовж перших кількох років після початку першої менструації поступово зменшується тривалість фолікулярної фази [86]. Вважається також, що у вагітних дівчат-підлітків тривалість фолікулярної фази менструального циклу, що передує зачаттю, є довшою в гінекологічно незрілих [87], і тому саме ця фаза може зумовлювати (коротшу) тривалість вагітності.
Молодий материнський вік іноді пов''язують із підвищеним ризиком передчасної родової діяльності та/або передчасних пологів. Однак погляди авторів щодо цього питання розділяються; результати деяких досліджень свідчать про підвищений ризик передчасної родової діяльності/пологів [88а], інші не підтверджують жодного несприятливого впливу віку на тривалість вагітності [89]. Суперечності можуть пояснюватися поширеністю недостатнього гінекологічного віку. У дослідженнях, що вивчають біологічну незрілість, підвищений ризик передчасних пологів, імовірно, є специфічним щодо молодого гінекологічного віку, а не до хронологічного віку [82, 83]. Молодий гінекологічний вік є фактично унікальним показником незрілості для підліткового віку. Материнський хронологічний вік має слабкий негативний зв''язок із підвищеним ризиком передчасних пологів, що становить до 3 % зниження ризику на рік збільшення віку. Молодий гінекологічний вік характеризується в цьому відношенні більш сильним зв''язком (з 20% зниженням ризику на рік після статистичної корекції на кожний хронологічний вік) [83]. Якщо класифікувати передчасну пологову діяльність згідно з етіологією (ідіопатична передчасна родова діяльність, передчасне руйнування оболонок і медичні або акушерські причини та ускладнення), ризик ідіопатичної передчасної родової діяльності й передчасних пологів, яким передує передчасна родова діяльність, удвічі більший у молодих дівчат-підлітків (молодше 16 років) молодого гінекологічного віку (менше 2 років) [90].
Гінекологічний вік — надійний показник незрілості для молодих осіб, у яких недавно почалася перша менструація, однак іноді він може бути нечутливим показником ризику. Наприклад, за наявності проявів хронічного недоїдання перша менструація часто запізнюється, поки не завершиться повне формування грудей і лобкового волосся. У цій ситуації молодий гінекологічний вік не може бути ані чутливим, ані особливим показником біологічної незрілості [91].
Б. Розвиток організму матері протягом вагітності. Підлітковий розвиток і підліткова вагітність часто збігаються в часі. Результати одного з досліджень засвідчили, що 63 % темношкірих дівчат-підлітків (віком 12–18 років) мали післяпологові рентгенограми зап''ястка руки, які показали відкритий епіфіз, що вказав на незрілість кістяку [92]. Отже, багато дівчат-підлітків можуть розвиватися навіть під час вагітності. Однак якщо зробити низку антропометричних вимірів, продовження розвитку багатьох вагітних дівчат-підлітків не є клінічно очевидним через гальмування материнського росту при вагітності [93]. Компресія хребців, вторинна до постурального лордозу, і гестаційний приріст ваги справляють помилкове враження про припинення росту [94]. Використання для визначення росту чутливих методів (приладу для вимірювання висоти коліна) і вимірювання сегмента тіла (гомілки ноги), на які менше впливає відносне «скорочення», показало, що приблизно 50 % підлітків продовжують рости під час вагітності [93, 95].
Протягом вагітності материнський розвиток супроводжується значним приростом маси тіла, збільшенням жирових накопичень і тривалішим утриманням цієї маси після пологів [95–97]. Незважаючи на ці зміни, що мали б привести до збільшення розміру плода, збільшення маси тіла матері при вагітності приводить до зменшення ваги новонародженої дитини (на 150–200 г) [98]. Змагання за живильні речовини між матір''ю, яка усе ще росте, і її плодом відбувається через помітне зменшення плацентарного кровообігу (вимірюється ультразвуковим дослідженням за методом Допплера) і зменшення передання живильних речовин від матері до її плода. Рівні феритинів і фолатів у крові пуповини плода зростаючої дівчини-підлітка нижчі, ніж у підлітків, які не ростуть; різниця концентрації становить більше 20 % для кожної живильної речовини [99]. Показник систола/діастола (S/D), показник судинного опору, вимірюється ультразвуковим дослідженням за методом Допплера на пупковій артерії. Майже вдвічі більше вагітних, які ростуть, мають підвищення показників систола/діастола у три рази чи більше, що свідчить про високий опір кровообігу, що вказує на уповільнення кровообігу [97].
На моделі змагання «матір — плод» у тварин [100] усе ще зростаючі самки щурів, яких запліднили відразу після відкриття вагіни й годували за бажанням, мали більші гестаційні прирости маси тіла порівняно зі зрілими вагітними самками. Молоді самки народили значно менших за розміром щурят із запізнілим кістяковим окостенінням; до того ж показник смертності серед них виявився високим. Молодим вівцям із імплантованими яйцеклітинами дорослих овець із надмірною овуляцією (запліднених одним плідником) давали дієтичне харчування для того, щоб гарантувати повільне або швидке материнське зростання [100а]. У перегодованих овець материнська маса була занадто збільшеною з супутніми впливами на масу тіла (плюс 2 кг при переміщенні ембріона, плюс 22 кг на 95-й день вагітності), але відмінності в материнському лінійному зростанні невідомі. Швидке зростання молодої вівці було пов''язане з меншою вагою новонародженої ягняти, меншою вагою плаценти та з підвищеним ризиком спонтанного аборту під час вагітності та смерті ягняти після народження. Отже, у різних біологічних видів тенденція до синтезу тканин молодої матері, яка продовжує рости, ймовірно, має пріоритет над живильними вимогами плода і матки.
Змагання між матір''ю та потомством може відбуватися під час лактації так само, як і під час вагітності. Дівчата-підлітки, які годують груддю, мають значно менший об''єм грудного молока порівняно зі зрілими годувальницями [101]. Щуренята, перехресно вигодовувані молодими самками, мали нижчі показники росту, ніж щуренята, перехресно вигодовувані дорослими самками, — можливо, на це впливала кількість або якість грудного молока [100]. Молоді перегодовані й швидко зростаючі вівці виробляли молозиво вже при окоті [100а]. Гіпотетично виробництво молозива (а можливо, і розвиток грудної залози), певно, спровокувала знижена секреція плацентарних гормонів протягом вагітності.
Однією з причин збільшеного гестаційного приросту маси є прогресування вагітності, що сприяє накопичуванню жирової маси впродовж третього триместру, коли жирові запаси звичайно мобілізуються, щоб підтримати розвиток плода [96]. У молодших матерів материнські запаси не мобілізовані, а збережені. І додаткова маса, і жир, накопичений упродовж вагітності, зберігаються в молодих усе ще зростаючих матерів і в післяпологовий період. У середньому вони зберігають понад 40 % свого гестаційного приросту маси протягом 4–6 тижнів після пологів порівняно з 14 % молодих жінок, які вже не ростуть під час вагітності, і зрілих жінок.
В. Інші фактори ризику та ускладнення. Поведінкові фактори ризику, як і паління, вживання алкоголю та наркотиків, імовірно, менше поширені серед вагітних дівчат-підлітків, аніж серед зрілих жінок, зокрема якщо молоді жінки належать до етнічних меншин [80, 102]. Більшість ускладнень (плацентарний розрив, передлежання плаценти, передчасне руйнування оболонок, інфекційні хвороби сечового шляху й анемія) та особливості пологів (тривалість періодів, розриви родових шляхів і епізіотомія, застосування амніотомії або використання лікарських засобів для стимуляції пологової діяльності) однаковою мірою трапляються і серед дівчат-підлітків, і серед зрілих жінок. Нині кесарів розтин зрілим жінкам проводять частіше, аніж дівчатам-підліткам; повідомлення про збільшення кількості пологів за допомогою кесарева розтину тепер надходять переважно з країн, що розвиваються [80, 102].
Гіпертензивні розлади вагітності більш поширені серед молодших дівчат-підлітків і дівчат-підлітків із країн, що розвиваються [102]. Однак багато опублікованих досліджень не використовують статистичну корекцію на плідність, плутаючи, таким чином, ризик, пов''язаний із відсутністю пологів в анамнезі, з будь-яким іншим додатковим ризиком через молодий материнський вік. Результати дослідження контрольних груп адекватного контингенту підтверджують, що навіть дуже молоді вагітні (молодше 16 років) не мають підвищеного акушерського ризику [80]. Крім того, існує постійне зменшення випадків материнської анемії і гіпертонії, спричинених вагітністю, серед вагітних дівчат-підлітків порівняно з ризиком, який має більшість зрілих жінок. У минулому, але не зараз, ці ризики переважали серед дівчат-підлітків [102]. Отже, незважаючи на попередні твердження про протилежне, вагітність, родова діяльність і пологи тепер, на наш погляд, не створюють надмірних медичних чи акушерських ризиків жінкам у підлітковому віці.
Г. Тривалі наслідки. Ранній вік початку першої менструації (раніше 12 років) — загальновизнаний фактор ризику раку грудей. Ризик знижується приблизно до 10 % протягом кожного року, якщо перша менструація запізнюється [103]. Перша менструація в ранньому віці пов''язана з раннім початком овуляції і регулярним менструальним циклом [77]. Вважається, що триваліша сукупна дія естрогену й прогестерону і, можливо, посилена дія естрадіолу в молодих дорослих жінок впливають на ризик через посилений розвиток епітеліальних тканин грудей [104]. Ризик раку грудей найімовірніше компенсується тим, що жінки, які рано дозрівають, проходять через вагітність і народження дитини. У жінок із першою повноцінною вагітністю в ранньому віці (молодше 20 років) ризик раку грудей зменшується порівняно з жінками, які народжують перших дітей пізно, і чим раніше настає вагітність, тим нижче ризик розвитку раку [103, 104].
Порівняно з дівчатами з пізнім варіантом статевого дозрівання, дівчата, у яких перша менструація починається рано, мають тенденцію бути міцнішими за будовою тіла; у них збільшені показники маси тіла й ожиріння в дитинстві й у період статевої зрілості, що зберігаються в них і в дорослому віці [1, 3, 105, 106]. Патерни розподілу жирової маси тіла, що склалися в підлітковому віці, також зберігаються; так, дівчата з міцною будовою тіла з раннім варіантом статевого дозрівання демонструють більш «центропетальний» розподіл жирової маси (більше відкладення жиру на тулубі, ніж на кінцівках), у них вищий ризик надлишку ваги й ожиріння в юності та в дорослому віці [105, 107].
Надмірні показники приросту маси тіла протягом вагітності частіше характерні для молодших дівчат-підлітків і дівчат-підлітків, які ростуть під час вагітності [106], і це може зумовлювати вищий ризик ожиріння й розподіл жирової маси по центру тіла, що пов''язано з раннім дозріванням. Існує більша ймовірність відкладання жирової маси в центральній частині тулуба, коли значний приріст маси відбувається в підлітковому віці, під час вагітності, й у невагітному стані також. Наприклад, у післяпологовому періоді матері-підлітки з надмірним приростом маси в період вагітності, найімовірніше, збережуть загальну значну масу тіла й матимуть вищий післяпологовий індекс маси тіла та більший ризик залишитись огрядними [108, 109]. У молодих матерів у центральній частині тулуба також зосереджується більше жирової маси, якщо у них був значний або надмірний приріст маси протягом вагітності [110].
Підлітковий вік — критичний період щодо розвитку ожиріння [111]; лише частина (20 %) дівчат-підлітків із ознаками ожиріння відновлюють більш-менш нормальну вагу протягом 10 років [112]. Разом із збільшенням післяпологової затримки ваги, пов''язаної із підлітковою вагітністю, транзиторні підвищення секреції інсуліну в підлітковому віці [113] можуть зберігатися та зростати, якщо материнська маса тіла збільшується з віком або з наступними вагітностями. Тривалі катамнестичні дослідження свідчать, що підліткове ожиріння може сприяти підвищенню ризику розвитку хронічної хвороби в майбутньому, зокрема, інсулінонезалежного цукрового діабету, коронарної хвороби серця й артриту [114]. Дослідження з дизайном випадок-контроль засвідчують зв''язок між частою вагітністю в підлітковому віці та коронарною хворобою серця [115]. Цей взаємозв''язок теоретично можна пояснити збереженням у дорослому житті резистентності до інсуліну періоду статевого дозрівання.
1. Tanner J.М. Growth at Adolescence, 2nd ed. Black-well, Oxford. — 1962.
2. Garn S.M., Wagner B. The adolescent growth of the skeletal mass and its implications to mineral requirements // Adolescent Nutrition and Growth / F.P. Heald, ed. — Applcton-Century-Crofts, New York. — 1969. — Рp. 139-161.
3. Malina R.M., Bouchard C. (1991). Growth, Maturation and Physical Activity. Human Kinetics Book, Champaign, IL.
3a. Sizoncnko P.C. Normal sexual maturation // Pediatrics. — 1987. — 14. — 191-201.
4. Lampl M., Johnson M.L. A case study of daily growth during adolescence: A single spurt or changes in the dynamics of saltatory growth? // Ann. Hum. Biol. — 1993. — 20. — 595-603.
5. Thalange N.K.S., Foster P.J., Gill M.S., Price D.A., Clayton P.E. Model of normal prepubertal growth // Arch. Dis. Child. — 1996. —75. — 427-431.
6. Lampl M., Veldhuis J.D., Johnson M.L. Saltation and status: A model of human growth // Science. — 1992. — 258. — 801-803.
7. Cameron N., Tanner J.M., Whithouse R.H. A longitudinal analysis of the growth of limb segments in adolescence // Am. Hum. Biol. — 1982. — 9. — 211-220.
8. Roche A.E., Davila G.H. Late adolescent growth in stature // Pediatrics. — 1972. — 50. — 874-880.
9. Frisch R.E. Fatness of girls from menarche to age 18 years, with a nomogram // Hum. Biol. — 1976. — 48. — 353-359.
10. Berkey C.S., Dockery D.W., Wang X., Wypij D., Ferris B.G.Jr. Longitudinal height velocity standards for U.S. adolescence // Stut. Med. — 1993. — 12. — 403-414.
11. Zacharias L., Rand W.M. Adolescent growth in height and its relation to menarche in contemporary American girls // Ann. Hum. Biol. — 1983. — 10. — 209-222.
12. Crоnk C.E., Schall J.I., Hediger M.L., Scholl T.O. Growth of postmenarcheal girls from three ethnic groups // Am. J. Hum. Biol. — 1996. — 8. — 31-42.
13. Garn S.M., Rohmann C.G., Apfelbaum B. Complete epiphyseal union of the hand // Am. J. Phys. Anthropol. — 1961. — 19. — 365-372.
14. Moerman M.L. Growth of the birth canal in adolescent girls // Am. J. Obstet. Gynecol. — 1982. — 43. — 528-532.
15. Malina R.M., Bouchard C. Subcutaneous fat distribution during growth // Fat Distribution During Growth and Later Health Outcomes / C. Bouchard, F.E. Johnston, еds. — Liss, New York. — 1988. — Рp. 63-48.
16. Deutsch M.I., Mueller W.H., Malina R.M. Androgyny in fat patterning is associated with obesity in adolescents and young adults // Ann. Hum. Biol. — 1985. — 12. — 275-286.
17. Hediger M.L., Scholl T.O., Schall J.I., Cronk C.E. One year changes in weight and fatness in girls during late adolescence // Pediatrics. — 1995. — 96. — 253-258.
18. Gruelich W.W., Pyle S.I. (1959). Radiographic Atlas of Skeletal Development of the Hand and Wrist // 2nd ed. Stanford University Press, Stanford, CA.
19. Tanner J.M., Whitehouse R.H., Marshall W.A., Healy M.J.K., Goldstein H. Assessment of Skeletal Maturity a Prediction of Adult Height // Academic Press, New York. — 1975.
20. Eveleth P.B., Tanner J.M. (1990). Worldwide Variation Human Growth // Cambridge University Press, Cambridge, UK.
21. Marshall W.A., Tanner J.M. Variations in pattern of pubertal changes in girls // Arch. Dis. Child. — 1969. — 44. — 291-303.
22. Bridges N.A., Cooke A., Healy M.J.R., Hindmarsh P.C, Brook C.G.D. Growth of the uterus // Arch. Dis. Chil. — 1996. — 75. — 330-331.
23. Duke P.M., Lilt I.E., Gross R.T. Adolescents'' self-assessment of sexual maturation // Pediatrics. — 1980. — 66. — 918-920.
24. Neinstein L.S. Adolescent self-assessment of sexual maturation // Clin. Pediatr. — 1982. — 12. — 482-501.
25. Bergsten-Brucefors A. A note on the accuracy of recalled age at menarche // Ann. Hum. Biol. — 1976. — 3. — 71-73.
26. Koo M.M., Rohan T.E. Accuracy of shortten recall of age at menarche // Ann. Hum. Biol. — 1997. — 24. — 61-64.
27. Damon A., Bajema C.J. Age at menarche: accuracy of recall after thirty-nine years // Hum. Biol. — 1974. — 46. — 381-384.
28. Bean J.A., Leeper J.D., Wallace R.B., Sherman В. M., Jagger H. Variations in the reporting of menstrual histories // Am. J. Epidemiol. — 1979. — 109. — 181-185.
29. Casey V.A., Dwyer J.T, Coleman K.A., Krall E.A., Gardner J., Valadian I. Accuracy of recall by middle-aged participants in a longitudinal study of their body size and indice of maturation earlier in life // Ann. Hum. Biol. — 1991. — 18. — 155-166.
30. World Health Organization. Physical Status: The Use and Interpretation of Anthropometry, W.H.O. Tech. Rep. Ser. № 854. WHO, Geneva. — 1995.
31. Marshall W.A., Tanner J.M. Puberty in human growth a comprehensive trentise // Postnatal Growth, Neurobiology / F. Falkner, J.M. Tanner, eds. — Plenum, New York. —1986. — Vol. 2. — Pp. 171-203.
32. MacMahon B. (1973). Age at Menarche: United States, DHEW Publ. № (HRA) 74-1615, NCHS Ser. 11, № 133. National Center for Health Statistics, Rockville, MD.
33. Jordan J.R. Desarollo Humano en Cuba. Ediciones Cientirico-Technica // Ministeno de Cultura, La Habana, Cuba. — 1979.
34. Litt I.E, Cohen M.I. Age of menarche: A changing pattern and its relationship lo ethnic origin and delinquency // J. Pediatr. — 1973. — 82. — 288-289.
35. Villarreal S.E. Martorell R., Mendoza E. Sexual maturation of Mexican-American adolescents // Am. J. Hum. Biol. — 1989. — 1. — 87-95.
36. Kelly H.J., Reynolds L. Appearance and growth of ossification centers and increases in the body dimensions of white and negro infants // Am. J. Roentgenol. Radium Ther. — 1947. — 57. — 477-516.
37. Garn S.M., Sandusky S.T, Nagy J.M., McCann M.B. Advanced skeletal development in low-income negro children // J. Pediatr. — 1972. — 80. — 965-969.
38. Roche A.E (1974). Skeletal Maturity of Children 6–11 Years, DHEW Publ. № (HRA) 75-1622, NCHS Ser. 11, № 140. National Center for Health Statistics, Rockville, MD.
39. Harlan W.R., Harlan E.A., Grillo G.P. Secondary sex characteristics of girls 12 to 17 years of age: United States Health Examination Survey // J. Pediatr. — 1980. — 96. — 1074-1078.
40. Herman-Giddens M.E., Slora E.J., Wasserman R.C, Bourdony C.J., Bhapkar M.V., Koch G.G., Hasemeier C.M. Secondary sexual characteristics and menses in young girls seen in office practice: A study from the pediatric research office settings network // Pediatrics. — 1997. — 99. — 505-512.
41. Morrison I.A., Barton B., Biro E.M., Sprecher D.L., Falkner E., Obarzanek E. Sexual maturation and obesity in 9- and 10-year old black and white girls: The National H Lung, and Blood Institute Growth and Health Study // J. Pet. — 1994. — 124. — 889-895.
42. Richards R.J., Svec F., Bao W., Srinivasan S.R., Berer G.S. Steroid hormones during puberty: Racial (black-white) differences in androstenedione and estradiol: The Bogalusa Heart Study // J. Clin. Endocrinol. Metab. — 1992. — 75. — 624-631.
43. Wyshak G., Frisch R.E. Evidence for a secular trend in age ofmenarche // N. Engl. J. Med. — 1982. — 306. — 1033-1035.
44. Garn S.M. The secular trend in size and maturational timing and its implications for nutritional assessment // J. Nutr. — 1987. — 117. — 817-823.
45. Frisch R.E. The right weight: Body fat, menarche and fertility // Proc. Nutr. Soc. — 1994. — 53. — 113-129.
46. Dreizen S., Spirakis C.N., Stone R.E. A comparison of skeletal growth and maturation in undernourished well-nourished girls before and after menarche // J. Pediatr. — 1967. — 70. — 256-264.
47. Caller J.R., Ramsey F., Solimano G. A follow-up study of the effects of early malnutrition on subsequent development-I. Physical growth and sexual maturation during adolescence // Pediatr. Res. — 1985. — 79. — 518-523.
48. Winick M., Meyer K.K., Harris R.C. Malnutrition and environmental enrichment by early adoption // Science. — 1975. — 190. — 1173-1175.
49. Proos L.A. Anthropometry in adolescence — secular trends, adoption, ethnic and environmental differences // Horm. Res. — 1993. —39(Suppl. 3). — 18-24.
50. Sanchez A., Kissinger D.G., Phillips R.I. A hypothesis on the etiological role of diet on age of menarche // Med. Hipotheses. — 1981. — 7. — 1339-1345.
51. Hughes R.E., Jones E. Intake of dietary fiber and the age ofmenarche // Am. Hum. Viol. — 1985. — 4. — 325-332.
52. Merzenich H., Boeing H., Wahrendorf J. Dietary and sports activity as determinants for age at menarche // Am. J. Epidemiol. — 1993. — 138. — 217-224.
53. Frisch R.E., Hegsted D.M., Yoshinaga K. Body weight and food intake at early estrus of rats on highfat diet // Proc. Natl. Acad. Sci. U.S.A. — 1975. — 72. — 4172-4176.
54. Moisan J., Meyer F., Gingras S. A nested c control study of the correlates of early menarche // Am. J. Epidemiol. — 1990. — 132. — 953-961.
55. Maclure M., Travis L.B., Willett W., MacMahon B. A prospective cohort study of nutrient intake and age at menarche // Am. J. Clin. Nutr. — 1991. — 54. — 649-656.
56. Post G.B., Kemper H.C.G. Nutrient intake biological maturation during adolescence: The Amsterdam Growth and Health Longitudinal Study // Eur. J. Clin. Nutr. — 1993. — 47. — 400-408.
57. Warren M.P. The effects of exercise on pubertal progression and reproductive function in girls // J. Clin. Endrocrinol. Metab. — 1980. — 51. — 1150-1157.
58. Frisch R.E., Gotz-Welbergen A.V., McArthur J.W., Albri T., Witschi J., Bullen B., Birnholz J., Reed R.B., Hermann H. Delayed menarche and amenorrhea of college athletes in relation to age of onset of training // JAMA; J. Am. Med. Assoc. — 1981. — 246. — 1559-1563.
59. Malina R.M. Physical growth and biological maturation of young athletes // Exercise Sport Sci. Rev. — 1994. — 22. — 389-433.
60. Malina R.M., Ryan R.C, Bonci C.M. Age at menarche in athletes and their mothers and sisters // Ann. Hum. Biol. — 1994. — 21. — 417-422.
61. Bale P., Doust J., Dawson D. Gymnasts, distance runners, anorexics body composition and menstrual status // Sports Med. Phys. Fitness. — 1996. — 36. — 49-53.
62. Fischbein S. Onset of puberty in MZ and DZ twins // Acta Genet. Med. Gemellol. — 1977. — 26. — 151-158.
63. Eveleth P.B. Timing of menarche: Secular trend and population differences. // Life Cycle and Biological Development / J.B. Lancaster, B.A. Hamburg, eds. — 1996. — Aldine, New York. — Pp. 39-52.
64. Lindgren G. Height, weight and menarche in Swedish urban school children in relation to socio-economic status and regional factors // Ann. Hum. Biol. — 1976. — 3. — 501-528.
65. Malina R.M., Katzmarzyk P.T, Bonci C.M., Ryan R.C, Wellens R.E. Family size and age at menarche in athletes // Med. Sci. Sports Exercise. — 1997. — 29. — 99-106.
66. Belsky J., Steinberg L., Draper P. Childhood experience, interpersonal development and reproductive strategy: An evolutionary theory of socialization // Child Dev. — 1991. — 62. — 647-670.
67. Campbell B.C., Udry J.R. Stress and age at menarche of mothers and daughters // J. Biosoc. Sci. — 1995. — 27. — 127-134.
68. Moffitt T.E., Casp A., Belsky J., Silva P.A. Childhood experience and the onset of menarche: A test of a sociobiol-ogical model // Child Dev. — 1992. — 63. — 47-58.
69. Apter D., Vihko R. Premenarchcal changes in relation to age at menarche // Clin. Endocrinol. — 1985. — 22. — 753-760.
69a. Largo R.H., Prader A. Pubertal development in Swiss girls // Helv. Paediatr. Acta. — 1983. — 38. — 229-243.
70. Halpern C.T., Udry J.R., Suchindran C. Testosterone predicts initiation of coitus in adolescent females // Psychosom. Med. — 1997. — 59. — 161-171.
71. Soefer E.E, Scholl T.O., Sobel E., Tanfer K., Levy D.B. Menarche: Target age for reinforcing sex education for adolescents // J. Adolesc. Health Care. — 1985. — 6. — 383-386.
71a. Udry J.R. Age at menarche, first intercourse and at first pregnancy // J. Biosoc. Sci. — 1979. — 11. — 433-441.
72. Zabin L.S., Smith E.A., Hirsch M.B., Hardy J.B. Ages of physical maturation and first intercourse in black teenage males and females // Demography. — 1986. — 23. — 595-605.
73. Phinney V.G., Jensen L.C, Olsen J.A., Cundich B. The relationship between early development and psychosexual behaviors in adolescent females // Adolescence. —1990. — 25. — 321-332.
74. Adolph C., Ramos D.E., Linton K.L., Grimes D.A. Pregnancy among Hispanic teenagers: Is good parental communication a deterrent? // Contraception. — 1995. — 51. — 303-306.
75. Udry J.R., Cliquet R.L. A cross-cultural examination of the relationship between ages at menarche, marriage, and first birth // Demography. — 1982. — 19. — 53-63.
76. Buga G.A.B., Amoko D.H.A., Ncayiyana D.J. Sexual behaviour, contraceptive practice and reproductive health among school adolescents in rural Transkei // S. Afr. Med. J. — 1996. — 86. — 523-527.
77. Apter D., Vihko R. Early menarche, a risk factor for breast cancer, indicates early onset of ovulatory cycles // J. Clin. Endocrinol. Metab. — 1983. — 57. — 82-86.
78. Vihko R., Apter D. Endocrine characteristics of adolescent menstrual cycles: Impact of early menarche // J. Steroid Biochem. — 1984. — 20. — 231-236.
78b. Ventura S.J., Martin J.A., Curtin S.C., Matthews T.S. (1997). Report of Final Natality Statistics, 1995, Mon. Vital Stat. Rep., Vol. 45, № 11, Suppl. 2. National Center for Health Statistics, Hyattsville, MD.
79. Scholl T.O., Decker E., Karp R.J., Greene G., De Sales M. Early adolescent pregnancy outcome in young adolescents and mature women // J. Adolesc. Health Care. — 1984. — 5. — 167-171.
80. Perry R.L., Mannino B., Hediger M.L., Scholl T.O. Pregnancy in early adolescence: Are there obstetric risks? // J. Maternal-Fetal Med. — 1996. — 5. — 333-339.
81. Bender S. Premenarcheal pregnancy // Br. Med. J. — 1989. — 1. — 760.
82. Scholl T.O., Hediger M.L., Salmon R.W., Belsky D.H., Ances I.G. Association between low gynaecological age and preterm birth // Paediatr. Perinatal Epidemiol. — 1989. — 3. — 357-366.
83. Scholl T.O., Hediger M.L., Huang J., Johnson F.E., Smith W., Ances I.G. Young maternal age and parity // Ann. Epidemiol. — 1992. — 2. — 565-575.
84. Zlatnik F.J., Burmeister L.F. Low «gynecologic age» an obstetric risk factor // Am. J. Obstel. Gynecol. — 1977. — 128. — 183-186.
85. Apter D. Hormonal events during female puberty in relation to breast cancer risk // Eur. J. Cancer Prev. — 1996. — 5. — 476-482.
86. Apter D., Viinikka L., Vihko R. Hormonal pattern of adolescent menstrual cycles // J. Clin. Endocrinol. Metab. — 1978. — 47. — 944-954.
87. Stevens-Simon C., McAnarney E.R. Further evidence of reproductive immaturity among gynecologically young pregnant adolescents // Fertil. Steril. — 1995. — 64. — 1109-1112.
88. Brown H.L., Fan Y.D., Gonsoulin W.J. Obstetric complications in young teenagers // South. Med. J. — 1991. — 84. — 46-48.
88a. Fraser A.M., Brockert J.E., Ward R.H. Association of young maternal age with adverse reproductive outcomes // N. Engl. J. Med. — 1995. — 333. — 1113-1117.
89. Lubarsky S.L., Schiff E., Friedman S.A., Mercer В.M., Sibai В.M. Obstetric characteristics among multiparas underage 15 // Obstet. Gynecol. — 1994. — 84. — 365-368.
90. Hediger M.L., Scholl T.O, Schall J.I., Krueger P.M. Young maternal age and preterm labor // Ann. Epidemiol. — 1997. — 7. — 400-406.
91. Frisancho H.R., Matos J., Bolletino L.A. Role of gynecological age and growth maturity status in fetal maturation and prenatal growth of infants born to young still-growing adolescent mothers // Hum. Biol. — 1984. — 56. — 583-593.
92. Slevens-Simon C., McAnarney E.R. Skeletal maturity and growth of adolescent mothers // J. Adolesc. Health Care. — 1993. — 13. — 428-432.
93. Scholl T.O., Hediger M.L., Ances I.G., Cronk C.E. Growth during early teenage pregnancies // Lancet. — 1988. — 1. — 701-2.
94. Sukanich A.C., Rogers K.D., McDonald H.M. Physical maturity and outcome of pregnancy in primiparas younger than 16 years of age // Pediatrics. — 1986. — 78. — 31-6.
95. Scholl T.О., Hediger М.L., Cronk C.E., Schall J.I. Maternal growth during pregnancy and lactation // Norm. Res. — 1993. — 39(Suppl. 3). — 59-67.
96. Scholl T.O., Hediger M.L., Schall J.I., Khoo C.S., Fischer R.L. Maternal growth during pregnancy and the competition for nutrients // Am. J. Clin. Nutr. — 1994. — 60. — 183-188.
97. Scholl T.O., Hediger M.L., Schall J.I. Maternal growth and fetal growth: Pregnancy course and outcome in the Camden Study // Ann. N. Y. Acad. Sci. — 1997. — 817. — 292-301.
98. Scholl T.O., Hediger M.L., Ances I.G. Maternal growth during pregnancy and decreased infant birth weight // Am. J. Clin. Nutr. —1990. — 51. — 790-793.
99. Scholl T.O., Hediger M.L., Schall J.I., Mead J.P., Fischer R.L. Reduced micronutrient levels in the cord blood of growing teenage gravida // JAMA; J. Am. Med. Assoc. — 1995. — 274. — 26-27.
100. Hashizume K., Ohashi K.., Hamajima F. Adolescent pregnancy and growth of progeny in rats // Physiol. Behav. — 1991. — 49. — 367-371.
100a. Wallace J.M., Aitken R.P., Cheyne M.A. Nutrient partitioning and fetal growth in rapidly growing adolescent ewes // J. Reprod. Fertil. — 1996. — 107. — 183-190.
101. Motil K.J., Kertz B., Thotath U., Chery M. Lactational performance of adolescent mothers shows preliminary difference from that of adult women // J. Adolesc. Health Care. — 1997. — 20. — 442-446.
102. Scholl T.O., Hediger M.L., Belsky D.H. Prenatal care and maternal health during adolescent pregnancy: A review and meta-analysis // J. Adolesc. Health Care. — 1994. — 15. — 444-456.
103. Kelsey J.L., Gammon M.D., John E.M. Reproductive factors and breast cancer // Epidemiol. Rev. — 1993. — 15. — 36-47.
104. Kelsey J.L., Bernstein L. Epidemiology and prevention of breast cancer // Ann. Rev. Public. Health. — 1996. — 17. — 47-67.
105. Wellens R., Malina R.M., Roche A.R, Chumlea W.C, Guo S., Siervogel R.M. Body size and fatness in young adults in relation to age at menarche // Am. J. Hum. Biol. — 1992. — 4. — 783-787.
106. Hediger M.L., Scholl T.O., Schall J.I. Implications of the Camden Study of adolescent pregnancy: Interactions among maternal growth, nutritional status and body composition // Ann. N. Y. Acad. Sci. — 1997. — 817. — 281-291.
107. Garn S.M., LaVelle M., Rosenberg K.R., Hawthorne V.M. Maturational timing as a factor in female fatness and obesity // Am. J. din. Nutr. — 1986. — 43. — 879-883.
108. Scholl T.O., Hediger M.L., Schall J.I., Ances I.G., Smith W.K. Gestational weight gain, pregnancy outcome, and postpartum weight retention // Obstet. Gynecol. — 1995. — 86. — 423-427.
109. Segel J.S., McAnarney E.R. Adolescent pregni and subsequent obesity in African-American girls // J. Adolesc. Health Care. — 1994. — 15. — 491-494.
110. Scholl T.O., Hediger M.L., Schall J.I. Excessive gestational weight gain and chronic disease risk // Am. J. Hum. Biol. — 1996. — 8. — 735-741.
111. Dietz W.H. Critical periods in childhood for the development of obesity // Am. J. Clin. Nutr. — 1994. — 59. — 955-959.
112. Garn S.M. Continuities and changes in fatness from infancy through adulthood // Curr. Probl. Pediatr. — 1985. — 15. — 1-47.
113. Amiel S.A., Caprio S., Sherwin R.S., Plewe G., Haymond M.W., Tamborlane W.V. Insulin resistance of puberty: A defect restricted to peripheral glucose metabolism // J. Clin. Endocrinol. Metab. — 1991. — 72. — 277-282.
114. Must A., Jacques P.F., Dallal G.E., Bejema C.J., Dietz W.H. Long-term morbidity and morality of overweight adolescents: A follow-up of the Harvard Growth Study of 1922 to 1935 // N. Engl. J. Med. — 1992. — 327. — 1350-1355.
115. Palmer J.R., Rosenberg L., Shapiro S. Reproductive factors and risk of myocardial infarction // Am. J. Epidemiol. — 1992. — 136. — 408-416.
116. Sizonenko P.C. Normal sexual maturation // Pediatric. — 1987. — 14. — 191-201.
