Газета «Новости медицины и фармации» Пульмонология (318) 2010 (тематический номер)
Вернуться к номеру
Диффузный лейомиоматоз легких
Авторы: Н.Е. Моногарова, Е.В. Павлов, А.В. Семендяева, А.В. Глухов, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренней медицины им. А.Я. Губергриц, ДокТМО
Версия для печати
Диффузный лейомиоматоз легких (LAM) — редкое заболевание, которое развивается спорадически или в сочетании с генетическим заболеванием «туберозный склерозный комплекс» (TSC) независимо от возраста и расовой принадлежности. Чаще болеют женщины. Частота заболевания LAM составляет один случай на 400 000 взрослых женщин, LAM + TSC встречается у 30–40 % взрослых женщин и у детей и мужчин (S.R. Johnson, 2010). Нельзя исключить и иммунную природу процесса «метастазирования». Иммунологические сдвиги создают условия для миграции клеток лейомиомы в другие органы за счет повышения толерантности к гетеротопическим клеткам.
Лейомиоматоз легких часто развивается в сочетании с лейомиомой матки, иногда прогрессирует после овариоэктомии, а также в результате неоправданного (без доказательства эффективности) лечения эстрогенами, тамоксифеном и гонадотропин-рилизинг-гормоном. Возможно, это связано с эндокринными и иммунологическими сдвигами в организме. У каждой второй больной ранее была удалена матка. Клинически проявляется только нарастающей одышкой, кровохарканьем, иногда могут быть периодические пневмо- и хилотораксы, а также может развиться лимфостаз брюшины и малого таза.
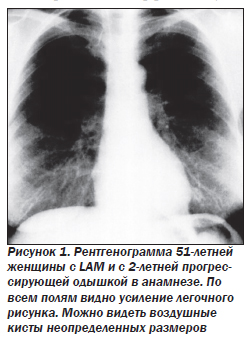
Макроскопически легкие уплотнены, на разрезе пористого, мелкоячеистого строения, в периферических отделах и под плеврой определяются плотные беловатые узелки диаметром 0,3–0,6 см. Очаги поражения звездообразной или сферической формы, четко отграничены от паренхимы легкого. Количество их по направлению к корню уменьшается.
При гистологическом исследовании выявляется диффузная гиперплазия гладкомышечных клеток в стенках альвеол, бронхиол и мелких бронхов. Лейомиоматозные разрастания сдавливают и деформируют предсуществующие легочные структуры. Отмечается некоторый полиморфизм опухолевых элементов, однако митозы отсутствуют, подозрения на злокачественную опухоль не возникает. Очаги пневмонии, как правило, не обнаруживаются. Местами видны скопления макрофагов. В длительно существующих образованиях происходит постепенное фиброзирование гладкомышечных пролифератов, развитие картины, характерной для фибромиомы. В регионарных лимфатических узлах иногда встречается разрастание гладкомышечных клеток, преимущественно в синусах.
Диффузный лейомиоматоз медленно прогрессирует и в течение нескольких лет нередко приводит к смерти от дыхательной недостаточности.
К первичному лейомиоматозу легких примыкает своеобразное заболевание, которое гистологически трудно отличить от описанного.
 Это доброкачественная метастазирующая лейомиома матки («злокачественный фиброид»). Речь идет о необычном феномене «метастазирования» доброкачественной опухоли матки в легкое. Впервые эта опухоль описана в 1901 году W. Minakowski. P.E. Steiner провел анализ накопленных наблюдений, предложил термин «метастазирующая фибромиома матки» и поднял проблему метастазирования доброкачественной опухоли.
Это доброкачественная метастазирующая лейомиома матки («злокачественный фиброид»). Речь идет о необычном феномене «метастазирования» доброкачественной опухоли матки в легкое. Впервые эта опухоль описана в 1901 году W. Minakowski. P.E. Steiner провел анализ накопленных наблюдений, предложил термин «метастазирующая фибромиома матки» и поднял проблему метастазирования доброкачественной опухоли.
Обычно через 1–10 лет после операции на матке (особенно у чернокожих больных) в возрасте 35–40 лет в легких развиваются множественные узелки от нескольких миллиметров до 2 см в диаметре. Поражение может быть односторонним (справа в 2,5 раза чаще), но преимущественно заболевание двустороннее. Иногда узелки опухоли распространяются по брюшине, в коже, мышцах, сердце, спинном мозге. Следует особо подчеркнуть, что гистологически «метастазы» отличаются от лейомиосаркомы. Опухоль имеет вполне доброкачественный вид, митозы единичные. R. Bressel и соавт. (1951) считали, что метастазирующая фибролейомиома — промежуточная форма между фибролейомиомой и лейомиосаркомой. Тем не менее для «метастазов» не характерна дегенерация, отличающая доброкачественную опухоль от злокачественной.
Диффузный легочный лимфангиолейомиоматоз — крайне редко встречающееся заболевание легких, характеризующееся мультицентричной узловой пролиферацией гладкомышечных элементов лимфатических сосудов. Процесс во многом сходен с диффузным лейомиоматозом легких, отличие заключается только в том, какая морфофункциональная единица легочной ткани является преобладающим источником опухолевого роста. Лимфангиолейомиоматоз может быть частью общего дефекта развития гладких мышц в организме и обычно проявляется в «сотовых» легких. Впервые заболевание описано в 1937 г. За рубежом к 1975 г. было известно о 32 наблюдениях. В отечественной литературе известны работы И.В. Двораковской (1983, 1989). А.Г. Чучалин с соавт. (1988) описали 100 случаев этой патологии. Заболевание встречается у женщин 2–47 лет, не наследуется. Проявляется одышкой, спонтанным пневмотораксом, кровохарканьем или хилотораксом. Все больные умирают в течение 10 лет, в среднем через три года после выявления заболевания.
Макроскопически ткань легких уплотнена, пропитана молочного цвета хилезной жидкостью, с мелкими мягко-эластичными узлами серо-розового цвета. Плевра утолщена, с множественными кистами, заполненными прозрачным содержимым, отмечаются множественные вздутия и буллы с утолщенными стенками. Лимфатические узлы увеличены и имеют вид губки. Нередко расширен грудной проток, который тоже может иметь губчатый характер. Часто возникают его разрывы, приводящие к пневмотораксу. Скопление хилезной жидкости отмечается также в плевральных полостях. Процесс может распространяться в брюшную полость (хилоперитонеум) и на шею.
Гистологически отмечается деформация легочной паренхимы, в утолщенных альвеолярных перегородках, в стенках бронхиол и мелких бронхов видны разрастания сравнительно мономорфных клеток с овальными или веретенообразными ядрами. Клетки сформированы в переплетающиеся пучки, располагающиеся вокруг сосудистых щелей с неизмененным эндотелием. Среди опухолевых клеток видны также скопления зрелых лимфоцитов.
 Интерстициальная пролиферация гладких мышц в перегородках долек, плевры, стенках альвеол и бронхов сочетается с аналогичными изменениями в стенках легочных вен, что вызывает кровоизлияния в альвеолы. Узелки состоят из мелких округлых клеток — незрелых миоцитов. Переполненные лимфатические пути образуют мелкие кисты и эктазии протоков. Характерные изменения паренхимы легких приводят к образованию воздушных клапанов и формированию мелких воздушных кист.
Интерстициальная пролиферация гладких мышц в перегородках долек, плевры, стенках альвеол и бронхов сочетается с аналогичными изменениями в стенках легочных вен, что вызывает кровоизлияния в альвеолы. Узелки состоят из мелких округлых клеток — незрелых миоцитов. Переполненные лимфатические пути образуют мелкие кисты и эктазии протоков. Характерные изменения паренхимы легких приводят к образованию воздушных клапанов и формированию мелких воздушных кист.
При прогрессировании заболевания возникают легочная гипертензия, гипертрофия правого желудочка сердца. Может наблюдаться усиление дыхательной недостаточности во время менструации. В менопаузе может наступить ремиссия.
Туберозный склероз. Туберозный склероз развивается в молодом возрасте, проявляется спонтанным пневмотораксом и нарастающей одышкой.
При патоморфологическом исследовании отмечаются следующие признаки заболевания:
 При LAM часто выявляют и внелегочные изменения: поражения медиастинальных и ретроперитонеальных лимфатических узлов, ангиомиолипомы (гамартомы).
При LAM часто выявляют и внелегочные изменения: поражения медиастинальных и ретроперитонеальных лимфатических узлов, ангиомиолипомы (гамартомы).
Гистологическое подтверждение основывается на данных трансбронхиальной биопсии. Если трансбронхиальная биопсия не информативна, проводится открытая или торакоскопическая биопсия легких. Типичная морфологическая картина LAM характеризуется пролиферацией гладкомышечных клеток в интерстиции и вокруг бронховаскулярных структур. Пролиферирующие клетки напоминают миоциты сосудов, однако они более короткие, плейоморфные, и в ряде случаев их можно спутать с фиброцитами. В спорных случаях отличить атипичные гладкомышечные клетки при LAM от других элементов позволяет положительная реакция атипичных миоцитов с моноклональными антителами НМВ45. Характерными морфологическими признаками LAM являются также кистозная дилатация дистальных воздухоносных пространств и легочный гемосидероз.
Ультраструктурный и иммунофлюоресцентный анализ волокон показывает высокое содержание гликогена в мышечных клетках и гладкомышечных антигенов. В настоящее время серологических тестов для определения этих антигенов не существует.
Дифференциальная диагностика причины спонтанного пневмоторакса включает следующие заболевания:
Отличить LAM от других заболеваний помогает компьютерная томография (КТ) высоких разрешений.
Выявленные изменения в легких необходимо дифференцировать с туберкулезным склерозом Бурневилля, так как данные компьютерной томографии и гистологические изменения при этих двух заболеваниях практически идентичны. Однако в отличие от LAM туберкулезный склероз является семейным заболеванием и сопровождается умственным недоразвитием. Кроме того, при туберкулезном склерозе характерны изменения почек, которые выявляются при компьютерной томографии почек с внутривенным контрастированием.
Таким образом, если у женщины молодого возраста в клинической картине доминируют прогрессирующая одышка, рецидивирующие пневмо- и хилоторакс, а также хилоперикард, кровохарканье, асцит и лимфаденопатия, то необходимо заподозрить лимфангиолейомиоматоз.
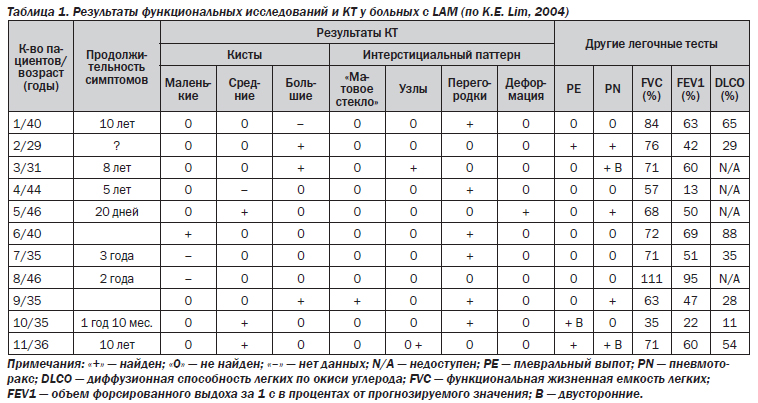
Рентгенологическое исследование легких. Главными рентгенологическими признаками LAM легких на обычных рентгенограммах грудной клетки являются:
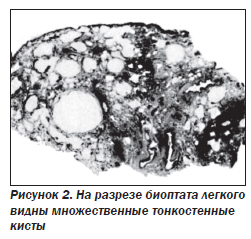
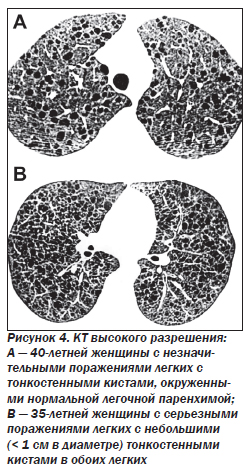
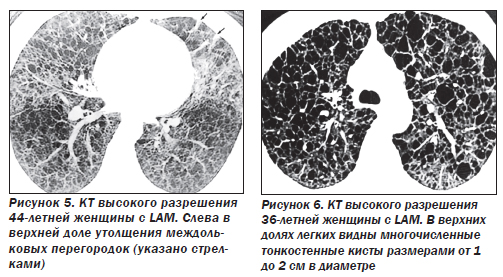
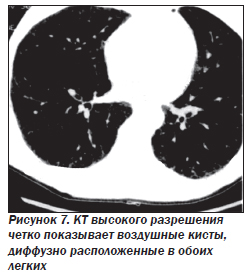
Наиболее характерный морфологический признак LAM — кистозная трансформация легких, которая обычно выявляется на компьютерных томограммах. Кисты бывают двух типов: мелкие множественные типа «сотового легкого» и крупные кисты, присущие буллезной эмфиземе. Толщина стенки кисты не превышает 2 мм, причем стенка кисты выявляется не всегда и не на всем протяжении. Окружающая легочная ткань часто не изменена. Однако сочетание фиброзных и кистозных изменений не противоречит диагнозу LAM. Таким образом, рентгенологическая картина LAM не патогномонична. Ведущим рентгенологическим признаком этого заболевания является образование множественных воздушных тонкостенных полостей буллезного характера.
 Для очаговой формы характерны очаги затемнения от 0,5 до 1,5 см в диаметре с четкими границами.
Для очаговой формы характерны очаги затемнения от 0,5 до 1,5 см в диаметре с четкими границами.
При развитии пневмоторакса определяется спавшееся поджатое воздухом легкое, при развитии хилоторакса — интенсивная гомогенная тень (за счет выпота) с косовосходящей верхней границей.
Компьютерная томография легких. Для LAM характерны множественные диффузные хорошо очерченные мелкие тонкостенные кисты. Кисты при этом заболевании значительно отличаются от зон центрилобулярной эмфиземы легких, которые не имеют четких границ и своих собственных стенок, а также от фиброзирующего альвеолита, при котором основные изменения расположены по периферии легких, имеются поля фиброза и дезорганизации паренхимы легких, а кисты расположены субплеврально и характеризуются довольно толстыми стенками. Данные компьютерной томографии настолько специфичны для LAM, что некоторые авторы для постановки точного диагноза полагают достаточным заключение компьютерной томографии без проведения биопсии легких.
Некоторые исследователи показывают, что легочные кисты уменьшаются в объеме во время выдоха, что свидетельствует о наличии связи кист с воздухоносными путями. В связи с этим рекомендуется выполнять КТ во время глубокого вдоха и выдоха. Некоторые авторы считают, что изменения размеров воздушных образований в легких во время респираторной пробы характерны для кистозных бронхоэктазов (в отличие от субплевральных булл).
Многие авторы отмечают большие трудности дифференцирования LAM с другими диффузными поражениями легких, в частности с гистиоцитозом Х, в связи с чем в целях окончательной диагностики считают необходимым производить биопсию легкого.
Исследование вентиляционной способности легких. Характерно увеличение остаточного объема легких в связи с образованием множественных кист. У большинства больных определяется также обструктивный тип дыхательной недостаточности: снижение объема форсированного выдоха за одну секунду (FEV1). Обструктивные изменения выявляют уже на самых ранних стадиях заболевания, поэтому больным может быть ошибочно установлен диагноз бронхиальной астмы или хронического обструктивного заболевания легких даже при отсутствии соответствующей клинической картины. Однако для LAM (в отличие от бронхиальной астмы или хронического обструктивного заболевания легких) характерно выраженное снижение диффузионной способности легких. Рестриктивная дыхательная недостаточность (снижение FEV1) присоединяется по мере прогрессирования заболевания.
Исследование газов крови. По мере развития дыхательной недостаточности появляется артериальная гипоксемия, парциальное напряжение кислорода снижается, особенно после физической нагрузки.
Патологоанатомические исследования еще долго будут сохранять ведущую роль в диагностике, однако все больше ощущается необходимость комплексного подхода к оценке каждого клинического случая. Проблемы, возникающие при гистологической классификации новообразований, далеко не всегда разрешимы даже при использовании самых современных методов. Ошибки морфологов нередко приводят к неправильному выбору тактики лечения. Опыт в этой области накапливается медленно и не всегда успевает за требованиями клиники.
 Классификация ВОЗ является безусловной схемой индивидуализации гистологических особенностей практически всех новообразований легкого по объективным признакам, но даже опытные специалисты старой универсальной онкологической закалки не всегда могут охватить весь спектр нарушений структуры тканей. Известно, что стандартная классификация — это только основа для выбора дополнительных методов исследования. Нередко приходится сталкиваться со смешанными злокачественными структурами, когда оценка нозологии затруднительна и только субъективная оценка ситуации помогает правильно выбрать оптимальную трактовку морфологической ситуации. Современный онколог хорошо представляет себе условность любой удобной классификации, понимает противоречия реальной практической работы. Успехи всегда связаны с эрудицией, широким кругозором и постоянным совершенствованием научного багажа специалиста.
Классификация ВОЗ является безусловной схемой индивидуализации гистологических особенностей практически всех новообразований легкого по объективным признакам, но даже опытные специалисты старой универсальной онкологической закалки не всегда могут охватить весь спектр нарушений структуры тканей. Известно, что стандартная классификация — это только основа для выбора дополнительных методов исследования. Нередко приходится сталкиваться со смешанными злокачественными структурами, когда оценка нозологии затруднительна и только субъективная оценка ситуации помогает правильно выбрать оптимальную трактовку морфологической ситуации. Современный онколог хорошо представляет себе условность любой удобной классификации, понимает противоречия реальной практической работы. Успехи всегда связаны с эрудицией, широким кругозором и постоянным совершенствованием научного багажа специалиста.
Не только от патологоанатомов, но и от клиницистов требуется знание современных течений в онкологии и смежных областях науки, понимание текущих проблем и ограниченных возможностей новейших методов диагностики. Без каждодневного труда у постели конкретного больного, без творческого использования уже накопленных знаний не может быть адекватного профессионального роста всех сотрудников онкологической бригады, основным звеном которой остается опытный морфолог.
Несмотря на имеющиеся современные диагностические возможности (чрезбронхиальная биопсия легких, открытая биопсия легких, КТ высокого разрешения), количество диагностических ошибок велико.
Лечение
Эффективной терапии LAM, за исключением трансплантации легких, пока не существует. В ряде случаев стабилизации заболевания удается достигнуть на фоне оперативного удаления яичников, назначения медроксипрогестерона (400–800 мг один раз в месяц внутримышечно или 10–20 мг/сут внутрь), тамоксифена (20 мг/сут) или аналогов лютеинизирующего рилизинггормона. Анализ 300 опубликованных клинических случаев LAM показал, что наиболее эффективными оказались прогестерон и офорэктомия, которые чаще приводили к улучшению состояния больных. Беременность и терапия эстрогенами ускоряют прогрессирование заболевания.
Вероятно, со временем будут разработаны новые эффективные подходы к лечению данной патологии.
1. Садовников А.А., Панченко К.И., Смирнова М.Ю. Лейомиоз легких // Проблемы туберкулеза и легких. — 2006. — № 7. — С. 47-50.
2. Швец Н.И., Бенца Т.М., Станишевский В.В. Лимфангиолейомиоматоз: современный взгляд на проблему // Ліки України. — 2009. — № 8. — С. 41-45.
3. Abbott G.F., Rosado-de-Christenson M.L., Frazier A.A. et al. From the archives of the AFIP: lymphangioleiomyomatosis: radiologicpathologic correlation // Radiographics. — 2005. — 25. — 803-828.
4. Avila N.A., Dwyer A.J., Rabel A. et al. CT of pleural abnormalities in lymphangioleiomyomatosis and comparison of pleural findings after different types of pleurodesis // AJR Am. J. Roentgenol. — 2006. — 186. — 1007-1012.
5. Avila N.A., Dwyer A.J., Rabel A. and Moss J. Sporadic lymphangioleiomyomatosis and tuberous sclerosis complex with lymphangioleiomyomatosis: comparison of CT features // Radiology. — 2007. — 242(1). — 277-85.
6. Avilo N.A., Chen C.C., Chu S.C., Wu M., Jones E.C., Neumann R.D., Moss J. Pulmonary lymphangioleiomyomatosis: correlation of ventilation-perfusion scintigraphy, chest radiography, and CT with pulmonary function tests // Radiology. — 2000. — 214. — 441-6.
7. Benden C., Rea F., Behr J. et al. Lung transplantation for lymphangioleiomyomatosis: the European experience // J. Heart Lung Transplant. — 2009. — 28. — 1-7.
8. Bissler J.J., McCormack F.X., Young L.R. et al. Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis // N. Engl. J. Med. — 2008. — 358. — 140-151.
9. Bittmann I., Rolf B., Amann G., Lohrs U. Recurrence of lymphangioleiomyomatosis after single lung transplantation: new insights into pathogenesis // Hum. Pathol. — 2003 Jan. — 34(1). — 95-8.
10. Casper K.A., Donnelly L.F., Chen B. et al. Tuberous sclerosis complex: renal imaging findings // Radiology. — 2002. — 225. — 451-456.
11. Cohen M.M., Freyer A.M., Johnson S.R. Pregnancy experiences among women with lymphangioleiomyomatosis // Respir. Med. — 2009. — 103. — 766-772.
12. Costello L.C., Hartman T.E., Ryu J.H. High frequency of pulmonary lymphangioleiomyomatosis in women with tuberous sclerosis complex // Mayo Clin. Proc. — 2000 Jun. — 75(6). — 591-4.
13. Davies D.M., Johnson S.R., Tattersfield A.E. et al. Sirolimus therapy in tuberous sclerosis or sporadic lymphangioleiomyomatosis // N. Engl. J. Med. — 2008. — 358. — 200-203.
14. Johnson S.R. Lymphangioleiomyomatosis // Eur. Respir. J. — 2006. — 27(5). — 1056-65.
15. Glassberg M.K., Elliot S.J., Fritz J. et al. Activation of the estrogen receptor contributes to the progression of pulmonary lymphangioleiomyomatosis via MMP-induced cell invasiveness // J. Clin. Endocrinol. Metab. — 2008. — 93. — 1625-1633.
16. Harari S., Cassandro R., Chiodini J., et al. Effect of a gonadotrophin-releasing hormone analogue on lung function in lymphangioleiomyomatosis // Chest. — 2008. — 133. — 448-454.
17. Hohman D.W., Noghrehkar D., Ratnayake S. Lymphangioleiomyomatosis: A review // Eur. J. Intern. Med. — 2008. — 19(5). — 319-24.
18. Kircher J., Stein A., Viel K., Dietrich C.F., Thalhammer A., Schneider M., Jacobi V. Pulmonary lymphangioleiomyomatosis: high-resolution CT findings // Eur. Radiol. — 1999. — 9. — 49-54.
19. Kpodonu J., Massad M.G., Chaer R.A., Caines A., Evans A., Snow N.J., Geha A.S. The US experience with lung transplantation for pulmonary lymphangioleiomyomatosis // J. Heart Lung Transplant. — 2005. — 24(9). — 1247-53.
20. Keyzer C., Banker A.A., Remmelinck M., Gevenois P.A. Pulmonary lymphangiomyomatosis mimicking Langerhans cell histiocytosis // J. Thorac. Imaging. — 2001. — 16. — 185-7.
21. Lazor R., Valeyre D., Lacronique J. et al. Low initial KCO predicts rapid FEV1 decline in pulmonary lymphangioleiomyomatosis // Respir. Med. — 2004. — 98. — 536-541.
22. McCormack F.X. Lymphangioleiomyomatosis: a clinical update // Chest. — 2009. — 133(2). — 507-16.
23. Oberstein E.M., Fleming L.E., Gomez-Marin O. et al. Pulmonary lymphangioleiomyomatosis (LAM): examining oral contraceptive pills and the onset of disease // J. Women''s Health. — 2003. — 12. — 81-85.
24. Pechet T.T., Meyers B.F., Guthrie T.J. et al. Lung transplantation for lymphangioleiomyomatosis // J. Heart Lung Transplant. — 2004. — 23. — 301-308.
25. Reynaud-Gaubert M., Mornex J.F., Mal H. et al. Lung transplantation for lymphangioleiomyomatosis: the French experience // Transplantation. — 2008. — 86. — 515-520.
26. Roach E.S., Sparagana S.P. Diagnosis of tuberous sclerosis complex // J. Child Neurol. — 2004. — 19. — 643-649.
27. Schiavina M., Di Scioscio V., Contini P. et al. Pulmonary lymphangioleiomyomatosis in a karyotypically normal man without tuberous sclerosis complex // Am. J. Respir. Crit. Care Med. — 2007. — 176. — 96-98.
28. Steagall W.K., Glasgow C.G., Hathaway O.M. et al. Genetic and morphologic determinants of pneumothorax in lymphangioleiomyomatosis // Am. J. Physiol. Lung. Cell Mol. Physiol. — 2007. — 293. — L800-L808.
29. Taveira-DaSilva A.M., Steagall W.K., Moss J. Lymphangioleiomyomatosis // Cancer Control. — 2006 Oct. — 13(4). — 276-85.
30. Tomasian A., Greenberg M.S., Rumerman H. Tamoxifen for lymphangioleiomyomatosis // N. Engl. J. Med. — 1982. — 306. — 745-746.