Газета «Новости медицины и фармации» 8(321) 2010
Вернуться к номеру
Иммунологичеcкие аспекты болезней пародонта и внутренних органов
Состояние здоровья тканей и органов полости рта — губ, зубов, языка и пародонта определяют уровень здоровья человека в рамках интегративной концепции. В связи с этим привлекает внимание идея И.И. Мечникова о ведущей роли микрофлоры полости рта в поддержании здоровья человека с современных мировоззренческих позиций.
Микрофлоре полости рта принадлежит особая роль в поддержании стабильного состояния здоровья человека. Хронические гингивиты и пародонтиты разрушают соединительную ткань пародонта, связки периодонта и альвеолярные отростки челюстей, перманентно поставляя в пищеварительную и дыхательную системы организма патогенную микрофлору и продукты ее жизнедеятельности.
Основным субстратом патогенеза, запускающим воспалительный процесс в пародонте, является микробиота зубного налета, локализующегося в специфичных локусах: на поверхностях коронковых частей зубов, ямках и фиссурах, а также на апроксимальных поверхностях: от клинических шеек зубов до контактных пунктов. Кроме того, много зубного налета откладывается в областях зубо-десневых соединений sulcus gingivae (SG).
Микрофлора полости рта представлявляет собой высокочувствительную индикаторную систему микробиоты, реагирующую как качественными, так и количественными сдвигами на патологические изменения в органах и системах организма человека.
Клиническая картина воспаления в тканях пародонта характеризуется гиперемией, отеком и кровоточивостью.
На молекулярном и клеточном уровнях воспалительный процесс проявляется возникновением клеточных инфильтратов и высвобождением цитокинов, ведущих факторов воспаления, сочетающихся с факторами комплемента. Продукты воспаления — молекулы липополисахаридов, запускают цепные иммунологические реакции местного и общего уровня, в свою очередь, проявляющиеся деструктивными процессами в тканях пародонта, образуя классический circulus vitiosus [5].
Кроме того, патологические процессы в полости рта негативно информационно-энергетически влияют на органы через посредство системы гомогетероэнергетических связей организма.
В ходе эволюции при постоянных взаимодействиях организма человека и многочисленных популяций микроорганизмов окружающей среды происходила адаптация, сопровождавшаяся совершенствованием симбиоза организма человека, а также селекция микроорганизмов, способных к адгезии и колонизации биотопа полости рта микробиотой. Образовались стойкие симбиотические ассоциации микроорганизмов, а также своеобразные экологические ниши микробиоты в фиссурах и естественных углублениях коронковых частей зубов, зубо-десневых бороздках, на спинке языка etc.
Полость рта — среда обитания, биотоп микробных ассоциаций, здесь в процессе филогенеза сформировались стабильные симбиотические ассоциации, запустившие процесс образования микробиоты макроорганизма хозяина.
Микробиота организма человека стала своеобразным органом, состоящим из микробных клеток, количество которых от 10 до 30 раз превышает клеточные структуры макроорганизма. Согласно литературным данным, общая площадь кожного покрова и слизистых оболочек человека достигает
Из этой площади поверхности 80 % приходится на поверхность толстого и тонкого кишечника, 16 % — на слизистую оболочку легких, 0,5 % (
Полость рта — открытый биотоп, обладающий свойствами своеобразного биологического термостата-инкубатора. Постоянная температура, влажность, благоприятные показатели рН, аэрация, наличие измельченной пищи, пункты ретенции создают благоприятные условия для колонизации, размножения и снабжения не только микробными ассоциациями, но и продуктами их жизнедеятельности.
В полости рта человека в процессе онтогенеза постоянно формируется и совершенствуется микроэкологическая система защитной биопленки в пищеварительной и дыхательной системах. Биологическая пленка полости рта представлена ротовой жидкостью, в которую имплантированы многочисленные колонии индигенной микрофлоры. Защитная биопленка содержит продукты метаболизма макроорганизма и его микрофлоры, ферменты, иммуноглобулины, иммунные клетки, полисахариды.
Плод человека имеет стерильные биотопы полости рта и носоглотки. При прохождении через родовые пути матери полость рта и носоглотка новорожденного заселяются микробными ассоциациями биоценоза вагины, которые запускают развитие индивидуального биоценоза, задающего, в свою очередь, алгоритм развития микробиоты организма и иммунитета. Поэтому строгое ограничение половых контактов роженицы, деконтаминационно-заместительная терапия при необходимости являются гарантией нормального естественного становления микробной экосистемы и иммунитета человека.
В естественных условиях микробиота защитной биопленки полости рта в первую очередь выполняет функцию противомикробного фильтра, предотвращающего колонизацию биотопа патогенными микроорганизмами, транслокацию и проникновение токсинов во внутреннюю среду организма, прежде всего в дыхательную и пищеварительную системы.
Посредством микробиоты биопленки организм человека регулирует иммунные ответы местного и системного уровней. Защитная биопленка — это активный сорбент, выводящий из организма токсины. Она поддерживает энергетический и трофический обмен веществ, выполняет роль специфического регулятора, поддерживающего гармонию взаимоотношений организма с собственной индигенной микрофлорой биотопа полости рта, а также с транслоцировавшимися в биотоп во время приема пищи и дыхания микроорганизмами.
Из клинических наблюдений известно, что зубной налет (dental plaqne), образованный микробиотой, наиболее часто локализуется на оральных поверхностях шеек нижних центральных резцов. Один грамм зубного налета, по данным разных авторов, содержит от 59 до 811 микробных тел. Зубной налет, «сползая» по поверхности эмали зубов в sulcus gingivae, раздражает, вызывая воспалительный процесс, увеличивающий объем истекающего периодонтального ликвора в десятки раз. Установлено, что определяющим значением для здоровья человека обладают не только состав, но и локализация зубного налета относительно поверхности эпителиального слоя слизистой оболочки полости рта.
В ходе развития пародонтита микробиота зубного налета пенетрирует дно SG, проникая под эпителий в строму соединительной ткани, вызывая в ней воспалительный процесс. Воспаление, в свою очередь, увеличивает объем истекающего ликвора и таким способом улучшает объем питательной среды микробиоты зубо-десневых карманов. Кроме того, воспалительный процесс дна SG стимулирует присущий эпителию SG, вызывает дефект эпителиального покрова дна SG, отсекает связки периодонта. Погружной рост эпителия ограничивают пределы компактной пластинки периодонтальной щели. Периодонт замещает грануляционная ткань, значительно увеличивая площадь поверхности тканей, инфильтрируемых микробиотой зубного налета.
Таким образом, можно постулировать, что основным патогенетическим звеном, гранью, преобразующей микробиоту зубного налета, образованного индигенной микробиотой полости рта, является, во-первых, преодоление эпителиального покрова, во-вторых, возникновение и распространение воспалительного инфильтрата в соединительную ткань пародонта за зубо-десневое соединение SG и проникновение в системный кровоток.
Площадь поверхностей периодонта зубов составляет 75 см2. Таким образом, если у пациента наблюдается атрофия половины (1/2) кости альвеолярного отростка челюсти, то инфицированная микробиотой зубного налета раневая поверхность составит от 30 до 40 см2. Такая площадь инфицированной раны значительно увеличивает риск транслокации представителей микробиоты зубного налета в системный кровоток. При этом если при генерализованных пародонтитах патологические десневые карманы достигают глубины 4–5 мм, то в совокупности они представляют собой хронически инфицированную рану площадью от 10 до 20 см2.
С учетом данных о распространенности заболеваний пародонта и клинических наблюдений о том, что большинство пациентов обращаются за стоматологической помощью несвоевременно, воспалительный процесс в полости рта может приводить к длительной выраженной бактериемии, существенно снижающей показатели иммунитета, и истощению иммунной системы [10].
Микроорганизмы биотопа полости рта на фоне пародонтитов оказывают влияние на системное здоровье человека четырьмя путями: бактериемией, системной диссиминацией, локально образующимися медиаторами воспаления, провоцирующими аутоиммунный ответ, при аспирации бактериального содержимого и его попадании в органы дыхания и систему пищеварения [11].
Современные модели функционирования микробиоты биотопа полости рта, пищеварительной, дыхательной систем и кожного покрова свидетельствуют о том, что местные антигены микробиоты, продуцируемые бактериальным налетом на внешних оболочках, обеспечивают не только местную толерантность, не только местные, но и системные иммунные реакции организма. Кроме того, местные антигены микробиоты полости рта принимают активное участие в «системной передаче информации», реализуемой через серию ядерных факторов — каппа и бета — синтеза и секреции цитокинов и хемокинов, регулирующих воспалительный процесс как локально, так и системно. Большинство клеток пародонта, фибробластов тканей десны секретируют простагландины, интерлейкин-1-бета, интерлейкин-6, интерлейкин-8, фактор некроза опухоли (ФНО) и гамма-интерферон. Медиаторы влияют на воспалительный процесс как локально, так и системно (табл. 1) [13].
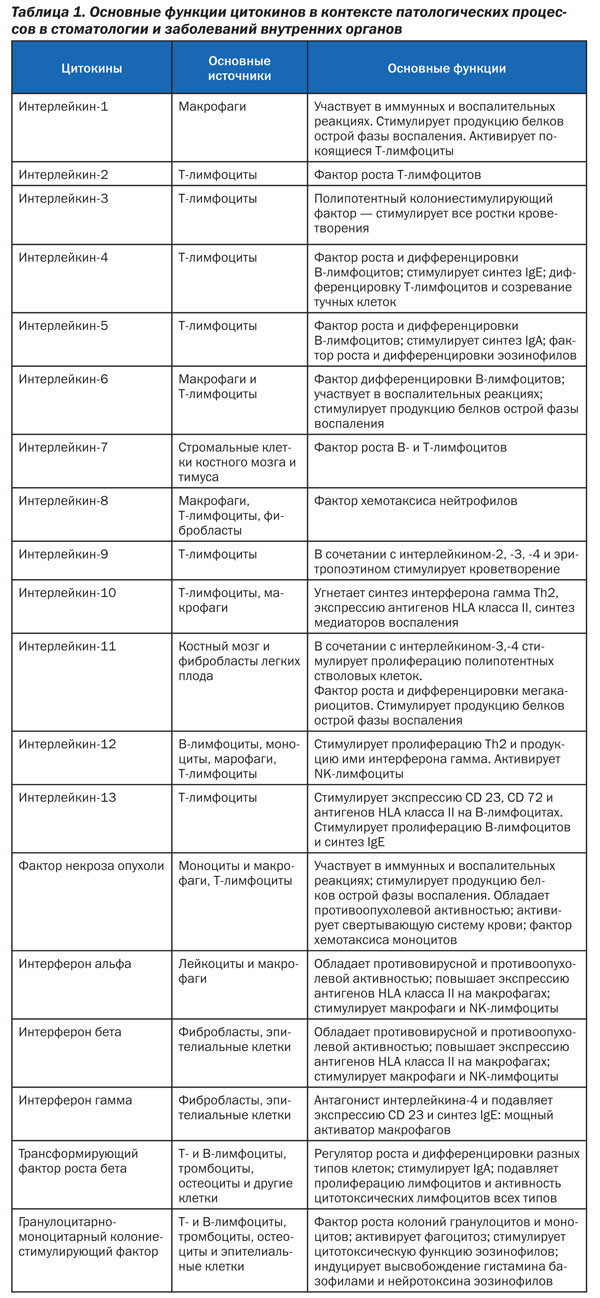 3
3
Объясняется тесная корреляция между воспалением тканей пародонта и патофизиологией хронических воспалительных заболеваний организма двумя механизмами: первый связан с влиянием микробиоты биотопа полости рта и продуктов ее жизнедеятельности на патогенез атеросклеротических бляшек при инфаркте миокарда; второй — с установленным влиянием медиаторов воспаления, вызванных патогенами пародонта, на патогенез атеросклероза, сахарного диабета, имеющих многофакторную этиологию. Эти внутренние болезни, как правило, возникают как следствие хронических заболеваний пародонта.
Установлена тесная связь между С-реактивным белком острой фазы сыворотки крови и тяжестью заболевания пародонта. Обычно С-реактивный белок активируется при травмах, инфицированных некрозах и опухолях, связан с сердечно-сосудистыми заболеваниями и сахарным диабетом. С-реактивный белок синтезируется в печени в ответ на отсутствие цитокинов, таких как интерлейкин-1-альфа, интерлейкин-1-бета и интерлейкин-6. В их продуцировании принимают участие ФНО альфа, ФНО бета, металлопротеазы матрикса и фактор трансформированного роста [7]. Современные методы лечения направлены на снижение инфицирования пародонта, включающее в себя механическое удаление над- и поддесневых зубных отложений.
Предложенный нами метод лечения включает деконтаминационно-заместительную терапию: последовательное использование местных противомикробных средств, таких как, например, нитрофуроксазид, в течение 5–7 суток, а затем аппликации пробиотической микрофлоры, например, симбитер-2 концентрат, на такой же срок. Для создания высокой местной концентрации противомикробного препарата и пробиотика использовали тонкостенные каппы из термопласта. После такого лечения уменьшается количество и даже совсем исчезают маркеры заболеваний пародонта, тем самым уменьшая риск возникновения острого коронарного синдрома и сахарного диабета [6].
Антимикробный и противовоспалительный эффект может дать применение пасты с триклозаном/кополимером/фтором (Colgate Total). Триклозан подавляет высвобождение простагландина Е2 из фибробластов тканей десен, что стимулируется интерлейкином-1-бета, а также уменьшается образование интерлейкина-1-альфа и гамма-интерферона (IF-гамма). Местное действие специально синтезированного триклозана уменьшает частоту и предупреждает возникновение заболеваний пародонта [18, 19].
В течение 24 месяцев триклозан существенно улучшал гигиеническое состояние полости рта, состояние десен и пародонта в группах высокого риска — курильщиков [12].
Для больных инфарктом миокарда в анамнезе было характерно худшее состояние полости рта по сравнению с контрольной группой. Каким образом воспалительный процесс в пародонте влияет на атерогенез? Происходит стимуляция цитокинов в периферической крови. Она, в свою очередь, стимулирует синтез в печени С-реактивного белка, который вызывает повреждение сосудов, тем самым стимулируется атерогенез, приводя к инсультам или инфаркту миокарда [14].
Pseudomonas aeruginosa, Staphylococcus aureus и кишечные бактерии проявили способность колонизировать зубы. Цитокины — факторы воспаления продуцируются пародонтом и попадают в слюну, а затем и в дыхательные пути, вызывая обструктивную болезнь легких и нагноительные заболевания легких за счет недостаточности компонентов фактора Н комплемента или компонентов факторов R комплемента (табл. 2) [13].
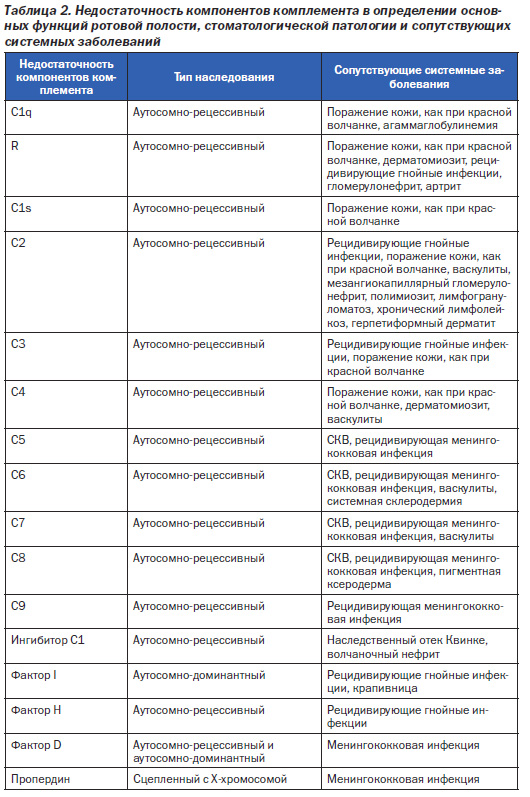
Заболевания легких — госпитальная пневмония и хроническая обструктивная болезнь легких — связаны с плохим состоянием полости рта.
Таким образом, зубной налет приводит к хроническому воспалению, и гингивит — начальное проявление этого процесса. Избыточный местный ответ, включая синтез цитокинов и антител, в определенных условиях приводит к разрушению связок периодонта и опорного костного каркаса, вызывая пародонтит, связующее звено между системными заболеваниями — атеросклерозом, инфарктом миокарда, болезни легких [15].
Под регенерацией в стоматологии понимают восстановление структурных элементов тканей взамен погибших. Регенерация может происходить на разных уровнях (органа, ткани, клетки и т.п.). Однако во всех случаях речь идет о возмещении структуры, выполняющей специализированные функции. Иначе говоря, полноценная регенерация предполагает восстановление как морфологии, так и функции [16].
В настоящее время в челюстно-лицевой хирургии разработаны методы хирургических вмешательств, предполагающие регенеративное течение послеоперационной фазы.
Различают три вида регенерации: физиологическую, репаративную восстановительную и репаративную патологическую. Говоря о направленной регенерации ткани, следует иметь ввиду полную репаративную регенерацию, для которой характерно замещение дефекта тканью, идентичной погибшей, т.е. восстановление костных структур пародонта, его связочного аппарата, цемента [4].
До недавнего времени регенерация рассматривалась в качестве завершающего этапа различных патологических процессов, когда с ее помощью организм после освобождения от омертвевших тканей устраняет образовавшийся дефект. Однако теперь на основе данных электронно-микроскопических исследований стало очевидным, что процесс регенерации запускается не на финальном этапе болезни, а в самом ее начале в качестве «противовеса» возникающему повреждению, который активно протекает на протяжении всего патологического процесса, становясь четко выраженным на его завершающей стадии. Поэтому возникла необходимость «управлять» регенерацией с самого начала процесса повреждения тканей [21].
Весь комплекс тканей, которые окружают зуб, называют пародонтом. В его состав входят кость альвеолярного отростка челюсти, цемент корня зуба и периодонтальные связки [9].
В настоящее время в пародонтологии для лечения заболеваний пародонта используют методы направленной регенерации тканей. Она применяется для изменения течения раневого процесса путем влияния на размножение и миграцию клеток.
Клетками «управляют», чтобы убедиться, что раневой процесс идет именно путем регенерации, т.е. восстановления архитектуры и функции тканей опорно-удерживающего аппарата зуба, а не репарации, которая, как известно, приводит к «починке», но не к реставрации околозубных тканей. Таким образом, направленная регенерация тканей увеличивает предсказуемость восстановления структур пародонта, разрушенных пародонтином [23].
Стремление к полному морфофункциональному восстановлению пораженных тканей (по большому счету к выздоровлению) так же старо, как и сама медицина. Но систематическое исследование процессов регенерации началось лишь в конце XIX века. В начале XX века активно изучались процессы регенерации поврежденных мышц, нервных волокон при переломах костей и др. Долгое время для лечения деструктивных заболеваний пародонта цель — регенерация пораженных тканей — не могла быть достигнута, поскольку применялись исключительно репаративные хирургические методики.
Исследования показали, что контакт альвеолярной кости с соединительной тканью десны и с поверхностью корня, освобожденной от пародонтальных волокон, не формирует прикрепление, а вызывает анкилоз и резорбцию корней зубов. Следовательно, необходимо было помешать срастанию как эпителия, так и соединительной ткани и альвеолярной кости с обнаженной поверхностью корня. Выход был найден, когда была продемонстрирована способность клеток периодонтальной связки регенерировать с помощью целлюлозного фильтра; при этом удаляли с вестибулярной поверхности зубов альвеолярную кость, периодонт, цемент. Над каждым дефектом фиксировался целлюлярный фильтр. Раневая поверхность закрывалась слизисто-надкостальным лоскутом. Через 6 месяцев гистологически определялась регенерация альвеолярной кости, образование нового цемента с приросшими к нему волокнами периодонта.
Таким образом, периодонтальная связка способна восстанавливаться при условии ограничения десневого эпителия и соединительной ткани. Тем самым показана важность сохранения жизнеспособности периодонтальной связки для регенерации пародонта. Ткань периодонтальной связки содержит родительские клетки типа остеобластов, которые дифференцируются в остеобласты и цементобласты.
Основные показания для применения методики направленной регенерации тканей — это глубокие узкие двух- или трехстеночные карманы, поражение функции 2-й степени на нижней челюсти.
Ход операции и использование методики направленной регенерации тканей у больных с прогрессирующим пародонтитом, например, в области нижнего резца сводится к следующему.
После откидывания полного лоскута необходимо полирование корня, инструментальная обработка костного канала, проведение скейлинга с удалением грануляционной ткани. Вокруг обработанного корня в виде манжетки укладывается целлюлярный фильтр вплоть до эмалево-цементной границы, окруженный своего рода воротничком, изолирующий как эпителий, так и соединительную ткань от контакта с поверхностью зуба. Затем ушивается лоскут. Через 3 месяца гистология показала наличие нового цемента с вросшими в него коллагеновыми волокнами.
Данная операционная техника называется направленной регенерацией тканей, и после применения при этой технике нерезорбирующих мембран политетрафторэтилена и резобирующих мембран, состоящих из животного или человеческого коллагена и синтетических полимеров — полилактидной кислоты и лактид-гликолид-кополимеров, ее принято называть золотым стандартом.
Этапы операции с использованием мембран следующие:
7. Припасовка мембраны и ее фиксация. В случае резорбирующих мембран применяется резорбирующий шовный материал, а при использовании нерезорбирующих мембран — специальные штифты [2].
8. Фиксация лоскута швами так, чтобы лоскут перекрывал мембрану на 2–
При появлении признаков инфицирования необходимо удалить мембрану.
Нерезорбирующие мембраны удаляют через 6 недель.
С позиций иммунологических процессов и регенерации важная роль принадлежит факторам роста, к которым относятся ТФР-бета, ГМ-КСФ, М-КСФ, Г-КСФ [3].
Трансформирующий фактор роста бета (ТФР-бета), который продуцируется различными типами клеток, включая В- и Т-лимфоциты и моноциты-макрофаги. Основной функцией этого фактора является угнетение роста и активности Т-клеток, а также функции макрофагов, В-клеток, нейтрофилов и природных киллеров (NK-killers). Не принимая во внимание, что этот фактор получил характеристику негативного регулятора иммунных ответов, его повышенное образование в организме приводит к ускоренным репаративным процессам в случае нагноительных ран, усиления синтеза коллагена под влиянием этого фактора. Усиливается продукция IgA.
Таким образом, основная роль ТФР-бета состоит в угнетении иммунного ответа, когда нет его развития (например, после ликвидации инфекции), данный трансформирующий фактор роста способствует процессам регенерации и репарации.
Следующий фактор роста — гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ), который продуцируется Т-лимфоцитами и моноцитами-макрофагами; усиливает рост клеток, дифференцировку их и активацию незрелых и зрелых гранулоцитов и моноцитов.
Моноцитарный колониестимулирующий фактор Т-лимфоцитами и моноцитами-макрофагами (М-КСФ); усиливает рост, дифференцировку и активацию незрелых и зрелых гранулоцитов и моноцитов.
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) продуцируется стромальными клетками костного мозга и моноцитами-макрофагами; усиливает рост, дифференцировку и активацию незрелых и зрелых гранулоцитов и моноцитов.
Различные патологии ротовой полости часто идентифицируются в обобщенной форме и группируются под одним названием — заболевания пародонта. Даже дифференциальная диагностика этих патологий, как правило, недостаточна для того, чтобы избежать ненужных видов терапии, которые не только отличаются друг от друга, но зачастую бесполезны и даже вредны [1].
Гомотоксический анализ, напротив, показывает, что для патологии такого рода, как гингивит, характерна своя специфическая этиология. Более того, проведение антигомотоксической терапии свидетельствует о том, что ответ на данный вид терапии позволяет выявить новые проявления течения заболевания, которые важны в плане новых интерпретаций патологического процесса у конкретного пациента.
Анализ патологических изменений в динамике терапии должен дать новую информацию для понимания причин нарушения психонейроэндокринно-метаболически-иммунологического и генного баланса, что впоследствии приведет к уменьшению предрасположенности организма к воздействию внешних неблагоприятных факторов или возникновению осложнений. Такая оценка должна помочь выяснить истинное состояние пациента с позиций заболевания пародонта в контексте возможных осложнений внутренних органов.
Различные заболевания десен — гингивиты — характеризуются многообразием клинических проявлений в форме бактериальных гингивитов, гингивитов гормональной природы (предменструальной, пубертатной, при беременности), гиперпластический гингивит при диабете, гиперпластический гингивит после приема лекарственных препаратов, шелушащийся гингивит, острый язвенно-некротический гингивит и пародонтальный гингивит при СПИДе [20].
Гиперпластический гингивит при сахарном диабете или развивающийся после приема лекарственных препаратов может быть верифицирован при гистологическом исследовании препаратов тканей пораженных областей, а также при визуальном исследовании десен. Патологические изменения происходят на фоне угнетения иммунной системы и длительной перегрузки токсинами. Одним из лекарственных препаратов, вызывающих гиперплазию десен, является циклоспорин, мощный иммуносупрессор, который оказывает эффект на Т-лимфоциты и продукцию цитокинов [8].
Поражение внутренних органов при гиперпластическом гингивите в форме хронического персистирующего гепатита и жировой дистрофии печени, макро- и микропатий с присоединением атеросклероза осложняет в целом течение основного заболевания [22].
По данным литературных источников, сочетание заболеваний пародонта с болезнями внутренних органов характеризуется достоверным увеличением процентного содержания активированных Т- и В-лимфоцитов и моноцитов (СD 25), приблизительно до 25 %, что свидетельствует об активности иммунного ответа организма.
О глубине иммунного повреждения свидетельствуют повышение уровня ЦИК и снижение абсолютного количества естественных киллеров (СD 16). Наряду с изменением клеточного и гуморального звеньев иммунитета отмечается и угнетение фагоцитарного числа и показателя завершения фагоцитоза [17].
Cимптоматика гингивита беременных сходна, хотя и в более выраженной форме, с таковой при пубертатном гингивите. Фито- и гомеопатическая терапия имеет большое значение при лечении этой патологии, так как больные часто страдают от побочных эффектов после применения аллопатических препаратов.
Таким образом, существует определенное число исследований, которые указывают на существование связей заболеваний пародонта с некоторыми системными заболеваниями. Необходимо проведение дальнейших исследований, которые могут оперировать более совершенными определениями того, как заболевания десен и пародонта как локализованный хронический процесс способствуют развитию, прогрессированию и тяжести системных заболеваний и патологии внутренних органов.
1. Бардаро С. Гингивиты: анализ с позиции гомотоксикологии // Биологическая терапия. — 1999. — № 2. — С. 4-20.
2. Барабанти Н., Черутти А. Клинические инструкции применения стекловолоконных шифтов для постэндодонтических реставраций // Дента блиц. — 2008. — № 6 (27). — С. 4-7.
3. Клиническая иммунология и аллергология / Под редакцией Г.Н. Дранника. — Киев: Здоровье, 2006 — С. 96.
4. Сивовол И. Методика направленной регенерации ткани // Дентальные технологии. — 2001. — № 2. — С. 20-22.
5. Стоматологический компендиум — заболевания пародонта: гингивит // Medical World Bisness Press. — 2004. — 19 с.
6. Brown D.L., Lee H.M., Kong K. et al. Effect of sub-antimicrobial doxicycline on biomarkers with acute coronare syndromes // J. Dent. Res. — 2003 — 82 (Spec. iss.). Abstract 1443.
7. Gabay C., Kushner I. Acute phase proteins and other systemic responses to inflamation // N. Engl. J. Med. — 1999. — 340. — S. 448-454.
8. Gaffar A., Scherl D. et. al. The effects of triclosan on mediators of gingival inflamation // J. Clin. Periodentol. — 1995. — 22. — S. 480-484.
9. Grossi S.G., Screpsinsi F.B. et al. Treatment of periodontal disease in diabetics reduced glicated hemoglobin // J. Periodentol. — 1997. — 68. — S. 713-719.
10. Haffajee A., Socransky S.S. Microbial etiological agents of destructive periodontal disesses // Periodentol. — 2000. — 1994. — 5. — S. 78-111.
11. Hayday A., Viney J.L. The ins and outs of body surfase immunology // Science. — 2000. — 290. — S. 97-100.
12. Kerdvongbundit V. Wikesjz Effect of triclosan on healing following non-surgucal periodontal therapy in smokers // J. Clin. Periodentol. — 2003. — 30. — S. 1024-1030.
13. Koj A. Iniation of acute phase response and syntesis of cytokines // Biochim. Biophys. Acta. — 1996. — 131. — S. 84-94.
14. Lin Y., Fung K.K., Sherl D., Affitto J. et al. Gingival absorbtion of triclosan oll owing topical mouthrinse inflamation // Amer. J. Dent. — 1994. — 7. — S. 13-16.
15. Loesche W.J., Lopatin D.E. Interaction between periodontal disease, medical disease and immunity in older individuals // Periodentol. — 2000. — 1998. — 16. — S. 80-105.
16. Loos B.G., Grandijk J. et al. Evalution of systemic markers related to cardiovascular diseases in peripheral blood of periodontis pts // J. Periodentol. — 2000. — 71. — S. 1528-1534.
17. Moshage H. Cytokines and acute phase response // J. Pathol. — 1997. — 181. — S. 257-266.
18. Mustafa M., Wondimu B., Bachiet M. et al. Induction of interferon gamma in human gingival fibroblast chalenged with fitogemaglobin // Cytokine. — 2000. — 12. — 368-373.
19. Mustafa M., Wondimu B. et al. Effects of triclosan of interleukin-1 beta production in human gingival fibroblast chalenged with tumor necrosis phactor alfa // Eur. J. Oral. Sci. — 1998. — 106 (
20. Page R.C., Korman K.S. The patogenesis of human periodontis: an introduction // Periodentol. — 2000. — 1997. — 14. — S. 9-11.
21. Rosling B., Wanfors B. et al. The use triclosan/copolimer dentifice may retard progression of periodontitis // J. Clin. Periodentol. — 1997 — 24. — S. 837-880.
22. Slade G.D., Offenbacher S. et al. Acute phase inflamatory response to periodontal disease in the US population // J. Dent. Res. — 2000. — 79. — S. 49-57.
23. Teng Y.T. The role of acquired immunity and periodontal disease // Crit. Res. Oral. Biol. Med. — 2003. — 14. — S. 237-252.
