Газета «Новости медицины и фармации» 8(321) 2010
Вернуться к номеру
Эффективность Энерлива у больных ИБС пожилого возраста, получающих гиполипидемическую терапию статинами
Авторы: В.Ю. Приходько, д.м.н., Л.И. Коваленко, к.м.н., Н.А. Масленникова, Е.А. Кононенко, И.Р. Микропуло, И.А. Диба. Национальная медицинская академия последипломного образования им. П.Л. Шупика, Институт геронтологии АМН Украины, г. Киев
Версия для печати
Несмотря на прогресс в диагностике, лечении и профилактике сердечно-сосудистых заболеваний, они остаются наиболее частой причиной смерти среди населения экономически развитых стран. Сердечно-сосудистые заболевания являются самой распространенной причиной смертности и инвалидности населения Украины (63 % всех смертей в Украине). В 2006 году в Украине зарегистрированы около 24 млн больных сердечно-сосудистыми заболеваниями, что составляет 63 % взрослого населения страны. Только за один год в Украине было зарегистрировано около 50 тыс. инфарктов миокарда и 110 тыс. инсультов. Основной патологический процесс, лежащий в основе развития этих заболеваний, — нарушение обмена холестерина (ХС), липопротеидов и атеросклеротическое поражение сосудов усугубляются у пожилых людей возрастными изменениями в сосудах и жизненно важных органах (артериосклероз, эндотелиальная дисфункция, инсулинорезистентность, тканевая гипоксия и др.) (О.В. Коркушко, 1980, 1993; А.В. Токарь, 1991; В.В. Фролькис, 1984). Согласно возрастной динамике сывороточных липидов, в процессе старения происходит накопление атерогенных фракций липопротеидов — увеличивается содержание в крови липопротеидов очень низкой и низкой плотности (ЛПНП) и снижается уровень липопротеидов высокой плотности (ЛПВП), которые являются антириск-факторами атеросклероза. Этому способствует возрастное уменьшение липопротеидлипазы, повышение количества насыщенных жирных кислот с длинной углеродной цепью и уменьшение количества ненасыщенных. Возрастная диспротеинемия с понижением мелкодисперсных фракций белка и повышением крупнодисперсных приводит к увеличению атерогенных апопротеидов, что благоприятствует образованию атерогенных липопротеидов. С возрастом наблюдается снижение толерантности к глюкозе у 70 % здоровых пожилых и 85 % старых людей, что сопровождается гиперинсулинемией и является фактором атерогенеза. Ускоряют процессы атерогенеза у людей пожилого возраста развивающиеся явления полигиповитаминоза и дисбаланс микроэлементного обмена. Благоприятствующими факторами развития атеросклероза в позднем онтогенезе являются гиперактивность симпатоадреналовой системы, гипотиреоз, гипоэстрогенемия у женщин и андрогенная недостаточность у мужчин, иммунный дефицит и аутоиммунные реакции [1, 12–14].
Несмотря на продолжающиеся дискуссии о снижении негативной роли дислипидемии с возрастом, нарушения липидного обмена признаны сегодня одним из основных факторов риска сердечно-сосудистых заболеваний без оговорок на возраст (ESC, ESH Guidelines, 2007).
К факторам, значительно повышающим риск сердечно-сосудистой смерти, относятся (ESC, ESH Guidelines, 2007):
— или холестерин ЛПНП > 3,0 ммоль/л (> 115 мг/дл);
— холестерин ЛПВП: для мужчин < 1,0 ммоль/л (< 40 мг/дл), для женщин < 1,2 ммоль/л (< 46 мг/дл);
— триглицериды (ТГ) > 1,7 ммоль/л (> 150 мг/дл).
Повышение уровня общего холестерина более 8,5 ммоль/л увеличивает риск фатальных кардиоваскулярных событий в 4 раза, при сочетании с артериальной гипертензией — в 9 раз, в случае наличия трех факторов риска — гиперхолестеринемии, курения и артериальной гипертензии — в 16 раз. Установлено, что снижение уровня общего холестерина на 10 % сопровождается снижением риска смертности от сердечно-сосудистых заболеваний на 15 %, а общей смертности — на 11 % [1, 12, 13]. Согласно данным доказательной медицины, гиполипидемическая терапия статинами рассматривается как долговременная стратегия первичной и вторичной профилактики сердечно-сосудистых заболеваний и тяжелых ишемических исходов: смерть, инсульт, инфаркт. Проспективный метаанализ данных, полученных на 90 056 пациентах — участниках 14 рандомизированных исследований статинов, свидетельствует о том, что снижение концентрации холестерина липопротеинов низкой плотности достоверно уменьшает частоту коронарной болезни сердца и других основных сердечно-сосудистых событий. В настоящее время отмечается несколько новых тенденций в применении статинов, в том числе и в гериатрической практике. В соответствии с современными рекомендациями такие патологические состояния, как метаболический синдром, сахарный диабет, симптомные атеросклеротические поражения сонных, периферических артерий, аневризма брюшного отдела аорты, рассматриваются как эквиваленты кардиальных нарушений и увеличивают популяцию пациентов, нуждающихся в терапии статинами [12–14].
Показания к медикаментозной терапии дислипидемий
Медикаментозная терапия (статины, фибраты) назначается пациентам без ИБС или 2 факторов риска при отсутствии эффекта от диеты, снижения массы тела и физических тренировок, когда уровень холестерина ЛПНП остается более 4,9 ммоль/л.
У пациентов с 2 и более факторами риска медикаментозное лечение начинают при уровне холестерина ЛПНП более 4,1 ммоль/л.
Подтвержденная ИБС является показанием к лечению, независимо от уровня ХС (NB!). Статины снижают риск развития инфаркта миокарда и инсульта на 30 % не только за счет гиполипидемического эффекта, но также противовоспалительного и антитромботического.
Целевой уровень ХС ЛПНП не должен превышать 3,0 ммоль/л независимо от наличия или отсутствия ИБС и количества факторов риска ее развития.
Целевые значения липопротеидов:
Следуя международным рекомендациям, практический врач вынужден будет все шире назначать гиполипидемическую терапию, объясняя больному ее преимущества. При этом мы неизбежно столкнемся и с необходимостью жесткого контроля побочных действий статинов, негативного отношения пациентов к этим препаратам, способным ухудшить и без того неидеальную в позднем онтогенезе функцию печени.
Статины и печень
Однако применение препаратов группы статинов, особенно увеличение доз, сопряжено с возникновением побочных эффектов в виде снижения функциональной активности печени. Согласно экспертной оценке ведущих специалистов в области гепатологии (Национальная липидная ассоциация США), на основании достаточного количества рандомизированных клинических исследований с высокой степенью убедительности и доказанности установлено, что повышение уровней печеночных ферментов (0,5–2 % случаев) — аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) — является наиболее частым побочным эффектом статинов и зависит от дозы препарата [16, 18, 22, 23].
У пожилых пациентов это осложняется имеющейся возрастной закономерной инволютивной морфологической и метаболической недостаточностью органов и систем, наличием множественной хронической патологии (полиморбидности). Масса и размеры печени после 60 лет уменьшаются на 150–200 г за счет уменьшения числа гепатоцитов. Возрастная инволюция печеночных клеток характеризуется уменьшением проницаемости клеточных мембран, усилением в цитоплазме явлений стеатоза, который охватывает 10–20 %, уменьшением и повреждением митохондрий, увеличением матрикса и наличием паракристаллических включений. Это способствует развитию портального фиброза, а впоследствии — цирроза печени, который обнаруживается у 66 % мужчин пожилого и старческого возраста. Морфологические изменения гепатоцитов и снижение уровня биохимических процессов нарушают ферментативную активность печени.
Снижается активность ферментов микросомального окисления в печени (деметилазы, гидроксилазы). Активация перикисного окисления липидов на фоне сниженной антиоксидантной защиты приводит к деградации мембран и разрушению цитохрома Р450. Накопление продуктов ПОЛ — альдегидов — активирует звездчатые клетки печени, продуцирующие коллаген, и стимулирует хемотаксис нейтрофилов, выработку цитокинов (ФНО, ИЛ-6, ИЛ-8), продолжительный воспалительный ответ, синтез амилоидных пептидов, угнетение синтеза белка, подавление глюконеогенеза, нарушение митохондриального дыхания, индукцию апоптоза. Это тормозит метаболизм эндогенных и экзогенных веществ, обусловливает частые осложнения и побочные реакции, особенно при приеме медикаментозных препаратов [9].
Кроме того, в гериатрической клинической практике практически у всех пациентов с дислипопротеинемией, которым рекомендуется проводить терапию статинами, выявляются различные хронические диффузные заболевания печени, сопровождающиеся жировой инфильтрацией печени с элементами фиброза. При этом изменения метаболизма липидов носят системный характер и сопровождаются нарушением обмена на уровне гепатоцита, синтеза желчи, ее выведения из печени, активацией перекисного окисления липидов, угнетением активности ретикулоэндотелиальной системы печени. Применение статинов дополнительно вызывает снижение функциональной активности печени в виде повышения уровней некоторых ферментов — АЛТ, ГГТ, ЩФ. Если считается, что у пациентов зрелого возраста повышение трансаминаз более трех верхних границ нормы при терапии статинами в терапевтических дозах, как правило, бессимптомное и преходящее и не требует дополнительной коррекции, то в пожилом возрасте такой подход не всегда оправдан, так как компенсаторные возможности организма ограничены. Следует учитывать, что препараты группы статинов метаболизируются с участием изоферментов 3А4 и 2С9 системы цитохрома в печени. Конкурентное связывание фермента препаратами, метаболизм которых также осуществляется теми же изоферментами, ведет к повышению концентрации статинов в плазме крови и усилению их токсических влияний. Изофермент цитохрома 3А4 участвует в метаболизме таких препаратов, применяемых у пожилых кардиологических больных, как фелодипин, нифедипин, верапамил, варфарин, а 2С9 — в метаболизме атенолола, диклофенака, варфарина. В случае сочетания с указанными препаратами целесообразно в начале лечения назначать минимальную дозу статинов и не реже 1 раза в месяц контролировать уровень печеночных ферментов крови [16–19].
Частота эффекта гиперферментемии у больных пожилого возраста, страдающих артериальной гипертензией, ишемической болезнью сердца и принимающих гиполипидемическую терапию статинами, как и методы коррекции, мало изучены. Не решен вопрос о связи терапии статинами с возникающими значимыми нарушениями функции печени или печеночной недостаточностью. В связи с этим при исходном (до начала терапии статинами) повышении трансаминаз следует уточнить причину гиперферментемии. На протяжении всей терапии статинами практическое значение имеет вопрос о мониторировании трансаминаз. Согласно действующим рекомендациям, следует определять трансаминазы исходно, затем через 4–6–12 недель после начала терапии статинами, при повышении дозы, в начале комбинированной гиполипидемической терапии и периодически впоследствии [16, 22, 23]. Необходимо внимательно относиться к жалобам пожилых пациентов на недомогание, слабость, сонливость, дискомфорт в правом подреберье, проявления желудочной и кишечной диспепсии, иногда — обострение желчнокаменной болезни (ЖКБ), кожные проявления, желтуху как к возможным проявлениям гепатотоксичности. В таких случаях для диагностики поражения печени предпочтительно определение фракций билирубина, которые в отсутствие холестаза являются более четким маркером в сравнении с изолированным повышением трансаминаз. При подтверждении поражения печени следует прервать терапию статинами и установить причину. При изолированном бессимптомном повышении трансаминаз более 3 раз выше границы нормы следует определить их уровни повторно, при сохраняющейся гиперферментемии — исключить возможные вторичные причины [16–19]. Развитие печеночной недостаточности может быть проявлением идиосинкразии или аутоиммунных заболеваний печени, спровоцированных приемом статинов [22, 23]. Только исчезновение симптомов на фоне отмены лечения свидетельствует в пользу диагноза «статин-индуцированная ферментопатия печени». В последнее время рассматриваются возможности профилактики нарушений функциональной активности печени при приеме гиполипидемических препаратов в виде дополнительной гепатопротекторной терапии, которая благодаря этиопатогенетическим свойствам может способствовать стабильному проведению длительной статинотерапии.
Гепатопротекторный эффект Энерлива
Группа гепатопротекторов гетерогенна и включает вещества различных химических групп с разнонаправленным воздействием на метаболические процессы. Лидирующее место среди применяющихся групп гепатопротекторов сохраняют эссенциальные фосфолипиды (ЭФЛ). Связано это прежде всего с широким спектром гепатопротекторного влияния данной группы на ткань печени. Главными свойствами препарата являются [3–7]:
В настоящее время интерес представляет современный препарат ЭФЛ Энерлив (Berlin-Chemie Menarini).
В своем составе он содержит обезжиренные и обогащенные соевые фосфолипиды (содержащие не менее 76 % полиненасыщенного фосфатидилхолина), которые обладают гепатопротекторным и гипохолестеринемическим действием, а также способностью тормозить жировое перерождение печени и развитие в ней соединительной ткани. Главным отличием Энерлива от других препаратов ЭФЛ является то, что наряду с высоким уровнем фосфатидилхолина он не содержит красителей, детергентов и вкусовых добавок. Для понимания механизма защитного действия Энерлива следует учитывать, что все клеточные мембраны имеют типичное строение и в среднем на 2/3 (мембрана митохондрий — на 92 %) состоят из фосфолипидов, 80–90 % которых представлены фосфатидилхолином. Помимо структурной функции, фосфолипиды участвуют в процессах молекулярного транспорта, делении и дифференцировке клетки, стимулируют активность различных ферментных систем. Статины, выступая в определенной степени как гепатотоксические вещества, вызывают повреждение цитоплазматической и митохондриальных мембран гепатоцитов, что закономерно ведет к нарушению внутриклеточного метаболизма и повреждению клетки. Благодаря своим физиологическим функциям Энерлив способствует ускорению восстановления гепатоцитов (уменьшает апоптоз клеток), стабилизирует клеточные мембраны, тормозит окисление липидов в пероксидные соединения, уменьшает жировую дистрофию печени и стимулированную продукцию провоспалительных цитокинов (таких как TNF α и интерлейкин-1). Это приводит к угнетению синтеза коллагена и торможению трансформации звездчатых клеток печени (клетки Ито) в коллагенпродуцирующие, что повышает вероятность формирования антифибротического эффекта. Восстанавливаются обменные процессы в клетках печени, что способствует повышению ее детоксикационного и экскреторного потенциала. Кроме того, Энерлив повышает активность липопротеинлипазы, ответственной за внутрисосудистое расщепление липопротеидов очень низкой плотности, и приводит к снижению уровня холестерина и триглицеридов, а также активирует лецитинхолестеринацилтрансферазу, которая участвует в этерификации холестерина в составе липопротеидов высокой плотности. Данные свойства Энерлива позволяют использовать этот препарат в качестве «медикаментозной защиты» печени при применении статинов и будут способствовать более эффективным результатам гиполипидемической терапии.
В связи со всем вышеизложенным нами было проведено исследование эффективности Энерлива у больных пожилого возраста, страдающих артериальной гипертензией, ишемической болезнью сердца, имеющих нарушения липидного обмена и получающих гиполипидемическую терапию статинами (аторвастатин).
Материалы и методы
Дизайн исследования предусматривал сравнение результатов терапии аторвастатином и аторвастатином в комбинации с Энерливом пациентов с дислипидемией, страдающих артериальной гипертензией, ХИБС, дисциркуляторной гипертензивной и атеросклеротической энцефалопатией 1–2-й ст. В клинике было обследовано 30 пациентов пожилого возраста (60–74 лет, средний возраст — 65,4 ± 2,3 года). Критериями исключения явились вирусные и алкогольные поражения печени.
В план обследования сравниваемых групп входили:
1. Изучение общеклинических показателей исходно и после лечения (сбор анамнеза, объективное клиническое обследование больного, измерение АД, ЭКГ).
2. Изучение биохимических показателей исходно и после лечения. Для оценки состояния липидного спектра крови определялись следующие показатели: общий холестерин, ХС липопротеидов низкой плотности, ХС липопротеидов высокой плотности, триглицериды, индекс атерогенности (ИА). Определялись показатели печеночных ферментов трансаминазы (АЛТ, АСТ), общий, прямой и непрямой билирубин, креатинин и мочевина, общий белок крови, глюкоза крови. Всем больным проводился анализ на маркеры вирусных гепатитов.
3. Ультразвуковое исследование органов брюшной полости.
Все пациенты были госпитализированы в клинику с сердечно-сосудистыми заболеваниями (артериальная гипертензия, ХИБС, дисциркуляторная гипертензивная и атеросклеротическая энцефалопатия 1–2-й ст.). Однако на этом фоне у всех обследованных больных отмечались при УЗИ диффузные изменения в печени, соответствовавшие неалкогольному стеатогепатозу, признаки хронического холецистита, а у 5 — ЖКБ. Учитывая показатели липидограммы (увеличение уровня общего холестерина выше 5,2 ммоль/л, ЛПНП выше 4,5 ммоль/л, триглицеридов выше 1,8 ммоль/л), а также наличие ИБС, являющейся независимым показанием к назначению статинов, всем пациентам назначался аторвастатин в дозе 10 мг/сут. При назначении статинов мы столкнулись с настороженностью и некоторым негативизмом со стороны пациентов, опасавшихся возможного ухудшения функции печени при приеме этих небезразличных, по их мнению, для печени препаратов.
Всех обследованных мы разделили на 2 группы, сравнимые по возрасту, патологии и принимаемым препаратам. Больные группы 1 получали антигипертензивную терапию (ИАПФ, БРА 2, бета-блокаторы и кальциевые антагонисты), аторвастатин 10 мг в сутки и Энерлив в качестве гепатопротектора по 1 капсуле 3 раза в сутки. Больным группы 2 Энерлив не назначался, но для облегчения синдрома «правого подреберья» они получали желчегонный сбор, приготовленный в кабинете фитотерапии Института геронтологии. Длительность стационарного курса лечения составила 21–28 дней (в среднем 24 дня), затем больные выписывались с рекомендациями продолжать прием препаратов под наблюдением участкового терапевта. Обследование проводилось в первые дни после поступления в клинику и непосредственно перед выпиской. В этом исследовании проверялась гипотеза о положительной роли Энерлива в целях коррекции функциональной активности печени при лечении гипохолестеринемическими препаратами.
Результаты исследования
В группе 1, которая получала дополнительно к статинотерапии Энерлив в качестве гепатопротектора, отмечена следующая динамика основных биохимических показателей (табл. 1).
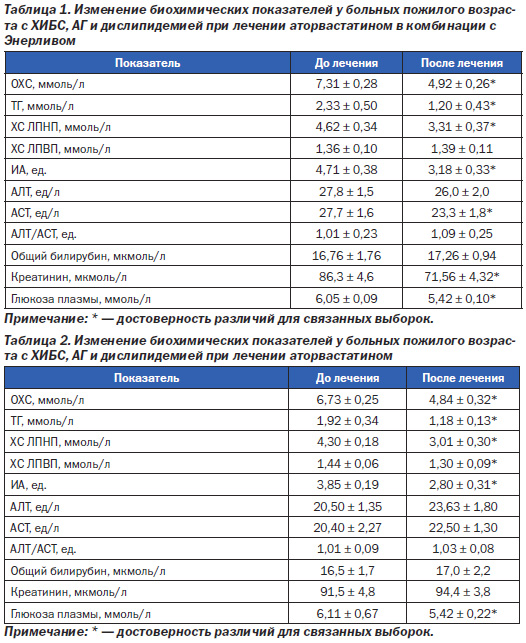
Как и следовало ожидать, за 3 недели терапии статинами у больных группы 1 удалось снизить уровень ОХС, ТГ и ХС ЛПНП (соответственно на 42,5, 48,5 и 28,4 %). Нормальные значения этих показателей были достигнуты у всех пациентов, а целевые для ИБС — у 73 % (11 человек). ИА также достоверно снизился (на 32,5 %). В группе 1 отмечена очень позитивная тенденция в отношении ХС ЛПВП. Этот показатель имел тенденцию к увеличению (у 12 пациентов он незначительно увеличился, у 3 — не изменился), что в целом по группе выразилось в отсутствии динамики. В отношении АЛТ у пациентов группы 1 не было отмечено достоверных изменений, а вот активность АСТ достоверно снизилась (на 16 %). Соотношение АЛТ/АСТ достоверно не изменилось, так же как показатели билирубина. Интересно было отметить достоверное снижение креатинина сыворотки крови (на 17 %). Никогда прежде при статинотерапии мы такого явления не наблюдали, тем более что антигипертензивная терапия больных группы 1 не отличалась от стандартной, не приводящей к динамике уровня креатинина.
Для того чтобы пояснить отмеченные изменения, приведем данные группы 2, не получавшей дополнительной гепатопротекторной терапии (табл. 2).
У пациентов группы 2 при приеме такой же дозы аторвастатина (10 мг/сутки) на протяжении 3 недель лечения было отмечено достоверное снижение уровня ОХС, ТГ и ХС ЛПНП (соответственно на 28,2, 38,5 и 30 %). Следует отметить, что степень снижения липидных показателей была несколько ниже, чем у больных группы 1. Особенно это касалось ОХС и ТГ, для которых отмечены достоверные различия с группой 1. Подобные различия можно объяснить возможным потенцирующим действием Энерлива на гиполипидемический эффект статинов. ИА в группе 2 снизился на 27,2 %. А вот в отношении ХС ЛПВП отмечалась динамика, противоположная группе 1. Этот показатель достоверно снизился на 9,7 %. Таким образом, добавление Энерлива в комплексную терапию больных с гиперлипидемией позволило не допустить снижения уровня ХЛПВП и даже способствовало некоторому его повышению у ряда больных. Показатели ферментов АЛТ и АСТ в группе 2 достоверно не изменились, тогда как в группе 1 было отмечено снижение активности АСТ на 16 %. Этот эффект мы также склонны пояснять действием гепатопротектора Энерлива.
Труднее пояснить различия в динамике креатинина. В группе 2 этот показатель не изменился, тогда как в группе 1 он снизился на 17 %. Косвенным пояснением этого факта может быть усиление дезинтоксикационной функции печени под влиянием Энерлива.
Возможно, интенсификация обменных процессов в печени под влиянием эссенциальных фосфолипидов привела к активации цикла мочевины, связыванию и выведению аммиака, что косвенно отразилось в улучшении показателя деятельности почек. Хотя на сегодняшний день прочную теоретическую основу под этот факт подвести трудно.
В отношении субъективного состояния больных хотим отметить, что в группе 1 ни один пациент не пожаловался на дискомфорт в правом подреберье, хотя раньше больные отмечали такие явления при приеме нескольких препаратов одновременно. В группе 2, несмотря на прием желчегонного сбора, у 3 пациентов отмечалась тяжесть в правом подреберье, которую пациенты связывали с медикаментозной нагрузкой. Связи частоты возникновения дискомфорта в правом подреберье с явлениями хронического холецистита по данным УЗИ мы не отметили.
Таким образом, прием Энерлива в дозе 1 капсула 3 раза в сутки одновременно со статинами способствует:
Все это подтверждает выраженное мембранопротекторное, репаративное, гиполипидемическое действие препарата Энерлив.
В литературе описаны подобные эффекты эссенциальных фосфолипидов. Гепатопротекция проявляется в снижении уровня печеночных ферментов в сыворотке крови (К.Й. Гундерман, 2002; К.Г. Гуревич, 2002; И.И. Дегтярева, 2002), замедлении процессов перекисного окисления липидов, улучшении процессов печеночного метаболизма, регенерации гепатоцитов. О.М. Драпкина (2004) указывает на то, что эссенциальные фосфолипиды повышают активность липопротеинлипазы, ответственной за внутрисосудистое расщепление липопротеидов очень низкой плотности, что приводит к снижению уровня холестерина и триглицеридов. Этим и можно объяснить более значимое снижение ОХС и ТГ у больных, получавших одновременно со статинами Энерлив. Кроме того, ЭФЛ активируют лецитинхолестеринацилтрансферазу, которая участвует в этерификации холестерина в составе липопротеидов высокой плотности, что поясняет положительное влияние на эту липидную фракцию.
Снижение уровня креатинина сыворотки крови в группе, получавшей Энерлив, также можно связать с действием этого препарата, хотя четко объяснить это явление пока не удается.
Таким образом, на основании полученных данных:
1. Доказана эффективность применения Энерлива у пожилых пациентов с сердечно-сосудистыми заболеваниями, получающих статинотерапию.
2. Подтверждена хорошая переносимость Энерлива у гериатрических пациентов. При этом достаточным является прием Энерлива по 1 капсуле 3 раза в сутки. На фоне применения Энерлива быстрее купируется «синдром правого подреберья», диспептический синдром, не повышается активность трансаминаз и в большей мере нормализуется липидный спектр (снижение атерогенных фракций и повышение антиатерогенных).
3. Рекомендуется применение Энерлива
1. Аронов Д.М. Лечение атеросклеротической дислипидемии и атеросклероза // Трудный пациент. — 2003. — Том 1, № 4. — С. 31-34.
2. Подымова С.Д. Жировой гепатоз, неалкоголный стеатогепатит. Клинико-морфологические особенности. Прогноз. Лечение // РМЖ. — 2005. — Том 7, № 2. — С. 61-67.
3. Гундерман К.Й. Новейшие данные о механизмах действия и клинической эффективности эссенциальных фосфолипидов // Клин. перспективы гастроэнтерол., гепатол. — 2002. — № 2. — С. 21-24.
4. Гуревич К.Г. Эссенциальные фосфолипиды в лечении заболеваний печени // Качественная клин. практика. — 2002. — № 4. — С. 1-4.
5. Дегтярева И.И., Козачок Н.Н., Куц Т.В. и др. Терапевтическая эффективность применения Эссенциале форте Н при хронических токсических диффузных заболеваниях печени // Сучасна гастроентерологія. — 2005. — № 4. — С. 76-79.
6. Дегтярева И.И., Скрыпник И.Н., Невойт А.В. и др. Гепатопротекторы-антиоксиданты в терапии больных с хроническими диффузными заболеваниями печени // Новые медицинские технологии. — 2002. — № 2. — С. 18-23.
7. Звягинцева Т.Д., Чернобай А.И., Дергачева А.В. Эссенциальные фосфолипиды в гастроэнтерологии // Сучасна гастроентерологія. — 2004. — № 2. — С. 51-55.
8. Коркушко О.В. Клиническая кардиология в гериатрии. — М.: Медицина, 1980. — 285 с.
9. Коркушко О.В., Чеботарев Д.Ф., Калиновская Е.Г. Гериатрия в терапевтической практике. — К.: Здоров''я, 1993. — 800 с.
10. Токарь А.В., Ена Л.М., Негарэ А.И. Возрастные особенности простагландиновой системы у здоровых людей и больных с артериальной гипертензией // Вестник АМН СССР. — 1990. — № 3. — С. 33-36.
11. Фролькис В.В., Безруков В.В., Шевчук В.Г. Кровообращение и старение. — Л.: Наука, 1984. — 210 с.
12. Baigent C. Cholesterol Treatment Trialists'' (CTT) collaborators // Lancet. — 2005. — 366. — 1267-78.
13. National Cholesterol Education Program (NCEP) Adult Treatment Panel (ATP) III // JAMA. — 2001. — 285. — 2486-97.
14. Grundy S.M., Cleemam J.I., Merz C.N.B. et al. National Heart, Lung, and Blood Institute,
15. Bays H. Statin safety: an overview and assessment of the data.2005 // Am. J. Cardiol. — 2006. — 97 (8A). — 6C-27.
16. Thompson P.D., Clarkson P.M., Rosenson R.S. An assessment of statin safety by muscle experts // Am. J. Cardiol. — 2006. — 97 (8A). — 69С-77.
17. Cohen D.E., Anania F.A., Chalasani N. An assessment of statin safety by hepatologists // Am. J. Cardiol. — 2006. — 97 (8A). — 77С-82.
18. McKenney J.M., Davidson M.H., Jacobson T.A. Final conclusions and recommendations of the NLA Statin Safety Task Force // Am. J. Cardiol. — 2006. — 97 (8A). — 89С-96.
19. Guyton J.R. Benefit versus risk in statin treatment // Am. J. Cardiol. — 2006. — 97 (8A). — 96С-9.
20. Pasternak R.C., Smith S.C. Jr, Bairey-Merz C.N. et al. ACC/AHA/NHLBI clinical advisory on the use and safety of statins // JACC. — 2002. — 40. — 567-72.
21. Satapathy S., Sakhuja P., Malhotra V., Sharma B., Sarin S. Beneficial effects of pentoxifylline on hepatic steatosis, fibrosis and necroinflammation in patients with non alcoholic steatohepatitis // J. Gastroenterol. Hepatol. — 2007. — 22. — 634-638.
22. Parra J.L., Reddy K.R. Hepatotoxicity of hypolipidemic drugs // Din. Uver. Dis. — 2003. — 7. — 415-33.
23. De Denus S., Spinier
