Газета «Новости медицины и фармации» Аллергология и иммунология (322) 2010 (тематический номер)
Вернуться к номеру
Наблюдение больного с атопическим дерматитом на педиатрическом участке
Авторы: В.А. Клименко, В.П. Кандыба, Л.М. Адарюкова, Е.В. Давиденко, Т.С. Котовщикова, А.А. Соколова. Харьковский национальный медицинский университет. Областная детская клиническая больница № 1. Харьковский областной детский аллергоцентр
Версия для печати
Атопический дерматит (АД) остается актуальной проблемой для педиатров. Актуальность проблемы обусловлена распространенностью патологии (5–20 % в зависимости от возраста). Учитывая размер педиатрического участка (800 детей), у каждого педиатра под наблюдением находится минимум 50 пациентов с АД. В Украине (в связи с экономическим кризисом и угрозой сокращения узких специалистов) периодически возникают дискуссии, кто должен лечить больного АД. Но пока идут дискуссии (более или менее жаркие в зависимости от интеллектуального и культурного уровня собравшихся), всех этих детей наблюдает педиатр, и именно он решает основные практические проблемы, в том числе и вопрос направления к узким специалистам. Подобным образом решена проблема во всем мире. Например, в Великобритании ребенка, страдающего АД, наблюдает врач общей практики. Потребность в консультациях узких специалистов, показания к которым строго определены, возникает в 3 % случаев при легком течении болезни, в 15 % — при среднетяжелом и в 43 % — при тяжелом течении заболевания (в среднем — 6 %) [1].
В статье освещены основные вопросы, которые предстоит решать педиатру при ведении больного с АД.
Терминология
Атопический дерматит — генетически детерминированное хроническое воспалительное иммунопатологическое заболевание кожи, характеризующееся зудом, рецидивирующим стадийным течением с соответствующими клинико-морфологическими особенностями в зависимости от возраста; в типичных случаях начинается в раннем возрасте, чаще — на основе IgE-зависимых механизмов.
Термин «атопический дерматит» предложен в
Часто применяются термины «экссудативный диатез», «экссудативно-катаральный диатез» (введены А. Черни, 1905) и «аллергический диатез» (Гуго Кеммерер, 1920-е годы). Последние 3–5 лет на аллергологических форумах велась дискуссия о возможности применения термина «диатез» при АД. Сегодня детские аллергологи достигли консенсуса: термин «диатез» (греч. diathesis — склонность) как «аномалия конституции» применяется к детям с отягощенной по аллергии наследственностью без клинических проявлений заболевания. Наличие первого аллергического элемента на коже знаменует реализацию предрасположенности в заболевание и начало АД. Таким образом, даже при минимальных клинических признаках должен выставляться диагноз АД.
Термин «экзема» также получил широкое распространение. В Великобритании и в настоящее время общепринятым является термин «атопическая экзема» как синоним АД. Этот термин имеет шифр в МКБ-10. Но этимологическое значение слова «экзема» связано с «кипением» и изначально характеризовало только острые мокнущие дерматозы. Таким образом, данный термин является столь же несовершенным, как и термин «АД».
Врачи старшего поколения часто используют понятие «нейродермит». Термин имеет длительную историю: впервые был предложен Brocq (1902), потом к нему возвращались и в 1932 году (Rost, Marchionini), и в 1967-м (Schnyder, Borelli). Сегодня данный термин имеет больше историческое значение, чем научное, и отражает изменение наших представлений о роли нервной системы в патогенезе АД.
Таким образом, экссудативный диатез, экссудативно-катаральный диатез, аллергический диатез, экзема, нейродермит, пруриго Бенье, атопический дерматит — это синонимы. Термином, который должен применяться в практике, является «атопический дерматит». Именно он используется в современных Протоколах диагностики и лечения детей (Дополнение № 5 к Приказу МЗ Украины от 27.12.2005 г. № 767), при составлении статистики аллергических заболеваний, в методических рекомендациях, в большинстве научных работ.
Диагностика
Диагноз АД ставится согласно диагностическому алгоритму, созданному на основании критериев Hanifin, Rajka (1980). Прошло уже 30 (!) лет, но ничего принципиально нового к диагностическим критериям добавить не удалось. Диагноз основывается на типичных клинических признаках. Лабораторные и инструментальные обследования являются вспомогательными — ни один параклинический признак не может со 100% достоверностью ни подтвердить, ни исключить диагноз АД.
Диагностические критерии АД (Hanifin, Rajka, 1980)
Обязательные:
4. Индивидуальная или семейная история атопического заболевания.
Дополнительные:
Классификация
Официальной классификации АД в Украине нет. В своей практической работе мы пользуемся классификацией, созданной на основе рекомендаций О.И. Ласицы, 2004 (табл. 1). Она включает указание клинико-морфологической формы дерматита, определение тяжести течения и распространенности поражения кожи.
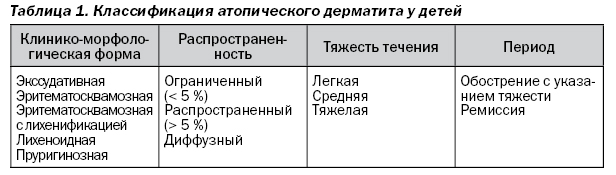
Название формы зависит от наличия соответствующих первичных и вторичных элементов сыпи. В пояснении нуждается только пруригинозная форма, характеризующаяся наличием множественных плотных пруригинозных (зудящих) папул.
Для унификации и объективизации оценки тяжести атопического дерматита, обеспечения последовательности ведения больного разными врачами на всех этапах лечения предложены полуколичественные шкалы. Общепризнана и наиболее распространена шкала SCORAD (Scoring of Atopic Dermatitis), предложенная в
Лечение
Элиминация триггеров. При ведении больного АД важное практическое значение имеет идентификация триггеров — ирритантов, кожной инфекции, контактных, пищевых и ингаляционных аллергенов, разработка элиминационных мероприятий. Для идентификации триггеров решающее значение имеют сбор анамнеза и осмотр больного. Важно не только выявить причинно-следственные связи обострений с действием определенных факторов, но и выяснить клинические проявления АД в зависимости от возраста. Так, например, аллергия к коровьему молоку, сое и яйцам маловероятна при начале АД после 2 лет. Сенсибилизация к ингаляционным аллергенам должна учитываться у больных с сезонными обострениями АД, при сочетании АД с астмой и аллергическим ринитом, а также у детей старше 3 лет при наличии участков поражения кожи на лице и особенно вокруг глаз.
На практике наиболее сложным вопросом является разработка элиминационной диеты (актуально для детей раннего возраста). Доказано наличие пищевой аллергии у 37–56 % детей с АД (чаще при среднетяжелом и тяжелом течении заболевания). Пищевые триггеры должны учитываться:
При назначении элиминационных диет надо учитывать:
Более точно выявить пищевые аллергены и определить элиминационную стратегию возможно методами аллергологического обследования — пациент должен быть направлен к аллергологу. Золотым стандартом для выявления пищевой гиперчувствительности остается провокационный пищевой тест [2]. Доказана высокая чувствительность (90–95 %) кожного прик-теста для выявления аллергической реакции немедленного типа. Чувствительность определения специфического IgE также высокая и составляет 83–100 % (для антигенов молока и яиц), 94–97 % (для антигенов пшеницы, сои, рыбы, арахиса). Патч-тест выявляет немедленную и замедленную аллергические реакции.
В Украине при назначении элиминационной диеты педиатры часто рекомендуют исключить сахар. Теоретически углеводы не являются «полноценными» аллергенами, не могут вызвать классическую аллергическую реакцию. На практике влияние сахара на обострение АД изучено I. Ehlers (2001). В исследование было включено 30 больных с АД, среди которых было 9 детей. Не выявлено разницы в тяжести обострений при оценке по шкале SCORAD у больных при исключении сахара из диеты [3].
С высоким уровнем доказательности показано, что мероприятия по элиминации домашней пыли имеют позитивное влияние на тяжесть болезни [4, 5].
Остается нерешенным и требует дальнейшего изучения вопрос относительно домашних животных — требуется ли немедленная их элиминация? В каком возрасте и как формируются аллергия и толерантность к домашним животным? Клинические наблюдения свидетельствуют о формировании толерантности к домашнему животному в раннем детстве и потере этой толерантности в тинейджерский период, когда подростки уходят из дома. Рекомендовать удаление животных из дома не всегда оправданно, так как для детей домашнее животное является одним из важнейших факторов, влияющих на их психологический дистресс.
В выборе элиминационной стратегии незаменимой является консультация аллерголога — именно он поможет выбрать правильный метод диагностики и установить причинно-значимые аллергены, без устранения которых невозможно добиться положительной динамики.
В лечении АД ведущее значение имеет наружная терапия.
Эмолиенты (смягчающие средства). Кожа больных АД характеризуется снижением барьерных свойств, обусловленным наличием генетического дефекта в строении белка филаггрина, обеспечивающего связь между эпителиоцитами [6]. Поэтому больные с АД нуждаются в особом уходе за кожей. Для устранения сухости кожи рекомендуются ежедневные купания. Кроме гидратации кожи, купание, душ уменьшают колонизацию кожи стафилококком. Оптимальным является 20-минутное купание в ванне или под душем прохладной дехлорированной водой (используют фильтры или отстаивают воду в ванне в течение 1–2 часов с последующим добавлением кипятка). При купании нельзя пользоваться мочалками, растирать кожу. Рекомендуется использование масел (неароматизированных!) типа эспафлора (Германия), которые наносятся непосредственно на кожу под душем или добавляются в воду. При вступлении в контакт с водой масло образует очень тонкую эмульсию, восстанавливающую поврежденную гидролипидную пленку кожи, защищая ее от дегидратирующего и раздражающего эффекта солей водопроводной воды.
Необходимо применение лечебных шампуней или мыла с нейтральным рН. После купания кожу необходимо промокнуть и нанести смягчающие и увлажняющие средства на влажную кожу. Наносить крем/мазь в течение дня нужно настолько часто, насколько это необходимо. Кремы/мази наносят как для создания окклюзионного эффекта и предотвращения потери воды, так и в качестве источника липидов, необходимых для формирования межклеточных соединений между кератиноцитами. Созданы новые поколения наружных средств для постоянного применения. Среди них — препараты, содержащие в своей основе липиды, керамиды, незаменимые жирные кислоты, олеосомы, мочевину и т.д. Примерами лечебных линий для базисной терапии АД являются топикрем (Франция), атопрел (Греция).
Оценка базисной терапии АД на практике позволила выявить две типичные ошибки при ведении больных. Первая — попытка заменить специализированные лечебные линии детским кремом. Делается это с благой целью — уменьшить бремя материальных затрат (довольно значительных!), а получается как всегда… Вторая ошибка — очень малое количество применяемых эмолиентов. В исследовании M.J. Cork (2003) была определена приблизительная потребность в эмолиентах у детей с АД — до 581 г/нед [7].
Применение эмолиентов также важно при проведении наружной терапии ТКС, учитывая наличие стероид-спаринг эффекта — возможности уменьшения дозы кортикостероидов на фоне применения эмолиентов. В исследовании M.J. Cork, 1998 (Германия), изучалась эффективность четырех различных алгоритмов наружной терапии ТКС (n = 44):
Через 3 недели констатировано отсутствие достоверной разницы в клинических проявлениях АД в группах, но при этом в четвертой группе было использовано гормона на 75 % меньше, чем в первой [8]. Таким образом, применение непарфюмированных эмолиентов ежедневно в большом количестве (до 250–500 г/нед) является необходимым условием для успешной терапии АД.
Топические кортикостероиды. ТКС остаются стандартом терапии АД — они обладают противовоспалительным, иммуносупрессивным действием, но также ингибируют пролиферацию фибробластов и синтез коллагена. В зависимости от вазоконстрикторного эффекта все ТКС по активности делятся на 4 класса. Активность ТКС зависит не только от формулы, концентрации активного вещества, но и от основы — так, ТКС в форме мази считаются более активными, чем в форме эмульсии. Эффективность ТКС доказана во многих рандомизированных контролируемых исследованиях (РКИ) [9–11] и ни у кого не вызывает сомнения, но остается дискуссионным вопрос: c какого класса активности ТКС целесообразно начинать лечение? Какой алгоритм предпочтителен — step up или step down?
Анализ историй болезни детей, поступавших в Харьковский областной детский аллергоцентр в
Учитывая сложившиеся стереотипы, считаем необходимым привести некоторые данные по побочным эффектам ТКС.
В двух перекрестных исследованиях было изучено влияние ТКС на кору надпочечников у детей, которые с раннего детства длительно применяли ТКС. В первое исследование (L. Patel, 1995) были включены дети, которые получали только мазь гидрокортизона 1% (n = 28, возраст 3–10 лет) [12], во второе (J.A. Ellison, 2000) — получавшие ТКС разной активности (n = 35, возраст 0,5–17 лет) [13]. У всех детей первой группы и у детей второй группы, которые получали ТКС слабой и средней активности, уровень кортизола в плазме крови после стимуляции низкими дозами адренокортикотропным гормоном (АКТГ) не отличался от контроля. У 4 детей из второго исследования, которые получали ТКС высокой и очень высокой активности, ответ на АКТГ был нарушен. Таким образом, ТКС высокой и очень высокой активности могут вызывать супрессию коры надпочечников, но остается нерешенным вопрос: какое количество и какая длительность применения препаратов являются безопасными?
Пример еще двух исследований по обсуждаемой проблеме. Применение мази гидрокортизона 2,5% (слабая активность) в течение 4 недель (n = 10) не вызывало супрессии коры надпочечников [14]. С другой стороны, при лечении так называемым безопасным кремом мометазона фуроатом 0,1% (n = 13) в течение в среднем 27 дней (максимум — 42) атрофия кожи отмечена у 4 детей (17 %). Также отмечено жжение при аппликации у 3 детей и гипертрихоз у 1 ребенка [15].
В Украине нет консенсуса по проблеме, с какого ТКС (слабой или сильной активности) начинать терапию АД у детей. Нам более импонирует алгоритм step up и начало терапии с применения ТКС слабой активности. Этот вопрос — тема последующих научных дискуссий, но хочется привести пример решения данной проблемы в Великобритании. В «Руководстве по лечению атопической экземы у детей от рождения до 12 лет» (декабрь 1997), созданном Национальным центром здоровья матери и ребенка Великобритании на основе принципов доказательной медицины, указаны следующие рекомендации по применению ТКС:
5. Лечение сильными ТКС в течение короткого периода так же эффективно, как продолжительное лечение слабыми ТКС.
Таким образом, отношение к ТКС сильной активности достаточно осторожное, и, по- видимому, пришло время и в Украине выработать определенные подходы к назначению ТКС разной активности.
Из бесспорных положений при применении ТКС необходимо учитывать следующее:
1. Аппликации ТКС должны быть прописаны с частотой не более 1–2 раз в сутки.
2. Необходимо чередовать ТКС различных химических соединений с учетом их активности для предупреждения развития тахифилаксии.
3. Запрещено разбавлять или смешивать ТКС — это меняет их структуру и адсорбционные характеристики. Должен быть интервал в несколько минут между нанесением ТКС и эмолиентов.
4. Для снижения риска осложнений рекомендуется применять современные технологии аппликаций ГКС:
Из новых технологий, которые применяются в Европе, необходимо отметить weekend therapy — у детей с неконтролируемым АД (более 2–3 обострений в месяц) рекомендовано наносить ТКС последовательно два дня в неделю профилактически. В Украине профилактическое применение ТКС запрещено.
Помимо ТКС существует еще один класс препаратов, обладающих противовоспалительным действием, — это топические ингибиторы кальциневрина (местные иммуносупрессанты) — пимекролимус (элидел) и такролимус. Препараты ингибируют активность белка кальциневрина, который вовлечен в активацию Т-клеток, и таким образом ингибируют продукцию провоспалительных цитокинов, не влияя на фибробласты и синтез коллагена. Такролимус рекомендован к применению при среднетяжелом и тяжелом АД, пимекролимус — при легком течении АД. Такролимус уже зарегистрирован в Украине, но он отсутствует в аптечной сети, и мы не имеем опыта его применения. Пимекролимус разрешен к применению в Украине с 3-месячного возраста, показан при наличии очагов поражения на лице и шее — тех участках, где важно не допустить развития атрофии кожи. Возможно его применение в ступенчатой схеме наружной терапии АД: первые 3–5 дней до уменьшения тяжести обострения применяется ТКС, а затем — пимекролимус до полной ликвидации воспалительных явлений на коже. Многочисленными РКИ доказана высокая эффективность и безопасность препарата. Его важнейшими преимуществами (в сравнении с ТКС) являются отсутствие воздействия на структурные клетки кожи (не развивается атрофия) и отсутствие воздействия на макрофаги кожи (клетки Лангерганса), являющиеся основными регуляторами иммунного ответа в коже.
Кромоны. В Украине кромоны для наружного применения не зарегистрированы, но уж больно драматична их судьба в истории лечения аллергических заболеваний, чтобы не остановиться на интересном факте. В Великобритании есть препарат алтодерм — лосьон кромогликата натрия 4%. Двойное слепое рандомизированное плацебо-контролируемое исследование R. Stainer (2005) изучило эффективность лосьона кромогликата натрия 4% у 114 детей в возрасте 2–12 лет. Через 12 нед. отмечено снижение индекса SCORAD на 36 и 20 % в основной и контрольной группах соответственно, а общее количество детей, у которых достигнуто снижение индекса SCORAD на 25 % и более, составило 50 и 30 % (отношение шансов — 2,29) в основной и контрольной группах соответственно [16]. Таким образом, доказательство эффективности кромогликата натрия при лечении АД соответствует наиболее высокому уровню доказательности.
Антигистаминные препараты. Антигистаминные препараты включены в протоколы лечения АД у детей. Длительное рутинное назначение антигистаминных препаратов (что практиковалось в Украине) при ведении АД у детей является нецелесообразным, что было доказано двумя РКИ.
Первое — двойное слепое РКИ «The Early Treatment of the Atopic Child» (ETAC), в котором изучалось профилактическое применение цетиризина на протяжении 18 мес. у детей раннего возраста (12–24 мес.) с АД (n = 795) [17, 18]. В исследовании ETAC доказано, что через 18 мес. лечения цетиризином суммарно не отмечено разницы в частоте развития бронхиальной астмы — она сформировалась у 38 % детей. Не было достоверных различий в частоте и длительности применения топических препаратов (в том числе ТКС, нестероидных противовоспалительных средств, антибиотиков, антисептиков, эмолиентов), системных антибиотиков у пациентов основной и контрольной групп. Что же дал пациентам длительный прием цетиризина? У этих пациентов отмечены меньшее количество эпизодов крапивницы (5,8 % в сравнении с 16,2 % в группе плацебо; P < 0,001), меньшая потребность в других антигистаминных препаратах (18,6 % в сравнении с 24,9 %; P = 0,03) и меньшая общая продолжительность применения антигистаминных препаратов (3,4 % в сравнении с 4,4 %; P = 0,035). Также среди пациентов со среднетяжелым и тяжелым (SCORAD > 25) течением АД (в исследование было включено 44 % таких пациентов) на фоне приема цетиризина отмечено снижение длительности применения ТКС средней и сильной активности (25,8 % в сравнении с 35,1 %, что составило 51 день за весь период лечения; P = 0,014). Общая динамика тяжести дерматита не отличалась в группах цетиризина и плацебо (снижение SCORAD на 39 и 37 % соответственно). Исследование продемонстрировало высокую безопасность цетиризина: частота побочных эффектов составила 9,3 и 13,6 % (P = 0,053), госпитализаций — 9 и 11,8 % (P = 0,189) в основной и контрольной группах соответственно, ЭКГ и лабораторные тесты были в пределах нормы [19]. Оценка поведения, психомоторного развития по шкале McCarthy (изучена у 41 и 20 % детей в основной и плацебо-группе) не выявила достоверных различий между группами [20].
Другое проспективное рандомизированное двойное слепое плацебо-контролируемое в параллельных группах исследование «Ранняя профилактика астмы у детей с атопией» (Early Prevention of Asthma in Atopic Children Study) также не выявило преимуществ длительного применения левоцетиризина. В исследовании приняли участие 2500 детей из Европы, Южной Африки и Австралии в возрасте 1–2 года. Пациенты принимали левоцетиризин в течение 3 лет, но бронхиальная астма сформировалась у 40 % детей как в основной, так и в плацебо-группе [21].
В терапии АД преимущественно должны применяться антигистаминные препараты 2-го поколения (как более безопасные), но при наличии выраженного зуда, беспокойства, нарушения сна у ребенка патогенетически оправдано и назначение короткими курсами препаратов 1-го поколения, обладающих седативным эффектом.
Доказательство эффективности других групп препаратов в лечении АД у детей (сорбентов, биопрепаратов, гепатопротекторов, витаминов) соответствует 3-му уровню доказательности в соответствии с принципами доказательной медицины, следовательно, их применение является нецелесообразным.
Образовательные программы. Необходимым условием успешной терапии АД являются образовательные программы — доказательство их эффективности соответствует самому высокому уровню. Наиболее эффективной является когнитивная поведенческая терапия, целью которой является прерывание зудо-расчесывающего цикла путем изменения привычек больного, коррекции поведения, обучения релаксации. Самое большое РКИ по изучению эффективности образовательных программ при АД выполнено в Германии (D. Staab, 2006). В исследование были включены 992 ребенка в возрасте от 3 мес. до 18 лет. Образовательная программа зависела от возраста пациентов, включала вопросы ухода, питания, психологической поддержки, проводилась в течение 6 недель в виде 2-часовых занятий 1 раз/нед мультипрофессиональной командой. Исследование завершило 83 % детей. При оценке результативности программ через 1 год выявлено значительное улучшение как по динамике тяжести согласно шкале SCORAD, так и по оценкам родителей и пациентов, получивших образовательную программу [22]. В Украине недостаточно развито подобное направление — в лучшем случае образовательные программы по АД включают в себя информационные сообщения в рамках астма-школы или аллергошколы. Более тесное сотрудничество с психоневрологом, внедрение когнитивной поведенческой терапии — в этом мы видим резерв повышения эффективности лечения АД в Украине.
Прогноз
С возрастом частота АД уменьшается — за 10 лет у 50–70 % больных отмечено выздоровление [23]. Авторы выражают надежду, что грамотное ведение больного АД на педиатрическом участке позволит нам избежать полипрагмазии, повысить качество оказания медицинской помощи и достичь подобного результата.
1. Emerson R.M., Williams H.C., Al-
len B.R. Severity distribution of atopic dermatitis in the community and its relationship to secondary referral // British Journal of Dermatology. — 1998. — 139(1). — 73-6.
2. Bindslev-Jensen C., Ballmer-Weber B.K., Bengtsson U. et al. Standardization of food challenges in patients with immediate reactions to foods — position paper from the European Academy of Allergology and Clinical Immunology // Allergy. — 2004. — 59(7). — 690-7.
3. Ehlers I., Worm M., Sterry W. et al. Sugar is not an aggravating factor in atopic dermatitis // Acta Dermato-Venereologica. — 2001. — 81(4). — 282-4.
4. Ricci G., Patrizi A., Specchia F. et al. Effect of house dust mite avoidance measures in children with atopic dermatitis // British Journal of Dermatology. — 2000. — 143(2). — 379-84.
5. Tan B.B., Weald D., Strickland I. et al. Double-blind controlled trial of effect of housedust-mite allergen avoidance on atopic dermatitis // Lancet. — 1996. — 347(8993). — 15-18.
6. Palmer C.N., Irvine A.D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nature Genetics. — 2006. — 38(4). — 441-6.
7. Cork M.J., Britton J., Butler L. et al. Comparison of parent knowledge, therapy utilization and severity of atopic eczema before and after explanation and demonstration of topical therapies by a specialist dermatology nurse // British Journal of Dermatology. — 2003. — 149(3). — 582-9.
8. Cork M.J. Complete Emollient Therapy. The National Association of Fundholding Practice Official Yearbook. — London: Scorpio, 1998. — Р. 159-68.
9. Stalder J.F., Fleury M., Sourisse M. et al. Local steroid therapy and bacterial skin flora in atopic dermatitis // British Journal of Dermatology. — 1994. — 131(4). — 536-40.
10. Roth H.L., Brown E.P. Hydrocortisone valerate. Double-blind comparison with two other topical steroids // Cutis. — 1978. — 21(5). — 695-8.
11. Lupton E.S., Abbrecht M.M., Brandon M.L. Short-term topical corticosteroid therapy (halcinonide ointment) in the management of atopic dermatitis // Cutis. — 1982. — 30(5). — 671-5.
12. Patel L., Clayton P.E., Addison G.M. et al. Adrenal function following topical steroid treatment in children with atopic dermatitis // British Journal of Dermatology. — 1995. — 132(6). — 950-5.
13. Ellison J.A., Patel L., Ray D.W. et al. Hypothalamic-pituitary-adrenal function and glucocorticoid sensitivity in atopic dermatitis // Pediatrics. — 2000. — 105 (4, Part 1). — 794-9.
14. Lucky A.W., Grote G.D., Williams J.L. et al. Effect of desonide ointment, 0.05%, on the hypothalamic-pituitary-adrenal axis of children with atopic dermatitis // Cutis. — 1997. — 59(3). — 151-3.
15. Prado de Oliveira Z.N., Cuce L.C., Arnone M. Comparative evaluation of efficacy, tolerability and safety of 0.1% topical momethasone furoate and 0.05% desonide in the treatment of childhood atopic dermatitis // Anais Brasileiros de Dermatologia. — 2002. — 77(1). — 25-33.
16. Stainer R., Matthews S., Arshad S.H. et al. Efficacy and acceptability of a new topical skin lotion of sodium cromoglicate (Altoderm) in atopic dermatitis in children aged 2-12 years: A double-blind, randomized, placebo-controlled trial // British Journal of Dermatology. — 2005. — 152(2). — 334-41.
17. Diepgen T.L., Early Treatment of the Atopic Child Study Group. Long-term treatment with cetirizine of infants with atopic dermatitis: a multi-country, double-blind, randomized, placebo-controlled trial (the ETAC trial) over 18 months // Pediatric Allergy and Immunology. — 2002. — 13(4). — 278-86.
18. Estelle F., Simons R. Prevention of acute urticaria in young children with atopic dermatitis // Journal of Allergy and Clinical Immunology. — 2001. — 107(4). — 703-6.
19. Simons F.E.R. Prospective, long-term safety evaluation of the H1-receptor antagonist cetirizine in very young children with atopic dermatitis // Journal of Allergy and Clinical Immunology. — 1999. — 104 (
20. Stevenson J., Cornah D., Evrard P. et al. Long-term evaluation of the impact of the H1-receptor antagonist cetirizine on the behavioral, cognitive, and psychomotor development of very young children with atopic dermatitis // Pediatric Research. — 2002. — 52(2). — 251-7.
21. Hugo P. Van Bever, Sudesh T. Samuel, Bee Wah Lee. Halting the Allergic March // WAO Journal. — 2008 April. — 57-62.
22. Staab D., Diepgen T.L., Fartasch M. et al. Age related, structured educational programmes for the management of atopic dermatitis in children and adolescents: multicentre, randomised controlled trial // British Medical Journal. — 2006. — 332(7547). — 933-8.
23. Williams H. The natural history of atopic eczema // Atopic Dermatitis: the Epidemiology, Causes and Prevention of Atopic Eczema / Ed. by H. Williams. —
