Газета «Новости медицины и фармации» Гастроэнтерология (323) 2010 (тематический номер)
Вернуться к номеру
Легеневі «маски» гастроезофагеальної рефлюксної хвороби
Авторы: І.М. Скрипник, д.м.н., професор, зав. кафедри; О.Ф. Гопко, к.м.н., асистент, Н.Л. Соколюк, к.м.н., доцент. Кафедра внутрішніх хвороб та медицини невідкладних станів факультету післядипломної освіти, ВДНЗ України «Українська медична стоматологічна академія», м. Полтава
Версия для печати
Найбільш актуальною проблемою сучасної гастроентерології є гастроезофагеальна рефлюксна хвороба (ГЕРХ), що була зарахована до п''яти станів, які значною мірою погіршують якість життя пацієнтів [5]. Останнім часом констатовано зниження частоти виразкової хвороби при одночасному збільшенні числа хворих на ГЕРХ, що дало підставу проголосити на 6-му Об''єднаному європейському гастроентерологічному тижні (Бірмінгем, 1997) гасло: «ХХ століття — століття виразкової хвороби, ХХI століття — століття ГЕРХ» [1, 4].
Результати сучасних епідеміологічних досліджень свідчать про високу поширеність ГЕРХ, включаючи її неерозивну форму, в усьому світі. Захворювання виявляється майже в 40 % дорослого населення, причому така ситуація стабільно зберігається протягом останніх десятиріч. Щоденно в промислово розвинутих країнах печію як основний симптом ГЕРХ відчувають 4–10 % населення, щотижнево — 30 %, щомісячно — 50 %. Однак справжній рівень захворюваності вищий, якщо враховувати, що значна частина хворих тривалий час лікується іншими спеціалістами з приводу позастравохідних проявів ГЕРХ [11, 13, 14].
ГЕРХ — це хронічне рецидивуюче захворювання, яке обумовлене порушенням моторно-евакуаторної функції гастродуоденальної зони та характеризується спонтанним і/або постійно повторюваним закидом у стравохід шлункового чи дуоденального вмісту, що призводить до ураження дистального відділу стравоходу [4, 39, 40].
Основною причиною рефлюксу вважають швидкоплинну релаксацію нижнього стравохідного сфінктера (НСС). У більшості пацієнтів із ГЕРХ наявний нормальний базальний тонус НСС. Одночасний вимір pH і моторики стравоходу показав, що в стані спокою тиск НСС не досягає рівня, необхідного для виникнення рефлюксу як у здорових, так і у хворих на ГЕРХ. Більшість епізодів рефлюксу виникають завдяки релаксації НСС, рідше рефлюкси обумовлені постійним зниженням тиску НСС або зменшенням його базального тонусу [8].
В основі патогенезу ГЕРХ лежить порушення рухової функції стравоходу і шлунка, а також пригнічення захисних механізмів, таких як антирефлюксна бар''єрна функція гастроезофагеального з''єднання і нижнього стравохідного сфінктера, езофагеальний кліренс, нормальна резистентність слизової оболонки стравоходу, своєчасна евакуація шлункового вмісту, контроль кислото-утворюючої функції шлунка. У результаті цього рефлюктат зі шлунка та/або дванадцятипалої кишки агресивно впливає на слизову оболонку стравоходу через контакти слизової оболонки стравоходу з кислотою і пепсином [1, 10].
У більшості випадків діагностувати дану патологію дозволяють характерні симптоми — печія та відчуття регургітації. Однак у частини пацієнтів трапляються позастравохідні прояви — легеневі (кашель, бронхоспазм, фіброз легеневої тканини), кардіальні (напади стенокардії, порушення ритму), орофарингеальні (рефлюкс-ларингіт), стоматологічні (запальні зміни слизової оболонки ротової порожнини, карієс, пародонтоз). Досить часто вони недооцінюються в практичній діяльності лікаря-інтерніста, особливо за відсутності специфічних симптомів ГЕРХ, що призводить до несвоєчасної діагностики та, відповідно, неадекватної тактики ведення хворих [2, 3, 26, 41].
Актуальним питанням залишається взаємозв''язок між захворюваннями органів дихання та ГЕРХ, що підтверджується результатами когортного популяційного дослідження за участю 8513 пацієнтів. Було показано, що в осіб із вихідним діагнозом ГЕРХ, але без ознак захворювань органів дихання на початку дослідження, після 20-річного спостереження відбувалося реальне збільшення ризику госпіталізацій у зв''язку з розвитком бронхолегеневої патології. У пацієнтів з езофагітами та стриктурами стравоходу ризик розвитку бронхіальної астми (БА), загострень хронічних обструктивних захворювань легень (ХОЗЛ) практичино у 2 рази вищий, ніж у групі хворих без патології стравоходу в анамнезі [31, 32].
Ізольований хронічний кашель і симптоми бронхіальної обструкції часто викликаються та/або провокуються ГЕРХ. Більше того, специфічне лікування ГЕРХ може сприяти помітному зменшенню або зникненню кашлю та диспное [7, 25].
Кашель виникає переважно при зміні положення тіла, особливо при нахиленнях, у денний час доби, рідше вночі, що, ймовірно, обумовлено активізацією механізмів захисту, які перешкоджають релаксації НСС у горизонтальному положенні тіла, він зазвичай сухий і триває в середньому від 13 до 58 місяців, у більшості пацієнтів загострюється після інфекції верхніх дихальних шляхів.
У пацієнтів із хронічним кашлем, які не палять, мають бути виключені три його основні причини: постназальний заплив (обумовлений ринітом, синуситом), кашльовий варіант БА і ГЕРХ [41]. Є дані, що 90 % випадків хронічного кашлю обумовлені цими трьома станами, а ГЕРХ є причиною хронічного кашлю в 10–70 % випадків. Якщо пацієнти не палили, не отримували інгібітори АПФ і мали нормальну рентгенограму органів грудної клітки, цей відсоток збільшувався до 99,4 %, із них ГЕРХ була причиною хронічного кашлю у 40 % хворих [29, 37].
На сьогодні відомі два механізми кашлю, індукованого ГЕРХ: стимуляція езофаготрахеобронхіального рефлексу при дії шлункового вмісту на вагусні рецептори дистальної частини стравоходу й активація кашльового рефлексу з рецепторів гортані і трахеобронхіального дерева при мікро- або макроаспірації вмісту стравоходу [18].
Кашель, що виникає в результаті ГЕРХ, якоюсь мірою можна розцінити як активацію легеневих захисних механізмів. Проте кашель призводить до підвищення внутрішньогрудного тиску, посилюючи патологічний рефлюкс і знову запускаючи механізм активації вагусних рецепторів.
Вірогідність того, що езофаготрахео-бронхіальний рефлекс є основним механізмом кашлю, викликаного ГЕРХ, підтверджують такі дані: більша кількість епізодів кашлю реєструвалася при контакті кислоти з дистальним, а не з проксимальним відділом стравоходу; часто відзначалася наявність дистального езофагіту; ларингоскопія і бронхоскопія не виявляли ушкоджень, викликаних аспірацією кислоти [35, 36].
За результатами проспективного дослідження встановлено, що з 199 обстежених, які страждають від БА, у 164 реєструвалися симптоми ГЕРХ. У 119 пацієнтів напади задухи, за даними 24-годинної рН-метрії, були зумовлені рефлюксом, у 76 хворих напади нічного кашлю збігалися за часом з рефлюксами. Існують й інші роботи, що підтверджують значну поширеність ГЕРХ у пацієнтів на БА, що коливається в широких межах — 33–90 %, при цьому у 25–30 % хворих патологічні рефлюкси виявилися безсимптомними [23, 24, 26].
ГЕРХ може потенціювати розвиток гіперреактивності бронхів у відповідь на інші стимули. Так, при зрошуванні дистальної частини стравоходу соляною кислотою відбувалося зниження миттєвої об''ємної швидкості на рівні 50 % та об''єму форсованого видиху в першу секунду (ОФВ1) на 17,5 та 21,4 % відповідно тільки в пацієнтів із БА та ГЕРХ. За даними інших досліджень, зменшення ОФВ1 на 20 % відбувалося при поєднаному використанні метахоліну зі зрошуванням дистальної частини стравоходу соляною кислотою порівняно з поєднаним застосуванням метахоліну та зрошуванням ізотонічним розчином натрію хлориду, що свідчить про посилення гіперреактивності бронхів під впливом соляної кислоти [19]. Згідно з даними сучасних досліджень, патологічний рефлюкс не лише відіграє важливу роль у виникненні певної кількості випадків БА, але також може впливати на перебіг БА, що розвинулася під впливом інших екзогенних або ендогенних факторів [42].
Загострення ХОЗЛ характеризується посиленням задишки, виділенням слизово-гнійного харкотиння, гіпоксемією і є головною причиною збільшення захворюваності й смертності хворих на ХОЗЛ. Частіше за все причиною загострення є тютюнопаління, вплив зовнішніх патогенних факторів, інфекційні агенти. Як один із факторів загострення ХОЗЛ розглядається мікроаспірація рефлюктату в дихальні шляхи [12]. Доведено, що пацієнти з ХОЗЛ більше ніж у два рази частіше страждають від ГЕРХ порівняно з контролем: відносний ризик (ВР) становив 2,13 (95%, довірчий інтервал (ДІ) 0,88–5,25), та що хворі на ХОЗЛ, які страждають від ГЕРХ, більше ніж у два рази частіше відзначають загострення ХОЗЛ протягом 6 місяців: ВР 1,93 (95%; ДІ 1,32–2,84) [21].
У Великій Британії було проведене дослідження за участю 9509 пацієнтів, які були розподілені на 2 групи: І група — 4391 хворий із первинним діагнозом ГЕРХ, ІІ група — 1628 хворих із первинним діагнозом ХОЗЛ. Протягом 5-річного дослідження встановлено, що у 124 пацієнтів І групи виявлено ознаки ХОЗЛ, причому зі збільшенням віку хворих зростає ризик розвитку ХОЗЛ. Жінки з ГЕРХ мали нижчий ризик діагнозу ХОЗЛ, ніж чоловіки з ГЕРХ, — ВР 0,7 (95%; ДІ 0,5–1,0). Попередній діагноз астми був головним фактором ризику для наступного діагнозу ХОЗЛ у хворих на ГЕРХ (ВР 10,9; 95% ДІ 6,8–17,3). Серед хворих ІІ групи ГЕРХ розвинулась у 106 пацієнтів та частіше була пов''язана з надмірним вживанням алкоголю (ВР 2,1; 95% ДІ 1,0–4,2). Ризик розвитку ГЕРХ був вищим у пацієнтів, які приймали нітрати, b2-агоністи короткої та тривалої дії. Слід зазначити, що на фоні прийому аспірину, антагоністів кальцію ця залежність вірогідно зменшувалась [16].
Отже, результати цього дослідження доводять тісний взаємозв''язок ГЕРХ та загострень ХОЗЛ, що негативно впливає на якість життя пацієнтів із поєднаною патологією.
Відкритим залишається питання щодо впливу ГЕРХ на перебіг інтерстиціальних захворювань легень. Дана група захворювань характеризується постійним прогресуючим перебігом, вираженою задишкою, гіпоксемією, інтерстиціальним фіброзом. Періодична мікроаспірація визначена як потенційний фактор підтримки запального процесу. За результатами досліджень встановлено, що у 79–90 % хворих на «ідіопатичний» фіброз виявлені симптоми ГЕРХ [33]. Однак поширеність ГЕРХ у загальній популяції (10–20 %) значно вища порівняно з фіброзуючими захворюваннями легень (13–20 випадків на 100 000 населення). За результатами метааналізів та епідеміологічних досліджень, зростання поширеності ГЕРХ пов''язане зі зменшенням інфікування населення Helicobacter pylori (НР). Тому існує гіпотеза, що фіброзуючий альвеоліт частіше виникає у хворих на ГЕРХ із супутньою контамінацією НР [13, 20].
Дихальні шляхи є основним джерелом синтезу цитокінів і ростових факторів, що сприяють міграції фібробластів, проліферації та диференціації міофібробластів у легенях. В епітеліальних клітинах легень синтезується фактор росту тромбоцитів, трансформуючий фактор росту b (TGF-a) та туморнекротичний фактор a (TNF-a). Усі ці фактори відіграють суттєву роль у фіброзі легеневої тканини. В експериментальних дослідженнях доведено: жовчні кислоти, що входять до складу патологічного рефлюктату, за рахунок мікроаспірації в дихальні шляхи стимулюють синтез TGF-b та проліферацію фібробластів, які роблять суттєвий внесок у патогенез фіброзу бронхолегеневої системи [15, 28, 30, 34].
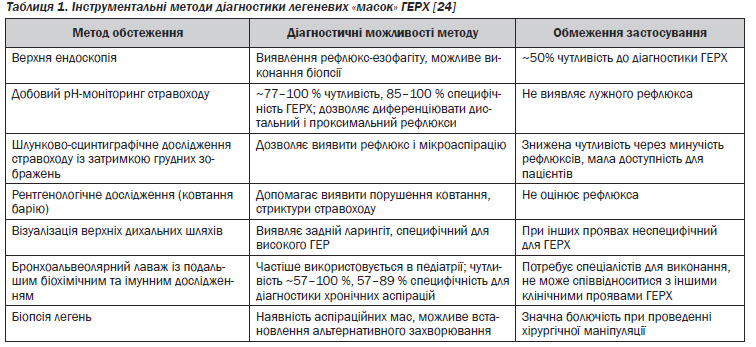
Діагностика ГЕРХ базується на клінічному обстеженні (збір анамнезу, огляд) пацієнтів і проведенні інструментальних досліджень для верифікації діагнозу. Скарги, що визначають наявність легеневих «масок» ГЕРХ, неспецифічні, тому необхідно при опитуванні особливу увагу звертати на скарги, пов''язані з ГЕРХ (печія, дисфагія) [1, 9]. Важлива роль у діагностиці ГЕРХ відводиться інструментальним методам (табл. 1).
Відповідно до Генвальських та Монреальських рекомендацій (1999, 2005) лікування ГЕРХ має бути патогенетично обгрунтованим, мати клінічні переваги (швидко і якісно зменшувати симптоми захворювання, покращувати ендо-скопічну, гістологічну і клінічну картини), мати добру переносимість, низьку частоту побічних дій, не взаємодіяти з іншими препаратами, а також мати прийнятне співвідношення «ефективність/вартість». Найбільшою мірою цим вимогам відповідають антисекреторні препарати з групи інгібіторів протонної помпи (ІПП), при використанні яких істотно знижується кислотна агресивність шлункового вмісту, який закидається, що сприяє припиненню запального й ерозивно-виразкового процесу в слизовій оболонці стравоходу [1, 4, 39, 40].
Згідно з результатами дослідження, у хворих на ГЕРХ при її поєднанні з БА застосування ІПП (езомепразол, пантопразол, рабепразол) призводить не лише до вираженої тривалої клінічної ремісії ГЕРХ, але й справляє позитивний вплив (у комбінації з традиційною протиастматичною терапією) на клініко-функціональні показники стану респіраторної системи. Аналіз динаміки змін гастроезофагеальних і легеневих симптомів на фоні лікування ІПП довів, що вже після 4-го тижня лікування відбувається істотне зменшення печії, відрижки, епігастрального і ретростернального болю, а також кашлю, задишки, свистячих хрипів і добової потреби в бронходилататорах короткої дії. Застосування сучасних ІПП сприяє не лише швидкому зменшенню клінічних проявів цієї тяжкої поєднаної патології, але й дає стійкий протирецидивний ефект [6].
В одному з досліджень [18] оцінювалась ефективність езомепразолу у дорослих пацієнтів із середньою і тяжкою бронхіальною астмою, що регулярно приймали протиастматичні препарати.
Пацієнтів розподілили на три групи: І група (201 хворий) — із нічною ядухою, але без ГЕРХ; ІІ група (219 хворих) — із ГЕРХ, але без нічною ядухи; ІІІ група (350 хворих) — із ГЕРХ і нічними ядухою. Кожній групі призначали езомепразол у дозі 40 мг 2 рази на добу або плацебо протягом 16 тижнів. Потім у цих пацієнтів, а також у тих, хто додатково приймав b2-агоністи тривалої дії, визначали показники функції зовнішнього дихання.
Завдяки езомепразолу пікова швидкість видиху в усіх пацієнтів у середньому збільшилася на 6,3 л/хв. Максимальний ефект ІПП був у пацієнтів ІІ групи. ОФВ1 у цих хворих збільшився на 8,3 л/хв, у пацієнтів І групи показник зріс на 7,0 л/м, у пацієнтів ІІІ групи — лише на 3,6 л/хв.
Ефективність препарату виявилася більш вираженою за умов його комбінації з b2-агоністами — ОФВ1 збільшувався на 12,2 л/хв. Частота побічних ефектів при цьому була незначною.
Використання ІПП як монотерапії або в комбінації з прокінетичним засобом є ефективним при кашлі, зумовленому ГЕРХ, більше ніж у 80 % випадків. При неефективності цієї терапевтичної схеми показане хірургічне лікування.
За рахунок зменшення кислотопродукції, бактеріостатичного ефекту щодо НР ІПП позитивно впливають на попередження прогресування фіброзуючого альвеоліту.
Таким чином, ІПП є препаратами вибору при лікуванні «легеневих масок» ГЕРХ. Однак одним із небажаних ефектів тривалої кислотосупресивної терапії є можливість розвитку негоспітальних пневмоній. Так, в осіб, які тривалий час приймали антисекреторні препарати, пневмонія спостерігалася в 4,47 раза (4,63 — ІПП; 4,24 — Н2-гістаміноблокатори) частіше порівняно з тими хворими, хто не приймав препарати. Крім цього, в пацієнтів, які продовжують прийом ІПП, ризик розвитку пневмоній у 1,89 раза вищий, ніж у тих, хто перестав приймати ІПП [17]. Отримані результати можуть пояснюватися зниженням захисних властивостей шлункового вмісту в хворих похилого віку, а також властивістю ІПП блокувати Н+/К+-АТФазу нейтрофілів, пригнічуючи їхню фагоцитарну активність, схильність до дегрануляції [10].
Отже, патогенетичні механізми позастравохідних проявів ГЕРХ недостатньо вивчені та потребують більш глибокого аналізу. Викладені літературні дані щодо «легеневих масок» ГЕРХ свідчать про тісний взаємозв''язок бронхолегеневої патології (БА, ХОЗЛ, фіброзуючого альвеоліту) та ГЕРХ. Дискутабельним залишається питання ролі НР у патогенезі ГЕРХ та її проявів, тактика ведення даної когорти пацієнтів на етапах діагностики та лікування.
1. Бабак О.Я. Эзофагеальные и экстраэзофагеальные проявления ГЭРБ: основы диагностики и лечения / О.Я. Бабак, Ю.Н. Шапошникова. — Харьков: Харьковский госмедуниверситет, 2005.
2. Барер Г. Проявления гастроэзофагеальной рефлюксной болезни в полости рта / Г. Барер, И. Маев, Г. Бусарова [и др.] // Cathedra. — 2004. — № 9. — С. 58-61.
3. Иванова О.В. Внепищеводные проявления гастроэзофагеальной рефлюксной болезни / О.В. Иванова, В.А. Исаков, С.В. Морозов [и др.] // Русский медицинский журнал. Болезни органов пищеварения. — 2004. — Т. 6, № 2. — С. 24-29.
4. Лазебник Л.Б. Современное понимание гастроэзофагеальной рефлюксной болезни: от Генваля к Монреалю / Л.Б. Лазебник, Д.С. Бордин, А.А. Машарова // Эксперим. и клин. гастроэнтерол. — 2007. — № 5. — С. 4-10.
5. Маев И.В. Неэрозивная рефлюксная болезнь с позиций современной гастроэнтерологии: клинические особенности и влияние на качество жизни пациентов / И.В. Маев, А.С. Трухманов // Рус. мед. журн. — 2004. — Т. 12, № 23. — С. 1344-1348.
6. Маев И.В. Клинико-функциональная оценка эффективности применения рабепразола, омепразола и эзомепразола у больных неэрозивной рефлюксной болезнью, ассоциированной с бронхиальной астмой / И.В. Маев, А.С.Трухманов // Рос. журн. гастроэнтеролог., гепатол. и колопроктологии. — 2004. — № 5. — С. 22-30.
7. Овсянников Е.С., Семенкова Г.Г. Гастроэзофагеальная рефлюксная болезнь как причина хронического кашля / Е.С. Овсянников, Г.Г. Семенкова // Consilium Medicum. — 2004. — Т. 6, № 10. — C. 22-27.
8. Саблин О.А. Гастроэзофагеальная рефлюксная болезнь и ее внепищеводные проявления: клинико-диагностическое значение двигательных дисфункций верхних отделов пищеварительного тракта: Автореф. дис... д-ра мед. наук / О.А. Саблин. — СПб., 2004. — 316 с.
9. Соломенцева Т.А. Пищеводный рефлюкс: что необходимо знать практическому врачу / Т.А. Соломенцева // Здоров''я України. — 2007. — № 20. — С. 72-73.
10. Ткаченко Е.И. Гастроэзофагеальная рефлюксная болезнь: патогенетические основы дифференцированной тактики лечения / Е.И. Ткаченко, Ю.П. Успенский, А.Е. Каратеев [и др.] // Экспер. и клинич. гастроэнтерол. — 2009. — № 2. — С. 104-114.
11. Bohmer C.J. The prevalence of gastro-oesophagealreflux disease based on non-specific symptoms in institutionalized, intellectually disabled individuals / C.J. Bohmer, E.C. Klinkenberg-Knol, R.С. Niezen-de-Boer [et al.] // Eur. J. Gastroenterol. Hepatol. — 1997. — Vol. 9, № 2. — P. 187-190.
12. Casanova C. Increased gastrooeso-phageal reflux disease in patients with severe COPD / C. Casanova, J.S. Baudet, M. del Valle Velasco [et al.] // Eur. Respir. J. — 2004. — Vol. 23. — P. 841-845.
13. Cremonini F. Meta-analysis: the relationship between Helicobacter pylori infection and gastro-oesophageal reflux disease / F. Cremonini, S. Di Caro, S. Delgado-Aros [et al.] // Aliment. Pharmacol. Ther. — 2003. — Vol. 18. — P. 279-289.
14. Dent J. Epidemiology of gastrooesophageal reflux disease: a systematic review / J. Dent, H.B. El-Serag, M.A. Wallander // Gut. — 2005. — Vol. 54. — P. 710-717.
15. Diahn-Warng Perng. Relation to Transforming Growth Factor-β1 Production and Fibroblast Proliferation / Perng Diahn-Warng, Chang Kuo-Ting, Su Kang-Cheng // CHEST. — Vol. 132. — P. 1548-1556.
16. García Rodríguez Luis A. Relationship Between Gastroesophageal Reflux Disease and COPD in UK Primary Care / Luis A. García Rodríguez, Ana Ruigómez, Elisa Martín-Merino // CHEST. — 2008. — Vol. 134. — P. 1223-1230.
17. Gulmez S. Use of proton pump inhibitors and the risk of community-acquired pneumonia: a population-based case control study / S. Gulmez, A. Holm, H. Frederiksen [et al.] // Arch. Intern. Med. — 2007. — Vol. 167, № 9. — P. 950-955.
18. Harding S.M. Effects of esomeprazole 40 mg twice daily on asthma: a randomized placebo-controlled trial // S.M. Harding, T.O. Kiljander, S.K. Field [et al.] // Am. J. Respir. Crit. Care. Med. — 2006. — Vol. 173(10). — P. 1091-1097.
19. Herve Ph. Intraesophageal perfusion of acid increases the bronchomotor response to metacholine and to isocapnic hyperventilation in asthmatic subjects / Ph. Herve, A. Denjean, R. Jian [et al.] // Am. Rev. Respir. Dis. — 1986. — Vol. 134. — P. 986-989.
20. Ibrahim W.H. Helicobacter pylori eradication in the management of idiopathic pulmonary fibrosis / W.H. Ibrahim // Eur. Respir. J. — 2007. — Vol. 30. — P. 395-396.
21. Ivan E. Role of Gastroesophageal Reflux Symptoms in Exacerbations of COPD / E. Ivan, Mark Pamer, Peter Wludyka // CHEST. — 2006. — Vol. 130, № 4. — P. 1096-1101.
22. Kappler M. Gastroosophagaler Reflux und Atemwegserkrankungen / M. Kappler, T. Lang // Monatsschrift Kin-derheikd. — 2005. — Vol. 153. — P. 220-227.
23. Leggett J.J. Prevalence of gastroesophageal reflux in difficult asthma: relationship to asthma outcome / J.J. Leggett, B.T. Johnston, M. Mills [et al.] // CHEST. — 2005. — Vol. 127. — P. 1227-1231.
24. Morehead R.S. Gastro-oesophageal reflux disease and non-asthma lung disease / R.S. Morehead // Eur. Resp. Review. — 2009. — Vol. 18. — P. 233-243.
25. Napierkowski J. Extraesophageal manifestations of GERD / J. Napierkowski // Am. J. Med. Sci. — 2003. — Vol. 326. — P. 285-299.
26. Nordenstedt H. The relation between gastroesophageal reflux and respiratory symptoms in a population-based study / H. Nordenstedt, M. Nilsson, S. Johansson [et al.] // CHEST. — 2006. — Vol. 129. — P. 1051-1056.
27. Pandak W.M. Short course of omeprazole: a better first diagnostic approach to non-cardiac chest pain than endoscopy, manometry, or 24-hour esophageal pH monitoring / W.M. Pandak, S. Arezo, S. Everett [et al.] // J. Clin. Gastroenterol. — 2002. — Vol. 35. — P. 307-14.
28. Perng D. Exposure of airway epithelium to bile acids associated with gastroesophageal reflux symptoms / D. Perng, K. Chang, K. Su [et al.] // CHEST. — 2007. — Vol. 132. — P. 1548-1556.
29. Рoe R. Chronic cough and gastroesophageal reflux disease. Exprerience with specific therapy for diagnosis and treatment / R. Рoe, М. Kallay // CHEST. — 2003. — Vol. 123. — Р. 679-684.
30. Raghu G. High prevalence of abnormal acid gastro-oesophageal reflux in idiopathic pulmonary fibrosis / G. Raghu, T.D. Freudenberger, S. Yang [et al.] // Eur. Respir. J. — 2006. — Vol. 27. — P. 136-142.
31. Rascon-Aguilar I.E. Role of gastroesophageal reflux symptoms in exacerbations of COPD / I.E. Rascon-Aguilar, M. Pamer, P. Wludyka [et al.] // CHEST. — 2006. — Vol. 130. — P. 1096-1101.
32. Ruhl C.E. Respiratory complications of gastroesophageal reflux disease (GERD) in a prospective population-based study / C.E. Ruhl, J.E. Everhart // Gastroentero-logy. — 1999. — Vol. 115. — P. A92.
33. Salvioli B. Gastroesophageal reflux and interstitial lung disease / B. Salvioli, G. Belmonte, V. Strangellini [et al.] // Dig. Liver. Dis. — 2006. — Vol. 38. — P. 879-884.
34. Savarino E. Gastroesophageal reflux and pulmonary fibrosis in scleroderma: a study using pH-impedance monitoring / E. Savarino, M. Bazzica, P. Zentilin [et al.] // Am. J. Respir. Crit. Care. Med. — 2009. — Vol. 179. — P. 408-413.
35. Songur N. Gastroesophageal scinti-graphy in the evaluation of adult patients with chronic cough due to gastroesophageal reflux disease / N. Songur, Y. Songur, S.S. Cerci [et al.] // Nucl. Med. Commun. — 2008. — Vol. 29. — P. 1066-1072.
36. Starosta V. Bronchoalveolar pepsin, bile acids, oxidation, and inflammation in children with gastroesophageal reflux disease / V. Starosta, R. Kitz, D. Hartl [et al.] // CHEST. — 2007. — Vol. 132. — P. 1557-1564.
37. Tututian R., Castell D.O. Diagnosis and treatment of pharyngolaryngeal reflux // Current opinion in otolaryngology and head and neck surgery. — 2004. — № 12. — Р. 174-179.
38. Vaezi M.F. Extraesophageal manifestations of gastroesophageal reflux disease / M.F. Vaezi // Clin. Cornerstone. — 2003. — Vol. 5. — P. 32-38.
39. Vakil N. The Montreal definition and classification of gastro-esophageal reflux disease (GERD): a global evidence-based consensus / N. Vakil, S. Veldhuyzen van Zanten, P. Kahrilas [et al.] // Am. J. Gastroenterol. — 2006. — Vol. 101. — P. 1900-1920.
40. Vakil N. The Montreal definition and classification of gastroesophageal reflux
disease / N. Vakil, S.V. van Zanten, P. Kahrilas [et al.] // Am. J. Gastroenterol. — 2006. — Vol. 101. — P. 1900-1920.
41. Weaver E.M. Association between gastroesophageal reflux and sinusitis, otitis media, and laryngeal malignancy: a systematic review of the evidence / E.M. Weaver // Am. J. Med. — 2003. — Vol. 115. — P. 81S-89S.
42. Zerbib F. Effects of bronchial obstruction on lower esophageal sphincter motility and gastroesophageal reflux in patients with asthma / F. Zerbib, O. Guisset, H. Lamouliatte [et al.] // Am. J. Respir. Crit. Care. Med. — 2002. — Vol. 166. — P. 1206-1211.