Газета «Новости медицины и фармации» 9(325) 2010
Вернуться к номеру
Значение провоспалительных факторов в прогрессировании диабетической ретинопатии, патогенетическое обоснование и эффективность их коррекции
Авторы: Н.В. Иванова, Н.А. Ярошева, Крымский государственный медицинский университет им. С.И. Георгиевского, кафедра отоларингологии и офтальмологии; Л.М. Ярошева, КРУ «КБ им. Н.А. Семашко», г. Симферополь, АР Крым, Украина
Версия для печати
 Сахарный диабет (СД) является важной медико-социальной проблемой, в Украине уже свыше 1 млн больных СД. Первое место по частоте среди поздних осложнений СД занимает диабетическая ретинопатия (ДР) [11–13].
Сахарный диабет (СД) является важной медико-социальной проблемой, в Украине уже свыше 1 млн больных СД. Первое место по частоте среди поздних осложнений СД занимает диабетическая ретинопатия (ДР) [11–13].
В патогенезе ДР особая роль отводится метаболическим сдвигам, а также нарушениям механизма межклеточных взаимодействий, необходимых для нормального функционирования органов и тканей [8]. Регуляция межклеточных взаимодействий осуществляется системой цитокинов, влияющих на тип и длительность иммунного ответа, пролиферацию клеток, гемопоэз, ангиогенез, воспаление и другие процессы [9]. В норме цитокины, которые образуются при первичном иммунном ответе, поступают в кровоток в очень низких количествах. Повышение уровня цитокинов свидетельствует об активном патологическом процессе и может использоваться как один из критериев диагностики ряда заболеваний и оценки эффективности проводимой терапии [3].
По данным N. Demircan и соавт., при изучении образцов стекловидного тела больных ДР выявлено повышенное содержание в них IL-1β и TNF-α, что, по мнению авторов, играет важную патогенетическую роль в патогенезе неоваскуляризации при ДР [16].
Известно, что IL-1β стимулирует развитие нейтрофильного лейкоцитоза, а также синтез других цитокинов, включая IL-6, IL-8, TNF-α и др. [19], играет ключевую роль в иммуногенезе и участвует в процессах взаимодействия иммунной, эндокринной и нервной систем [2]. Иммунная система очень тесно взаимодействует с соматическими клетками, а нарушения в системе этих взаимодействий могут способствовать прогрессированию воспаления любого генеза [1].
Также IL-1β играет важную роль в развитии воспаления при офтальмологической патологии [15, 17, 18]. Это было подтверждено и нашими исследованиями при ДР [5, 7, 14].
Разработка новых методов терапевтического воздействия на цитокин-зависимые механизмы диабетической ретинопатии является актуальной. Препаратом выбора был липофлавон (в виде глазных капель и внутривенных инъекций) из группы флавоноидов, который, согласно нашим исследованиям, оказывает воздействие на провоспалительные факторы, а именно на цитокины [4, 6]. По данным литературы, препарат проявляет антиоксидантное и противовоспалительное действие [10].
Целью исследования было изучить значение провоспалительных цитокинов (IL-1β и TNF-α) в прогрессировании диабетической ретинопатии и исследовать эффективность применения липофлавона для коррекции выявленных нарушений.
Материалы и методы
Материалом исследования служила сыворотка крови. Обследовано 119 (238 глаз) больных: 1-я группа — 16 (32 глаза) больных непролиферативной диабетической ретинопатией (НДР) (рис. 1), 2-я группа — 39 (78 глаз) больных с препролиферативной ретинопатией (ППДР) (рис. 2), 3-ю группу составили 42 (84 глаза) больных пролиферативной ретинопатией (ПДР) (рис. 3). Контролем служили 22 здоровых донора в соответствующем возрастном диапазоне.
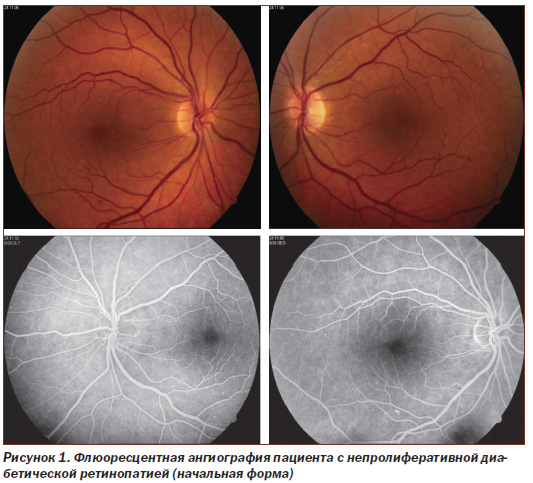
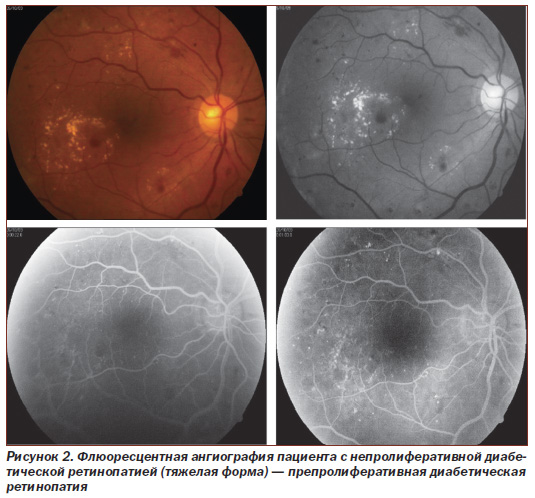
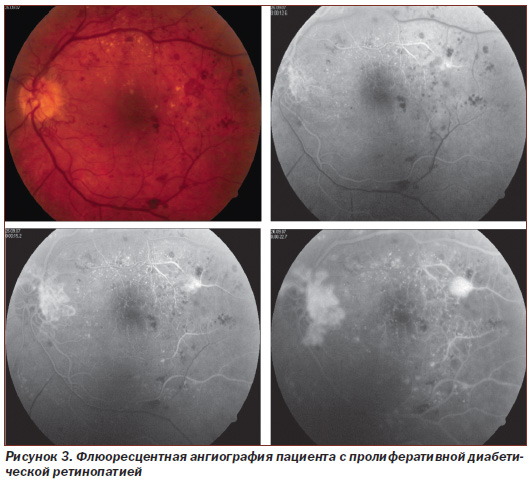
Обследовано 134 больных (268 глаз) ДР, средний возраст которых составил 39,7 ± 8,2 года (мужчин и женщин было поровну), согласно классификации ETDRS (1991) разделенных на группы. В исследование были включены больные непролиферативной ДР (НДР) с начальной формой и с тяжелой формой НДР — препролиферативной ДР (ППДР), а также больные с пролиферативной ДР (ПДР).
1-ю группу составили 39 больных (78 глаз) НДР, получавшие только комплексную терапию и служившие контролем ко 2-й группе. 2-ю группу — 53 больных (106 глаз) с НДР и 3-ю группу — 42 больных (84 глаза) с ПДР составили больные, получавшие в комплексном лечении ДР инстилляции липофлавона по 2 кап. 6 раз в день в течение 1-го месяца, а также внутривенный курс инъекций липофлавона по 2 флакона (1 флакон содержит 15 мг кверцетина и 550 мг лецитина-стандарта; вспомогательное вещество — лактоза) производства ЗАО «Биолек» в 20 мл физиологического раствора (предварительно нагретого до 37–39 оС) 1 раз в сутки внутривенно № 3 (патент на корисну модель № 36203 «Спосіб лікування діабетичної ретинопатії»).
Больным проводили общепринятые офтальмологические исследования: визометрию, тонометрию, биомикроскопию, офтальмоскопию с помощью фундус-линз (Voik (78D и 90D) и Гольдмана). Всем больным определяли порог электрической чувствительности по фосфену (ПЭЧФ) и критическую частоту исчезновения мельканий по фосфену (КЧИМФ). Из исследования были исключены больные с сопутствующими глазными заболеваниями (катаракта, глаукома, миопия, гемофтальм и др.) и больные с диабетическим макулярным отеком. По возрасту, полу, клиническим формам ДР группы исследования были идентичными.
Концентрацию IL-1β и TNF-α в сыворотке крови и культуральной среде определяли иммуноферментным методом с использованием наборов (ООО «Цитокины» IL-1β, протеиновый контур — TNF-α). Оценка результатов осуществлялась фотометрически. Проводилось также исследование уровня TNF-α в культуральной среде по методу O. Westphal (1984). Использован метод краткосрочных органных культур, обеспечивающий культивирование клеток (мононуклеарных лейкоцитов, клеток сосудистого эндотелия) in vitro по Е.А. Лурия. Полученные результаты исследования подвергнуты статистической обработке с использованием программы MedStat.
Результаты и их обсуждение
Результаты исследования уровня провоспалительных цитокинов (IL-1β и TNF-α) в сыворотке крови у больных НДР, ППДР и ПДР представлены на рис.4.
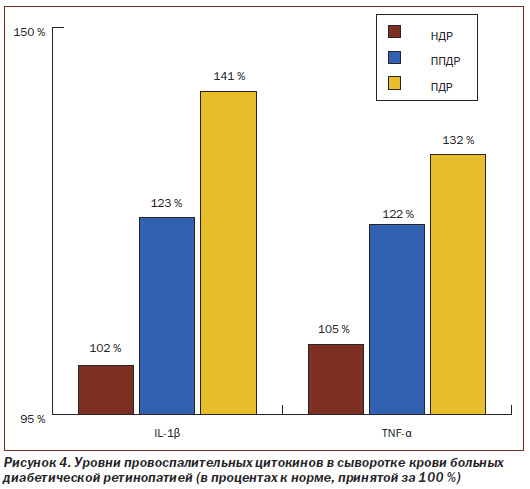
В результате исследований установлено (рис. 4), что у больных НДР уровень IL-1β в системном кровотоке не выходит за пределы нормы (здоровые лица — 33,81 пг/мг), а у больных ППДР и ПДР повышен соответственно на 23,3 % (составляет 41,68 пг/мг) и на 41,0 % (составляет 47,67 пг/мг), причем чем тяжелее стадия ДР, тем достоверно выше уровень IL-1β, то есть, являясь провоспалительным цитокином, IL-1β способствует развитию воспаления у больных ППДР и ПДР. В свою очередь, такая зависимость свидетельствует о важной роли уровня IL-1β в прогрессировании ДР.
Как показано на рис. 4, уровень TNF-α в сыворотке крови у больных НДР соответствует 14,02 пг/мг и не выходит за пределы нормы (здоровые лица — 13,35 пг/мг), а у больных ППДР и ПДР повышен на 21,7 и 32,2 % соответственно и составляет 16,25 пг/мг и 17,65 пг/мг соответственно, причем чем тяжелее стадия ДР, тем достоверно выше уровень TNF-α. Данный цитокин является провоспалительным цитокином, и увеличение его уровня способствует развитию воспаления у больных ППДР и ПДР и также свидетельствует о важной роли в прогрессировании ДР.
Результаты исследования динамики уровня провоспалительных цитокинов (IL-1β и TNF-α) in vitro в культуре мононуклеарных лимфоцитов больных НДР, ППДР, ПДР под влиянием глюкозы, инсулина и липофлавона представлены на рис. 5–8.
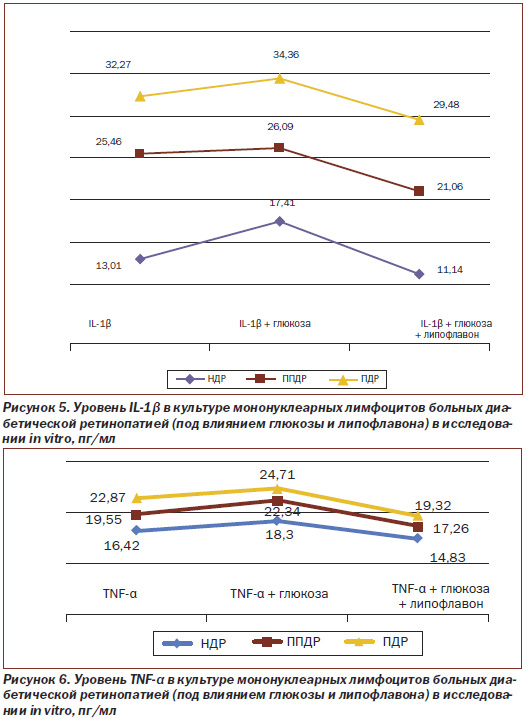
Установлено (рис. 5), что в культуре мононуклеарных лимфоцитов уровень IL-1β при ППДР и ПДР равен 25,46 пг/мл и 32,27 пг/мл соответственно, то есть повышен на 95,7 и 148,0 % соответственно, по сравнению с показателем при НДР — 13,01 пг/мл, принятым за 100 %.
При введении глюкозы (рис. 5) in vitro уровень IL-1β при НДР соответствует 17,41 пг/мл, то есть возрастает на 33,8 % по сравнению со значением до введения глюкозы, что свидетельствует о том, что гипергликемия является фактором увеличения уровня провоспалительных цитокинов. А при ППДР и ПДР уровень IL-1β равен 26,09 пг/мл и 34,36 пг/мл соответственно, то есть достоверно значимо не меняется (при ППДР — 25,46 пг/мл и при ПДР — 32,27 пг/мл). Можно предположить, что у больных ППДР и ПДР имеет место полная реализация in vivo глюкозо-индуцированной функциональной активности мононуклеарных лимфоцитов, что и проявляется отсутствием глюкозо-индуцированного синтеза цитокина IL-1β.
При введении липофлавона (рис. 5) in vitro в культуру мононуклеарных лимфоцитов уровень цитокина IL-1β при НДР снижается на 14,4 % (равен 11,14 пг/мл) по сравнению с уровнем при введении глюкозы (был равен 17,41 пг/мл), при ППДР и ПДР достоверно снижается на 17,3 % (равен 21,06 пг/мл) и на 8,6 % (равен 29,48 пг/мл) соответственно, что свидетельствует об уменьшении уровня провоспалительного цитокина под влиянием липофлавона.
В исследованиях in vitro установлено (рис. 6), что уровень цитокина TNF-α в культуре мононуклеарных лимфоцитов крови больных ППДР и ПДР выше на 19,1 % (составляет 19,55 пг/мл) и 39,3 % (22,87 пг/мл) соответственно, чем у больных НДР (составляет 16,42 пг/мл).
Как видно из рис. 6, при введении глюкозы in vitro уровень TNF-α возрастает при НДР на 11,4 % (с 16,42 до 18,30 пг/мл) и ППДР на 14,3 % (с 19,55 до 22,34 пг/мл).
При введении липофлавона (рис. 6) in vitro уровень цитокина TNF-α при НДР снижается на 19,0 % (с 18,30 до 14,83 пг/мл), а у больных ППДР и ПДР — на 22,7 % (с 22,34 до 17,26 пг/мл) и 21,8 %(с 24,71 до 19,32 пг/мл) соответственно, что также свидетельствует об уменьшении уровня провоспалительного цитокина.
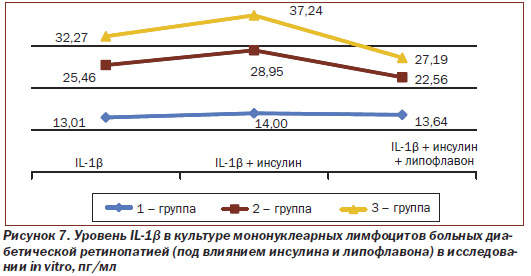
При введении инсулина in vitro (рис. 7) уровень IL-1β в культуре мононуклеарных лимфоцитов больных ППДР и ПДР возрастает на 13,7 % (с 25,46 до 28,95 пг/мл) и на 15,4 % (с 32,27 до 37,24 пг/мл), то есть при прогрессировании ДР инсулин способствует повышению уровня провоспалительного цитокина IL-1β.
Как видно из рис. 7, при введении липофлавона in vitro выявлена не только отмена инсулинзависимого повышения синтеза мононуклеарными лимфоцитами — снижение IL-1β при ППДР и ПДР на 22,0 % (с 28,95 до 22,56 пг/мл) и на 27,0 % (с 37,24 по 27,19 пг/мл) соответственно, но и достоверное снижение независимого от инсулина синтеза цитокина мононуклеарными лимфоцитами.
Как видно из рис. 8, изменение уровня TNF-α при введении инсулина in vitro не выявлено. Под влиянием липофлавона in vitro уровень TNF-α у больных НДР снижается на 10,2 % (с 16,45 до 14,77 пг/мл), а при ППДР и ПДР — на 12,1 % (с 20,06 до 17,64 пг/мл) и 14,5 % (с 23,85 до 20,38 пг/мл) соответственно, что свидетельствует о том, что липофлавон снижает уровень провоспалительного цитокина, но от уровня исулина не зависит.
Установлено, что уровень IL-1β при введении взвеси мононуклеарных лимфоцитов больных НДР, ППДР, ПДР в культуру клеток сосудистого эндотелия здоровых лиц возрастает соответственно на 11,2 % (19,73 пг/мл), 45,2 % (25,78 пг/мл) и 76,3 % (31,29 пг/мл), без введения — 17,75 пг/мл; уровень TNF-α возрастает на 57,0 % (13,61 пг/мл), 100,8 % (17,41 пг/мл) и 149,8 % (21,66 пг/мл) соответственно, без введения — 8,67 пг/мл.
При введении липополисахарида (LPS) in vitro уровень IL-1β возрастает при НДР на 17,0 % (с 19,73 до 23,09 пг/мл), ППДР — на 16,0 % (с 25,78 до 29,90 пг/мл), ПДР — на 15,3 % (с 31,29 до 36,09 пг/мл); уровень TNF-α — на 35,7 % (с 13,61 до 18,47 пг/мл), 33,4 % (с 17,41 до 23,23 пг/мл) и 21,7 % (с 21,66 до 26,35 пг/мл) соответственно, то есть лимфоциты больных всех групп стимулируют синтез IL-1β и TNF-α эндотелиальными клетками.
При введении липофлавона in vitro у больных всех групп выявлено значимое снижение IL-1β на 28,2 % (с 19,73 до 14,17 пг/мл), 27,1 % (с 25,78 до 18,80 пг/мл),
28,7 % (с 31,29 до 22,32 пг/мл) соответственно по сравнению с введением мононуклеаров; уровень TNF-α — на 23,8 % (с 13,61 до 10,37 пг/мл), 30,9 % (с 17,41 до 12,04 пг/мл), 27,6 % (с 21,66 до 15,68 пг/мл) соответственно.
При клиническом исследовании у всех пациентов были выявлены микроангиопатии, что включало нарушение калибра сосудов, их неравномерность, микроаневризмы и четкообразные микрогеморрагии по ходу сосудов. Все больные в результате лечения отмечали улучшение самочувствия, хорошую переносимость препарата, аллергических реакций не наблюдалось.
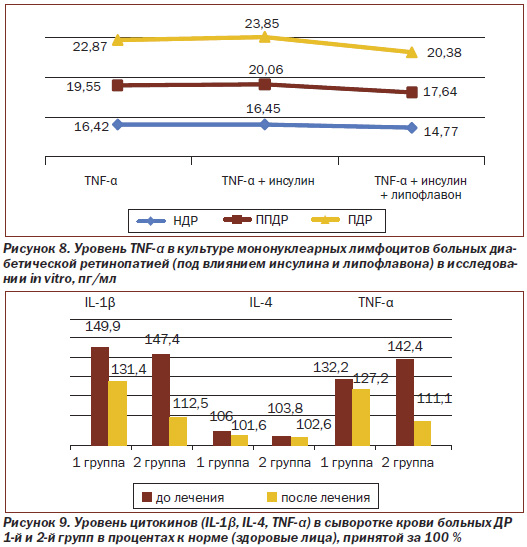
Уровень цитокинов (IL-1β, IL-4 и TNF-α) у больных диабетической ретинопатией при лечении традиционной терапией и при применении липофлавона в комплексном лечении представлены на рис. 9.
Как видно из рис. 9, при поступлении в стационар уровень IL-1β в системном кровотоке больных ДР 1-й и 2-й групп существенно не различается. Установлено, что под влиянием традиционной комплексной терапии у больных 1-й группы исследованный показатель несколько меняется — снижается лишь на 9,5 %, а у больных 2-й группы, получавших липофлавон по разработанной нами схеме, достоверно снижается на 34,9 % (р < 0,001, р1 < 0,01).
В результате наших исследований было установлено, что у больных с НДР уровень противовоспалительного цитокина IL-4 снижен на 38 % и при прогрессировании ДР постепенно увеличивается почти до нормы уже при ПДР, также in vitro в культуре мононуклеарных лимфоцитов под влиянием липофлавона исследованный показатель статистически значимо не меняется; тем не менее мы посчитали целесообразным исследовать его у больных ДР на этапе клинических исследований.
Анализ представленных на рис. 9 данных свидетельствует, что уровень IL-4 в системном кровотоке больных ДР 1-й и 2-й групп существенно не различается и не меняется под влиянием проводимой терапии, включая липофлавон.
Как видно из рис. 9, при поступлении в стационар уровень TNF-α в системном кровотоке больных ДР 1-й и 2-й групп достоверно не различается. Установлено также, что под влиянием традиционной комплексной терапии у больных 1-й группы исследованный показатель значимо не меняется (р < 0,5), а у больных 2-й группы, получавших липофлавон по разработанной нами схеме, — снижается на 31,4 % (р < 0,001, р1 < 0,02), хотя еще не полностью возвращается к норме.
Таким образом, как видно из представленных исследований, уровень провоспалительных цитокинов (IL-1β и TNF-α) снижается всего лишь на 9,5 и 4,9 % соответственно под влиянием традиционной терапии, а при применении липофлавона в комплексном лечении эти показатели достоверно выше — снижаются на 34,9 и на 31,4 % соответственно; на уровень противовоспалительного цитокина IL-4 ни традиционная терапия, ни терапия в комплексе с липофлавоном статистически достоверного действия не оказывает.
Но рекомендуемое нами лечение способствует восстановлению баланса между провоспалительными (IL-1β и TNF-α) и противовоспалительным (IL-4) цитокинами, так как дисбаланс цитокинов является важным патогенетическим «пусковым» механизмом сосудистых реакций у больных СД, способствует улучшению функции сосудистого эндотелия.
Динамика остроты зрения больных ДР при применении липофлавона в комплексном лечении и в группе контроля представлена на рис. 10.
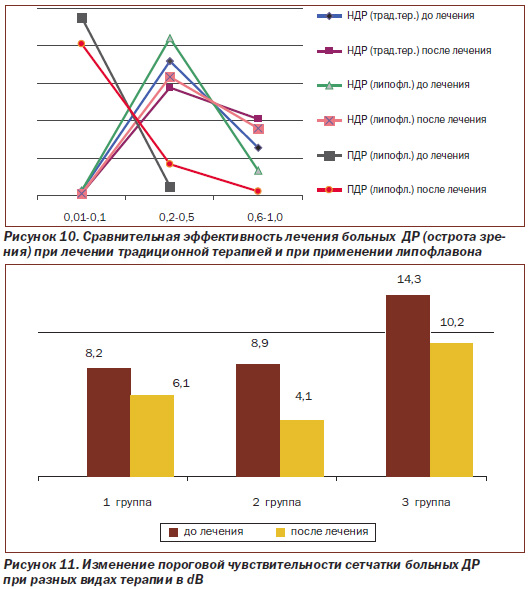
Как видно из рис. 10, до лечения в 1-й группе (группа контроля), получавшей только традиционную терапию, острота зрения в пределах 0,01–0,1 из 78 глаз была на 2 (2,6 %), 0,2–0,5 — на 56 глазах (71,8 %), 0,6–1,0 — на 20 глазах (25,6 %). После лечения зрение в указанных пределах в этой группе было соответственно на 1 (1,3 %), 45 (57,7 %) и 32 глазах (41 %). Во 2-й группе, получавшей липофлавон на фоне традиционного лечения, из 106 глаз с НДР острота зрения 0,01–0,1 была на 3 (2,8 %), 0,2–0,5 — на 89 (84 %) и 0,6–1,0 — на 14 глазах (13,2 %). В этой же группе после лечения острота зрения 0,01–0,1 отмечена на 1 (1 %), 0,2–0,5 — на 67 глазах (63,2 %) и 0,6–1,0 — на 38 глазах (35,8 %). В 3-й группе больных ПДР, получавших липофлавон на фоне традиционного лечения, острота зрения из 84 глаз до лечения составляла 0,01–0,1 на 80 глазах (95,2 %), 0,2–0,5—на 4 глазах (4,8 %). Более высокой остроты зрения в этой группе больных не отмечено. После лечения в этой группе больных из 84 глаз на 68 (80,9 %) отмечено зрение 0,01–0,1, на 14 (16,7 %) — 0,2–0,5 и на 2 глазах (2,4 %) оно было равно 0,6–1,0.
Динамика изменений пороговой чувствительности сетчатки согласно компьютерной статической периметрии Хамфри у больных ДР в зависимости от вида терапии представлена на рис. 11.
Как видно из рис. 11, у больных ДР пороговая чувствительность сетчатки снижена во всех группах исследования, причем степень ее снижения зависит от степени ДР — чем тяжелее стадия, тем ниже пороговая чувствительность.
При применении комплексной терапии с липофлавоном среднее отклонение световой чувствительности сетчатки от среднестатистической нормы — МD, что характеризует среднестатистическое значение пороговой чувствительности сетчатки (при достоверности p < 0,5), существенно возрастает, то есть показатель уменьшается как у больных 2-й группы (на 53,9 %), так и у больных 3-й группы (на 28,7 %) по сравнению с исходным значением до лечения в данной группе больных, принятым за 100 %. В группе больных, получавших традиционную терапию при ДР, пороговая чувствительность сетчатки возросла на 25,8 % по сравнению с исходным значением показателя, что достоверно ниже на 28,1 %, нежели во 2-й группе больных ДР, комплексное лечение которых включало липофлавон.
Как известно, определение пороговой чувствительности сетчатки является субъективным методом исследования и во многом зависит от самосознания пациента и от многих других факторов, но тем не менее при исследовании мы наблюдали четкое соответствие клинической картины глазного дна (наличия или отсутствия геморрагий, плазморрагий, очагов твердого и мягкого экссудата) и степени снижения пороговой чувствительности сетчатки в результате проводимой терапии, что, по нашему мнению, позволяет рассматривать данный метод исследования как чувствительный и необходимый для контроля динамики и эффективности лечения больных ДР.
Протоколы исследований пороговой чувствительности сетчатки с помощью периметрии Хамфри больного N с ДР (правый глаз и левый глаз) до лечения и после консервативного лечения с применением липофлавона представлены на рис. 12–15.
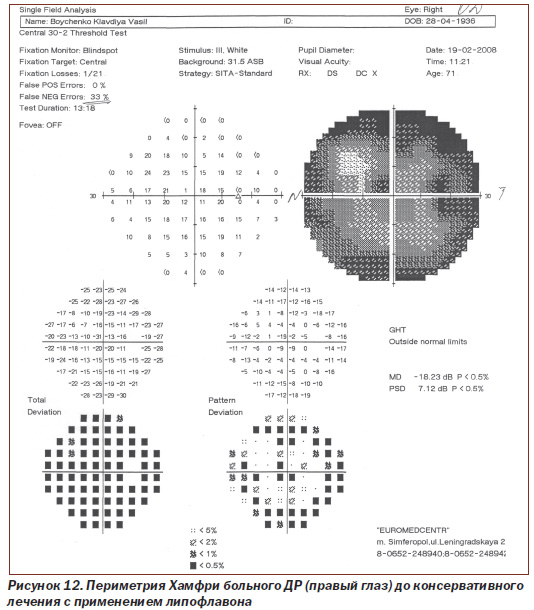
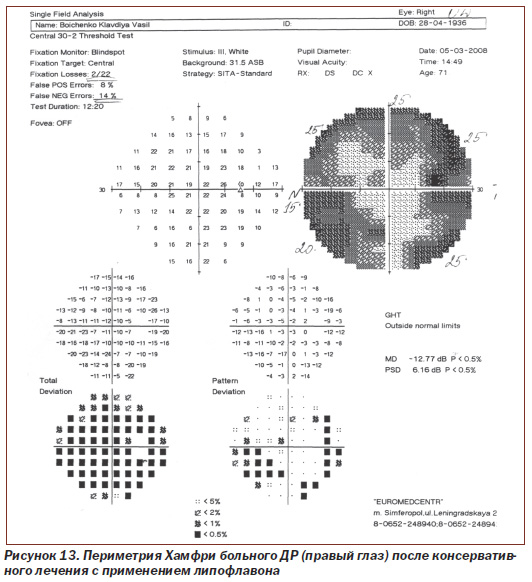
Как видно из рис. 12, 13, при исследовании на периметре Хамфри пороговая чувствительность сетчатки правого глаза у больного N с ДР до лечения составила 18,23 dB, p < 0,5 %; РSD 7,12 dB, p < 0,5 %, после проведения рекомендуемой нами терапии показатель соответствовал 12,77 dB, p < 0,5 %; РSD 6,16 dB, p < 0,5 %.
Таким образом, среднее статистическое отклонение (МD) пороговой чувствительности сетчатки правого глаза у пациента N с ДР до лечения снижено более чем в 9 раз по сравнению с нормой у здоровых людей (до 2 dB), после проведения рекомендуемой нами комплексной терапии с применением липофлавона оно снижено в 6 раз, то есть пороговая чувствительность сетчатки более чем на 30 % выше (показатель имеет обратное значение), чем до лечения (при достоверности p < 0,5).
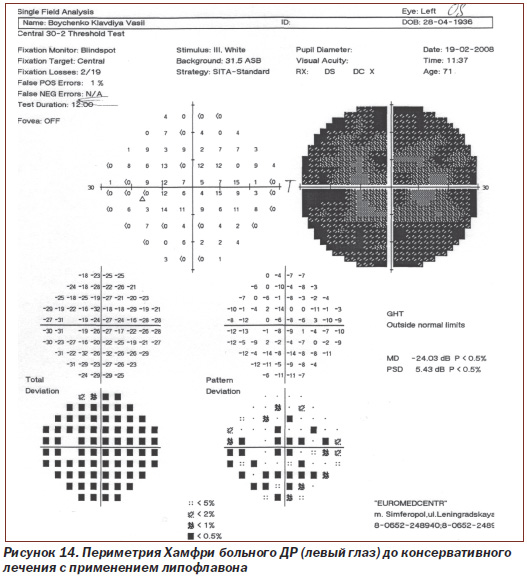
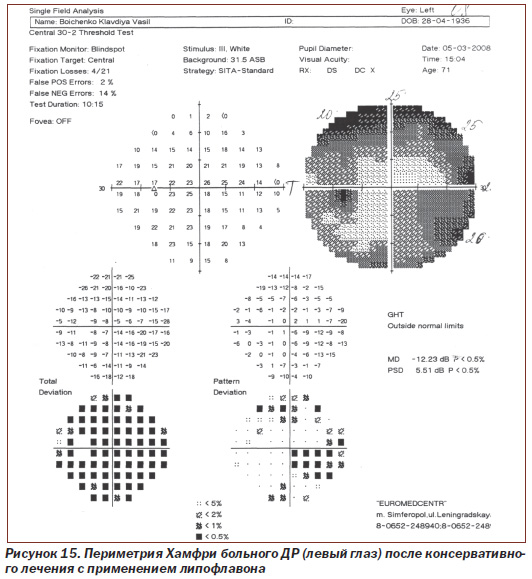
При исследовании пороговой чувствительности сетчатки левого глаза у больного N с ДР на периметре Хамфри (рис. 14, 15) показатель до лечения составлял 24,03 dB, p < 0,5 %; РSD 5,43 dB, p < 0,5 %, после проведения рекомендуемой нами терапии значение показателя стало 12,23 dB, p < 0,5 %; РSD 5,51 dB, p < 0,5 %.
Таким образом, значение среднего статистического отклонения (МD) пороговой чувствительности сетчатки левого глаза у пациента N с ДР снижено до лечения в 12 раз по сравнению с нормой у здоровых людей, после проведения рекомендуемой нами терапии — снижено в 6 раз, то есть пороговая чувствительность сетчатки на 50 % выше (показатель имеет обратное значение), чем до лечения (при достоверности p < 0,5).
Таким образом, по данным компьютерной статической периметрии Хамфри, у исследуемых больных с ДР пороговая чувствительность сетчатки снижена при НДР (1-я и 2-я группы) более чем в 4 раза, а при ПДР — более чем в 7 раз. После проведения традиционной терапии (1-я группа) показатель снизился на 20 % и был ниже нормы в 3 раза. После проведения рекомендуемой нами терапии с применением липофлавона (2-я группа) пороговая чувствительность сетчатки исследуемых больных ДР увеличилась на 53 % по сравнению с исходным значением до лечения и была ниже нормы в 2 раза, а при ПДР показатель снизился на 30 % по сравнению с исходным значением и был снижен по сравнению с нормой в 5 раз. То есть в результате проведения традиционной терапии показатель в среднем повышается на 20 % (1-я группа) против 53 % (2-я группа), что достоверно выше, при применении рекомендуемой нами терапии, показывает более высокую эффективность лечения (на 33 %) и позволяет нам рекомендовать липофлавон в комплексном лечении больных ДР.
Изменение ПЭЧФ и КЧИМФ у исследуемых больных ДР при лечении разными видами терапии представлено на рис. 16, 17.
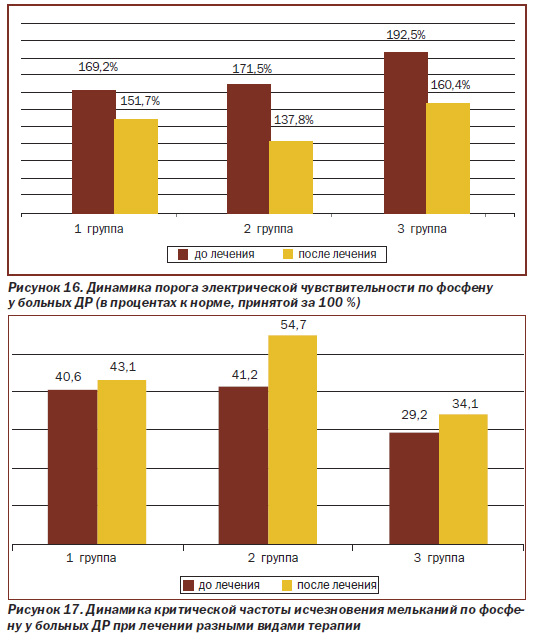
Как видно из рис. 16, у больных ДР в зависимости от стадии заболевания имеется достоверное снижение ПЭЧФ (показатель имеет обратное значение) по сравнению с нормой, причем чем тяжелее стадия ДР, тем ниже показатель.
Так, у больных, получавших традиционную терапию (1-я группа), показатель ПЭЧФ до лечения был равен 118,5 мкА, что на 69,2 % выше нормы, принятой за 100 %, после лечения он составлял 106,2 мкА — на 51,7 % выше нормы, то есть в результате лечения показатель ПЭЧФ возрос на 17,5 %.
А при применении препарата липофлавон в комплексной терапии больных ДР (2-я группа) показатель ПЭЧФ до лечения составляет 120,1 мкА, что на 71,5 % выше нормы, а после лечения он равен 96,5 мкА — выше нормы на 37,8 %, что достоверно выше на 33,7 % по сравнению с его исходным значением.
У больных 3-й группы с ПДР до лечения ПЭЧФ составил 134,8 мкА, что на 92,5 % выше нормы, а после применения рекомендуемой нами терапии — 112,3 мкА, что выше нормы на 60,4 %, и достоверно увеличился (обратное значение показателя) на 32,1 % по сравнению с его исходным значением.
Таким образом, у исследуемых больных ДР показатель ПЭЧФ повышен во всех группах исследования, причем при НДР — на 69,2–71,5 %, а при ПДР — на 92,5 %. При применении традиционной терапии ПЭЧФ при НДР снижается на 17,5 %, а при применении модифицированного способа лечения при НДР — на 33,7 %, что достоверно больше, чем при традиционной терапии, а при ПДР — на 32,1 %.
При исследовании изменения показателя КЧИМФ (рис. 17) в лечении больных ДР различными видами терапии установлено: показатель у больных 1-й и 2-й групп с НДР до лечения — в пределах физиологического диапазона (нормы), после лечения показатель повысился в пределах нормы, но в 1-й группе (традиционная консервативная терапия) повышение показателя (на 6,2 %) не было достоверным по сравнению с исходным значением, принятым за 100 %, а во 2-й группе (с применением липофлавона в комплексной терапии) показатель КЧИМФ достоверно увеличился на 32,7 % по сравнению с исходным значением до лечения, что в 5 раз (на 26,6 %) достоверно выше, чем при традиционной терапии.
В 3-й группе показатель КЧИМФ был снижен на 41,6 % по сравнению с нормой и увеличился при применении липофлавона в комплексной терапии на 16,8 % по сравнению с исходным значением. Полученные результаты исследования свидетельствуют о большей эффективности терапии с применением липофлавона, что, по нашему мнению, связано с активацией биохимических и иммунологических процессов сетчатки, способствующих улучшению чувствительности и лабильности зрительного анализатора.
Полученные результаты исследования по данным электрической чувствительности и лабильности сетчатки свидетельствуют о большей эффективности (в 3 раза) модифицированного способа лечения с применением липофлавона по сравнению с традиционной терапией, что может быть связано с повышением функциональной активности зрительного анализатора.
Выводы
У больных ДР выявлен повышенный уровень провоспалительных цитокинов (IL-1β и TNF-α), причем чем тяжелее стадия заболевания, тем выше уровень изучаемых цитокинов, что является важным фактором прогрессирования ДР.
Установлено, что по мере нарастания степени тяжести ДР идет нарастание синтеза провоспалительных цитокинов (IL-1β и TNF-α) лимфоцитами, что может быть важным звеном патогенеза прогрессирования диабетической ретинопатии.
В исследованиях in vitro установлено, что липофлавон влияет на функциональную активность мононуклеарных лимфоцитов, то есть достоверно снижает уровень цитокинов (уровень IL-1β и TNF-α снижается как в присутствии глюкозы (в среднем на 16,7 % при НДР, на 15,2 % при ППДР), так и инсулина (в среднем на 5,1, 17,0 и 20,8 % соответственно). Выявлено модулирующее (ингибирующее) влияние липофлавона на лимфоидную регуляцию функциональной активности эндотелиальных клеток (синтез IL-1β и TNF-α), то есть при введении липофлавона уровень IL-1β и TNF-α значимо ниже у больных всех групп, чем при LPS.
При применении традиционной комплексной терапии у больных 1-й группы уровень провоспалительных цитокинов IL-1β и TNF-α снижается на 9,5 и 4,9 % соответственно, а у больных 2-й группы, получавших в комплексном лечении липофлавон, снижается на 34,9 % (р < 0,001, р1 < 0,01) и на 31,4 % (р < 0,001, р1 < 0,02) соответственно.
Под влиянием традиционной комплексной терапии у больных 1-й группы уровень провоспалительных цитокинов IL-1β и TNF-α снижается на 9,5 и 4,9 % соответственно, а у больных 2-й группы, получавших в комплексном лечении липофлавон по разработанной нами схеме, — на 34,9 % (р < 0,001, р1 < 0,01) и 31,4 % (р < 0,001, р1 < 0,02) соответственно.
Установлено улучшение зрительных функций у больных ДР в среднем на 0,15–0,2 ед (против 0,1 при традиционной терапии), нормализация калибра микрососудов наступает при НДР на 9-й день и при ПДР — на 11-й день, что достоверно быстрее, чем при традиционной терапии (на 13-й день). Уменьшение микрогеморрагий (а в некоторых случаях — и их рассасывание) при применении липофлавона наблюдалось при НДР на 10-й день, при ПДР — на 13-й день, что также достоверно быстрее, чем при традиционной терапии (на 16-й день).
По данным компьютерной статической периметрии Хамфри у исследуемых больных ДР пороговая чувствительность сетчатки снижена в зависимости от стадии заболевания: чем тяжелее стадия, тем ниже пороговая чувствительность. При применении липофлавона в комплексном лечении пороговая чувствительность сетчатки существенно возрастает, то есть показатель уменьшается как у больных 2-й группы — на 53,9 %, так и у больных 3-й группы — на 28,7 %, что достоверно выше на 28,1 %, нежели в 1-й группе больных ДР (на 25,8 %), получавших традиционную терапию.
У больных ДР показатель ПЭЧФ снижен во всех группах исследования в зависимости от стадии заболевания — на 69,2, 71,5, 92,5 % соответственно. При применении традиционной терапии показатель ПЭЧФ достоверно снижается на 17,5 %, а при применении липофлавона — на 33,7 %, что почти в 2 раза больше, чем при традиционной терапии.
Показатель КЧИМФ у больных 1-й и 2-й групп с НДР до лечения — в пределах физиологического диапазона, после лечения показатель повысился в пределах нормы, в 3-й группе показатель КЧИМФ был снижен на 41,6 % по сравнению с нормой. При применении липофлавона в комплексном лечении показатель во 2-й группе достоверно увеличился на 32,7 % по сравнению с исходным значением до лечения, что в 5 раз (на 26,6 %) достоверно выше, чем при традиционной терапии. В 3-й группе показатель увеличился на 16,8 % по сравнению с исходным значением до лечения. То есть чувствительность и лабильность зрительного анализатора повышаются в большей степени при применении липофлавона в комплексном лечении больных ДР.
Таким образом, полученные результаты свидетельствуют о большей, чем у традиционной терапии, эффективности применения липофлавона в комплексном лечении больных ДР.
1. Воспаление: рук-во для врачей / Под ред. В.В. Серова, В.С. Аукова. — М.: Медицина, 1995. — 640 с.
2. Громыхина Н.Ю., Крымская Л.Г., Козлов В.А. Роль макрофагов в процессе формирования регуляторных связей между иммунной, нервной и эндокринной системами в ходе иммунного ответа // Успехи физиологических наук. — 1993. — Т. 113, вып. 1. — С. 59-79.
3. Жабоедов Г.Д., Скрипник Р.Л., Сидорова М.В. Иммунопатологические процессы в сетчатке при развитии диабетической ретинопатии // Вестник офтальмологии. — 2000. — № 6. — С. 36-39.
4. Иванова Н.В., Ярошева Н.А. Влияние липофлавона на функциональную активность клеток сосудистого эндотелия у больных с диабетической ретинопатией в эксперименте (in vitro) // Проблемы, достижения и перспективы развития медико-биологических наук и практического здравоохранения: Труды Крымского медицинского университета им. С.И. Георгиевского. — Симферополь, 2008. — Т. 144, ч. 2. — С. 60-66.
5. Иванова Н.В., Ярошева Н.А. Значение взаимосвязи провоспалительных цитокинов, фибринолитического потенциала крови и дисфункции эндотелия в патогенезе диабетической ретинопатии // Актуальні питання медичної науки та практики: збірник наукових праць. — Запоріжжя, 2009. — Вип. 75, К 2. — С. 178-186.
6. Іванова Н.В., Ярошева Н.А. Патогенетичне обгрунтування застосування ліпофлавону у хворих з різними формами діабетичної ретинопатії // Клінічна фармація. — 2008. — Т. 12, № 2. — С. 11-16.
7. Иванова Н.В., Ярошева Н.А. Роль дисбаланса цитокинового гомеостаза в патогенезе диабетической ретинопатии // Офтальмологический журнал. — 2008. — № 2. — С. 11-14.
8. Кочемасова В.Т. Состояние эндотелия и адгезия лейкоцитов при сахарном диабете // Сахарный диабет. — 2000. — № 3. — С. 73-78.
9. Пальцев М.А., Иванов А.А. Межклеточные взаимодействия. — М.: Наука, 1995. — 418 с.
10. Балаболкин М.И., Никишова М.С., Волкова А.К. и др. Применение антиоксидантов из группы флавоноидов в лечении диабетической ретинопатии при сахарном диабете типа 2 // Клиническая эндокринология. — 2003. — Т. 49, № 3. — С. 3-6.
11. Сидорова М.В. Диабетическая ретинопатия. Патогенез, клиника, лечение. — К.: СМП АВЕРС, 2006. — 156 с.
12. Смирнова О.М., Кураева Т.Л. Диабетология: реальность и перспективы // Здоров''я України. — 2005. — № 11–12. — С. 10-11.
13. Пасечникова Н.В., Дмитриев С.К., Науменко В.А. и др. Характер поражения органа зрения у больных сахарным диабетом в Украине по данным обращаемости в институте глазных болезней и тканевой терапии им. В.П. Филатова АМН Украины // Офтальмологический журнал. — 2008. — № 1. — С. 47-49.
14. Ярошева Н.А. Цитокиновый дисбаланс при диабетической ретинопатии // Мат-ли II Всеукраїнськії конференції «Сучасні методи діагностики та лікування в офтальмології». — Харків, 2008. — С. 140-142.
15. Cubitt C.L., Lausch R.N., Oakes J.E. Differential induction of GROα gene expression in human corneal epithelial cells and keratinocytes exposed to proinflammatory cytokines // Invest. Opthalmol. Vis. Sci. — 2002. — Vol. 38, № 11. — P. 1149-1158.
16. Demircan N., Safran B.G., Soylu M. et al. Determination of vitreous interleukin-1 (IL-1) and tumour necrosis factor (TNF) levels in proliferative diabetic retinopathy // Eye. — 2006. — Vol. 20, № 12. — P. 1366-1369.
17. Kumaraguru U., Davis I., Rouse B.T. Chemokines and ocular pathology caused by corneal infection with herpes simplex virus // J. Neurovirol. — 1999. — Vol. 5, № 1. — P. 42-47.
18. Pearlman E., Rothenberg M.E. Chemokines in ocular allergy and inflammation // Chemokines in Allergic Disease. — New York: Marcel Dekker, 2000. — P. 435-452.
19. Yamagata T., Ichinose M. Agents against cytokine synthesis or receptors // Eur. J. Pharmacol. — 2006. — Vol. 8, № 533 (1–3). — P. 289-301.
