Газета «Новости медицины и фармации» Неврология (328) 2010 (тематический номер)
Вернуться к номеру
Медикаментозная поддержка при операциях на сонных артериях
Авторы: Ю.В. Родин, Д.Ш. Дюба, Е.Ю. Маленкова. Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины, г. Донецк
Версия для печати
Введение
При оперативном лечении стенозов внутренней сонной артерии (ВСА) тромбозы зоны реконструкции остаются основной причиной возникновения послеоперационных неврологических нарушений и смерти [4].
Профилактические мероприятия предупреждения данного осложнения базируются на широком комплексе мер, направленных на предотвращение ранних и поздних послеоперационных осложнений [1, 2]. Применение различных методик с целью расширения втока во внутреннюю сонную артерию уменьшает риск послеоперационных тромбозов [2, 3, 9]. Однако наличие заплаты не защищает от нарушений кровообращения у больных с сочетанной патологической извитостью, остаточной флотирующей бляшкой или наличием тромбов в дистальной части внутренней сонной артерии. Эти проблемы в основном встают перед хирургом в процессе выполнения операции и требуют применения нестандартных приемов [3]. По нашему мнению, уменьшение числа осложнений базируется на предположении, что гемодинамически устойчивая система с минимальной турбулентностью и зоной тромбогенерации, отсутствием извитости дистального русла при адекватности эндартерэктомии уменьшает возможность возникновения послеоперационного тромбоза и развития рестенозов.
Вторым не менее важным способом предотвращения данного вида осложнений остается медикаментозная коррекция, которая резко снижает возможность возникновения тромбов и микроэмболов, особенно из зоны эндартерэктомии. Проблема назначения антитромбоцитарных препаратов для первичной и вторичной профилактики острых сосудистых событий у больных с атеросклеротическим поражением сосудов разной локализации еще со-всем недавно считалась окончательно решенной. Исследование Antiplatelets Trialists Collaboration в 2002 году, казалось, поставило точку в этом вопросе, показав, что длительное применение антитромбоцитарных лекарственных средств снижает риск развития острых сосудистых событий более чем на 30 %. Ацетилсалициловая кислота была признана золотым стандартом антитромбоцитарной терапии, а ее широкое назначение принято к неукоснительному исполнению медицинской общественностью всего мира. Однако столь оптимистическое начало не увенчалось победой над инфарктами и инсультами — их частота из года в год продолжала расти, а в литературе все чаще стали появляться данные о том, что ацетилсалициловая кислота далеко не всегда справляется с возложенной на нее задачей.
Наличие выраженных индивидуальных различий чувствительности к аспирину заставило задуматься о необходимости и возможности использования альтернативных антитромбоцитарных препаратов. Из них в арсенале врачей на сегодня имеются дипиридамол (действие препарата связано с повышением концентрации циклических нуклеотидов и влиянием на концентрацию аденозиндифосфата (АДФ), тромбина, арахидоновой кислоты) и тиенопиридины — тиклопидин и клопидогрель (необратимые и селективные ингибиторы аденозиновых рецепторов тромбоцитов). Ингибиторы гликопротеиновых рецепторов тромбоцитов GP IIb/IIIа, воздействующие на конечный этап формирования тромбоцитарного агрегата путем предотвращения образования межтромбоцитарных фибриногеновых «мостиков», имеют показания к назначению только в хирургической практике и при острых коронарных событиях.
Долгосрочная эффективность и безопасность клопидогреля (плавикса) установлены в основных клинических испытаниях с участием более чем 100 тыс. пациентов, а также в исследовании CAPRIE, в котором в популяции пациентов с атеросклеротическим поражением сосудов зафиксировано преимущественное снижение относительного риска сосудистой смерти, ишемического инсульта и инфаркта миокарда на 8,7 % по сравнению с таковыми при приеме аспирина. Доказанная антиагрегантная эффективность клопидогреля позволила рекомендовать препарат в качестве альтернативы аспирину у пациентов, имеющих противопоказания к назначению либо нечувствительных к ацетилсалициловой кислоте. Клопидогрель селективно ингибирует связывание аденозиндифосфата с рецепторами тромбоцитов и активацию комплекса GPIIb/IIIa, угнетая таким образом агрегацию тромбоцитов. Агрегацию же тромбоцитов, вызванную другими агонистами, ингибирует путем блокады повышения активности тромбоцитов высвобожденным аденозиндифосфатом. Препарат не влияет на активность фосфодиэстеразы.
Клопидогрель необратимо изменяет АДФ-рецепторы тромбоцита, в связи с чем тромбоциты остаются нефункциональными на протяжении всей жизни, а восстановление нормальной функции происходит по мере обновления тромбоцитов (приблизительно через 7 дней).
Статистически значимое и зависящее от дозы торможение агрегации тромбоцитов наблюдается через 2 ч после приема внутрь разовой дозы клопидогреля. Повторный прием дозы 75 мг приводит к значительному торможению агрегации тромбоцитов. Эффект усиливается прогрессивно, и стабильное состояние достигается через 3–7 дней. При этом средний уровень торможения агрегации под действием дозы 75 мг составляет 40–60 %. Агрегация тромбоцитов и время кровотечения возвращаются к исходному уровню в среднем через 7 дней после прекращения приема клопидогреля.
Однако любая операция представляет собой определенный риск развития ранних и поздних осложнений, и нивелирование их, пусть даже с некоторым избытком, отвечает поговорке: «Цель оправдывает средства» [4, 9, 11].
Риск осложнений, связанный с операцией каротидной эндартерэктомии, в первую очередь при остром нарушении мозгового кровообращения (ОНМК), разными авторами оценивается в пределах 0,9–6 %. Пережатие сонной артерии СА является непосредственной причиной 5–30 % периоперационных ОНМК от их общего количества [6–11].
В связи с вышеизложенным очевидна необходимость защиты головного мозга во время операций на каротидном бассейне от гипоксии. Мозговая ткань является особенно чувствительной к перекисно-обусловленному повреждению из-за высокого содержания железа, полиненасыщенных липидов и бедной антиоксидантной системы. Следовательно, перекисный механизм во-влекается в процесс ишемического реперфузионного повреждения мозговой ткани, которое в моделях на животных может быть предупреждено или ослаблено применением антиоксидантной терапии. Каротидная эндартерэктомия (КЭ) представляется как отдельный эпизод фокальной ишемии головного мозга с последующей реперфузией. Эта парадигма ишемического реперфузионного повреждения мозговой ткани имеет как преимущества, так и недостатки патофизиологической модели ишемического повреждения нейронов. Использование внутреннего шунта во время операции уменьшает тяжесть повреждения; таким образом, клинически значимые повреждения нейронов наблюдаются редко. Тем не менее большими преимуществами этой модели являются клиническая база, контролируемость и возможность оценки тяжести ишемического инсульта с помощью полимодального мониторинга, основанного на транскраниальной допплерографии, определении газового насыщения венозной крови и регистрации электрофизиологических данных вследствие церебральной ишемии. Более того, возможность забора образцов артериальной и венозной крови позволяет изучить колебания уровня биологически значимых соединений в циркулирующей крови.
Имеются работы, в которых каротидная эндартерэктомия использована в качестве клинической модели ишемии головного мозга, а характер изменений индикаторов ишемического повреждения в плазме коррелировал с тяжестью ишемии, определенной яремной оксиметрией.
Цель работы: определение путей медикаментозной и технической защиты головного мозга во время выполнения каротидной эндартерэктомии.
Материалы и методы
В течение периода с 2005 по 2009 гг. в отделе неотложной и восстановительной хирургии сосудов ИНВХ им. В.К. Гусака АМН Украины выполнено 545 каротидных эндартерэктомий — 404 (74,1 %) у мужчин и 141 (25,9 %) у женщин. Операции в основном выполнены под общей анестезией 472 (87 %). Все пациенты оперированы первично (6 операций по поводу рестенозов не включены в анализ). Двусторонняя КЭ выполнена у 227 пациентов. Возраст пациентов от 31 до 78 лет. Сопутствующая патология, наблюдаемая в данной группе пациентов: ИБС — 69 %, артериальная гипертензия — 59 %, диабет — 16 %. По неврологической симптоматике: у 187 пациентов наблюдались транзиторные ишемические атаки, 256 пациентов перенесли инсульт в течение одного года до операции, 336 пациентов имели выраженный неврологический дефицит. Показанием к КЭ у асимптомных пациентов явилось наличие лакунарных инфарктов при выполнении магнитно-резонансной томографии (МРТ) [2].
Степень стеноза варьировала от 58 до 99 %. Показания к оперативному лечению:
Всем больным проведено ультразвуковое исследование для определения степени поражения экстракраниальных сосудов и состояния виллизиева круга на аппарате Sonoline Elegra advanced фирмы Siemens. В случае множественных и эшелонированных поражений экстракраниальных артерий дополнительно проводилось изучение цереброваскулярного резерва с помощью пробы с нитроглицерином. При этом по той же методике проводилось измерение кровотоков по СМА исходно и через 1, 3, 5, 7, 9 минут после сублингвального введения 0,25 мг нитроглицерина. Оценивались время и степень снижения пиковой систолической скорости, время восстановления исходных показателей кровотока. Основным показанием к операции служила не степень стеноза, а эмбологенная опасность бляшки. СКТ-исследование, в том числе компьютерно-томографическая ангиография, перфузионная КТ проводились на спиральном компьютерном томографе FX/I фирмы General Electric (США), МРТ-исследование, в том числе MP-ангиография, — на магнитно-резонанс-ном томографе Gyroscan Intera фирмы Siеmens (Германия).
При МРТ определялись состояние артерий виллизиева круга, наличие зоны предшествующих инфарктов, сопутствующая патология. При малейшем подозрении на неудовлетворительное состояние периферического мозгового русла или стеноза сифона больным выполнялась селективная ангиография.
Во время и после операции проводился мониторинг артериального давления. Интраоперационная защита заключалась в следующем. Артериальное давление в момент пережатия сонных артерий поддерживалось на цифрах выше рабочего на 20–30 мм рт.ст.; индукция в наркоз с применением натрия оксибутирата 20% — 40,0 мл, перед пережатием дополнительно вводился тиопентал натрия 1% — 40,0 мл, производилось введение гепарина в дозе 5000 ЕД. Фоново проводилась инфузия нимотопа со скоростью 1 мг/ч; начало инфузии — за 2 часа до операции. Перед пережатием сонной артерии внутривенно вводились 1000 мг цераксона, 10 мл L-лизина. Для определения необходимости применения внутрипросветного шунта применялись два критерия:
Временный шунт использовался в 175 (32 %) случаях. Ни одному пациенту не было отказано в оперативном лечении из-за недоступности непораженной части внутренней сонной артерии. Некоторые предпосылки использования внутреннего шунта (ВШ) в каротидной хирургии [1, 7, 11]:
Для приблизительной проверки гипотезы ишемического повреждения мозга во время пережатия ВСА проведено субисследование. После получения согласия 50 пациентам (средний возраст 63 ± 4 года, от 54 до 76 лет) была выполнена КЭ. Группа включала 4 женщины и 46 мужчин. У всех пациентов показанием к КЭ был симптоматический стеноз сонных артерий более 70 %, который подтверждался сонографически.
Перед операцией проводилась проба Матаса, в соответствии с полученными результатами определялась целесообразность проведения внутрипросветного шунтирования. У всех пациентов КЭ выполнялась под общим обезболиванием (натрия оксибутират 20 мл, тиопентал натрия 2 мг/кг). 18 пациентам во время КЭ проводилось внутрипросветное шунтирование шунтом Пруитт — Инахара
Для исследования некоторых биохимических особенностей во время пережатия внутренней сонной артерии пациенты были разделены на две группы — с ВШ и без ВШ. Образцы венозной и артериальной крови собирались непосредственно перед каротидным клипированием и спустя 10 мин после восстановления каротидного кровотока. Определялись напряжение СО2, О2, содержание в плазме оксида азота (NO), катаболической тимидинфосфорилазы (ТФк), анаболической тимидинфосфорилазы (ТФа). Количество образующегося в тканях NO определяли по его стабильному метаболиту (NО2 — нитрит-анион) с помощью реактива Грисса спектрофотометрическим методом, описанным в литературе [6]. Реактив Грисса готовили, смешивая 1 часть 0,1% нафтилэтилендиамина гидрохлорида в дистиллированной воде с 1 частью 1% сульфаниламида в 5% НзРС > 4 непосредственно перед определением. Определение NО2 проводили в депротеинизированных образцах, которые готовили, добавляя к 0,5 мл образца 0,1 мл 35% сульфосалициловой кислоты. Через 30 мин образующийся осадок белка устраняли центрифугированием при 10 000 об. в течение 10 мин, нейтрализовали 5% раствором NaOH и в аликвоте определяли NО2, добавляя реактив Грисса в соотношении 1 : 1 (V : V). Определяли величину экстинкции при 543 нм через 5 мин после смешивания. Количество NO определяли по калибровочной кривой.
Содержание ТФк в плазме определялось по следующей методике: пробы (представляющие смесь раствора тимидина — 0,1 мл, калийфосфатный буфер (рН = 7,4) — 0,3 мл, сыворотка, разведенная в 10 раз, — 0,16 мл) инкубируются в термостате 30 мин при 37 °С. После инкубации в контрольные пробы добавляется сыворотка — 0,16 мл. Реакция останавливается кипящей водяной баней — 3 мин. Для осаждения добавляется 2,5 мл 0,01% раствора гидроксида натрия. Выпавший в осадок белок удаляется центрифугированием при 3000 об/мин, 2 мин. Спектрофотометрирование производится на СФ-46 при 300 нм (водородная лампа). Активность тимидинфосфорилазы определяется по формуле:
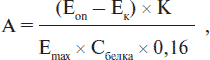
где А — единица ферментативной активности, нмоль/мин · мг; Eon — коэффициент экстинкции опытной пробы; Ек — коэффициент экстинкции контрольной пробы; К — коэффициент пересчета из у.е. в нмоль/мин·мг; для ТФк = 128, для Тфа = 24; Сбелка — концентрация белка по Лоури, мг/мл; Еmax — максимальный коэффициент экстинкции тимина (тимидина), который определяется следующим образом: 0,2 мл раствора тимина (тимидина) в 2,8 мл раствора гидроксида натрия; 0,16 — объем добавляемой сыворотки, мл. За единицу ферментативной активности принимают увеличение экстинкции тимина (тимидина для анаболической тимидинфосфорилазы) при 300 нм на 1 мг белка в течение 30 мин инкубации.
Результаты
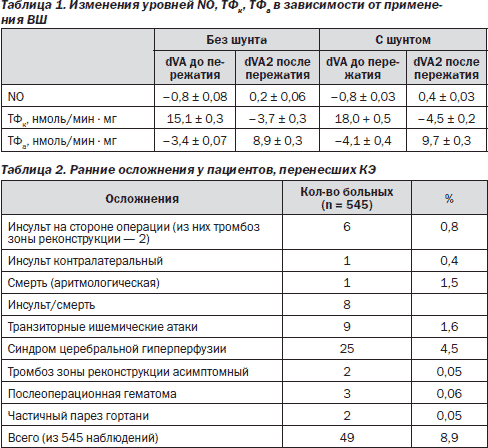
Полученные результаты были обработаны с помощью программы Statistica 6.0. Результаты измерений представлены в табл. 1.
Для выбора метода антитромботической защиты зоны реконструкции нами произведено поисковое исследование 50 больных, разделенных поровну на 2 группы. Пациентам первой группы произведена пластика артериотомического дефекта синтетической заплатой, второй группы — эверсионная эндартерэктомия. Исследовались активированное частичное тромбопластиновое время (АЧТВ), АДФ-индуцированная агрегация тромбоцитов, активность антитромбина III (AT III).
Статистическая обработка результатов исследования проводилась с использованием U-критерия Манна — Уитни, рангового однофакторного анализа Крускала — Уоллиса, критерия Данна для множественных сравнений, критерия χ2. Различия считали достоверными при р < 0,05. Данные представлены как М ± m.
В течение операции ретроградный кровоток по внутренней сонной артерии составлял 51,1 ±
Результаты лечения пациентов в ближайшем послеоперационном периоде представлены в табл. 2.
Всего в послеоперационном периоде нами диагностировано 4 тромбоза зоны реконструкции, в одном случае нам удалось вовремя произвести тромбэктомию с полным регрессированием неврологической симптоматики. Причиной тромбоза во всех случаях явились некорригируемые гемокоагуляционные нарушения в сочетании с недиагностированными тандемными стенозами.
Обращает на себя внимание высокое число послеоперационных осложнений (8,9 %), однако частично эти осложнения были прогнозируемыми. У 15 пациентов, у которых наблюдался гиперперфузионный синдром, имели место критический стеноз внутренней сонной артерии на фоне контралатеральной окклюзии ВСА и низкое ретроградное перфузионное давление (менее
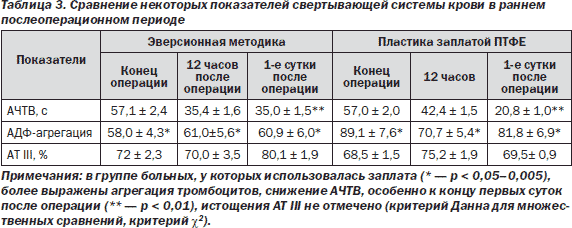
Для большей объективности в исследование включены пациенты без послеоперационных осложнений, сопоставимые по степени стеноза и соматическому статусу. Интраоперационно больные получали фиксировано 5000 ЕД гепарина без последующей инактивации. Адгезивно-агрегационная функция тромбоцитов — это способность прилипать к поврежденной сосудистой стенке и образовывать агрегаты. Активаторами тромбоцитов являются вещества поврежденной сосудистой стенки (АДФ, коллаген и др.), фактор Виллебранда, а также ристоцетин. Хочется отметить, что в случае выполнения каротидной эндартерэктомии мы имеем иногда до 15 см2 внутренней поверхности артерии, лишенной интимы и частично медии, на которых расположены микроучастки интимы и атеросклеротической бляшки. Селективные, микроэмбологенерирущие показатели свертывающей системы представлены в табл. 3.
Обсуждение
По данным литературы, в послеоперационном периоде из-за нарушений в системе гемостаза в оперированной зоне частота НМК составляет 2,7 % [11]. По данным мультицентрового исследования, НМК, как правило, возникают в первые часы после операции КЭ [5–7]. В своей работе P.D. Hayes и соавт. (2001) показали, что наиболее значимым фактором риска развития послеоперационных НМК являются не технические ошибки во время операции, а гиперфункция тромбоцитов [5]. Эти же авторы выявили, что дооперационный функциональный статус тромбоцитов является предиктором послеоперационных тромбозов мозговых сосудов [7, 10]. В нашем исследовании исходно все пациенты имели нормальное функциональное состояние тромбоцитов, однако у больных, перенесших в раннем послеоперационном периоде НМК, уже в конце операции наблюдалась гиперагрегация тромбоцитов. Необходимо отметить, что больные с осложненным течением послеоперационного периода наряду с гиперактивностью тромбоцитов характеризовались и более выраженным атеросклеротическим поражением сосудов мозга. Повышение коагуляционного статуса при этом может быть связано и с прокоагулянтной активностью макрофагов атеросклеротической бляшки. P.G. Tipping и соавт. (1989) выявили при гистологическом исследовании в области атеросклеротического поражения обильное скопление активных макрофагов и моноцитов [8]. При этом макрофаги, выделенные из атеросклеротической бляшки, были способны вызывать локальное отложение фибриновых депозитов в сосудах.
На основании анализа литературы, данных исследования гиперагрегации тромбоцитов в ответ на АДФ, руководствуясь опытом и логикой, мы ввели в протокол медикаментозной поддержки операции плавикс — 75 мг начиная за 1 сутки до операции продолжая его прием минимум до 1 месяца после операции, и клексан в дозе, соответствующей массе больного, в течение 7 суток после операции. Следует отметить, что при применении разработанной методики не зафиксировано кровотечений и ранних послеоперационных тромбозов (107 операций).
То, что во время пережатия ВСА практически всегда возникает оксидантный стресс, обусловливает следующее, возможно, спорное положение — необходима препаратная защита мозга во время пережатия ВСА.
Основываясь на данных литературы, логическом смысле и собственном опыте в течение последних 2 лет, мы применяли следующую схему интраоперационного введения препаратов по точкам операции:
Почему нами выбраны цитиколин (цераксон) и актовегин? При развитии ишемии головного мозга возникает снижение уровня аденозинтрифосфата, что приводит к утечке ионов через клеточные мембраны, деполяризации мембран, высвобождению глутамата и других возбуждающих аминокислот, приводящих к гибели нейронов по механизмам апоптоза и некроза. В экспериментальных исследованиях показано снижение активности участвующих в апоптозе нейронов каспаз и прокаспаз при введении цитиколина.
Цитиколин уменьшает потерю фосфолипидов, снижает образование полиненасыщенных жирных кислот, замедляет процессы перекисного окисления липидов [9]. Цитиколин стимулирует биосинтез структурных фосфолипидов в мембране нейронов, что способствует улучшению функции мембран, в том числе функционированию ионообменных насосов и нейрорецепторов. Благодаря стабилизирующему эффекту на мембрану цитиколин оказывает противоотечное действие, уменьшает отек мозга.
Под влиянием актовегина значительно повышаются диффузия и утилизация кислорода клетками различных органов и тканей, в том числе и альвеол легких, что приводит к улучшению оксигенации в микроциркуляторной системе. Одновременно улучшается анаэробный энергообмен в эндотелии сосудов, сопровождающийся высвобождением эндогенных веществ с мощными вазодилатирующими свойствами — простациклина и оксида азота. В результате улучшается перфузия органов и снижается периферическое сопротивление [10]. Активации кислородного энергообмена практически во всех органах, находящихся в состоянии метаболической недостаточности, способствуют усиление обмена высокоэнергетических фосфатов в клетке, активация ферментов окислительного фосфорилирования и ускорение синтеза углеводов и белков и распада продуктов анаэробного гликолиза.
Таким образом, можно сделать следующие выводы:
4. Считаем применение оригинального клопидогреля обоснованным в до- и послеоперационном периоде в терапевтических дозах, что не приводит к увеличению количества послеоперационных и интраоперационных кровопотерь.
1. Белов Ю.В., Базылев В.В., Степаненко А.Б. Отдаленные результаты хирургического лечения больных с асимптомным стенозом сонных артерий // Хирургия. — 2002. — № 5. — С. 4-6.
2. Родин Ю.В. Влияние характеристик атеросклеротической бляшки и факторов риска на вероятность тромбоза внутренней сонной артерии // Вестник неотложной и восстановительной медицины. — 2005. — № 4. — С. 565-570.
3. Archie J.P., Feldtman R.W. Determinants of cerebral perfusion pressure during carotid endarterectomy // Arch. Surg. — 1982. — Vol. 117, № 3. — P. 319-32.
4. Brothers-Thomas E. Initial experience with eversion carotid endarterectomy: Absence of a learning curve for the first 100 patients // JVS. — 2005. — Vol. 42, № 3. — P. 429-435.
5. De Borst G.J., Hilgevoord A.A.J., de Vries J.P.P.M., van der Mee M., Moll F.L., van de Pavoordt W.M., Ackerstaff R.G.A. Influence of Antiplatelet Therapy on Cerebral Micro-Emboli after Carotid Endarterectomy using Postoperative Transcranial Doppler Monitoring // European Journal of Vascular and Endovascular Surgery. — 2007 Aug.— Vol. 34, № 2. — P. 143-145.
6. Fisher M., Paganini-Hill A., Aldana M., Cosgrove M. et al. Carotid Plaque Pathology Thrombosis, Ulceration, and Stroke Pathogenesis // Stroke. — 2005. — Vol. 36. — P. 253-258.
7. Hayes P.D., Box H., Tull S., Bell P.R., Goodall A., Naylor A.R.J. Patients'' thromboembolic potential after carotid endarterectomy is related to the platelets'' sensitivity to adenosine diphosphate // Vasc. Surg. — 2003. — Vol. 38. — P. 1226-31.
8. Molloy J., Markus H.S. Asymptomatic embolization predicts stroke and TIA risk in patients with carotid artery stenosis // Stroke. — 1999. —Vol. 30. — P. 1440-1443.
9. Naylor A.R There is More to Preventing Stroke After Carotid Surgery than Shunt and Patch Debates // European Journal of Vascular and Endovascular Surgery. — 2005 Apr.— Vol. 29, № 4. — P. 329-334.
10. Patel M.R., Kuntz K.M., Klufas R.A., Kim D., Kramer J., Polak J.F., Skillman J.J., Whittemore A.D., Edelman R.R., Kent K.C. Preoperative assessment of the carotid bifurcation. Can magnetic resonance angiography and duplex ultrasonography replace contrast arteriography? // Stroke. — 1995. — Vol. 10. — P. 1753-1758.
11. Tytgat S.H., Laman D.M., Rijken A.M., Klicks R., Voorwinde A., Ultee J.M., Van Duijn H. Emboli Rate During and Early after Carotid Endarterectomy after a Single Preoperative Dose of 120mg Acetylsalicylic Acid-A Prospective Double-Blind Placebo Controlled Randomised Trial // European Journal of Vascular and Endovascular Surgery. — 2005 Feb. — Vol. 29, № 2. — P. 156-162.
