Газета «Новости медицины и фармации» 11-12(331-332) 2010
Вернуться к номеру
Применение Saccharomyces boulardii у детей
Авторы: Y. Vandenplas, Universitair Ziekenhuis Kinderen Brussel, Vrije Universiteit Brussel; O. Brunser, Institute of Nutrition and Food Technology (INTA), U. of Chile, Santiago, Chile; H. Szajewska, Medical University of Warsaw, Poland. Secretary of the Committee on Nutrition of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN)
Версия для печати
Введение
Микрофлора желудочно-кишечного тракта (ЖКТ), так называемая микробиота, представляет собой довольно сложную экосистему, которая сосуществует в равновесии с организмом хозяина. Растет количество данных, подтверждающих, что эта микробиота является основным регулятором иммунной системы, включая и ее внекишечные отделы. Слово «пробиотик» происходит из греческого языка и означает «для жизни». Пробиотики определяют как микроорганизмы (бактерии и дрожжи), устойчивые к перевариванию и достигающие живыми толстого кишечника, которые при употреблении в адекватных количествах оказывают положительное влияние на здоровье хозяина [44]. Еще недавно пробиотики обсуждались в основном в контексте нетрадиционной медицины, а уже сегодня они находят свое применение в обычной медицинской практике [85].
Дрожжи являются частью местной микробной системы, которая составляет < 0,1 % микробиоты. Основными дрожжами, изолируемыми из ЖКТ, является Candida albicans, хотя изредка обнаруживаются и другие дрожжи. Размер клеток дрожжей во много раз больше, чем таковой у бактерий (рис. 1).
Saccharomyces boulardii (S.b.) представляют собой дрожжи, изолируемые из кожуры личи, произрастающего в Индокитае, и принадлежат к тому же самому роду, что и Saccharomyces cerevisiae (S.cerevisiae), хотя перечисленные организмы имеют различные таксономические, физиологические, метаболические и генетические характеристики. Была описана уникальная и специфичная микросателлитная аллель, позволяющая отличить S.b. от штаммов S.cerevisiae [56]. В то время как большинство штаммов S.cerevisiae растет и осуществляет обмен веществ при температуре 30 °С, S.b. являются термотолерантными дрожжами и оптимально растут при температуре 37 °С [45].
Глубокое понимание механизмов действия пробиотиков важно для научного осознания их потенциальных преимуществ. К этим механизмам относят регуляцию кишечного микробного гомеостаза, препятствие способности патогенов образовывать колонии и инфицировать слизистую, модуляцию местного и системного иммунных ответов, стабилизацию барьерной функции желудка и кишечника, ингибирование прокарциногенных ферментов, стимуляцию активности ферментов, облегчающих всасывание и усвоение питательных веществ.
Фармакокинетика и фармакодинамика
В лиофилизированной форме S.b. устойчивы к действию желудочного сока и желчи и сохраняются живыми во всех отделах желудочно-кишечного тракта, если принимаются ежедневно. Лиофилизация подразумевает замораживание препарата и затем его высушивание в вакууме. S.b., кроме того, устойчивы к протеолизу. После 3 дней приема в кишечном содержимом достигается стабильная концентрация данных дрожжей. В течение 1 недели после прекращения приема S.b. они не определяются в кишечнике [11]. Как и все дрожжи, S.b. имеют природную устойчивость к антибиотикам. Одновременный прием амоксициллина и S.b. удваивает их количество, выживающее в ЖКТ [61]. Была обнаружена выраженная корреляция между количеством S.b. в кале и терапевтической активностью у пациентов с рецидивирующей инфекцией Clostridium difficile: у тех больных, у которых не наблюдались рецидивы, была более высокая концентрация S.b. в кале (1 × 106 клеток на грамм) по сравнению с теми, у которых рецидивы были (2,5 × 104 клеток на грамм) [40]. С увеличением вводимой дозы S.b. увеличивалась выживаемость мышей, инфицированных C.difficile [39].
Влияние на кишечные патогены
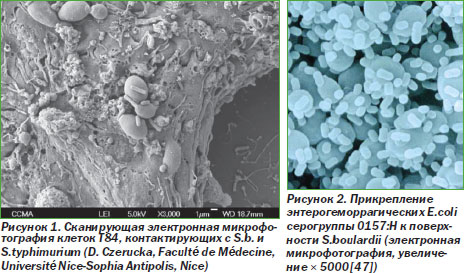
S.b. оказывают выраженное влияние на желудочно-кишечную микрофлору. Был обнаружен сильный прямой антагонизм S.b. в отношении большого количества патогенов. Исследования in vitro показали, что S.b. подавляют рост C.albicans, Escherichia coli, Shigella, Salmonella typhimurium, Pseudomonas aeruginosa, Staphylococcus aureus и Entamoeba histolytica. В исследованиях in vitro было показано, что S.b. подавляют клеточную инвазию S.typhimurium и Yersinia enterocolitica [31]. S.typhimurium и E.coli серогруппы 0157 связываются с поверхностью S.b. (рис. 1, 2) [47].
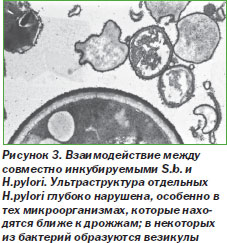
В исследованиях in vivo было продемонстрировано, что S.b. у крыс значительно уменьшают количество E.histolytica и тяжесть симптомов [74]. У мышей S.b. уменьшают количество C.albicans в 20–50 раз, снижают смертность мышей, инфицированных вирулентными штаммами S.typhimurium и Shigella [76]. По результатам исследования Т84-клеток, инфицированных энтеропатогенными штаммами E.coli, был сделан вывод, что S.b. способны увеличивать трансэпителиальную резистентность к патогенам посредством поддержания целостности плотных контактов [29] Предварительные данные Brunser свидетельствуют о том, что S.b. нарушают структуру Helicobacter pylori (рис. 3) [13].
Секреция ферментных белков
S.b. продуцируют два белка: один массой 120 кДа, другой — 54 кДа. Белок весом 54 кДа является серин-протеазой и ингибирует энтеротоксическую и цитотоксическую активность C.difficile путем протеолиза токсина А и его рецепторов. Pothoulakis и соавт. показали in vivo, что этот белок тормозит секрецию воды и электролитов, но не влияет на клеточные повреждения, вызванные C.difficile [24, 72]. Тем не менее кишечная проницаемость для маннитола в присутствии S.b. снижается на 93 %. Castagliuolo и соавт. показали, что протеаза массой 54 кДа тормозит связывание токсинов А и В со своими рецепторами на мембранах кишечных ворсинок [25, 26, 74].
Белок массой 120 кДа не обладает протеолитической активностью. Он специфически препятствует развитию гиперсекреции, вызванной токсинами Vibrio cholera, путем снижения концентрации циклического аденозинмонофосфата (цАМФ) в кишечных клетках. Метаболические изменения в слизистой оболочке кишечника, вызванные холерным токсином, уменьшаются в том случае, если S.b. принимаются до воздействия холерного токсина. Белок массой 120 кДа оказывает прямое воздействие на энтероциты и затрагивает пути сигнальной трансдукции, вовлеченные в регуляцию секреции [32].
Кроме вышеперечисленных белков, S.b. синтезируют фосфатазу, которая дефосфорилирует эндотоксины, такие как липополисахарид E.coli 055B5, и инактивируют их цитотоксические эффекты [22].
Влияние на кишечный тракт
Трофические эффекты
У здоровых взрослых волонтеров S.b. не влияли на толщину слизистой оболочки тонкого кишечника. Однако наблюдалось увеличение исходной энзиматической активности лактазы, альфа-глюкозидазы, щелочной фосфатазы. S.b. стимулируют экспрессию дисахаридаз — ферментов, вовлеченных в переваривание пищи (рис. 4).
.jpg)
S.b. столь интенсивно стимулируют секрецию сахаразы, что могут использоваться в лечении врожденной недостаточности сахаразы-изомальтазы [19]. Относительно недавно была обнаружена способность секретировать внутрь просвета кишечника лейцинаминопептидазу (принадлежит к семейству цинк-металлопротеаз), что способствует усилению протеолиза [21]. После проксимальной энтерэктомии S.b. улучшают абсорбцию D-глюкозы более чем на 50 % [20].
S.b. стимулируют продукцию гликопротеинов в щеточной кайме микроворсинок, например гидролаз, транспортеров, секреторных IgA, рецепторов для полимерных иммуноглобулинов [15].
Одним из наиболее значимых и специфичных механизмов действия является способность S.b. индуцировать и стимулировать продукцию кишечных полиаминов. Такие полиамины, как спермидин, спермин и путресцин, усиливают экспрессию ферментов щеточной каймы (гидролаз, протеаз и транспортных молекул) [18].
Противовоспалительный и иммунологический эффект
Врожденная иммунная система является первым звеном защиты против микробной агрессии. Пробиотики снижают воспаление путем оказания позитивного воздействия на дисфункцию эпителиальных клеток и иммунной системы слизистой оболочки, которая составляет основу воспалительного процесса. Пептидогликаны, липополисахариды и липотейхоевая кислота, присутствующие в бактериях, а также фосфолипоманнан, фосфопептидоманнан и гликан, присутствующие в дрожжах, являются патоген-ассоциированными антигенами и распознаются разными рецепторами, что и может обусловливать различный иммунный ответ на эти микроорганизмы [59].
S.b. снижают апоптоз энтероцитов, возможно, путем снижения синтеза TNFα [33].
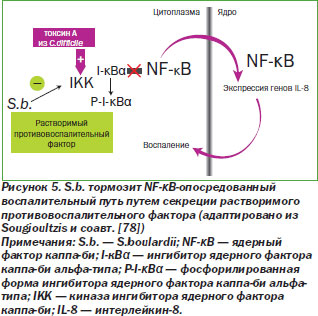 Введение S.b. приводит к увеличению выработки регуляторных цитокинов, которые играют большую роль в реализации их протективных эффектов, что, по всей видимости, осуществляется путем взаимодействия с дендритными клетками, которые продуцируют регуляторные цитокины или стимулируют Т-клетки с подобными свойствами. Недавно было показано, что S.b. тормозят активацию Т-клеток, ранее не контактировавших с ангигеном, которая запускается дендритными клетками [6], модифицируют миграцию лимфоцитов в модели хронической ВБК [34]. S.b. модифицируют способность лимфоцитов прикрепляться к эндотелиальным клеткам, приводя к улучшению их миграции и адгезии [34].
Введение S.b. приводит к увеличению выработки регуляторных цитокинов, которые играют большую роль в реализации их протективных эффектов, что, по всей видимости, осуществляется путем взаимодействия с дендритными клетками, которые продуцируют регуляторные цитокины или стимулируют Т-клетки с подобными свойствами. Недавно было показано, что S.b. тормозят активацию Т-клеток, ранее не контактировавших с ангигеном, которая запускается дендритными клетками [6], модифицируют миграцию лимфоцитов в модели хронической ВБК [34]. S.b. модифицируют способность лимфоцитов прикрепляться к эндотелиальным клеткам, приводя к улучшению их миграции и адгезии [34].
Экспериментальные исследования, выполненные в последние годы, подтвердили противовоспалительные свойства S.b. в различных моделях воспаления (мыши, инфицированные C.albicans [60] или Citrobacter rodentium [90], клетки Т84, инфицированные S.flexneri [69]).
S.b. заметно стимулируют секрецию IgA, что подтверждается увеличением содержания данного иммуноглобулина в просвете кишечника и клетках крипт. Этот эффект может быть объяснен трофическим влиянием на слизистую оболочку или прямой иммуностимуляцией (рис. 6) [15].
Клиническое применение S.b.
Все больше и больше положительных эффектов для здоровья связывают с приемом пробиотиков [1, 80]. Однако только некоторые из них подтверждены в хорошо спланированных и выполненных рандомизированных контролируемых исследованиях (РКИ). Причем в детской популяции этих исследований еще меньше.
Острая диарея
Диарея определяется как изменение подвижности кишечника с увеличением содержания воды, объема и частоты стула [73, 88]. В подавляющем большинстве случаев острая диарея является результатом кишечной инфекции — в развитых странах преимущественно вирусной этиологии. Основная терапия при дегидратирующем гастроэнтерите сводится к пероральной регидратации. Однако восполнение воды и электролитов не приводит ни к существенному укорочению эпизодов диареи, ни к уменьшению объема стула. Поэтому сегодня растет интерес к поиску дополнительных видов терапии острой диареи.
S.boulardii в лечении острой диареи
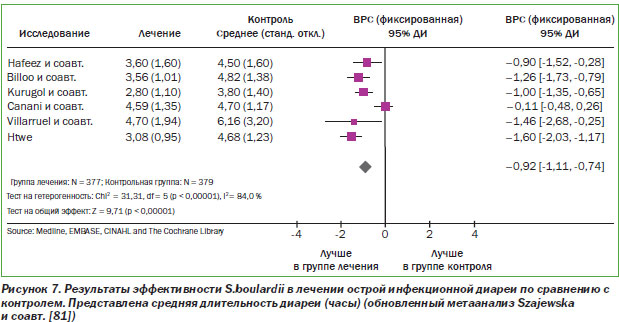
Цель одного из метаанализов сводилась к оценке эффективности S.b. в лечении острой инфекционной диареи у детей [81]. Для поиска исследований, посвященных острой инфекционной диарее и S.b., в августе 2006 г. были просмотрены следующие электронные базы публикаций: MEDLINE, EMBASE, CINAHL и Кокрановская библиотека; дополнительные источники были взяты из обзорных статей. В результате в метаанализ были включены данные из пяти РКИ (всего 619 больных) (рис. 7) [10, 27, 54, 63, 86].
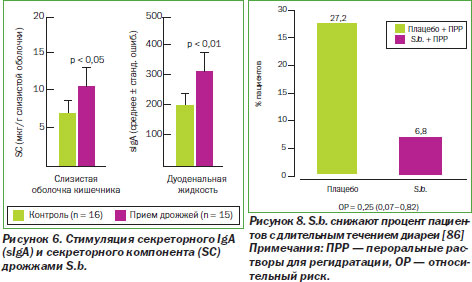
Комбинированные данные из четырех РКИ показали, что S.b. значительно снижают длительность диареи по сравнению с контролем, значительно снижали риск развития диареи на 3, 6 и 7-й день. Вдобавок риск того, что диарея будет длиться > 7 дней, был достоверно снижен в группе S.b. по сравнению с контрольной группой. Таким образом, метаанализ РКИ показал, что у детей с острым инфекционным гастроэнтеритом применение S.b. по сравнению с контролем (стандартной терапией) приводит к росту лечебного эффекта (рис. 8).
Принимая во внимание эти новые данные, вышеупомянутый метаанализ был выполнен еще раз. Исходя из обобщенных результатов шести РКИ, включавших 756 детей, было обнаружено, что S.b. снижали длительность диареи на сутки по сравнению с плацебо. Таким образом, данные свидетельствуют о том, что S.b. эффективны в лечении детей с острым гастроэнтеритом.
S.boulardii в профилактике острой диареи
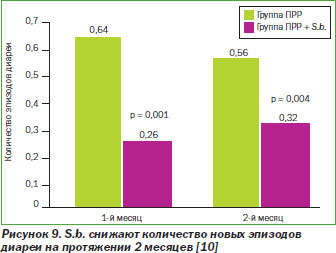
В РКИ из Пакистана, включавшем 100 детей с острой водной диареей, было сообщено о достоверном различии в частоте эпизодов диареи в течение 2 месяцев наблюдения в группе, получавшей S.b., по сравнению с контрольной группой (0,32 против 0,56, р = 0,04) (рис. 9) [10].
Персистирующая диарея
Большинство эпизодов диареи длятся менее 1 недели, однако у некоторых детей может развиваться персистирующая диарея. ВОЗ определяет это состояние как эпизод, который начинается остро, но длится до 14 дней или более. Основная опасность персистирующей диареи сводится к недостаточному питанию и развитию тяжелых некишечных инфекций [87]. Заболеваемость и смертность от персистирующей диареи, а также масштабы проблемы, особенно в развивающихся странах, оправдывают попытки повысить эффективность терапии данного заболевания.
В исследовании, выполненном на Кубе [26], 40 детей в возрасте от 6 до 36 месяцев с диареей длительностью 3–4 недели были рандомизированы к получению S.boulardii в дозе 500 мг/день (n = 20) или плацебо (n = 20).
Курс лечения составил 1 месяц. До начала исследования все пациенты получали либо тинидазол по поводу Giardia lamblia (87,5 %), либо триметоприм плюс сульфаметоксазол по поводу Shigella. Обе группы имели одинаковые исходные характеристики. К концу исследования процент детей с 1–3 дефекациями в день был достоверно выше в группе S.b. по сравнению с плацебо-группой (65 против 15 %). Большее число пациентов в группе S.b. имели гистологически нормальную слизистую оболочку (35 против 15 %).
Таким образом, результаты свидетельствуют о том, что S.b. полезны при лечении персистирующей диареи у детей. Однако необходимо провести более крупные исследования, для того чтобы определить, будет ли монотерапия S.b. достаточно эффективной для лечения персистирующей диареи у детей.
Безопасность
Ни в одном из исследований не было отмечено побочных эффектов при использовании S.boulardii. Однако следует с осторожностью использовать S.boulardii у пациентов с центральным венозным катетером [5, 75, 91]. О спорадических случаях фунгемии сообщалось, однако они наблюдались у пациентов с тяжелыми общими или кишечными заболеваниями, у которых был поставлен постоянный венозный катетер и не было точно определено, вызвана фунгемия S.boulardii или S.cerevisiae [52, 55]. Следует помнить, что S.cerevisiae также могут быть ответственными за значительную часть этих фунгемий.
Насколько известно автору, о случаях фунгемии S.boulardii не было сообщено в амбулаторной практике у пациентов с нормальным функционированием иммунной системы.
Рекомендации европейских педиатрических обществ
Экспертная рабочая группа Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN) и Европейского общества детских инфекций рассмотрела вопрос о клинической эффективности пробиотиков в лечении острых гастроэнтеритов [53]. Она пришла к выводу, что отдельные пробиотики могут быть эффективной дополнительной терапией при лечении острой диареи. Однако поскольку в отношении многих препаратов нет доказательств их эффективности, в качестве дополнительной терапии к пероральной регидратации у детей с острым гастроэнтеритом рекомендуют использовать только те штаммы пробиотиков, клиническая эффективность которых доказана, при этом должен быть правильно соблюден дозовый режим. Примерами подобных пробиотиков являются L.rhamnosus GG и S.boulardii.
К настоящему времени накоплены данные, которые подтверждают целесообразность применения S.boulardii для лечения острых гастроэнтеритов и предотвращения антибиотик-связанной диареи у детей.
Перевод А.В. Савустьяненко
Впервые опубликовано в Eur. J. Pediatr. — 2009. — 168. — 253-65 (публикуется с сокращениями)