Газета «Новости медицины и фармации» Кардиология (327) 2010 (тематический номер)
Вернуться к номеру
Рекомендации по определению предоперационного кардиального риска и периоперационному кардиологическому ведению пациентов при проведении внесердечных хирургических вмешательств
Материалы целевой группы Европейского общества кардиологов (ESC) по определению кардиального риска и периоперационному кардиологическому ведению больных во внесердечной хирургии, утвержденные Европейским обществом анестезиологов (ЕSА)
1. Введение
1.1. Масштабы проблемы
1.2. Влияние старения населения
1.3. Цель
2. Дооперационная оценка
2.1. Риск развития кардиологических осложнений при хирургических вмешательствах
2.2. Определение коронарного резерва
2.3. Показатели риска
2.4. Биомаркеры
2.5. Неинвазивное обследование
2.6. Ангиография
3. Стратегии снижения риска
3.1. Фармакологическая стратегия
3.2. Реваскуляризация
4. Сопутствующие заболевания
4.1. Хроническая сердечная недостаточность
4.2. Артериальная гипертензия
4.3. Пороки клапанов сердца
4.4. Аритмии
4.5. Заболевания почек
4.6. Цереброваскулярная патология
4.7. Заболевания легких
5. Периоперационный мониторинг
5.1. Электрокардиография
5.2. Чреспищеводная эхокардиография
5.3. Катетеризация правых отделов сердца
5.4. Нарушение метаболизма глюкозы
6. Обезболивание
6.1. Ведение интраоперационной анестезии
6.2. Спинномозговая и эпидуральная анестезия
6.3. Обезболивание в послеоперационном периоде
7. Заключение
AAA — аневризма абдоминального отдела аорты
АВК — антагонист витамина К
АКШ — аортокоронарное шунтирование
АН — аортальная недостаточность
АПФ — ангиотензинпревращающий фермент
АС — аортальный стеноз
БРА — блокатор рецепторов ангиотензина
ДСЭ — добутаминовая стресс-эхокардиография
ЖТ — желудочковая тахикардия
ЖЭ — желудочковая экстрасистола
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИМ — инфаркт миокарда
ИМБП ST — инфаркт миокарда без подъема сегмента ST
ИМСП ST — инфаркт миокарда с подъемом сегмента ST
КТ — компьютерная томография
ЛАГ — легочная артериальная гипертензия
ЛЖ — левый желудочек
МВ — минутная вентиляция
МЭТ — метаболический эквивалент
МН — митральная недостаточность
МНО — международное нормализованное соотношение
МНП — мозговой натрийуретический пептид
МПО — метопролол после операции
МРТ — магнитно-резонансная томография
МС — митральный стеноз
НМГ — низкомолекулярный гепарин
НФГ — нефракционированный гепарин
ОИТ — отделение интенсивной терапии
ОКС — острый коронарный синдром
ОНМК — острые нарушения мозгового кровообращения
СВТ — суправентрикулярная тахикардия
СЛНТ — сердечно-легочное нагрузочное тестирование
СРБ — C-реактивный белок
ССЗ — сердечно-сосудистые заболевания
СУ-QT—синдром удлиненного QT
ТИА — транзиторная ишемическая атака
УМЖТ — устойчивая мономорфная желудочковая тахикардия
УПЖТ — устойчивая полиморфная желудочковая тахикардия
ФП — фибрилляция предсердий
ХОБЛ — хроническая обструктивная болезнь легких
ХСН — хроническая сердечная недостаточность
ЦОГ-2 — циклооксигеназа-2
ЧКВ — чрескожное коронарное вмешательство
ЧПЭ — чреспищеводная эхокардиография
ЧСС — частота средечных сокращений
ЭКГ — электрокардиограмма
ACC — Американский колледж кардиологии
AHA — Американская кардиологическая ассоциация
BBSA — b-блокатор в спинномозговой анестезии
CARP — профилактическая реваскуляризация коронарных артерий
CASS — хирургическое исследование коронарных артерий
CPG — комитет по разработке практических принципов
cTnI — сердечный тропонин I
cTnT — сердечный тропонин Т
DECREASE — голландская эхокардиографическая оценка кардиологического риска с применением стресс-эхокардиографии
DES — элютинг-стент
DIPOM — диабетическая послеоперационная смертность и заболеваемость
ESC — Европейское общество кардиологов
FRISC — срочная реваскуляризация при нестабильной ИБС
HR — отношение рисков
LR — отношение вероятности
NT-проМНП — N-терминальный промозговой натрийуретический пептид
NYHA — Нью-Йоркская кардиологическая ассоциация
OPUS — орбофибан у больных с нестабильными коронарными синдромами
OR — отношение шансов
POBBbE — периоперационная бета-блокада
POISE — исследование по периоперационному определению ишемии
QUO-VADIS — исследование действия квинаприла на сосудистый АПФ и детерминанты ишемии
ROC — характеристическая кривая обнаружения, ROC-характеристика
SPECT — компьютерная томография с эмиссией одного фотона
SYNTAX — взаимодействие чрескожного коронарного вмешательства со стентом TAXUS и кардиохирургией
TACTICS — лечение стенокардии с агграстатом и определение стоимости лечения при инвазивной или консервативной стратегии
VCO2 — продукция диоксида углерода
VO2 — потребление кислорода
1.1. Масштабы проблемы
Данные рекомендации фокусируются на ведении кардиологических пациентов, у которых планируют проведение внесердечных хирургических вмешательств, то есть тех пациентов, у которых патология сердца является потенциальным источником осложнений во время операции.
Риск периоперационных осложнений зависит от состояния больного до операции, наличия сопутствующих заболеваний, а также от масштабов и продолжительности хирургических манипуляций. Кардиальные осложнения могут возникнуть у пациентов с документированной или бессимптомной ишемической болезнью сердца (ИБС), дисфункцией левого желудочка (ЛЖ) и пороками клапанов сердца, которым выполняют вмешательства, связанные с длительными гемодинамическими и кардиологическими нагрузками. В случае периоперационной ишемии миокарда важны два механизма: 1) несоответствие соотношения «обеспечение/потребность кровотока» метаболическим запросам (клинически напоминает стабильную ИБС из-за ограничения кровоснабжения вследствие стеноза коронарной артерии); 2) разрыв бляшки коронарной артерии вследствие сосудистого воспалительного процесса, который проявляется в виде острого коронарного синдрома (ОКС). Следовательно, хотя дисфункция ЛЖ может возникнуть по различным причинам в младших возрастных группах, периоперационная сердечная смертность и заболеваемость в основном доминируют среди взрослых пациентов, которым выполняются обширные внесердечные хирургические вмешательства.

К сожалению, нет систематических данных о ежегодном количестве проводимых оперативных вмешательств, их типах и исходах у пациентов. Сбор информации осуществляется на национальном уровне в ряде стран, однако его методика существенно различается. В Нидерландах (население 16 миллионов) на протяжении 1991–2005 гг. ежегодно у больных в возрасте старше 20 лет проводилось в среднем 250 000 хирургических вмешательств, что соответствует годовому уровню 1,5 %. Применительно к Европе (общее население 490 миллионов) эта цифра составляет приблизительно 7 миллионов в год у пациентов с кардиологическим риском.

Данные об осложнениях со стороны сердца могут быть получены из нескольких крупномасштабных клинических исследований пациентов, которым проводились внесердечные хирургические вмешательства. Lee et al. изучили состояние 4315 пациентов, перенесших крупные внесердечные хирургические операции за период 1989–1994 гг. Они отметили, что у 92 (2,1 %) пациентов были выявлены такие осложнения, как инфаркт миокарда (ИМ) или коронарная смерть. В когорте 108 593 больных, которым проводилось хирургическое вмешательство на протяжении 1991–2000 гг. в университетской больнице в Нидерландах, периоперационная смертность наблюдалась у 1877 пациентов (1,7 %), в 543 случаях (0,5 %) причинами ее были осложнения со стороны сердечно-сосудистой системы. В течение 1996–2008 годов в исследования DECREASE I, II, IV (Голландская эхокардиографическая оценка кардиологического риска с использованием стресс-эхокардиографии) были включены 3893 хирургических больных, в эту группу входили и пациенты среднего и высокого риска, из которых у 136 (3,5 %) наблюдались периоперационная коронарная смерть или ИМ. В исследовании POISE (Исследование по периоперационному определению ишемии), которое было проведено в течение 2002–2007 годов и включало 8351 пациента, перенесшего внесердечное хирургическое вмешательство, периоперативная смертность имела место у 226 пациентов (2,7 % ), при этом у 133 (1,6 %) ее причиной была патология сердечно-сосудистой системы, тогда как ИМ без летального исхода развился у 367 пациентов (4,4 %). Различия данных, полученных в исследованиях, в основном объясняются отбором пациентов и определением конечной точки (ИМ). При крупных внесердечных хирургических вмешательствах показатель смертности вследствие патологии сердца составляет 0,5– 1,5 %, а частота послеоперационных осложнений со стороны сердца — 2,0– 3,5 %. Применительно к населению Европейского Союза эти показатели составляют 150 000–250 000 угрожающих жизни кардиальных осложнений в год вследствие внесердечных хирургических вмешательств.
1.2. Влияние старения населения
В течение следующих 20 лет будет отмечаться увеличение числа пожилых людей, в связи с чем потребуется пересмотр подходов к ведению таких пациентов в периоперационном периоде. Предполагается, что пожилые люди требуют хирургического вмешательства в четыре раза чаще, чем остальная часть населения. По предварительным оценкам, число оперативных вмешательств, проведенных в странах Европы, к 2020 году увеличится на 25 %, за тот же период времени численность пожилых людей увеличится на 50 %. Данные 2005 US National Hospital Discharge Survey (non-federal short-stay hospitals) (Национальное исследование выписки из больницы в
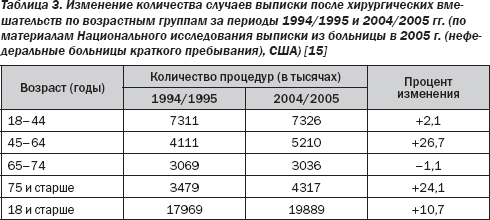
Демографические данные пациентов, подвергшихся хирургическому лечению, свидетельствуют о тенденции к увеличению числа пожилых пациентов и сопутствующих заболеваний у них. Хотя уровень смертности вследствие заболеваний сердечно-сосудистой системы снижается среди населения в целом, распространенность ИБС, сердечной недостаточности, сердечно-сосудистых факторов риска, сахарного диабета возрастает. Среди сопутствующих заболеваний у пожилых пациентов, отобранных для проведения хирургического лечения, сердечно-сосудистые заболевания (ССЗ) являются наиболее распространенными. По результатам оказания первичной медицинской помощи определено, что в возрастной группе 75–84 года 19 % мужчин и 12 % женщин страдают ССЗ. Однако возраст сам по себе связан лишь с небольшим увеличением риска осложнений; больше рисков связаны с тяжелой или неотложной патологией сердца, легких и почек. Количество заболевших, вероятно, будет выше в странах, где имеет место высокая смертность от сердечно-сосудистых заболеваний, особенно в Центральной и Восточной Европе. Следовательно, данная ситуация будет оказывать большое влияние на оценку риска у пациента.
1.3. Цель
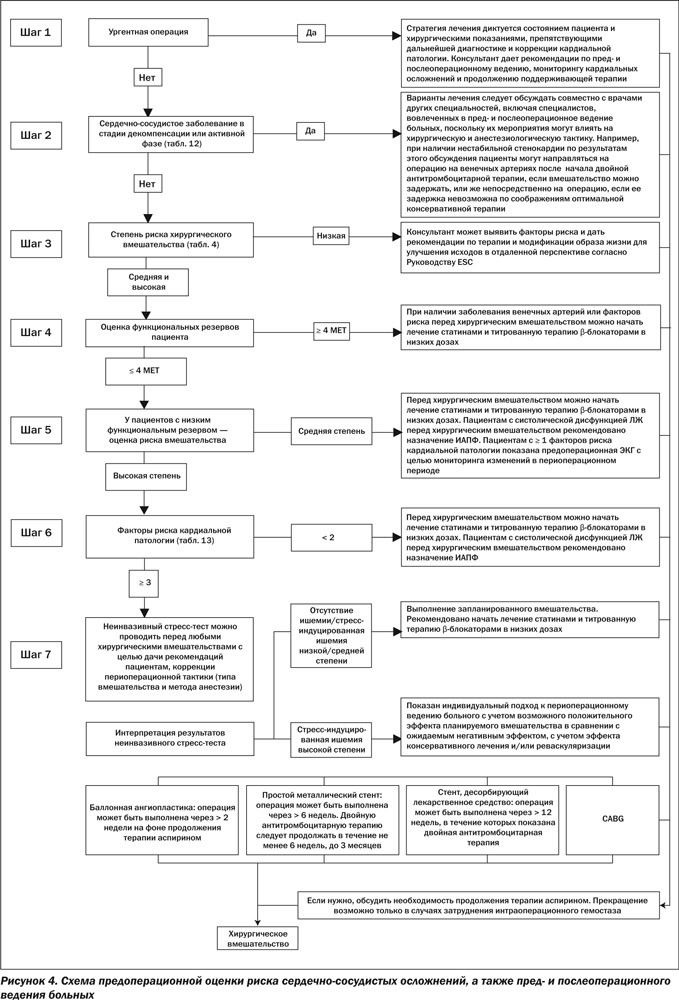
В настоящее время нет официальных рекомендаций ESC по предварительной оценке предоперационного риска и периоперационному кардиологическому ведению пациента. Цель данного документа — утвердить стандартизированный и научно обоснованный подход к периоперационному кардиологическому ведению пациента. В рекомендациях представлена практическая поэтапная оценка состояния пациента, которая интегрирует клинические факторы риска и результаты обследований на предмет осложнений плановых хирургических вмешательств. Это дает возможность индивидуальной оценки кардиологического риска, раннего проведения медикаментозной терапии, коронарного вмешательства, а также специфических хирургических и анестезиологических вмешательств с целью оптимизации периоперационного состояния пациента. Данных рандомизированных клинических исследований, которые могут служить идеальной базой для создания рекомендаций, крайне мало. Поэтому используются данные из нехирургических стационаров и аналогичные рекомендации, но с различными уровнями доказательности. Упор делается на ограниченное использование профилактической реваскуляризации сердца, так как она редко бывает показана для обеспечения выживания пациента после хирургического вмешательства. Дооперационная оценка требует комплексного междисциплинарного подхода с участием анестезиологов, кардиологов, терапевтов, пульмонологов, гериатров и хирургов. Как правило, координируют этот процесс анестезиологи.
Рекомендации дают возможность улучшить послеоперационные результаты. Однако, как показали наблюдения в обзорном исследовании 711 пациентов клиник сосудистой хирургии Нидерландов, их соблюдение оставляет желать лучшего. Хотя 185 из 711 пациентов (26 %) соответствовали руководящим критериям ACC/AHA для предоперационного неинвазивного кардиологического обследования, клиницисты обследовали только 38 из них (21 %). Рекомендованная руководящими принципами медикаментозная терапия в периоперационном периоде, а именно сочетание аспирина и статинов у всех пациентов и применение b-блокаторов у пациентов с ИБС, имело место лишь в 41 % случаев. Важно отметить, что использование лекарственных препаратов в периоперационном периоде, основанное на фактических данных, было связано с сокращением 3-летней смертности после корректировки с учетом клинических характеристик (OR 0,65; 95% CI 0,45–0,94). Эти данные подчеркивают наличие возможности для улучшения качества медицинского обслуживания в указанной группе пациентов высокого риска.
2. Предоперационная оценка
2.1. Риск развития кардиологических осложнений при хирургических вмешательствах
Кардиологические осложнения после внесердечного хирургического вмешательства зависят не только от конкретных факторов риска, но также от вида операции и обстоятельств, при которых они развиваются. Хирургические факторы, которые влияют на кардиологический риск, связаны с ургентностью, объемом, типом и продолжительностью оперативного вмешательства, а также с изменениями температуры тела, объемом кровопотери, нарушением баланса жидкости.
Любое оперативное вмешательство вызывает стрессовую реакцию организма, которая инициируется повреждением тканей при участии нейроэндокринных факторов, и может вызвать тахикардию и гипертензию, увеличение потребности миокарда в кислороде. Нарушения баланса жидкости в периоперационном периоде тоже играют роль. Хирургическое вмешательство также обусловливает нарушения баланса между тромботическими и фибринолитическими факторами, вызывая гиперкоагуляцию и возможный коронарный тромбоз (увеличение содержания фибриногена и других факторов свертывания, повышение активации и агрегации тромбоцитов, снижение фибринолиза). Степень таких изменений пропорциональна степени и длительности хирургического вмешательства. Все эти факторы могут привести к ишемии миокарда и сердечной недостаточности. Конечно, у пациентов с повышенным риском следует уделять внимание этим факторам и пытаться минимизировать риск.
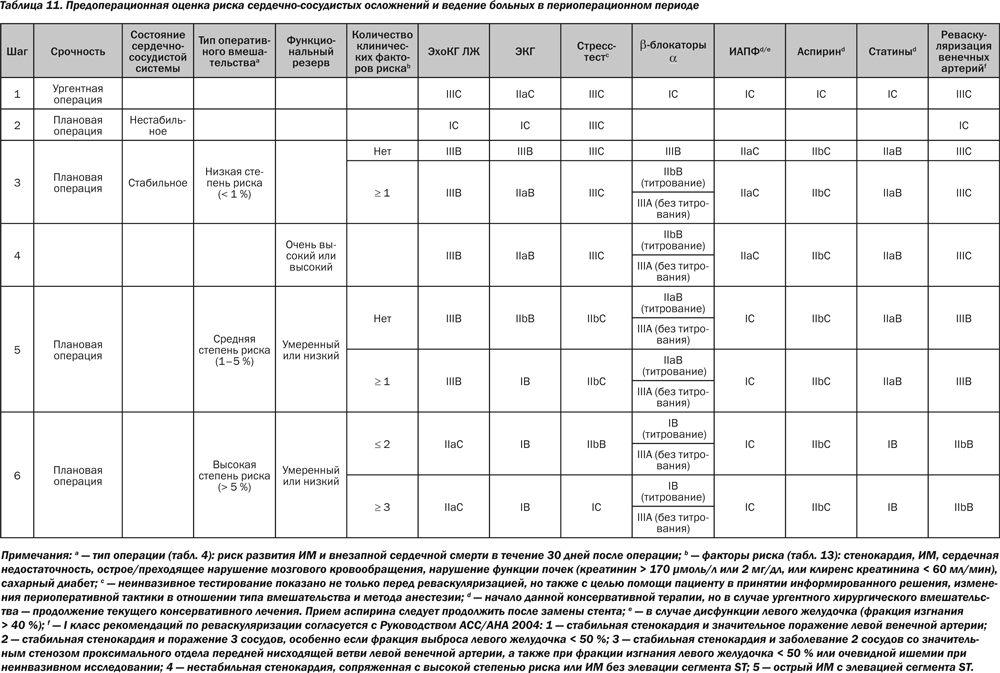
Хотя пациент-специфические факторы более важны, чем специфические хирургические факторы, при прогнозировании кардиологического риска внесердечных хирургических вмешательств тип операции не должен игнорироваться при принятии решения, можно ли конкретному пациенту проводить оперативное вмешательство. С учетом кардиологического риска хирургические вмешательства могут быть разделены на группы с низкой, средней и высокой степенью риска возникновения сердечных осложнений за 30-дневный период (сердечной смерти и ИМ) < 1, 1–5, и > 5 % соответственно (табл. 4). Хотя это лишь приблизительная оценка, такая классификация риска дает достаточное представление о необходимости кардиологической оценки, медикаментозной терапии, а также об определении риска осложнений со стороны сердца.

Группу повышенного риска составляют хирургические вмешательства на сосудах. Риск средней степени обусловлен объемом, продолжительностью, локализацией оперативного вмешательства, а также кровопотерей, дисбалансом жидкости при конкретной операции. В группе низкого риска кардиологический риск незначителен, если нет значимых пациент-специфических факторов риска.
Вопрос о необходимости предоперационной кардиологической оценки будет также зависеть от ургентности операции. В случае экстренного хирургического вмешательства, как при разрыве аневризмы абдоминальной аорты (ААА), при массированной травме или при перфорации органа, ход операции не зависит от результатов кардиологической оценки, но они могут влиять на ведение пациента в раннем послеоперационном периоде. При неэкстренных, но срочных хирургических вмешательствах, таких как шунтирование по поводу острой ишемии конечности или лечение кишечной непроходимости, заболеваемость и смертность от нелеченного основного состояния будет превышать потенциальный кардиологический риск, связанный с вмешательством. В таких случаях кардиологическая оценка может повлиять на периоперационные меры по сокращению кардиологического риска, но не будет влиять на решение о необходимости проведения вмешательства. В некоторых случаях кардиологический риск также может влиять на тип операции и быть причиной выбора менее инвазивного вмешательства, например, такого, как ангиопластика периферических артерий вместо подпахового шунтирования и др., даже если это будет давать менее благоприятные результаты в долгосрочной перспективе.
Наконец, в некоторых ситуациях кардиологическую оценку следует учитывать даже при принятии решения о том, следует ли выполнять вмешательство или нет, поскольку она позволяет достоверно предсказать периоперационные кардиологические осложнения и определить возможности позднего выживания. Это имеет место в ряде профилактических вмешательств, таких как лечение небольших ААА или бессимптомного стеноза сонных артерий, где ожидаемая продолжительность жизни пациента и риск операции являются важными факторами при оценке потенциальных преимуществ от хирургического вмешательства.
Хирургические вмешательства на сосудах представляют особый интерес, так как в этих случаях высок риск кардиальных осложнений и, как показали многочисленные исследования, можно предпринять адекватные меры по предупреждению этих осложнений в периоперационном периоде. Открытые вмешательства на аорте и сосудах паховой области считаются операциями высокого риска. Несмотря на то что реваскуляризация сосудов паховой области является менее тяжелой, чем операции на аорте, кардиологический риск такой же или даже больший, чем при вмешательствах на аорте. Это может быть объяснено наличием сахарного диабета, почечной дисфункции, ИБС и преклонным возрастом в этой группе пациентов. Это также объясняет, почему риск, связанный с ангиопластикой периферических артерий — минимально инвазивной процедурой, не считается незначительным. Несколько рандомизированных исследований показали, что кардиологический риск существенно ниже после эндоваскулярной пластики аневризмы аорты по сравнению с «открытой» операцией. Это может быть связано с меньшим повреждением тканей и недопущением перекрестного зажима аорты и послеоперационной кишечной непроходимостью. Однако на долгосрочное выживание, как представляется, не будет оказывать влияние используемая хирургическая техника, оно определяется имеющейся патологией сердца. Каротидная эндартерэктомия считается процедурой промежуточного риска. Тем не менее повышенный кардиологический риск и возможности выживания в позднем периоде должны быть учтены в процессе принятия решений, так как они могут влиять на выбор между эндартерэктомией или стентированием.
Преимущество лапароскопических операций состоит в том, что при их проведении имеют место меньшая травма тканей и менее выраженный парез кишечника по сравнению с открытым оперативным вмешательством. При лапараскопических операциях будут наблюдаться менее выраженная инцизионная боль и меньший послеоперационный дисбаланс жидкости, связанный с парезом кишечника. С другой стороны, пневмоперитонеум, используемый при лапароскопических процедурах, приводит к повышению внутрибрюшного давления и уменьшению венозного возврата. Это может вести к снижению сердечного выброса и увеличению системного сосудистого сопротивления. Таким образом, кардиологический риск у больных с сердечной недостаточностью, перенесших лапароскопию, не меньше, чем таковой при открытом хирургическом вмешательстве. Это особенно нужно принимать во внимание в отношении пациентов, перенесших вмешательства по поводу патологического ожирения.
2.2. Определение коронарного резерва
Определение коронарного резерва считается ключевым шагом в предоперационной оценке кардиологического риска. Коронарный резерв измеряется в метаболических эквивалентах (MЭT). Один МЭТ тождественен базальному метаболическому уровню. Нагрузочное тестирование обеспечивает объективную оценку коронарного резерва. Без тестирования коронарный резерв можно оценить по способности выполнять физическую нагрузку в повседневной жизни. Учитывая, что 1 МЭТ представляет метаболический запрос при отдыхе, подъем на два лестничных пролета требует 4 МЕТ, а напряженные виды спорта, такие как плавание, > 10 МЭТ (рис. 1).

Неспособность подняться на два лестничных пролета или бежать на короткое расстояние (< 4 MЭT) свидетельствует о недостаточном коронарном резерве и связана с увеличением риска послеоперационных сердечных осложнений. После торакального хирургического вмешательства низкий коронарный резерв был связан с ростом смертности (относительный риск 18,7; 95% CI 5,9–59). Однако по сравнению с торакальными операциями низкий коронарный резерв не был связан с ростом смертности после другого несердечного хирургического вмешательства (относительный риск 0,47; 95% CI 0,09–2,5). Это может свидетельствовать о важности легочной функции, тесно связанной с коронарным резервом, как об основном предикторе выживаемости после торакальных вмешательств. Эти выводы были подтверждены в исследовании с участием 5939 пациентов, которым проводилось плановое внесердечное хирургическое вмешательство, прогностическое значение предоперационного коронарного резерва измерялось в MЭT. Использованная в анализе ROC-кривая показала взаимосвязь функциональной способности с сердечными осложнениями или смертью в послеоперационном периоде, что соответствовало площади под ROC-кривой 0,664, в то время как возрастная норма — 0,814. С учетом относительно слабой связи между функциональной способностью и кардиологическим исходом в послеоперационном периоде какую роль мы должны отводить определению функциональной способности в предоперационной оценке риска во внесердечной хирургии, когда функциональный потенциал высок, прогноз благоприятен, даже при наличии стабильной ИБС или факторов риска? В этом случае тактика периоперационного ведения пациента будет редко изменяться в зависимости от данных кардиологического обследования. В дооперационном периоде способность подняться на два лестничных пролета или бежать на короткие расстояния свидетельствовала о хорошей функциональной способности. С другой стороны, когда функциональная способность низкая или не определена, наличие факторов риска, а также их количество относительно риска операции будут определять стратификацию риска в предоперационном периоде и тактику ведения операции.

2.3. Показатели риска
Эффективные стратегии, направленные на снижение риска коронарных интраоперационных осложнений, должны включать предоперационную кардиологическую оценку с учетом анамнеза. Пациенты с предполагаемым низким кардиологическим риском после тщательной оценки могут быть прооперированы безопасно без промедления. Маловероятно, что стратегия уменьшения риска может снизить периоперационный риск в дальнейшем. Снижение риска путем медикаментозного лечения является наиболее экономически эффективным у больных с подозрением на высокий кардиологический риск. Дополнительная неинвазивная кардиологическая визуализация является инструментом выявления пациентов высокого риска. Методы визуализации прежде всего должны применяться у тех больных, у которых результаты обследования будут влиять на лечение. Очевидно, что объем и длительность дооперационного кардиологического обследования должны зависеть от клинического состояния пациента и ургентности операции. Когда необходима экстренная операция, обследование обязательно должно быть ограничено во времени. Однако в большинстве клинических ситуаций возможно применение более широкого систематического подхода к оценке кардиологического риска, который изначально основан на клинических характеристиках и типе операции, а затем может быть дополнен, если показано, электрокардиографией (ЭКГ), лабораторными исследованиями и неинвазивным обследованием.
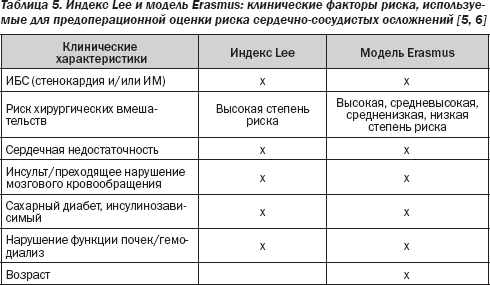
За последние 30 лет были определены некоторые показатели риска на основе анализа данных наблюдений, которые представляют собой взаимоотношения между клиническими характеристиками и периоперационной сердечной смертностью и заболеваемостью. Показатели, которые были разработаны Goldman (1977), Detsky (1986) и Lee (1999), теперь широко применяются. Индекс Lee, который фактически является изменением первоначального индекса Goldman, по мнению многих врачей и исследователей, лучший из всех ныне доступных индексов прогнозирования кардиологического риска во внесердечной хирургии. Он был разработан на основе проспективно собранных данных о 2893 неотобранных пациентах (и подтвержден у других 1422 пациентов). Они систематически наблюдались на послеоперационном этапе для выявления целого ряда клинически значимых кардиальных исходов. Индекс Lee включает пять независимых клинических детерминант по основным периоперационным сердечным осложнениям: анамнез ИБС, анамнез заболевания сосудов головного мозга, сердечной недостаточности, инсулинозависимого сахарного диабета и нарушения функции почек. Тип операции с высоким риском является шестым фактором, который включен в индекс. Все факторы в равной мере определяют величину индекса (по 1 пункту для каждого), а частота основных сердечных осложнений оценивается в 0,4; 0,9; 7 и 11 % у больных с 0, 1, 2 и ≥ 3 пунктами соответственно. Площадь под кривой ROC в достоверном наборе данных составляла 0,81, что свидетельствует о том, что индекс имеет высокий потенциал для различия между пациентами с серьезными сердечными осложнениями и без них.

Индекс Lee, вероятно, оптимален для выявления больных с множественными факторами риска. Фактически тип операции был классифицирован следующим образом: высокая степень риска (в том числе вмешательства на внутрибрюшинных, внутригрудных и супраингвинальных сосудах) и все остальные нелапароскопические операции, главным образом включающие ортопедические, абдоминальные и другие сосудистые процедуры. Существуют доказательства того, что более тщательно разработанная классификация, такая как модель Erasmus, улучшает распознавание риска. В этой модели обширные описания вида хирургического вмешательства и возраста повысили прогностическое значение модели для периоперационных сердечных осложнений (площадь под кривой ROC для прогнозирования сердечно-сосудистой смертности увеличилась с 0,63 до 0,85).
2.4. Биомаркеры
Биологический маркер — характеристика, которую можно объективно измерять и оценивать и которая является индикатором патологических процессов или ответов на терапевтические вмешательства. В периоперационной ситуации биомаркеры могут быть разделены на маркеры ишемии миокарда, повреждения, воспаления и маркеры функции ЛЖ.
Сердечные тропонины T и I (cTnT и cTnI) являются предпочтительными маркерами для диагностики ИМ, поскольку они демонстрируют чувствительность и тканевую специфичность, превосходящую другие доступные биомаркеры. Эти маркеры являются дополнительными к другим важным показателям кардиального риска, таким как отклонение сегмента ST и функция ЛЖ. Прогностическое значение даже небольшого повышения тропонинов было независимо подтверждено в исследованиях (TACTICS-TIMI 18, FRISC II, OPUS-TIMI). Как представляется, cTnI и сTnT имеют аналогичные значения для оценки риска при ОКС у больных с почечной недостаточностью и без нее. Прогноз смерти у больных с терминальной стадией почечной недостаточности и даже с небольшим повышением cTnT в 2–5 раз хуже, чем у лиц с нормальными показателями. Опыт показывает, что даже небольшое увеличение уровня cTnT в периоперационном периоде свидетельствует о клинически значимом повреждении миокарда с плохим кардиальным прогнозом. Внедрение оценки новых биомаркеров, включая тропонины с высокой чувствительностью, будет способствовать дальнейшему улучшению оценки повреждения миокарда. Следует отметить, что повышение уровня тропонинов можно наблюдать при многих других условиях. Диагноз инфаркта миокарда без подъема сегмента ST (ИМБП ST) никогда не должен быть установлен исключительно на основе биомаркеров.
Благодаря определению маркеров воспаления можно до операции выявить пациентов с повышенным риском нестабильности коронарной бляшки. C-реактивный белок (СРБ), который продуцируется в печени, является реагентом острой фазы. СРБ также определяется в гладкомышечных клетках пораженных атеросклерозом артерий и вовлечен во многие аспекты атерогенеза и уязвимости бляшки, включая экспрессию адгезии молекул, индукцию оксида азота, измененную функцию комплемента и торможение внутреннего фибринолиза. Однако в настоящее время нет данных об использовании СРБ в качестве маркера для инициирования стратегий снижения риска при хирургических вмешательствах.

Мозговой натрийуретический пептид (МНП) и N-терминальный про-МНП (NT-проМНП) продуцируются в сердечных миоцитах в ответ на повышение напряжения стенки миокарда. Это может произойти на любой стадии сердечной недостаточности, независимо от наличия или отсутствия ишемии миокарда. Плазменные МНП и NT-проМНП стали важными прогностическими показателями у пациентов с сердечной недостаточностью, ОКС и стабильной ИБС в нехирургических клиниках. Предоперационные уровни МНП и NT-проМНП имеют дополнительное прогностическое значение для определения риска долгосрочной смертности и сердечных осложнений после серьезных несердечных сосудистых вмешательств.
Данные о предоперационном использовании биомаркеров, полученные в проспективных контролируемых исследованиях, являются неполными. На основании имеющихся данных рутинная оценка биомаркеров пациентов, перенесших несердечные хирургические вмешательства, не может быть предложена для широкого использования в качестве индикатора повреждения клеток.
2.5. Неинвазивное обследование
Дооперационное неинвазивное обследование направлено на получение информации о трех показателях наличия коронарного риска — дисфункции ЛЖ, ишемии миокарда и патологии сердечных клапанов, т.е. всех основных детерминант неблагоприятных послеоперационных результатов. Функция ЛЖ оценивается в покое с помощью методов визуализации. Для диагностики ишемии миокарда могут быть использованы ЭКГ с нагрузочными пробами и неинвазивные методы визуализации. Диагностический алгоритм стратификации риска ишемии миокарда и дисфункции ЛЖ должен быть аналогичным предлагаемому для пациентов в нехирургической клинике или при подозрении на ИБС. Неинвазивное обследование не следует рассматривать только для решения вопроса о реваскуляризации коронарных артерий, но также для консультирования пациентов, изменения периоперационного менеджмента (выбор типа операции, техники анестезии) и для долгосрочного прогноза. Эхокардиография является предпочтительной для оценки патологии клапанов (см. раздел 4 «Сопутствующие заболевания», подраздел 4.3 «Пороки клапанов сердца»).

2.5.1. Неинвазивное обследование на предмет кардиологической патологии
Электрокардиография
ЭКГ в 12 отведениях обычно проводится в рамках предоперационной оценки сердечно-сосудистого риска у пациентов, которым планируется проведение внесердечного хирургического вмешательства. У больных с ИБС дооперационная электрокардиограмма содержит важную прогностическую информацию и позволяет прогнозировать долговременные результаты независимо от клинических данных и возможной периоперационной ишемии. Тем не менее ЭКГ может быть нормальной или неспецифической у пациента с ишемией или инфарктом. Рутинное использование ЭКГ перед всеми видами хирургических вмешательств является предметом все более оживленной дискуссии. В ретроспективном исследовании изучены 23 036 пациентов, у которых намечено проведение 28 457 хирургических вмешательств; в группе пациентов с патологическими изменениями на ЭКГ показатель сердечно-сосудистой смертности был выше, чем у пациентов с нормальной ЭКГ (1,8 против 0,3 %). У пациентов после операции с низкой или средней степенью риска абсолютная разница в частоте сердечно-сосудистой смерти между теми, у кого были изменения ЭКГ, и у лиц без таковых составила лишь 0,5 %.
Оценка функции левого желудочка

Функция ЛЖ в покое может быть оценена до проведения внесердечного хирургического вмешательства с помощью радионуклидной вентрикулографии, эмиссионной томографии (SPECT), эхокардиографии, магнитно-резонансной томографии (МРТ) или мультиспиральной компьютерной томографии (КТ) с аналогичной достоверностью. Рутинная эхокардиография не рекомендуется для предоперационной оценки функции ЛЖ, но может проводиться у бессимптомных больных, подвергающихся операции высокого риска. Метаанализ имеющихся данных показал, что фракция выброса ЛЖ менее 35 % имела чувствительность 50 % и специфичность 91 % для прогнозирования периоперационного нефатального инфаркта миокарда или сердечной смерти. Ограниченное прогностическое значение оценки влияния функции ЛЖ на периоперационный исход может быть связано с невозможностью обнаружить наличие ИБС. Рекомендации по предоперационной оценке бессимптомных больных с сердечными шумами обсуждаются в разделе, посвященном патологии клапанов.
Неинвазивное обследование на предмет ИБС
Физическая нагрузка с использованием тредмила или велоэргометра является предпочтительным методом выявления ишемии. Физическая нагрузка позволяет оценить функциональный потенциал, выявляет реакцию АД и сердечного ритма и обнаруживает ишемию миокарда через изменения сегмента ST. Точность нагрузочной ЭКГ значительно варьирует в разных исследованиях. Метаанализ исследований с использованием тредмила у пациентов в сосудистой хирургии показал довольно низкие чувствительность (74 %; 95% CI 60–88 %) и специфичность (69 %; 95% CI 60–78 %), сопоставимые с показателями в ежедневной клинической практике. Положительная прогностическая ценность была низкой — 10 %, а негативная — очень высокой (98 %). Однако метод стратификации риска с помощью упражнений не подходит для пациентов с ограниченными физическими возможностями в силу их неспособности достичь ишемического порога. Кроме того, уже имеющиеся нарушения сегмента ST, особенно в отведениях V5 и V6 в покое, препятствуют достоверному анализу указанного сегмента. Градиент тяжести в результатах теста связан с периоперационным результатом: возникновение ишемического ответа миокарда при выполнении малой нагрузки связано со значительным увеличением риска периоперационных и долгосрочных осложнений со стороны сердца. В противоположность этому развитие ишемии миокарда при высоких рабочих нагрузках связано со значительно меньшим риском. Обследование с применением лекарственных препаратов под контролем ядерной перфузии или эхокардиографии является более подходящим методом у пациентов с ограниченными физическими возможностями.
Роль перфузионной визуализации миокарда для предоперационной стратификации риска хорошо известна. У больных с ограниченными физическими возможностями фармакологическая нагрузка (дипиридамол, аденозин или добутамин) является альтернативой. Визуализация отражает распределение крови в миокарде во время инъекции. Исследования проводились как во время фармакологической нагрузки, так и в покое, чтобы определить наличие обратимых изменений, угрозу ишемии миокарда или фиксированные дефекты (рубцы или нежизнеспособные ткани).
Прогностическое значение степени ишемии миокарда с использованием визуализации перфузии миокарда после введения дипиридамола было изучено в метаанализе исследований пациентов после хирургического вмешательства на сосудах. Контрольными точками изучения были периоперационная сердечная смерть и ИМ. Авторы включили девять исследований пациентов отделений сосудистой хирургии (общее количество больных — 1179) с 7% частотой осложнений в течение 30 дней. В ходе этого анализа обратимая ишемия ЛЖ в менее чем 20 % миокарда не изменила вероятности периоперационных сердечных осложнений по сравнению с таковыми без ишемии. Пациенты с более обширными обратимыми дефектами имели повышенный риск: 20–29 % обратимости (LR 1,6, 95% CI 1,0–2,6), 30–39 % обратимости (LR 2,9, 95% CI 1,6–5,1), 40–49 % обратимости (LR 2,9, 95% CI 1,4–6,2), ≥ 50 % обратимости (LR 11, 95% CI 5,8–20).
Во втором метаанализе, который оценил прогностическую ценность шести диагностических тестов, отмечается чувствительность 83 % (95% CI 77–92 %) с гораздо более низкой специфичностью — 47 % (95% CI 41–57 %) для визуализации перфузии миокарда. Положительное и отрицательное предиктивные значения — 11 и 97 % соответственно.
Третий метаанализ объединил результаты 10 исследований, оценки дипиридамол-201таллиевой визуализации у кандидатов для проведения оперативных вмешательств на сосудах за 9-летний период (1985–1994 годы). Сердечная смерть или нефатальный ИМ в 30-дневный срок наблюдались у 1 % пациентов с нормальными результатами теста, у 7 % больных с необратимыми дефектами и у 9 % — с обратимыми дефектами при визуализации 201таллием. Кроме того, в трех из 10 проанализированных исследований использовался полуколичественный подсчет, который продемонстрировал более высокую распространенность сердечных осложнений у пациентов с двумя или более обратимыми дефектами.
В целом положительная прогностическая ценность обратимых дефектов для периоперационной смерти или ИМ снизилась за последние годы. Вероятно, это связано с изменениями в периоперационном ведении и тактике хирургических вмешательств, что уменьшает частоту сердечных осложнений у пациентов с ишемией миокарда, которая была определена при обследовании перед операцией. Однако благодаря высокой чувствительности методов ядерной визуализации для выявления ИБС пациенты с нормальными результатами сканирования имеют отличный прогноз. Визуализация перфузии миокарда с помощью добутаминового стресс-теста имеет хороший профиль безопасности. Гипотония, снижение систолического АД на ≥
Эхокардиография с использованием физической нагрузки или фармакологического теста (добутамин, дипиридамол) широко применяется для предоперационной оценки сердечного риска. Данное обследование обобщает информацию о функции ЛЖ в состоянии покоя, патологии сердечных клапанов, а также о наличии и степени стресс-индуцированной ишемии. В одном исследовании 530 больных были включены в пошаговое определение значений добутаминовой стресс-эхокардиографии (ДСЭ) для оценки сердечного риска перед проведением несосудистых хирургических вмешательств. Предикторы послеоперационных осложнений со многими переменными параметрами у больных с ишемией оказались анамнезом сердечной недостаточности (OR 4,7; 95% CI 1,6–14,0) и ишемическим порогом менее 60 % от возрастной максимальной ЧСС (OR 7,0; 95% CI 2,8–17,6). По результатам ДСЭ 60 % пациентов определили в группу низкого риска (без ишемии), 32 % — в группу промежуточного риска (ишемический порог ≥ 60 %), 8 % — в группу высокого риска (ишемический порог < 60 %); частота послеоперационных осложнений составила 0, 9 и 43 % соответственно. Недавний метаанализ показал, что чувствительность и специфичность ДСЭ для определения риска периоперационной смерти вследствие коронарных причин и ИМ являются высокими (85 и 70 % соответственно). ДСЭ может быть выполнена безопасно при обоснованной переносимости пациентов (учет наличия сердечных аритмий и гипотензии (снижение САД на ≥
В общем эхокардиография с использованием физической или фармакологической нагрузки имеет высокую негативную прогностическую ценность (от 90 до 100 %): отрицательный тест связан с очень низкой частотой сердечных осложнений и указывает на безопасность хирургических вмешательств. Однако положительная прогностическая ценность является относительно низкой (между 25 и 45 %); это означает, что вероятность послеоперационных осложнений со стороны сердца является низкой, несмотря на обнаружение аномалий движения стенки при эхокардиографии с использованием физической или фармакологической нагрузки.
В метаанализе 15 исследований, сравнивающих методы дипиридамол-201таллиейвой визуализации и ДСЭ для стратификации риска перед сосудистым хирургическим вмешательством, было показано, что прогностическая ценность отклонений стрессовой визуализации для периоперационных ишемических осложнений сопоставима при использовании имеющихся технологий, но точность варьирует в зависимости от распространенности ИБС. У пациентов с низким уровнем заболеваемости ИБС диагностическая точность уменьшается по сравнению с лицами с высоким уровнем заболеваемости ИБС.
МРТ также может быть использована для выявления ишемии. И перфузия, и движение стенки могут быть оценены при нагрузке и в состоянии покоя. Выраженная ишемия, ИБС связаны с неблагоприятными послеоперационными сердечными осложнениями. Таким образом, обследование с функциональными пробами является предпочтительным для обнаружения анатомического стеноза. Точность оценки ишемии является высокой: чувствительность 83 % (95% CI 79–88 %) и специфичность 86 % (95% CI 81–91 %), когда используется движение стенки (14 исследований, 754 больных). Когда данные о перфузии добавляются к данным о нарушении движения стенки (24 исследования, 1516 пациентов), чувствительность оценки ишемии возрастает до 91 % (95% CI 88–94 %), однако специфичность уменьшается до 81 % (95% CI 77–85 %). МРТ с нагрузкой добутамином была использована у 102 больных, подвергающихся крупным внесердечным хирургическим вмешательствам. Вновь возникшие нарушения движения стенки были использованы в качестве маркера ишемии. Ишемия миокарда была самым сильным предиктором периоперационных сердечных осложнений (смерть, ИМ и сердечная недостаточность). МРТ дала возможность применить неинвазивную ангиографию и провести метаанализ имеющихся данных с учетом ИБС, диагностированной при коронарной ангиографии в качестве эталона и продемонстрировала чувствительность и специфичность 75 % (95% CI 68–80 %) и 85 % (95% CI 78–90 %) соответственно по сосудам (16 исследований, 2041 сосуд); по пациентам (13 исследований, 607 субъектов) чувствительность и специфичность составили 88 % (95% CI 82–92 %) и 56 % (95% CI 53–68 %) соответственно. В настоящее время нет данных для определения предоперационной стратификации риска.
КТ может быть использована для выявления кальциноза коронарных артерий, который отражает коронарный атеросклероз. Кроме того, электронное излучение и мультиспиральная КT были использованы для неинвазивной ангиографии и метаанализа имеющихся данных с использованием ИБС, обнаруженной при коронарной ангиографии в качестве эталона, и продемонстрировали чувствительность и специфичность 82 % (95 % CI 80–85%) и 91 % (95% CI 90–92 %) соответственно по сосудам (8 исследований, 2726 сосудов); по пациентам (21 исследование, 1570 пациентов) чувствительность и специфичность составили 96 % (95% CI 94–98 %) и 74 % (95% CI 65–84 %) соответственно. Данных для определения предоперационной стратификации риска пока нет. Следует сказать об осторожности применительно к риску радиоактивного облучения. У пациентов, перенесших операцию на сердечных клапанах, КТ-ангиография была использована для исключения сопутствующей ИБС, тем самым исчезала необходимость в инвазивной коронарной ангиографии. Такой подход может также быть использован для предоперационной стратификации риска, однако в настоящее время отсутствуют данные по определению предоперационной стратификации риска.
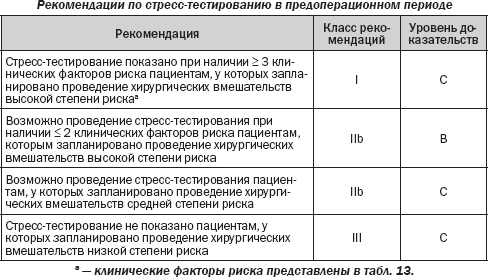
Каким образом эти данные могут быть использованы для создания алгоритма для применения во врачебной практике? Обследование должно проводиться в том случае, если его результаты изменят тактику периоперационного ведения пациента. Пациенты с обширной стресс-индуцированной ишемией составляют популяцию повышенного риска, в которой стандартная терапия недостаточна для предотвращения периоперационных сердечных осложнений. Дооперационное обследование может быть проведено у хирургических больных с высоким уровнем риска при наличии не менее трех клинических факторов риска. Тем не менее у таких больных положительного влияния кардиопротекторной терапии оказывается достаточно, чтобы исключить применение нагрузочных тестов на дооперационном этапе. Результаты рандомизированного многоцентрового исследования DECREASE II показали, что частота периоперационных кардиальных осложнений при хирургических вмешательствах на сосудах у пациентов, получающих b-блокаторы, уже была настолько снижена, что учет результатов тестов и последующие изменения периоперационного менеджмента были лишними. Никаких различий в показателях сердечной смерти и ИМ в течение 30 дней не наблюдалось у 770 пациентов, распределенных по группам с наличием и отсутствием сердечного нагрузочного тестирования (1,8 против 2,3 %; ОR 0,78; 95% CI 0,28–2,1). Важно отметить, что из-за предоперационного обследования проведение хирургического вмешательства откладывалось более чем на 3 недели. Аналогичные рекомендации даны для хирургических пациентов из группы промежуточного риска, хотя никаких данных рандомизированных испытаний нет. Учитывая низкую частоту осложнений у пациентов, у которых запланированы операции с низким риском, маловероятно, чтобы результаты обследования у кардиологически стабильных пациентов изменили периоперационное ведение.
2.5.2. Комплексная оценка сердечно-легочной функции
Сердечно-легочное нагрузочное тестирование (СЛНТ) дает возможность оценить комплексный ответ на нагрузку, включая легочную, сердечно-сосудистую и скелетно-мышечную системы. CЛНТ — это программированный нагрузочный тест, проводимый на велоэргометре либо на тредмиле, во время которого вдыхаемые и выдыхаемые газы измеряются через маску или мундштук. Этот тест дает информацию о потреблении и утилизации кислорода в организме. Наиболее часто используемые данные этого теста — объем потребления кислорода на пике нагрузки (VO2пик) и на анаэробном пороге (VO2АП), который определяется как точка, в которой метаболические требования превышают доставку кислорода и начинается анаэробный метаболизм. Пороговые значения для классификации пациентов низкого риска, как правило, такие: VO2пик более 15 мл/кг/мин и VO2АП более 11 мл/кг/мин. CЛНТ до резекции легкого может помочь в стратификации хирургического риска и оптимизации периоперационной помощи. В когорте из 204 больных, перенесших лобэктомию или пневмонэктомию, показатель VO2пик менее 20 мл/кг/мин был предиктором легочных осложнений, осложнений со стороны сердца и смертности; VO2пик менее 12 мл/кг/мин был связан с более высокой (в 13 раз) смертностью. В исследовании 187 пациентов пожилого возраста VO2АП измеряли перед массивными абдоминальными операциями. Общая смертность составила 5,9 %. У пациентов, имевших VO2АП менее 11 мл/кг/мин (n = 55), смертность составляла 18 % по сравнению с теми, у кого VO2AП был более 11 мл/кг/мин (n = 132), чья смертность 0,8 % (отношение рисков 24, 95% CI 3,1–183). У пациентов, у которых выявлялись признаки ишемии миокарда во время проведения теста, смертность составила 42 % для пациентов, у которых VO2AП был менее 11 мл/кг/мин, и только 4 % для тех, у которых VO2AП был более 11 мл/кг/мин (P < 0,001). CЛНТ также имеет большую прогностическую ценность в выявлении больных с сердечной недостаточностью: аномально высокое соотношение между минутной вентиляцией (МВ) и продукцией углекислого газа (VCO2) связано с неблагоприятным прогнозом. Внесердечные и нелегочные факторы, такие как функция скелетных мышц и физическая тренированность, могут приводить к недооценке аэробной метаболической активности. Роль CЛНТ в предоперационной оценке риска не установлена, и CЛНТ не следует рассматривать как замену нагрузочного тестирования в повседневной практике.
2.6. Ангиография
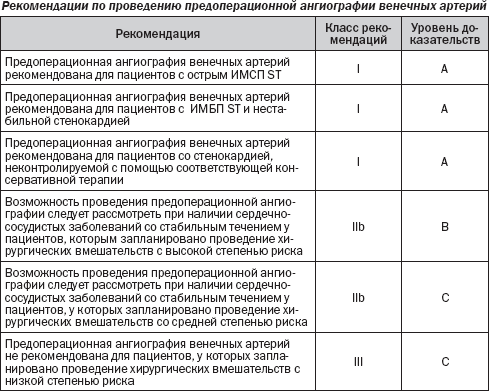
Коронарная ангиография представляет собой доказанную, но редко дающую возможность оценить риск сердечных вмешательств инвазивную диагностическую процедуру. В рандомизированных клинических исследованиях целесообразности данного метода у пациентов, у которых запланировано внесердечное хирургическое вмешательство, получено недостаточно информации. Оценка риска при помощи инвазивной коронарной ангиографии может привести к ненужным и непредсказуемым задержкам уже запланированных хирургических вмешательств. Вместе с тем отмечено, что ИБС может быть обнаружена у многих пациентов, которым показаны внесердечные хирургические вмешательства. У пациентов с выявленной ИБС показания к предоперационной коронарной ангиографии и реваскуляризации аналогичны показаниям к ангиографии в нехирургической клинике. Контроль ишемии миокарда до проведения операции рекомендован, когда хирургическое вмешательство может быть отложено.
3. Стратегии снижения риска
3.1. Фармакологическая стратегия
Возникновению ИМ в ходе операции или в раннем послеоперационном периоде часто предшествуют длительная или рецидивирующая ишемия миокарда. Стресс вследствие проведения хирургического вмешательства и анестезии может вызвать ишемию миокарда посредством дисбаланса между потребностью и доставкой кислорода. Кроме выбора стратегии снижения специфического риска, адаптированной к характеристикам пациента и типу операции, предоперационная оценка — это возможность проверки и оптимизации контроля всех сердечно-сосудистых факторов риска.
b-блокаторы
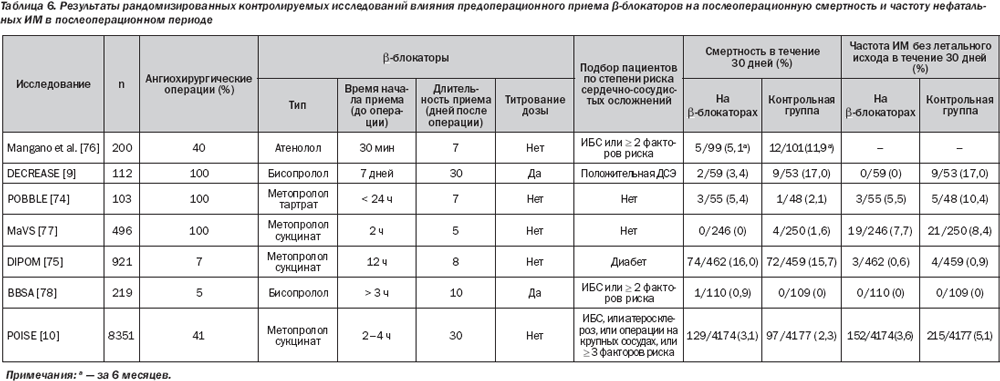
В дооперационном периоде наблюдается резкое увеличение уровня катехоламинов, в результате чего возрастают ЧСС и сократительная способность миокарда с последующим увеличением потребления кислорода миокардом. Основным обоснованием для периоперационного использования b-блокаторов является уменьшение потребления кислорода миокардом за счет снижения ЧСС, что приводит к удлинению периода диастолического наполнения, а также снижает сократительную способность миокарда. Дополнительные кардиопротекторные факторы — это перераспределение коронарного кровотока в эндокарде, стабилизация бляшки и увеличение порога для желудочковых аритмий. Рандомизированные исследования показали, что b-блокаторы и другие препараты, которые снижают ЧСС, могут сократить периоперационную ишемию миокарда по данным непрерывного мониторинга сегмента ST. Однако обеспечит ли это положительный клинический эффект, может быть установлено только путем анализа распространенности сердечно-сосудистых осложнений. Данные семи многоцентровых рандомизированных исследований оценки влияния периоперационной b-блокады на клинические результаты были опубликованы в рецензируемых журналах (табл. 6, рис. 2).
Три исследования были посвящены выявлению пациентов с высоким риском периоперационных осложнений в зависимости от вида операции, наличия ИБС или факторов риска периоперационных кардиальных осложнений.
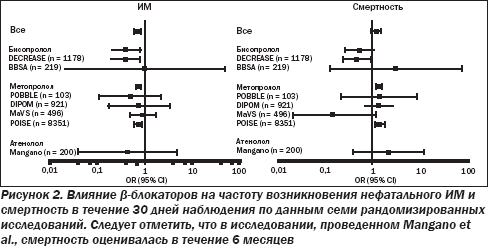
В одном их них было рандомизировано 200 пациентов по крайней мере с двумя факторами риска ИБС или с выявленной ИБС. Этим пациентам планировалось проведение внесердечных хирургических вмешательств под общим наркозом, в том числе из них 40 % — операций на крупных сосудах. Назначение атенолола было связано со значительным снижением общей смертности и увеличением выживания без осложнений в течение 6 месяцев, и этот эффект сохранялся в течение 2 лет. В испытании DECREASE были отобраны 112 из 1453 пациентов после хирургического вмешательства на сосудах, у которых сочетались по крайней мере один клинический фактор риска и положительный результат добутаминовой стресс-эхокардиографии, исключая больных с серьезными нарушениями движения стенки левого желудочка. Пациенты были рандомизированы на группы приема стандартной терапии или бисопролола, лечение которым было начато как минимум за 1 неделю до операции и регулировалось в соответствии с ЧСС. Было выявлено 89% сокращение сердечной смертности и/или ИМ в группе бисопролола (3,4 против 34 %, Р < 0,001), которое сохранялось до 3 лет.
Исследование POBBLE (Периоперационная бета-блокада) включало 103 пациента с низким кардиальным риском, перенесших хирургические вмешательства на инфраренальном отделе брюшной аорты и рандомизированных для приема метопролола тартрата или плацебо. Частота смерти, ИМ или инсульта в течение 30 дней не отличалась между группами метопролола и плацебо (13 и 15 % соответственно, P = 0,78). Были исключены пациенты с низким сердечным риском и те, у кого в анамнезе был ИМ в течение предыдущих 2 лет. В испытании MaVS (Метопролол после сосудистой хирургии) 497 пациентов, перенесших оперативное вмешательство на абдоминальных сосудах или сосудах паховой области, были рандомизированы на группы приема метопролола сукцината или плацебо. Комбинированные исходы в виде смерти, ИМ, сердечной недостаточности, аритмии или инсульта в течение 30 дней не отличались между группами метопролола и плацебо (10,2 и 12 % соответственно, Р = 0,57). Индекс Lee составлял ≤ 2 у 90 % пациентов и ≤ 1 — у 60 %.
В испытании DIPOM (Диабетическая послеоперационная смертность и заболеваемость) был выбран 921 пациент с сахарным диабетом в возрасте более 39 лет при продолжительности операции > 1 часа (39 % операций с низким риском). Пациенты были рандомизированы на группы приема метопролола сукцината или плацебо. Показатели достижения комбинированной конечной точки в виде смерти, ИМ, нестабильной стенокардии или сердечной недостаточности в течение 30 дней не отличались между группами метопролола и плацебо (6 и 5 % соответственно, P = 0,66). Однако только у 54 % пациентов в анамнезе были ИБС или дополнительные факторы кардиального риска и им выполнялись оперативные вмешательства высокой или средней степени.
Исследование POISE включало пациентов с широким спектром риска периоперационных сердечных осложнений. 8351 пациент в возрасте ≥ 45 лет был рандомизирован в группы для приема метопролола сукцината или плацебо. Пациенты включались в исследование, если у них диагностирована сердечно-сосудистая патология, есть по крайней мере три из семи клинических факторов риска или им проводились серьезные кардиоваскулярные вмешательства. Им назначался метопролола сукцинат 100 мг за 2–4 ч до операции, 100 мг в течение первых 6 ч после операции, но отменялся, если САД опускалось ниже
Расхождения в понимании защитной роли b-блокаторов могут быть объяснены различиями в характеристиках пациента, типа операции, и условий b-блокады (время начала, продолжительность, титрование дозы и тип препарата). Также оценка этих данных может быть затруднена при включении в многочисленные испытания, которые не предназначены для оценки воздействия на периоперационный сердечный риск или в которых b-блокатор используется однократно до анестезии. Недавний метаанализ показал, что наибольшие различия между исследованиями кардиопротекторного эффекта b-блокаторов могут быть связаны с реакцией вариабельности сердечного ритма. В частности, уменьшение количества послеоперационных ИМ было весьма значительным, когда проводился строгий контроль ЧСС.
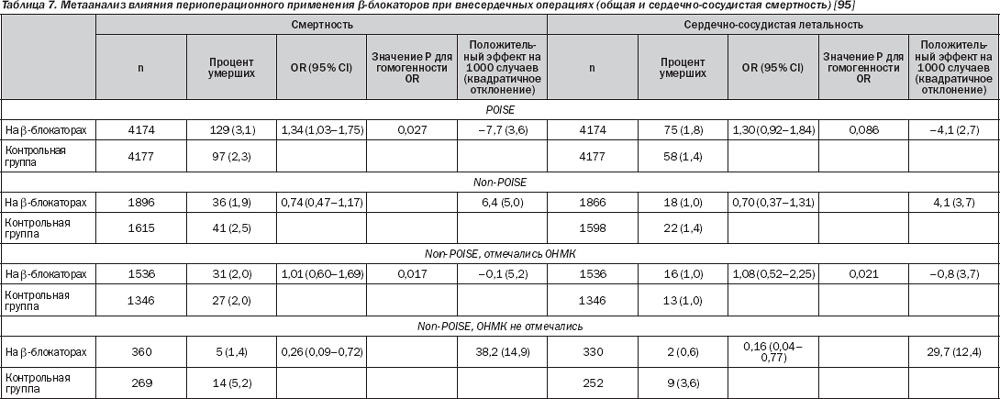
Хотя обзорные исследования следует интерпретировать с осторожностью, они предоставляют дополнительные сведения о взаимодействии стратификации риска и периоперационной b-блокады. В проспективной когорте из 1351 пациента, перенесшего сосудистое вмешательство, 360 (27 %) лечились с помощью b-блокаторов. В исследовании популяции 1351 пациента 83 % имели менее 3 клинических факторов риска. У них отмечался более низкий риск смерти или ИМ при использовании b-блокаторов (0,8 %), чем без них (2,3 %). У 17 % пациентов, которые имели ≥ 3 фактора риска, риск смерти или ИМ был снижен при использовании b-блокаторов с 5,8 до 2,0 % при отсутствовии стресс-индуцированной ишемии и с 33 до 2,8 %, когда стресс-индуцированная ишемия была ограничена (1–4 сегмента миокарда). Пациенты с обширной стресс-индуцированной ишемией (≥ 5/16 сегментов миокарда) имели особенно высокий риск смерти или ИМ независимо от назначенного лечения (33 % с b-блокаторами и 36 % без них). В большой ретроспективной когорте, извлеченной из баз данных качества лечения, проанализировано 663 635 пациентов, перенесших внесердечное хирургическое вмешательство (30 % операций высокого риска). Сравнение внутрибольничной смертности у 119 632 пациентов, получающих b-блокаторы, и 216 220 предрасположенных пациентов, не принимавших b-блокаторы, не показало в целом никакой разницы (2,3 против 2,4 % соответственно, Р = 0,68). Однако были отмечены различия в зависимости от профиля риска пациентов. Использование b-блокаторов было связано со значительным снижением смертности, когда индекс Lee составлял ≥ 3. Не наблюдалось существенной разницы по индексу Lee 1 или 2. Смертность была увеличена в группе низкого риска (индекс Lee 0).
В рандомизированных исследованиях при отборе пациентов высокого риска и проведении метаанализа было продемонстрировано последовательное уменьшение кардиальной смертности и ИМ при использовании b-блокаторов у пациентов с клиническими факторами риска, подлежащими оперативному вмешательству высокого риска (в основном сосудистому). Периоперационная b-блокада является также экономически эффективной у этих больных. Однако пациенты с обширной ишемией, о чем свидетельствует стресс-тестирование, имеют особо высокий риск периоперационных сердечных осложнений, несмотря на периоперационную b-блокаду.
С другой стороны, рандомизированные испытания пациентов с низкой степенью риска и групповые исследования позволяют предположить, что периоперационная b-блокада не снижает риск сердечных осложнений у пациентов без клинических факторов риска. Возможность отрицательного влияния на смертность была показана в ретроспективном когортном исследовании и в испытании POISE. Брадикардия и гипотония могут быть опасными у пациентов с атеросклерозом и, возможно, вызывают инсульт.
Это не оправдывает того, что пациенты низкого риска подвергаются возможным побочным эффектам при отсутствии доказанной эффективности. Вопрос остается дискуссионным для пациентов из промежуточной группы риска, т.е. для лиц с одним или двумя клиническими факторами риска. Результаты DECREASE IV свидетельствуют, что b-блокаторы также следует использовать у пациентов, подвергающихся вмешательствам среднего риска. У пациентов, рандомизированных в группу применения бисопролола (n = 533) эффективность была ниже, чем у лиц, рандомизированных в группу контроля (2,1 против 6,0 % осложнений, HR 0,34, 95% CI 0,17–0,67). Увеличение смертности вследствие отмены предоперационного назначения b-блокатора отмечалось в обзорных исследованиях. Прием b-блокаторов следует продолжить, если они назначены для лечения ИБС или аритмии. Когда b-блокаторы назначены для лечения гипертензии, отсутствие доказательств в пользу периоперационного кардиопротекторного эффекта с другими антигипертензивными лекарствами не поддерживает изменения терапии. b-блокаторы не должны быть отменены у больных, получающих терапию по поводу стабильной сердечной недостаточности, в связи с систолической дисфункцией ЛЖ. При декомпенсированной сердечной недостаточности прием b-блокаторов, возможно, необходимо будет сократить или временно исключить. Если возможно, то внесердечное хирургическое вмешательство должно быть отложено, чтобы оно могло быть выполнено при оптимальной медикаментозной терапии в стабильном состоянии. Противопоказания к назначению b-блокаторов (астма, тяжелые нарушения проводимости, симптоматическая брадикардия и гипотензия) должны быть учтены. b-блокаторы не противопоказаны пациентам с перемежающейся хромотой. Кроме того, недавнее исследование показало, что применение кардиоселективных b-блокаторов было связано с уменьшением смертности у пациентов с хронической обструктивной болезнью легких (ХОБЛ), которым проводилось хирургическое вмешательство на сосудах. При отсутствии противопоказаний доза b-блокатора должна подбираться для достижения ЧСС между 60 и 70 уд/мин. Предпочтение отдается b1-селективным блокаторам без внутренней симпатомиметической активности.
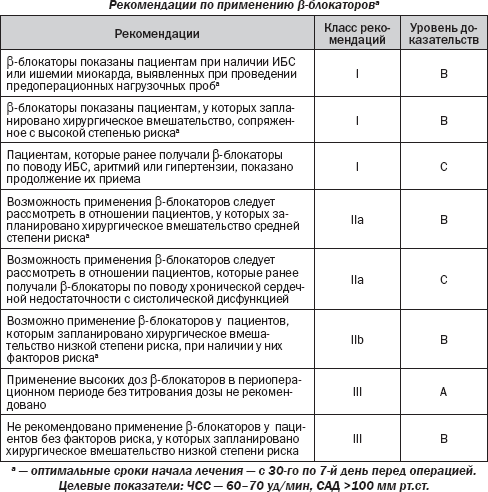
Начало лечения и выбор оптимальной дозы b-блокатора тесно связаны между собой. Периоперационная ишемия миокарда и высвобождение тропонина уменьшаются, и долгосрочные результаты улучшаются у пациентов, которые имеют более низкую ЧСС. С другой стороны, брадикардии и гипотонии следует избегать. Это подчеркивает важность предотвращения перенасыщения с фиксированной высокой начальной дозой. Доза b-блокатора должна тщательно подбираться, это требует, чтобы лечение оптимально было начато в срок между 30 днями и как минимум 1-й неделей до операции. Рекомендуется начинать лечение с суточной дозы 2,5 мг бисопролола или
50 мг метопролола сукцината, которая должна быть скорректирована до операции для достижения ЧСС покоя от 60 до 70 уд/мин при САД >
Оптимальная продолжительность периоперационной терапии b-блокатором не может быть определена в результате рандомизированных исследований. Уменьшение кардиальных осложнений является стимулом для продолжения терапии b-блокаторами по крайней мере на несколько месяцев. Долгосрочную терапию b-блокаторами следует применять у пациентов с положительным предоперационным стресс-тестом. Согласно современной концепции кардиопротекции рекомендуется использовать селективные b1-блокаторы без внутренней симпатомиметической активности и с большим периодом полураспада, например бисопролол.
Статины
Ингибиторы 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (статины) широко используются у больных с ИБС или риском ИБС благодаря липидоснижающему эффекту этих препаратов. Пациенты с атеросклерозом аорты, сонных и периферических артерий, почечных сосудов должны получать статины для вторичной профилактики. Статины также способствуют стабилизации бляшки в коронарных артериях посредством уменьшения окисления липидов, воспаления, содержания матриксной металлопротеиназы, гибели клеток и за счет повышения уровня тканевого ингибитора металлопротеиназы и коллагена. Эти так называемые нелипидные, или плейотропные, эффекты могут предотвратить разрыв бляшки и последующий ИМ в периоперационном периоде.

Несколько крупных клинических испытаний и обзорных исследований показали положительное влияние периоперационного использования статинов. В одном проспективном рандомизированном контролируемом исследовании у 100 больных, отобранных для проведения сосудистой операции, были выделены группы для назначения 20 мг аторвастатина или плацебо один раз в день в течение 45 дней независимо от концентрации холестерина в сыворотке крови. Сосудистые операции были выполнены в среднем через 31 день после рандомизации, и пациентов наблюдали более чем 6 месяцев. За эти 6 месяцев наблюдения значительно уменьшилось число кардиальных осложнений в группе приема аторвастатина (8 против 26 %, Р = 0,03). Метаанализ 223 010 пациентов из 12 ретроспективных и трех перспективных исследований показал, что статины значительно снижают уровень смертности — до 44 % — во внесердечной хирургии и до 59 % — в сосудистой хирургии. Последним было рандомизированное контролируемое исследование DECREASE III. В общей сложности 497 пациентов сосудистой хирургии были отобраны для назначения флувастатина (80 мг один раз в день) или плацебо за 37 дней до операции. Частота ишемии миокарда у больных, рандомизированных для назначения флувастатина или плацебо, составила 10,8 против 19,0 % соответственно (OR 0,55, 95% CI 0,34–0,88). Частота сердечной смерти или ИМ в двух изучаемых группах составила 4,8 против 10,2 % соответственно (OR 0,47, 95% CI 0,24–0,94).
Проблемой, связанной с использованием периоперационной терапии статинами, был риск развития статин-индуцированной миопатии и рабдомиолиза. В периоперационном периоде факторы, увеличивающие риск статиновой миопатии, многочисленны, например нарушение функции почек после серьезной операции, а также применение нескольких препаратов во время анестезии. Кроме того, использование анальгетиков и послеоперационные боли могут маскировать признаки миопатии. Неспособность обнаружить статиновую миопатию может привести впоследствии к продолжению назначения статинов и последующему развитию рабдомиолиза и острой почечной недостаточности.
Однако по этой проблеме не было опубликовано никаких исследований, за исключением некоторых тематических докладов. В ретроспективном исследовании 981 произвольно отобранного пациента, у которого было проведено хирургическое вмешательство на сосудах, не наблюдалось ни одного случая рабдомиолиза, отмечались значительно более высокий уровень креатинкиназы или увеличение случаев миопатии при применении статинов.
Недавно было высказано предположение, что прекращение приема статинов может быть неблагоприятным и вызвать обратный эффект. Потенциальным ограничением периоперационного использования статинов является отсутствие лекарственной формы для в/в введения.
Поэтому рекомендуются статины с длительным периодом полураспада или выпуск новых лекарственных форм таких препаратов, как розувастатин, аторвастатин и флувастатин, для применения в период сразу после операции, когда пероральный прием не представляется возможным.
Нитраты

Нитроглицерин, как хорошо известно, останавливает ишемию миокарда. Одно небольшое контролируемое исследование продемонстрировало уменьшение периоперационной ишемии миокарда у больных со стабильной стенокардией при в/в введении нитроглицерина во время внесердечного хирургического вмешательства. Однако не было отмечено никакого влияния на частоту ИМ или кардиальной смерти. Эти наблюдения были подтверждены в других исследованиях. Кроме того, периоперационное использование нитроглицерина может представлять значительный гемодинамический риск для пациентов. Снижение преднагрузки может вести к тахикардии и гипотонии.
Ингибиторы ангиотензинпревращающего фермента (ИАПФ)
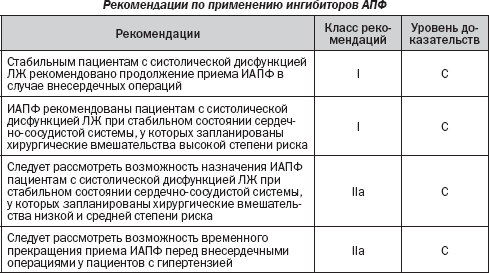
Независимо от гипотензивного эффекта ингибиторы АПФ обладают органопротективным действием. Этот эффект связан с улучшением функции эндотелия, противовоспалительными свойствами, а также с прямым вмешательством в атерогенез. Ингибирование АПФ может предотвратить осложнения, связанные с ишемией миокарда и дисфункцией ЛЖ. Поэтому рационально предположить, что периоперационное лечение ингибиторами АПФ может оказывать благотворное влияние на послеоперационный результат.
Исследование QUO VADIS сравнивало эффективность ингибитора АПФ квинаприла с плацебо у пациентов, перенесших операцию на сердце. Лечение квинаприлом было начато за 4 недели до плановой операцию и продолжалось до 1 года после операции. Это исследование показало, что частота послеоперационных сердечно-сосудистых осложнений значительно снизилась (ОR 0,23, 95% CI 0,06–0,87) у больных, пролеченных квинаприлом. Положительный эффект в исследовании QUO VADIS, однако, мог быть результатом послеоперационного лечения. Недавний обзор дает противоречивые данные относительно применения ингибиторов АПФ после операции на сердце.
Кроме того, периоперационное использование ингибиторов АПФ несет в себе риск тяжелой гипотензии при анестезии, в частности при сопутствующем использовании b-блокаторов. Гипотензия возникает реже, когда ингибиторы АПФ отменяются за день до операции. Хотя вопрос дискутируется, отмена ингибиторов АПФ может быть предложена за 24 ч до операции, если они назначены по поводу артериальной гипертензии. Их прием должен быть возобновлен после операции сразу после стабилизации объема циркулирующей крови. Риск гипотонии как минимум так же высок при применении блокаторов рецепторов ангиотензина (БРА), как и ингибиторов АПФ, и ответ на вазопрессоры может ухудшиться. У пациентов с систолической дисфункцией ЛЖ, которые находятся в стабильном клиническом состоянии, представляется целесообразным продолжить назначение ингибиторов АПФ во время периоперационного периода под тщательным контролем. Когда дисфункция ЛЖ обнаружена во время предоперационной оценки у больных без лечения в стабильном состоянии, хирургическое вмешательство должно быть отложено, если это возможно, чтобы добавить ингибиторы АПФ и b-блокаторы, как это прописано в рекомендациях ESC по лечению сердечной недостаточности.
Блокаторы кальциевых каналов
Влияние блокаторов кальциевых каналов на баланс между доставкой и потребностью миокарда в кислороде теоретически делает их подходящими для стратегий снижения риска. Следует различать эффекты дигидропиридинов, которые не действуют непосредственно на ЧСС, и дилтиазема или верапамила, которые снижают ЧСС.
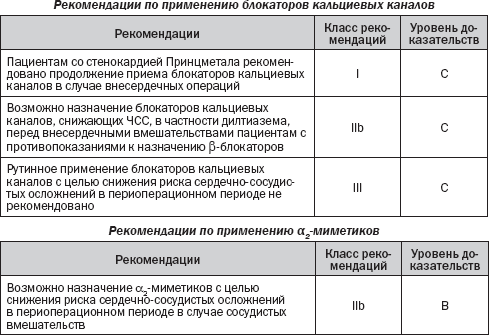
Значение рандомизированных исследований по оценке периоперационного эффекта блокаторов кальциевых каналов ограничено их малыми размерами, отсутствием стратификации риска, а также систематической отчетности о коронарной смерти и ИМ. Метаанализ 11 рандомизированных исследований включал в общей сложности 1007 пациентов. Все пациенты перенесли внесердечное хирургическое вмешательство с применением блокаторов кальциевых каналов (дилтиазем в семи испытаниях, верапамил — в двух, а нифедипин — в одном, еще одно испытание включало три группы — контроль, дилтиазем и нифедипин). В суммарном анализе при применении блокаторов кальциевых каналов было отмечено значительное сокращение числа эпизодов ишемии миокарда и суправентрикулярной тахикардии (СВТ).
Однако снижение смертности и ИМ достигло статистической значимости только тогда, когда обе конечные точки были объединены в комбинированную конечную точку «смерть и/или ИМ» (относительный риск 0,35, 95% CI 0,08–0,83, Р = 0,02). Анализ подгрупп дал результаты в пользу дилтиазема. Еще одно исследование, включавшее 1000 больных, перенесших неотложные или плановые операции по поводу аневризмы аорты, показало, что использование дигидропиридинового блокатора кальциевых каналов не было связано с увеличением случаев периоперационной смертности. Использования дигидропиридинов короткого действия, в частности нифедипина в капсулах, следует избегать.
Таким образом, хотя блокаторы кальциевых каналов, способные снижать ЧСС, не показаны больным с сердечной недостаточностью и систолической дисфункцией, у пациентов, которые имеют противопоказания к назначению b-блокаторов, может быть рассмотрена возможность начала или продолжения введения блокаторов кальциевых каналов, снижающих ЧСС.
Ивабрадин
Ивабрадин является специфическим ингибитором водителя ритма в синоатриальном узле и снижает ЧСС независимо от симпатической активации. Он не влияет на АД или на сократительную способность миокарда. В рандомизированном исследовании 111 пациентов отделения сосудистой хирургии ивабрадин и метопролола сукцинат значительно снизили число случаев ишемии и ИМ по сравнению с плацебо. Эти предварительные выводы должны быть подтверждены будущими исследованиями; ивабрадин может рассматриваться как препарат выбора для пациентов, у которых есть противопоказания к назначению b-блокаторов.
Агонисты a2-рецепторов
Агонисты a2-рецепторов уменьшают выброс норадреналина в постганглионарных нервных окончаниях и, следовательно, могут способствовать уменьшению катехоламинового выброса во время операции. В европейском исследовании Mivazerol было рандомизировано 1897 больных с ИБС, подвергшихся внесердечному хирургическому вмешательству средней или высокой степени риска. В Mivazerol не уменьшилась частота смерти или ИМ в популяции в целом. Вместе с тем имело место снижение послеоперационной смерти или ИМ, наблюдавшееся в субпопуляции 904 пациентов отделения сосудистой хирургии. Более позднее исследование, включавшее 190 больных с клиническими факторами риска или ИБС, показало сокращение 30-дневной и 2-летней смертности после периоперационного использование клофелина.
Периоперационное использование агонистов a2-рецепторов было связано со снижением смертности и ИМ только в подгруппе пациентов, перенесших хирургическое вмешательство на сосудах, в подгруппе пациентов, перенесших несосудистое хирургическое вмешательство, преимуществ выявлено не было.
Диуретики
Диуретики часто включаются в комплекс лечения больных с АГ или сердечной недостаточностью в качестве базовой терапии. При АГ диуретики, как правило, используются в низких дозах (оказывают умеренный гипотензивный эффект). В общем диуретики у пациентов с АГ могут быть отменены в день операции, и их пероральный прием можно возобновить при необходимости. При сердечной недостаточности часто используются высокие дозы диуретиков. Вопрос дальнейшего увеличения дозы диуретика рассматривается в случае наличия признаков задержки жидкости в организме. Вопрос снижения дозировки должен быть рассмотрен, если существует риск гиповолемии, гипотензии и электролитного дисбаланса. В общем диуретики при необходимости контроля сердечной недостаточности должны применяться вплоть до дня операции и их применение должно возобновляться в послеоперационном периоде сразу, как только возможно. В периоперационном периоде объем циркулирующей крови у больных с сердечной недостаточностью должен тщательно контролироваться, и петлевые диуретики могут быть назначены в/в для контроля объемной перегрузки.
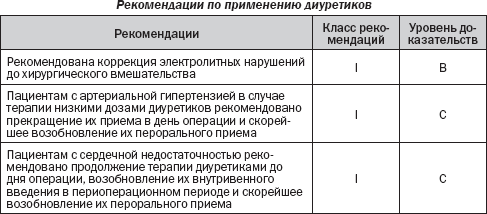
У любого пациента, получающего диуретики, должна рассматриваться возможность развития электролитных нарушений, так как диуретики увеличивают почечную экскрецию К и Mg. Гипокалиемия, как сообщалось, возникает у более чем 34 % хирургических больных.
Гипокалиемия, как хорошо известно, значительно увеличивает риск желудочковой тахикардии (ЖТ) и фибрилляции желудочков при сердечной патологии. В исследовании 688 пациентов с болезнями сердца, перенесших внесердечное хирургическое вмешательство, гипокалиемия была независимо связана с периоперационной смертностью. С другой стороны, в исследовании 150 пациентов, перенесших внесердечное хирургическое вмешательство, никакого учащения периоперационных аритмий при гипокалиемии не наблюдалось.
Важно отметить, что использование К- и Mg-сберегающих диуретиков, т.е. антагонистов альдостерона (спиронолактон и эплеренон), как теперь хорошо известно, сокращает смертность при тяжелой сердечной недостаточности. В общем гомеостаз К и Mg следует оценивать до операции. Особое внимание следует уделить больным, принимающим диуретики, и больным, склонным к развитию аритмии.
Любые электролитные нарушения, особенно гипокалиемия и гипомагниемия, должны быть устранены в надлежащее время до операции. Должны быть даны рекомендации по соблюдению определенной диеты с увеличением объемов потребления К и Mg; прием лекарственных средств, способствующих уменьшению содержания содержание К и Mg, если возможно, должен быть сокращен; могут быть выбраны или добавлены к лечению К- и Mg-сберегающие диуретики, также К и Mg могут назначаться дополнительно. Резкое предоперационное насыщение данными элементами у бессимптомных больных может иметь больше рисков, чем преимуществ. Таким образом, незначительные бессимптомные электролитные нарушения не должны быть причиной отсрочки ургентного оперативного вмешательства.
Ацетилсалициловая кислота
Хотя аспирин широко применяется у больных с ИБС и особенно после коронарного стентирования, доказательства применения его в периоперационном периоде ограничены. В рандомизированном исследовании 232 пациентов, перенесших каротидную эндартерэктомию, аспирин показал свою эффективность в предотвращении интраоперационных и послеоперационных инсультов, хотя не было отмечено никакого эффекта относительно смерти или ИМ.

В 2001 году метаанализ продемонстрировал сокращение серьезных сосудистых осложнений и сосудистой смерти у пациентов отделения сосудистой хирургии.
Это исследование включало 10 случаев назначения антитромбоцитарной терапии при шунтировании нижних конечностей, в шести из которых проводилось лечение аспирином. Однако польза от антитромбоцитарной терапии не достигла статистической значимости для комбинированной конечной точки сосудистых осложнений (OR 0,8, 95% CI 0,5–1,1) в этой сосудистой хирургической популяции.
Обеспокоенность относительно периоперационных геморрагических осложнений часто приводила к отмене аспирина в периоперационном периоде. Большой метаанализ, включающий 41 исследование с участием 49 590 пациентов, показал, что риск развития кровотечений был в 1,5 раза выше у пациентов, принимавших аспирин, по сравнению с теми, кто отказался от приема этого препарата, но при этом аспирин не обусловливал более тяжелые кровотечения. Систематический обзор с факторами риска или ИБС показал, что отказ от применения аспирина был связан с 3-кратным повышением риска серьезных осложнений со стороны сердца (OR 3,14, 95% CI 1,8–5,6). Аспирин должен быть отменен, если риск кровотечения выше потенциальной пользы для сердечно-сосудистой системы. До проведения малых хирургических или эндоскопических процедур серьезное внимание следует уделить вопросу об отмене антитромботических препаратов. В принципе и на основе индивидуальной оценки соотношения риска и пользы часто нет необходимости прекращать применение антитромбоцитарных препаратов до проведения вышеупомянутой процедуры у пациентов, которые принимают антитромбоцитарные препараты. Для пациентов, получающих антитромбоцитарную терапию, т.е. аспирин, клопидогрель или оба препарата, при массивном или угрожающем жизни периоперационном кровотечении рекомендуется переливание тромбоцитарной массы или назначение других гемостатических агентов.
Антикоагулянтная терапия
Антикоагулянтная терапия связана с повышенной кровоточивостью при проведении внесердечных хирургических операций. У некоторых пациентов польза антикоагулянтной терапии превышает риск от ее применения, ее применение является целесообразным, тогда как у других пациентов с низким риском тромбоза антикоагулянты должны быть отменены, чтобы свести к минимуму вероятность кровотечений.
Пациенты, получающие пероральную антикоагулянтную терапию антагонистами витамина К (АВК), имеют повышенный риск кровотечения. Если международное нормализованное отношение (МНО) < 1,5, то хирургическое вмешательство может осуществляться без опасений (табл. 8). Однако у пациентов с высоким риском тромбозов прекращение приема АВК является опасным, и таким пациентам будет необходимо назначение нефракционированного гепарина (НФГ) или терапевтических доз низкомолекулярного гепарина (НМГ) в/в или п/к. Высокий риск тромбоэмболии имеет место у пациентов с фибрилляцией предсердий (ФП), механическими протезами клапанов сердца, биологическими протезами клапанов сердца или после операции восстановления митрального клапана в течение последних 3 месяцев или после недавней венозной тромбоэмболии (< 3 месяцев) в сочетании с тромбофилией. Наиболее часто назначаются терапевтические дозы НМГ п/к. Применение АВК ограничено 5 днями (т.е. 5 дозами) до операции; НМГ или НФГ назначаются через 1 день после прекращения применения аценокумарола и через 2 дня после прекращения применения варфарина. Пациентам с высоким тромбоэмболическим риском рекомендуется введение
70 ЕД/кг антагониста Ха-фактора 2 раза в день и профилактически 1 раз в день пациентам группы низкого риска (табл. 9). Последняя доза НМГ должна быть назначена минимум за 12 часов до процедуры. У больных с механическими протезами клапанов сердца целесообразность в/в введения НФГ более доказана. Эти пациенты госпитализируются и получают НФГ в/в за 4 ч до операции, лечение с применением НФГ возобновляется после операции до тех пор, пока МНО не достигнет терапевтического диапазона. В день операции проверяется МНО.
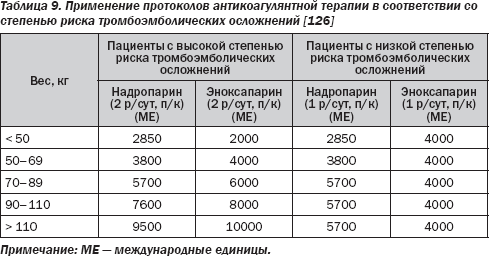
Необходимо рассматривать возможность откладывания операции, если МНО > 1,5. Назначение НМГ или НФГ возобновляется в дооперационной дозе через 1–2 дня после операции в зависимости от гемостатического статуса, минимально через 12 ч после операции. Прием антикоагулянтов перорально должен возобновляться через 1 или 2 дня после операции в зависимости от адекватности гемостаза (если пациент может принимать лекарства перорально) в предоперационной дозе плюс увеличение дозы на 50 % в течение двух дней подряд; в последующий период — поддерживающая доза. Назначение НМГ или НФГ должно быть продолжено до тех пор, пока МНО не возвращается к терапевтическим уровням.
Кроме того, важен тип хирургического вмешательства, так как риск кровотечений значительно варьирует и зависит от способности обеспечить контроль гемостаза. Процедурами с высоким риском серьезных кровотечений считаются те, при которых не может быть выполнена компрессия. В таких случаях прекращение терапии пероральными антикоагулянтами и НМГ обязательно.
У пациентов, перенесших хирургическое лечение с низким риском серьезного кровотечения, например при катаракте, никакие изменения пероральной антикоагулянтной терапии не нужны.
У больных, получающих АВК и требующих приостановки антикоагулянтного эффекта для срочного хирургического вмешательства, рекомендуются низкие дозы витамина K (2,5–5,0 мг) в/в или перорально.
Для более быстрого прекращения антикоагулянтного эффекта АВК рекомендуется введение свежезамороженной плазмы или другого услиливающего тромбообразование вещества в/в или перорально в дополнение к низким дозам витамина K. У пациентов, получавших НФГ и нуждающихся в прекращении антикоагулянтного эффекта для срочного хирургического вмешательства, достаточно отмены НФГ. При инфузионном введении достигается устойчивый антикоагулянтный эффект НФГ в течение 4–6 ч. Таким образом, при прекращении инфузии свертываемость крови в целом должна нормализоваться через 4 ч. Когда НФГ вводится п/к, антикоагулянтный эффект более длителен. Для немедленной остановки действия препарата используют протамина сульфат. Однако потенциально протамина сульфат может вызвать анафилактические реакции с развитием сердечно-сосудистого коллапса, особенно при слишком большой скорости введения. Доза протамина сульфата может быть рассчитана путем оценки количества гепарина, полученного в предыдущие 2 ч. Доза протамина сульфата при отмене инфузий гепарина составляет 1 мг на 100 ЕД гепарина. Если инфузия гепарина была остановлена на более чем 30 мин, но менее чем на 2 ч, далее следует использовать половину дозы протамина сульфата; если инфузия гепарина была остановлена более чем на 2 ч, но менее чем на 4 часа, далее нужно вводить четверть дозы. Максимальная доза протамина сульфата — 50 мг. У больных, получающих НМГ, его действие прекращается в течение 8 ч после последней дозы из-за короткого периода полувыведения. Если требуется немедленное прекращение действия НМГ, может быть использовано в/в введение протамина сульфата, но анти-Ха-активность никогда не может быть полностью нейтрализована (максимум — на 60–75 %).
Рекомендации по поводу того, как свести к минимуму кровотечения и тромбоэмболические осложнения во время операции, приведены в табл. 8.
3.2. Реваскуляризация
Основная цель профилактической реваскуляризации миокарда — предотвращение развития потенциально летального ИМ в периоперационном периоде. Хотя реваскуляризация может быть особенно эффективна при лечении стенозов высоких градаций, она не может предотвратить разрыв уязвимой бляшки в условиях хирургической операции.
Пациенты, клинически стабильные в первые годы после аортокоронарного шунтирования (АКШ), имеют сниженный риск коронарных осложнений после последующего внесердечного хирургического вмешательства. Данные из реестра CASS свидетельствуют, что это особенно относится к пациентам с поражением трех сосудов и/или со сниженной функцией ЛЖ и в случае операции высокого риска. Таким образом, пациенты, которым было проведено АКШ в течение последних 5 лет, могут быть отправлены на хирургическую операцию, если их клиническое состояние остается неизменным с момента последнего обследования.
У пациентов, которым до операции проводилась чрескожная реваскуляризация, риск кардиальных осложнений может быть повышен во время и после последующего внесердечного вмешательства, в частности в случае незапланированной или ургентной операции после коронарного стентирования. После проведения ангиопластики чрескожное коронарное вмешательство (ЧКВ) не ухудшает послеоперационные исходы, даже если операция выполняется ранее чем через 11 дней после ЧКВ. Появление стентирования в середине 1990-х годов резко изменило картину. Действительно, крайне высокий уровень смертности (до 20 %) был зарегистрирован в связи с острым тромбозом стента во время операции, если она выполняется в течение нескольких недель после коронарного стентирования при прекращении антитромбоцитарной терапии. Поэтому предпочтительно, чтобы отдельные вмешательства были отложены на срок не менее 6 недель (оптимально до 3 месяцев) после имплантации стента из чистого металла и была продолжена двойная антитромбоцитарная терапия. Когда операция была выполнена в эти сроки, прекращение двойной антитромбоцитарной терапии было связано с увеличением числа тромбозов стента. После 3 месяцев пациенты могут быть направлены для проведения внесердечного хирургического вмешательства с рекомендацией продолжать терапию по крайней мере аспирином (рис. 3).
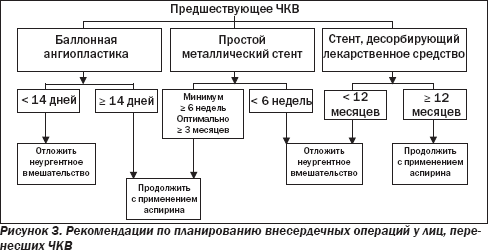
В 2002 году элютинг-стенты были внедрены в Европе и получили широкое признание как эффективное средство уменьшения рестеноза стента в дальнейшем. Однако их основной недостаток заключается в необходимости длительной двойной антитромбоцитарной терапии аспирином и клопидогрелем по крайней мере в течение 12 месяцев. В случаях когда операция была выполнена в течение этого периода, прекращение двойной антитромбоцитарной терапии ассоциировалось с увеличением случаев тромбозов стента. Сейчас общепризнанно, что после имплантации DES операция должна проводиться только после по крайней мере 12 месяцев непрерывной двойной антитромбоцитарной терапии (рис. 3). После этого пациент может быть направлен на внесердечное хирургическое вмешательство с продолжением по крайней мере приема аспирина. Необходимость в хирургическом вмешательстве с учетом его сроков и специфичности патологией (например, злокачественные опухоли, сосудистые аневризмы) должна быть определена в каждом конкретном случае, при этом должен быть принят во внимание повышенный риск тромбоза стента в течение первого года после имплантации DES. Решение должно приниматься консилиумом врачей — хирурга, анестезиолога и кардиолога.
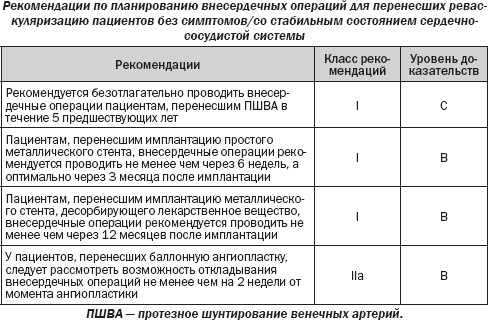
У пациентов, которые требуют временного прекращения приема аспирина или клопидогреля до операции, рекомендовано, чтобы это лечение было прекращено не позднее чем за 5 дней (желательно за 10 дней) до начала операции. Терапия может быть возобновлена приблизительно через 24 ч (или на следующее утро) после операции, когда обеспечен достаточный гемостаз. У пациентов, нуждающихся в проведении срочной хирургической или иной инвазивной процедуры с потенциально массивным или угрожающим жизни периоперационным кровотечением, рекомендуется трансфузия тромбоцитов или назначение других гемостатических растворов.
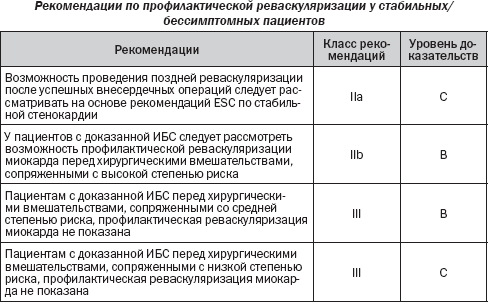
Профилактическая реваскуляризация у больных со стабильной ИБС
Только в двух рандомизированных исследованиях была рассмотрена роль профилактической реваскуляризации до проведения внесердечного оперативного вмешательства у стабильных пациентов, которым требовалось проведение операций на сосудах. Испытание CARP было первым, в котором сравнивали оптимальную медикаментозную терапию с реваскуляризацией (АКШ или ЧКВ) у больных со стабильной ИБС до проведения массивного сосудистого вмешательства. Из 5859 пациентов, обследованных в Госпитале ветеранов США, 510 пациентов были рандомизированы для проведения одного из двух вышеуказанных вариантов лечения. Критериями включения в исследование были наличие факторов риска со стороны сердечно-сосудистой системы и диагностированная при неинвазивном обследовании кардиологом ишемия.
Не было выявлено отличий в показателе смертности через 2,7 года после рандомизации: 22 % (группа реваскуляризации) против 23 % (группа медикаментозной терапии) (Р = 0,92). Кроме того, не было отличий в развитии периоперационных ИМ: 12 против 14 % соответственно (Р = 0,37).
В пилотном исследовании DECREASE V применяли более точную методологию отбора пациентов. 1880 пациентов, у которых была запланирована операция, были обследованы на наличие следующих факторов риска: возраст более 70 лет, стенокардия, предшествующие ИМ, застойная сердечная недостаточность — компенсированная или в анамнезе, лекарственная терапия по поводу сахарного диабета, почечной дисфункции и предшествующие инсульты или транзиторные ишемические атаки (ТИА). При наличии ≥ 3 факторов риска была проведена добутаминовая стресс-эхокардиография, при наличии обширной ишемии
(> 5/16 сегментов или более 3/6 стенки) пациенты были рандомизированы в группу проведения реваскуляризации или медикаментозной терапии. Важно отметить, во время операции всем пациентам были назначены b-блокаторы и не отменен аспирин. Поражение трех сосудов или патология левой коронарной артерии были выявлены в 75 % случаев. Кроме того, у 43 % пациентов имело место снижение фракции выброса до ≤ 35 %. ЧКВ была проведена у 65 % пациентов (n = 32, из которых 30 были поставлены драг-элютинг-стенты). Не было отличий в комбинированных первичных конечных точках (смертность от всех причин и нефатальный ИМ за 30 дней): 43 % в группе реваскуляризации против 33 % в группе медикаментозной терапии (Р = 0,30).
CARP было первым исследованием, указавшим, что профилактическая реваскуляризация до операции на сосудах не улучшает клинические исходы у стабильных пациентов. Тем не менее включение в исследование было основано на субъективных показателях и изучаемая популяция была группой относительно низкого риска. DECREASE V включало пациентов высокого риска с обширной стресс-индуцированной ишемией по оценке неинвазивного стресс-тестирования. Несмотря на относительно небольшую когорту исследования, DECREASE V подтверждает выводы CARP в популяции более высокого риска, причем у большинства пациентов имелись поражения трех сосудов и бессимптомная дисфункция ЛЖ.
Успешное проведение оперативного вмешательства на сосудах без профилактической реваскуляризации у стабильного коронарного пациента не означает, что этому пациенту не будет нужна реваскуляризация впоследствии. Ограниченные данные DECREASE V указывают на потенциальную необходимость реваскуляризации в группе медикаментозного лечения. Несмотря на отсутствие достаточного количества научных данных, реваскуляризация миокарда может быть рекомендована перед проведением планового внесердечного оперативного вмешательства пациентам, не имеющим осложнений и со стойкими признаками обширной ишемии, в соответствии с рекомендациями ESC для нехирургических клиник.
Исследования CARP и DECREASE V были проведены в клинике сосудистой хирургии, при оперативном вмешательстве имел место риск для пациентов с ИБС. Однако выводы этих исследований, вероятно, можно экстраполировать на другие варианты хирургического вмешательства.
Тип профилактической реваскуляризации у больных со стабильной ИБС
Иногда пациентам со стабильной ИБС может потребоваться плановая операция, а это означает, что ее можно отложить на несколько месяцев или вплоть до 1 года и более. Достоверных данных для выбора стратегии реваскуляризации в данном случае нет, и стратегия может базироваться лишь на основе рекомендаций экспертов. Тем не менее этих больных можно в некоторой степени сравнить с пациентами, которым ранее была выполнена реваскуляризация. Поэтому представляется разумным предложить обследование состояния сердечно-сосудистой системы в соответствии с рекомендациями ESC по ведению пациентов со стабильной стенокардией. АКШ должно быть выполнено для улучшения прогноза и облегчения симптомов у пациентов со значительным поражением ствола левой коронарной артерии или его эквивалентами, при значительном поражении трех сосудов, в частности в случае сниженной функции ЛЖ, как указано в этих рекомендациях. ЧКВ должно быть выполнено для облегчения симптомов у стабильных симптоматических больных с одно- или многососудистым поражением, у которых вмешательство технически выполнимо, и риск процедуры не перевешивает потенциальные преимущества.
Выбор между ЧКВ и АКШ часто является предметом обсуждения и будет зависеть от нескольких факторов. Недавно были опубликованы итоги годичного исследования SYNTAX, в котором 1800 больных с ишемическим поражением трех сосудов или ствола левой коронарной артерии были рандомизированы для проведения АКШ или ЧКВ. Результаты показывают, что АКШ по-прежнему остается методом выбора у этих больных, но ЧКВ является ценной альтернативой. Как упоминалось выше, современные рекомендации по ведению пациентов со стабильной стенокардией указывают роль обоих методов лечения. Тем не менее если ЧКВ выполняется до внесердечной операции, рекомендуется использование стентов из чистого металла, чтобы необоснованно не затягивать проведение операции.
Реваскуляризация у больных с нестабильной ИБС
Ни в одном исследовании не изучалась роль профилактической реваскуляризации у больных с нестабильной стенокардией, требующих внесердечных хирургических вмешательств. Нестабильная стенокардия, в частности ОКС без подъема сегмента ST, считается состоянием высокого клинического риска и требует своевременной диагностики, стратификации риска и реваскуляризации. В этом случае нужно ориентироваться на последние рекомендации ESC по ведению пациентов с ОКС без подъема сегмента ST. Базовая терапия включает антитромбоцитарную и антикоагулянтную терапии, прием b-блокаторов и неотложную реваскуляризацию. Особое внимание должно быть уделено предотвращению назначения прямых антикоагулянтов и/или антитромботической терапии нестабильным коронарным больным с сопутствующими хирургическими состояниями в связи с повышенным риском кровотечения, вторичным по отношению к фоновому хирургическому заболеванию (злокачественные опухоли и т.д.). За исключением уже упомянутых хорошо известных показаний для неотложной АКШ большинству пациентов проводят ЧКВ. В исключительной ситуации сочетания нестабильной стенокардии и необходимости последующего внесердечного хирургического вмешательства предпочтение необходимо вновь отдавать металлическим стентам, чтобы не откладывать операцию на 3 месяца.
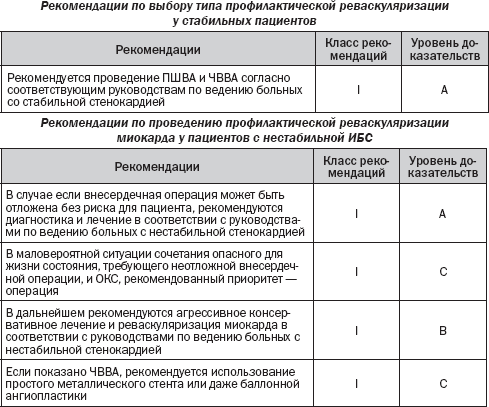
До сих пор в рекомендациях рассматривались маркеры сердечного риска и стратегии снижения риска. Однако пациентам с сопутствующими заболеваниями до операции необходимо комплексное обследование и лечение сопутствующей патологии в периоперационном периоде. В следующих разделах рассматриваются наиболее распространенные сердечно-сосудистые заболевания.
4.1. Хроническая сердечная недостаточность
Распространенность хронической сердечной недостаточности у взрослого населения в Великобритании составляет 1,8 % и с возрастом увеличивается. У пациентов старше 75 лет распространенность достигает 8,0 %.
Прогностическая ценность сердечной недостаточности для периоперационных сердечных осложнений широко признана и является важным фактором клинического риска при расчете показателей, таких как оценки риска по Goldman или Detsky.
Исследование, посвященное оценке функции ЛЖ до проведения операции на сосудах, в 1988 году выявило, что фракция выброса ЛЖ ≤ 35 % является оптимальным предиктором послеоперационных сердечных осложнений. В 2008 году еще в одном исследовании подтвердились эти выводы и было сделано заключение, что у пожилых пациентов с хронической сердечной недостаточностью, у которых запланировано проведение оперативного вмешательства на сосудах, риск операционной смертности и повторной госпитализации был выше, чем у других пациентов (в том числе с ИБС), госпитализированных для проведения тех же процедур. Значение сердечной недостаточности с сохраненной фракцией выброса ЛЖ в предоперационном прогнозе плохо изучено. Долгосрочные результаты сходны с таковыми у пациентов со сниженной фракцией выброса ЛЖ. Эти пациенты могут иметь повышенный сердечно-сосудистый риск во время операции. При отсутствии научно обоснованных исследований Комитет рекомендует проведение такой же терапии у больных с сохраненной фракцией выброса в периоперационном периоде, как и у больных со снижением фракции выброса.
Оценка жизнеспособности миокарда во время стресс-тестирования позволила проводить дальнейшую стратификацию риска у больных с дисфункцией ЛЖ. Как показано в исследовании 295 пациентов с фракцией выброса ЛЖ менее 35 %, у которых запланировано проведение хирургического вмешательства на сосудах, послеоперационные кардиальные осложнения были связаны с наличием стресс-индуцированной ишемии и рубцовыми участками миокарда. Тем не менее существует обратная связь между наличием и степенью дисфункции жизнеспособных сегментов, демонстрирующих улучшение функции без признаков ишемии во время инотропной стимуляции. При использовании многофакторного анализа число ишемических сегментов ассоциировалось с интраоперационными сердечными осложнениями (OR на сегмент 1,6, 95% CI 1,05–1,8), тогда как число сегментов с устойчивым улучшением ассоциировалось с улучшением исходов (OR на сегмент 0,2, 95% CI 0,04–0,7). Стратификация с помощью стресс-тестирования позволяет врачу определить подгруппу пациентов с устойчивым улучшением, которые имеют относительно благоприятный послеоперационный исход в отличие от пациентов с развивающейся ишемией.
Рекомендации ESC прописывают использовать ингибиторы АПФ (или БРА у пациентов с непереносимостью ингибиторов АПФ) и b-блокаторы в качестве препаратов первой линии для лечения больных с ХСН, чтобы улучшить показатели заболеваемости и смертности. Если отсутствуют противопоказания или непереносимость, эти препараты должны быть назначены в оптимальных дозах всем больным с симптомами сердечной недостаточности и фракцией выброса ≤ 40 %. БРА или антагонист альдостерона впоследствии может быть добавлен в зависимости от клинического состояния пациента. У пациентов с фракцией выброса ≤ 35 %, которые по-прежнему имеют серьезную симптоматику (функциональный класс III или IV по классификации New York Heart Association (NYHA)), дополнительно должно рассматриваться назначение низкой дозы антагониста альдостерона (при отсутствии гиперкалиемии и нарушения функции почек). В качестве альтернативного варианта добавление БРА рекомендуется у пациентов с сердечной недостаточностью и фракцией выброса ≤ 40 %, у которых сохраняется симптоматика, несмотря на лечение ингибиторами АПФ и b-блокаторами, исключая прием антагониста альдостерона. Диуретики рекомендуются при застойной сердечной недостаточности. Был сделан вывод о том, что периоперационное использование ингибиторов АПФ, b-блокаторов, статинов и аспирина независимо связано с уменьшением случаев госпитальной смертности у пациентов с дисфункцией ЛЖ, которым проводятся крупные оперативные вмешательства на сердце и сосудах. Таким образом, рекомендовано, чтобы поддерживающая терапия у пациентов со стабильной сердечной недостаточностью была продолжена вплоть до операции и возобновлена после операции, как только клинические условия станут удовлетворительными.
Диагноз послеоперационной сердечной недостаточности часто бывает трудно установить, поскольку она часто протекает атипично и может иметь различную этиологию. Оценка должна включать физикальное обследование, ЭКГ, серийные измерения биомаркеров, рентген и эхокардиографию. Особое внимание должно быть уделено показателю объема циркулирующей крови пациента, поскольку высокие объемы инфузии часто необходимы в интра- и послеоперационном периоде. В послеоперационном периоде объем жидкости, введенный интраоперационно, может обусловить гиперволемию и даже сердечную недостаточность, если они не контролировались должным образом. Перегрузка жидкостью может привести к декомпенсации хронической сердечной недостаточности или развитию острой сердечной недостаточности. Периоперационная сердечная недостаточность может развиваться или сразу после операции (в связи с длительной процедурой, ишемией миокарда, быстрым перемещением жидкости), или через несколько дней (в связи с поглощением жидкости третьим пространством). В соответствии с последними руководящими принципами ESC по сердечной недостаточности следует предпринять меры для оптимизации фармакологической терапии до операции. Это может иметь особое значение для b-блокаторов, которые рекомендованы в периоперационном периоде для всех пациентов высокого риска.
Для того чтобы избежать неконтролируемой гипотонии, не рекомендуется рутинное использование b-блокаторов в/в. Важно отметить, что если пациент с сердечной недостаточностью не получал ранее b-блокаторы, такая терапия должна быть начата заблаговременно до плановой операции, чтобы оптимально подобрать дозировку.
После того как выяснена этиология послеоперационной сердечной недостаточности, лечение будет подобно таковому в нехирургическом стационаре. Пациенты с сердечной недостаточностью имеют значительно более высокий риск повторной госпитализации после проведения хирургического вмешательства.
4.2. Артериальная гипертензия
В общем наличие артериальной гипертензии не считается независимым фактором риска сердечно-сосудистых осложнений в несердечной хирургии. Дооперационная оценка позволяет выявить больных с артериальной гипертензией, дает возможность целевого поиска повреждений органов и наличия сопутствующей сердечно-сосудистой патологии и начать соответствующее лечение. Это особенно важно для людей с сопутствующими факторами риска.
Не существует четких доказательств преимущества одного вида антигипертензивной терапии над другим у пациентов, которым проводится внесердечное оперативное вмешательство. Лечение больных с артериальной гипертензией должно осуществляться в соответствии с существующими принципами ESC. Тем не менее гипертоникам с сопутствующей ИБС, которые имеют высокий риск сердечно-сосудистых осложнений, рекомендуется периоперационное назначение b-блокаторов. У гипертоников антигипертензивная терапия должна быть продолжена до утра дня операции и возобновлена сразу же в послеоперационном периоде. У пациентов с АГ класса 1 или 2 нет никаких доказательств того, что задержка операции с целью оптимизации терапии полезна. В этих случаях антигипертензивное лечение должно быть продолжено в периоперационном периоде. У больных с АГ 3-й степени (САД
4.3. Пороки клапанов сердца
Пациенты с пороками клапанов сердца имеют более высокий риск периоперационных сердечно-сосудистых осложнений при внесердечной хирургии. Эхокардиография должна быть выполнена больным с диагностированными пороками или при подозрении на них, чтобы оценить их тяжесть и последствия. На основе имеющихся данных следующие рекомендации особенно применимы у таких больных.
Аортальный стеноз
Аортальный стеноз (АС) является наиболее распространенным пороком в Европе, особенно среди пожилых людей. Тяжелый АС (определяется как область аортального клапана менее 1 см2, менее 0,6 см2/м2 площади поверхности тела) — хорошо установленный фактор риска периоперационной смертности и ИМ. В случае срочной внесердечной операции у больных с тяжелым АС хирургические вмешательства должны выполняться под гемодинамическим мониторингом. В случае плановой внесердечной операции наличие симптомов является ключевым для принятия решения.
У симптомных больных возможность замены аортального клапана должна быть рассмотрена до плановой операции. У пациентов, которые не являются кандидатами на замену клапана из-за высокого риска, связанного с серьезными сопутствующими заболеваниями, или отказываются от замены клапана, внесердечное хирургическое вмешательство должно проводиться только тогда, когда оно действительно необходимо. У этих больных разумно выполнить баллонную аортальную вальвулопластику или транскатетерную имплантацию клапана до операции.
У бессимптомных больных внесердечная операция с низким или промежуточным риском может выполняться безопасно. Если планируется операция высокого риска, необходима дальнейшая клиническая оценка для замены аортального клапана. У тех, у кого имеется высокий риск операции замены клапана аорты, плановая операция под строгим гемодинамическим мониторингом должна проводиться только при крайней необходимости. У остальных пациентов замена аортального клапана должна рассматриваться как исходная процедура.

Стеноз митрального клапана
Внесердечная операция может быть выполнена с относительно низким риском у больных с незначительным митральным стенозом (МС) (область клапана более 1,5 см2) и у бессимптомных больных с выраженным МС (область клапана менее 1,5 см2) при систолическом давлении в легочной артерии менее
Аортальная и митральная недостаточность
Незначительные аортальная недостаточность (АН) и митральная недостаточность (МН) независимо не увеличивают риск сердечно-сосудистых осложнений во время внесердечного вмешательства. У бессимптомных больных с тяжелыми АН и МН (подробная классификация представлена в соответствующих рекомендациях ESC) и сохраненной функцией ЛЖ внесердечное вмешательство может быть выполнено без дополнительного риска. Симптомные больные и бессимптомные пациенты со значительно нарушенной фракцией выброса ЛЖ (менее 30 %) имеют высокий риск сердечно-сосудистых осложнений, и внесердечное оперативное вмешательство должно выполняться только в случае необходимости. Пациентам с тяжелой МН и АН можно оптимизировать медикаментозную терапию с целью максимальной гемодинамической стабилизации перед операциями высокого риска.
Пациенты с искусственными клапанами
Пациентам, которые подверглись хирургической коррекции порока сердца и имеют искусственный клапан, можно проводить внесердечное вмешательство без дополнительного риска, если нет доказательств клапанной или ЛЖ-дисфункции. У этих больных рекомендована профилактика эндокардита и модификация антикоагулянтной терапии в периоперационном периоде, при этом пероральный прием антикоагулянтов следует временно заменить на в/в введение НФГ, п/к — НФГ или п/к НМГ в терапевтических дозах.
Профилактика инфекционного эндокардита
У пациентов с клапанными пороками или искусственными клапанами, которым проводится внесердечное хирургическое вмешательство, при риске бактериемии должна быть начата профилактика инфекционного эндокардита антибиотиками. Этот вопрос подробно рассматривается в соответствующих рекомендациях ESC и AHA.
4.4. Аритмии
Появление периоперационной аритмии отмечалось у 70 % пациентов, которым при хирургических вмешательствах выполнялся общий наркоз. Ее частота, как сообщается, варьирует от 16 до 62 % при непостоянном мониторинге ЭКГ и составляет 89 % при непрерывном холтеровском мониторировании ЭКГ.
Желудочковые аритмии
Почти половина всех больных высокого риска, подвергающихся внесердечным хирургическим вмешательствам, имели частые желудочковые экстрасистолы (ЖЭ) или неустойчивую ЖТ. Не существует никаких доказательств того, что ЖЭ или неустойчивая ЖТ сами по себе связаны с худшим прогнозом. Рекомендации ACC/AHA/ESC по ведению пациентов с желудочковыми аритмиями и по профилактике внезапной сердечной смерти базируются на крупных клинических испытаниях. Независимо от причины устойчивая мономорфная желудочковая тахикардия (УМЖТ) с серьезными гемодинамическими нарушениями должна рассматриваться как показание для срочной электрической кардиоверсии.

В/в введение амиодарона может быть использовано в качестве начального лечения пациентов со стабильной УМЖТ. Кроме того, его рационально применять у больных с гемодинамически нестабильной УМЖТ, которая устойчива к конверсии электрическим шоком или повторяется, несмотря на введение других препаратов. При устойчивой полиморфной желудочковой тахикардии (УПЖТ), если имеются гемодинамические нарушения, должна быть выполнена немедленная электрическая кардиоверсия. b-блокаторы показаны пациентам с рецидивирующей УПЖТ, особенно если не может быть исключена ишемия.
Амиодарон является разумным выбором для пациентов с рецидивирующими УПЖТ при отсутствии синдрома удлиненного QT (СУ-QT). Тахикардия по типу пируэта встречается редко, и при ее наличии рекомендуются отмена любых провоцирующих препаратов и коррекция электролитных нарушений. Применение магния сульфата является целесообразным для пациентов с пируэт-тахикардией и СУ-QT. b-блокаторы в сочетании с кардиостимуляцией рекомендованы пациентам с пируэт-тахикардией и синусовой брадикардией.
Изопротеренол рекомендуется пациентам с рецидивирующей паузазависимой пируэт-тахикардией, при которой не диагностируется врожденный СУ-QT. При периоперационной ЖТ с отсутствием пульса или при фибрилляции желудочков необходима немедленная дефибрилляция.
Суправентрикулярные аритмии
Большее число больных, подвергающихся внесердечным оперативным вмешательствам, могут пострадать от СВТ и ФП по сравнению с желудочковыми аритмиями. Симпатическая активность является основным автономным триггерным механизмом, ответственным за ФП. Вагусные пробы в некоторых случаях могут остановить СВТ, и эта аритмия хорошо поддается лечению аденозином. Когда СВТ устойчива к аденозину, эффективная терапия для прекращения аритмии включает b-блокаторы короткого действия или недигидропиридиновые блокаторы кальциевых каналов (дилтиазем и верапамил) или амиодарон в/в. Верапамил следует применять с осторожностью из-за его отрицательного инотропного эффекта. Использование блокаторов кальциевых каналов не рекомендуется при предвозбудимой СВТ/ФП. При периоперационной ФП целью является контроль частоты сокращения желудочков. b-блокаторы и недигидропиридиновые блокаторы кальциевых каналов (дилтиазем и верапамил) являются препаратами выбора для контроля частоты при ФП.
Дигоксин может быть использован в качестве препарата первого выбора только у пациентов с хронической сердечной недостаточностью, поскольку он неэффективен при повышенном адренергическом статусе, который обычно бывает при хирургической операции. b-блокаторы, как было показано, ускоряют процесс перехода ФП в синусовый ритм после внесердечного хирургического вимешательства.
В ряде исследований назначение b-блокаторов в предоперационном периоде ассоциировалось с улучшением контроля аритмии.
Брадиаритмии
Тяжелые периоперационные брадиаритмии, требующие лечения, были зарегистрированы у 0,4 % из
17 021 пациента, у 6,4 % из них физическое состояние оценивалось 3 или 4 баллами по шкале Американской ассоциации анестезиологов. У этих пациентов проводился рутинный мониторинг ЭКГ в интраоперационном и раннем послеоперационном периоде. В общем периоперационные брадиаритмии хорошо реагируют на краткосрочную медикаментозную терапию, неинвазивную чреспищеводную предсердную стимуляцию у пациентов под наркозом или на неинвазивную чрескожную стимуляцию у пациентов под наркозом или в состоянии бодрствования. Временная сердечная стимуляция требуется редко, даже при наличии предоперационной бессимптомной двухпучковой блокады или блокады левой ножки пучка Гиса. Показания к временной кардиостимуляции во время периоперационного периода, как правило, те же, что и для постоянной кардиостимуляции. Бессимптомная двухпучковая блокада при наличии или отсутствии первой степени предсердно-желудочковой блокады не является показанием для временной эндокардиальной кардиостимуляции.
Электрокардиостимулятор/имплантируемый дефибриллятор-кардиовертер
Использование однополярного электрокаутера сопряжено со значительным риском для кардиостимулятор-зависимых пациентов. Электрический раздражитель электрокаутера может подавлять кардиостимулятор по требованию или перепрограммировать кардиостимулятор. Однако этих проблем можно избежать путем установки базовой пластины для электрической цепи, чтобы электрический ток проходил вдали от генератора. Удаление электроножа от кардиостимулятора, включение его лишь кратковременно, использование самой низкой возможной амплитуды могут уменьшить помехи. Во многих исследованиях авторы рекомендовали настраивать кардиостимулятор в асинхронном или невоспринимающем режиме у кардиостимулятор-зависимых больных и у тех, чей основной ритм является нестабильным, и перепроверять устройство после операции, чтобы сохранить соответствующие программы и пороги зондирования.
Вмешательство в функционирование имплантируемого дефибриллятора-кардиовертера может также иметь место в процессе хирургической операции на сердце и быть обусловлено влиянием электрического тока, генерируемого электроножом. Имплантируемый дефибриллятор-кардиовертер должен быть выключен во время операции и включен на этапе восстановления перед переводом в палату. Кроме того, рекомендовано, чтобы письменные инструкции по надзору и возобновлению работы имплантируемого дефибриллятора-кардиовертера были доступны.
4.5. Заболевания почек
Сниженная функция почек является независимым фактором риска возникновения неблагоприятных послеоперационных сердечно-сосудистых исходов, включая ИМ, инсульт и прогрессирование сердечной недостаточности.
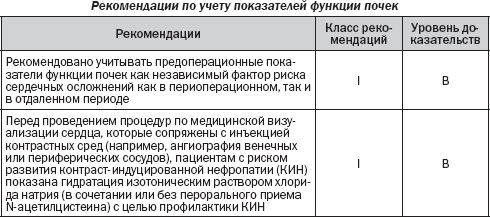
Традиционно функция почек оценивается по концентрации сывороточного креатинина. Например, пороговое значение уровня креатинина более 2,0 мг/дл (177 ммоль/л) используется в индексе Lee. Тем не менее клиренс креатинина (мл/мин) в комплексе с сывороточным креатинином, возрастом, весом обеспечивает более точную оценку функции почек, чем уровень креатинина отдельно. Чаще всего используется формула Cockcroft — Gault: (140 – возраст в годах) ´ (вес в кг) / (72 ´ сывороточный креатинин в мг/дл) ´ (0,85 для женщин). Оценка 852 субъектов, подвергнутых массивным сосудистым операциям, продемонстрировала рост смертности, когда уровень креатинина был более 2,0 мг/дл с OR для периоперационной смертности 5,2, 95% CI 2,9–10,8. Тем не менее можно утверждать, что пациенты с менее выраженной почечной недостаточностью также имеют худшие последствия по сравнению с пациентами с нормальным значением креатинина в сыворотке крови. Снижение клиренса креатинина на 10 мл/мин было связано с 40% увеличением риска послеоперационной смертности (OR 1,4, 95% CI 1,2–1,5; область ROC: 0,70, 95% CI 0,63–0,76). Анализ ROC-кривой показал, что пороговое значение клиренса креатинина 64 мл/мин дает наибольшую чувствительность/специфичность для прогнозирования послеоперационной смертности.
В дополнение к предоперационной функции почек ухудшение функции после операции — это прогностический фактор поздних неблагоприятных исходов. У 1324 пациентов, перенесших плановую открытую операцию по поводу AAA, клиренс креатинина измеряли до операции и на 1, 2 и 3-й день после операции. Пациенты были разделены на три группы в соответствии с изменением функции почек после операции по сравнению с базовыми показателями. В 1-й группе было отмечено улучшение или изменения не были зафиксированы (изменение клиренса креатинина ±10 % функции по сравнению с базовым значением); во 2-й группе — временное ухудшение (ухудшение > 10 % в 1-й или 2-й день, затем полное восстановление в пределах 10 % от базового на 3-й день), в 3-й группе отмечалось постоянное ухудшение (снижение по сравнению с исходным уровнем > 10 %). Смертность в течение 30 дней после операции составила 1,3; 5,0 и 12,6 % в группах 1, 2 и 3 соответственно. С поправкой на базовые характеристики и послеоперационные осложнения 30-дневная смертность была самой высокой у пациентов с постоянным ухудшением функции почек (HR 7,3, 95% CI 2,7–19,8), за которыми следуют пациенты с временным ухудшением (HR 3,7, 95% CI 1,4–9,9). В течение 6,0 ± 3,4 года последующего наблюдения 348 пациентов (36,5 %) умерли. Риск поздней смертности составил 1,7 (95% CI 1,3–2,3) в группе со стойким ухудшением, затем шла группа с временным ухудшением (HR 1,5, 95% CI 1,–1,4). Это исследование показало, что, хотя почечная функция может полностью восстановиться после хирургии аорты, временное ухудшение функции почек было связано с увеличением долгосрочной смертности.
Идентификация пациентов, у которых может возникнуть периоперационное ухудшение функции почек, является важной, чтобы инициировать меры поддержки, такие как поддержание адекватного внутрисосудистого объема для почечной перфузии и использования вазопрессоров. В большом ретроспективном исследовании были оценены факторы риска послеоперационной острой почечной недостаточности в течение первых 7 дней после массивного внесердечного вмешательства у больных с ранее нормальной функцией почек. Смертность от всех причин через 30 дней, 60 дней и через 1 год была также оценена. В общей сложности были рассмотрены 65 043 случая на протяжении 2003 и 2006 годов. Из них 15 102 больных отвечали критериям включения; у 121 пациента развилась острая почечная недостаточность (0,8 %), 14 была необходима замена почки (0,1 %). Было выявлено семь независимых дооперационных предикторов (Р < 0,05): возраст, экстренность хирургии, заболевание печени, высокий индекс массы тела, высокий риск операции, облитерирующее заболевание периферических артерий и ХОБЛ, требующая постоянной терапии бронходилататорами.
Контраст-индуцированная нефропатия, вызванная почечной гипоперфузией и прямой тубулярной токсичностью, возникает более чем у 15 % больных с хронической почечной дисфункцией, подвергающихся рентгенологическим процедурам. От 0,5 до 12 % этих пациентов требуются гемодиализ и длительная госпитализация. Значительное число пациентов испытывают ухудшение функции почек, возможно, прогрессирующее до конечной стадии почечной недостаточности. Краеугольным камнем предупреждения являются перипроцедурная гидратация и антиоксидантные препараты. Недавно в трех рандомизированных исследованиях было проведено сравнение эффективности лечения бикарбонатом натрия и использования введения физиологического раствора в организме человека, что привело к впечатляющему сокращению контрастной нефропатии в группе бикарбоната натрия с частотой менее 2 %. Эти результаты были недавно оцененены в адекватно проведенном рандомизированном исследовании, где сравнивали эффективность гидратации натрия бикарбонатом и физиологического раствора в дополнение к приему N-ацетилцистеина per os для профилактики контраст-индуцированной нефропатии в популяции больных с хронической почечной дисфункцией, подвергшихся плановой коронарной ангиографии или оперативному вмешательству. В общей сложности 502 больных с клиренсом креатинина менее
60 мл/мин были рандомизированы для инфузии физиологического раствора (0,9% NaCl) или бикарбоната натрия до и после введения контрастного вещества сверх N-ацетилцистеина per os (600 мг два раза в день). Лечение физиологическим раствором заключалось во введении 0,9% раствора натрия хлорида 1 мл/кг/ч в течение 12 ч до и после процедуры, а лечение бикарбонатом натрия (154 мг-экв/л в декстрозе и воде) — во введении
3 мл/кг за 1 ч до контрастного вещества, а затем во введении 1 мл/кг/ч в течение 6 ч после процедуры. Контраст-индуцированная нефропатия определялась как абсолютное увеличение сывороточного креатинина
≥ 0,5 мг/дл, измеренного в течение 5 дней после введения контрастного вещества. Не было отмечено разницы между этими двумя группами исследования; контраст-индуцированная нефропатия возникла у 54 больных
(10,8 %); 25 (10 %) лечились бикарбонатом натрия и 29 (11,5 %) — физиологическим раствором (Р = 0,60). Таким образом, гидратация с бикарбоната натрием плюс оральный
N-ацетилцистеин перед контрастным воздействием не была более эффективной, чем при гидратации с изотоническим раствором натрия хлорида плюс оральный N-ацетилцистеин для профилактики контраст-индуцированной нефропатии у больных с умеренной почечной дисфункцией. Расхождения между рандомизированными исследованиями могут быть объяснены различиями сопутствующего использования N-ацетилцистеина, применения контрастного вещества или базовой почечной дисфункции среди рандомизированных пациентов. На проведение премедикации бикарбонатом натрия требуется только 1 час, это может быть вариантом лечения у больных, у которых запланированы срочное введение препаратов или амбулаторные процедуры.
4.6. Цереброваскулярная патология
Цереброваскулярные заболевания являются третьей по значимости причиной смерти в западных странах (около 500 ТИА и 2400 новых инсультов на миллион жителей). Одна треть новых пациентов, перенесших инсульт, умирают в течение 1 года, а менее 50 % полностью выздоравливают и восстанавливают функциональность. Все большее число пожилых пациентов обращаются к внесердечной хирургии, в том числе с сопутствующими сосудистыми заболеваниями, влияющими на мозговое кровообращение. Факторами риска для периоперационных симптоматических или бессимптомных преходящих, или постоянных цереброваскулярных осложнений (ТИА/инсульт) являются эмболия или гемодинамические нарушения в крупных (аорте, сонных, позвоночных и основных внутримозговых артериях головного мозга) или малых сосудах (перфорирующих и пенетрирующих артериолах и капиллярах). Хотя частота фатального и нефатального инсульта может быть значительно снижена у симптомных больных с умеренным/тяжелым стенозом, связанным с односторонними симптомами, в частности, если начать лечение на ранней стадии (через 2–4 недели, но по крайней мере в течение 3–6 месяцев после появления симптомов), преимущество такого интервенционного/хирургического лечения невелико у неврологически бессимптомных пациентов. Таким образом, меры медицинского характера по предотвращению инсульта имеют первостепенное значение и включают многогранную стратегию, направленную на контроль за гипертензией, гиперлипидемией, сахарным диабетом и т.д. Польза специфических антитромбоцитарных агентов или антикоагулянтов была продемонстрирована во многих рандомизированных клинических исследованиях по первичной и вторичной профилактике и может быть даже увеличена у пожилых пациентов, подвергающихся внесердечным оперативным вмешательствам и анестезии.

Наряду с инсультом и ТИА могут возникнуть преходящие или постоянные изменения психического статуса, которые характеризуются нарушениями внимания, ориентации, памяти, иллюзиями, галлюцинациями, афазией и т.д. (ключевые диагностические признаки делирия), включая беспокойство и депрессию, которые часто недооцениваются или ошибочно диагностируются. Они могут быть вызваны медикаментами, самой операцией, интраоперационной гипо- или гипертензией, а также церебральной микроэмболией, вызывая множественную окклюзию малых сосудов и ишемию, о чем свидетельствует транскраниальная допплерография и МРТ-визуализация. В сердечной хирургии психические изменения являются частыми и могут быть связаны с преходящей, а иногда даже постоянной когнитивной дисфункцией (25–30 %). Очень вероятно, что они также встречаются у пожилых пациентов высокого риска, подвергающихся несердечной хирургии.
Современные концепции периоперационных инсультов можно суммировать в трех основных обзорах, которые сравнивают заболеваемость инсультом при различных хирургических процедурах (0,08–0,07 % — в общей хирургии, 1–5 % — в хирургии периферических и сонных артерий, 2–10 % — в сердечной хирургии). Вопреки общепринятому мнению большинство инсультов не связаны с гипоперфузией, но происходят в основном при интактной церебральной ауторегуляции. Ишемический и эмболический механизмы встречаются гораздо чаще, чем гемодинамический. Отсроченный инсульт в основном связан с различными источниками сердечной эмболии, а затем с повышенной свертываемостью крови и увеличением риска тромбогенных осложнений. Многие инсульты остаются недиагностированными из-за отсутствия основных сенсорно-моторных проявлений или наличия лишь небольших нейропсихологических нарушений, которые труднее выявить. Несколько относящихся к пациентам и процедурам факторов связаны с повышенным риском периоперационного инсульта — они должны быть тщательно рассмотрены для оценки индивидуального соотношения риска/пользы и оптимизации помощи, включая соответствующие изменения риска и сроков проведения операции. Недавние инсульт или ТИА в анамнезе являются решающим предиктором периоперационного инсульта и должны быть выявлены после сбора анамнеза и определения неврологического статуса каждого пациента. В таких случаях, если есть сомнения, рекомендуется дополнительная визуализация мозга и сосудов. У пациентов с поражением и сонных артерий, и сердца смертность от сердечных причин превышает риск инсульта; обзор литературы с 1970 по 2000 год показал, что пациенты со значительным бессимптомным стенозом подвергаются высокому риску фатальных и нефатальных сердечных осложнений (8 % в год), но не инсульта (1–2 % в год).
Однако в целом периоперационный риск инсульта повышен. Существуют не основанные на фактических данных рекомендации лечения каротидного стеноза до внесердечной операции, но есть и исключительные случаи лечения до кардиохирургической операции.
Прекращение назначения варфарина или антитромбоцитарных препаратов в ожидании операции подвергает пациентов повышенному риску периоперационного инсульта. Обзор периоперационных исходов у пациентов, нуждающихся в варфарине, выявил 0,6 % тромбоэмболий у тех, кто продолжал терапию, против 7,0 % у пациентов, получавших гепарин в/в как переходное лечение. Вопрос о том, возникает ли это из-за недостаточных контроля и дозировки гепарина, остается неопределенным. При замене коленного или тазобедренного сустава дальнейшее использование умеренных доз варфарина в периоперационном периоде было безопасным и эффективным и сходно с таковым у больных при стоматологических процедурах, хирургии катаракты, а также при диагностической эндоскопии, без прерывания режима приема антитромбоцитарных агентов или пероральных антикоагулянтов. Длительные операции связаны с повышенным риском периоперационного инсульта; выбор хирургической техники также важен, а типы анестезии и выбор анестезиологических препаратов требуют дополнительного рассмотрения. Индивидуальный выбор оптимального уровня АД во время операции и после нее, а также поддержание температуры тела пациента и контроль содержания глюкозы в крови, как считается, снижают частоту случаев инсульта и смерти. Полезно пред-, интра- и послеоперационное использование антитромбоцитарных агентов. Полезность так называемых нейропротекторных агентов является предметом спора.
4.7. Заболевания легких
Наличие болезней легких у пациентов, которые подлежат внесердечным хирургическим вмешательствам, может увеличить риск операции. К таким заболеваниям относятся острые респираторные инфекции, ХОБЛ, астма, кистозный фиброз, интерстициальная болезнь легких и другие состояния, вызывающие нарушения дыхательной функции. Предсуществующая легочная болезнь оказывает значительное влияние на периоперационный риск, но наиболее распространенным эффектом является повышение риска послеоперационных легочных осложнений. Эти осложнения в основном являются следствием развития ателектаза во время общей анестезии. Послеоперационное поверхностное дыхание, снижение легочной подвижности и другие факторы могут вести к сохранению коллапса легкого и содействовать респираторной инфекции. Эти осложнения возникают особенно после брюшной или грудной хирургии, считается, что риск повышен у курильщиков. Специфический периоперационный менеджмент необходим для снижения риска легочных осложнений. Есть некоторые респираторные состояния, которые связаны с сердечно-сосудистыми нарушениями и могут потребовать специальной сердечной оценки риска и тактики ведения в дополнение к менеджменту легочных осложнений как таковых. Два таких состояния — это ХОБЛ и легочная артериальная гипертензия (ЛАГ).
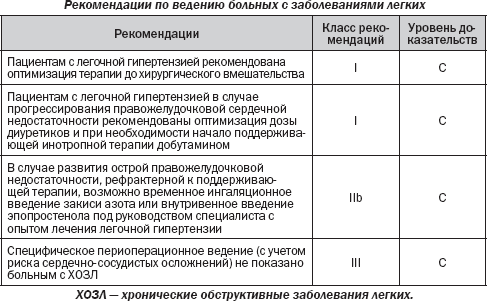
ХОБЛ, которая определяется как обструкция дыхательных путей, которая не полностью обратима, широко признана в качестве одной из основных причин заболеваемости и смертности. Распространенность ХОБЛ среди взрослых в Европе варьирует от 5 до 10 %, причем этот показатель выше у мужчин, чем у женщин. Таким образом, у одного из 10 пациентов с несердечным хирургическим вмешательством может быть ХОБЛ.
Легочное сердце с правожелудочковой сердечной недостаточностью является прямым серьезным осложнением ХОБЛ. Однако ХОБЛ также связана с повышенным риском развития ИБС. В систематическом обзоре 12 исследований популяционных когорт те пациенты, у которых был уменьшен объем форсированного выдоха за 1 с (ОФВ1) имели 75% риск сердечно-сосудистой смертности по сравнению с теми, у кого ОФВ1 был в норме.
Уменьшенный объем выдоха был также связан с более высокой заболеваемостью нефатальной ИБС и инсультом, каротидным стенозом, с низким лодыжечно-плечевым индексом и поражениями белого вещества мозга. Эти ассоциации возникают и у мужчин, и женщин и, несмотря на тесную взаимосвязь курения с ХОБЛ и сердечно-сосудистыми заболеваниями, не зависят от традиционных сердечно-сосудистых факторов риска.
При каждом 10% снижении ОФВ1 сердечно-сосудистая смертность увеличивается на 30 %, а нефатальные коронарные осложнения — на 20 %.
У пациентов, подвергающихся операции по поводу аневризмы аорты, были выявлены противоречивые результаты относительно краткосрочной смертности (часто из-за сердечных осложнений). Например, ХОБЛ была связана с оперативной смертью, но не с 30-дневной смертностью. У пациентов сосудистой хирургии в целом ХОБЛ не была связана с повышением 30-дневной смертности. Таким образом, несмотря на ассоциацию с ССЗ, не существует убедительных доказательств того, что ХОБЛ связана с повышенным риском сердечных периоперационных осложнений.
ЛАГ может быть идиопатической, семейной, связанной с врожденным пороком сердца или с конкретными состояниями, такими как коллагеновое сосудистое заболевание. Следует отличать от других причин ЛАГ в связи с ХОБЛ тромбоэмболию и врожденные заболевания. Диагноз устанавливается на основе среднего значения артериального легочного давления
ЛАГ учащает хирургические осложнения, особенно правожелудочковую недостаточность, ишемию миокарда и послеоперационную гипоксию. У больных после кардиопульмонального шунтирования среднее предоперационное артериальное давление более
Предсуществующая ХОБЛ часто рассматривается с точки зрения риска послеоперационных легочных осложнений. Отсутствуют убедительные доказательства того, что ХОБЛ увеличивает периоперационный сердечный риск, поскольку у больных с ХОБЛ дополнительная помощь оказывалась в процессе лечения кардиальной патологии, тем самым отрицая какую-либо связь. Тем не менее ХОБЛ не была включена в индексы предоперационного сердечного риска (Goldman, Detsky, Lee) и, по сути, никакого улучшения прогностического значения индекса Lee не было найдено у пациентов, которые подвергались операции на сосудах, когда включали ХОБЛ. С другой стороны, ЛАГ — это настолько редкое состояние, что ее включение в комплексную модель риска не рассматривалось.
У пациентов с болезнями легких, подвергающихся внесердечным хирургическим вмешательствам, целью предоперационного лечения должна быть оптимизация функции легких и минимизация дыхательных осложнений. Что касается ХОБЛ, то цели лечения будут включать: устранение активной инфекции антибиотиками; минимизацию хрипов, связанных с любым обратимым заболеванием, при помощи бронхолитиков или стероидов; облегчение право- и левожелудочковой недостаточности диуретиками; обеспечение адекватной оксигенации, и, наконец, рекомендацию прекратить курение до операции. Что касается периоперационного ведения кардиальной патологии, то у пациентов с ХОБЛ оно должно быть таким же, как и у пациентов без ХОБЛ, в частности, не существует никаких особых противопоказаний к использованию кардиоселективных b-блокаторов и статинов у больных с ХОБЛ.
ЛАГ является неизлечимым заболеванием, и цель ее ведения состоит в уменьшении симптомов, а также в укреплении нагрузочного потенциала и функции правого желудочка. Анестезия и хирургия могут осложняться острой правожелудочковой сердечной недостаточностью в связи с увеличением легочного сосудистого сопротивления, связанного с нарушением вентиляции легких, характерного для операционного и послеоперационного состояния в грудной и абдоминальной хирургии. Специфическая лекарственная терапия ЛАГ включает блокаторы кальциевых каналов (только для некоторых пациентов, которые реагируют на острый вазореактивный тест), простаноиды, антагонисты рецепторов эндотелина и ингибиторы фосфодиэстеразы-5. В идеале у пациентов с ЛАГ должен быть создан оптимизированный режим лечения перед любым хирургическим вмешательством. Рекомендовано также, чтобы специфическую для ЛАГ лекарственную терапию не отменяли на более чем 12 ч, что связано с периоперационным состоянием голодания. В случае прогрессирования правожелудочковой сердечной недостаточности в послеоперационном периоде рекомендуется оптимизировать дозу диуретика и, если необходимо, включить инотропную поддержку добутамином. Необходимость назначения специфической лекарственной терапии ЛАГ в периоперационном периоде не установлена. В случае тяжелой правожелудочковой сердечной недостаточности, не реагирующей на поддерживающую терапию, могут быть показаны временное назначение ингаляции окиси азота или в/в введение эпопростенола в соответствии с указаниями врача, имеющего опыт в лечении ЛАГ. В этом случае требуется постепенная отмена данных препаратов.
У больных с ХОБЛ и ЛАГ относительно высокая частота возникновения сердечной недостаточности и ИБС. Не существует свидетельств того, что у больных с ХОБЛ более высокий риск сердечных периоперационных осложнений и смерти, то есть их можно вести так же, как и больных без ХОБЛ. С другой стороны, ЛАГ увеличивает периоперационный риск и требует предоперационной оценки и в тяжелых случаях периоперационного лечения.
5.1. Электрокардиография
Хотя даже одна послеоперационная ЭКГ, демонстрирующая ишемию в восстановительном периоде, является предиктором серьезных сердечных осложнений позднее во время пребывания в стационаре, мониторинг ЭКГ сам по себе не является достаточным для выявления ишемии в реальном времени в отделении интенсивной терапии (ОИТ) и в операционной. В частности, обычный визуальный мониторинг ЭКГ для обнаружения преходящих изменений сегмента ST неточен. Хотя отведение V5 известно как лучший выбор для обнаружения интраоперационной ишемии в течение многих лет, в одном исследовании обнаружено, что отведение V4 является более чувствительным и уместным, чем V5 для обнаружения длительной послеоперационной ишемии миокарда. Отведения не специфичны для ишемических изменений, кроме того, эти изменения динамичны и не всегда могут появляться в одном и том же отведении. Если одно отведение используется для мониторинга, существует повышенный риск пропустить ишемические изменения. С помощью выбранной комбинации отведений больше ишемических изменений можно точно диагностировать в интраоперационной обстановке. В одном исследовании, несмотря на то что лучшая чувствительность была получена в отведении V5 (75 %), а затем в отведении V4 (61 %), использование комбинации V4 и V5 увеличивает чувствительность до 90 %. В том же исследовании, когда три отведения (II, V4 и V5) были использованы одновременно, чувствительность возросла до 96 %. Аналогично в другом исследовании, в котором были использованы два и более прекордиальных отведения, чувствительность мониторинга ЭКГ была более 95 % при обнаружении периоперационной ишемии и инфаркта. Было также показано, что мониторинг ЭКГ с меньшим количеством отведений (всего трех) имел чувствительность ниже, чем мониторинг в 12 отведениях, и была выявлена статистически значимая связь независимо от значений периоперационного тропонина между периоперационной ишемией на ЭКГ в 12 отведениях и долгосрочной смертностью. Таким образом, мониторинг ЭКГ в 12 отведениях особенно рекомендуется пациентам высокого риска.
Было показано, что мониторинг ST-сегмента имеет ограниченные возможности у пациентов с дефектами внутрижелудочковой проводимости (например, блокадой левой ножки пучка Гиса) и желудочковым ритмом. Вторичные изменения сегмента ST-T, которые были у этих больных, возникали вследствие патологической деполяризации, которая также искажала процесс реполяризации. Искаженный сегмент ST может ограничить чувствительность мониторинга по ST-сегменту. Поскольку выявление изменений ST-сегмента на электрокардиограмме при визуальном осмотре затруднено, компьютеризированный анализ стал стандартом в современных мониторах. Блоки непрерывного автоматизированного трендового мониторирования ST включены в большинство новых операционных ЭКГ-мониторов для облегчения обнаружения ишемии. Такие устройства повышают ЭКГ-чувствительность обнаружения ишемии. В одном исследовании холтеровские записи были использованы в качестве эталона для определения интраоперационной ишемии; было обнаружено, что ST трендовые мониторы имеют общую чувствительность и специфичность 74 и 73 % соответственно. Несколько условий обусловливали неточность ST трендового мониторинга, поэтому дополнительные изменения их производительности были необходимы для достижения лучшего согласования с холтеровским анализом.

В ходе ряда исследований в течение последнего десятилетия наличие изменений на ЭКГ во время мониторинга в когорте высокого риска было связано с более высокой частотой периоперационных ИМ и сердечных осложнений. Кроме того, продолжительность изменений ST-сегмента положительно коррелирует с частотой периоперационных ИМ. Поэтому, когда регистрируются изменения ST-сегмента, следует считать, что ишемия миокарда присутствует. Однако неочевидно, что ЭКГ-мониторинг достаточно чувствителен для выявления пациентов низкого риска. Кроме того, польза этого теста в общей популяции ограничена, поскольку многие исследования исключили больных с данными ЭКГ, что препятствует точной оценке ишемии.
5.2. Чреспищеводная эхокардиография
Чреспищеводная эхокардиография (ЧПЭ) часто используется в качестве инструмента контроля во время кардиохирургических операций с середины 1980-х. Однако мало фактических данных поддерживают использование ЧПЭ в несердечной хирургии. ЧПЭ имеет ряд преимуществ по сравнению с альтернативными методами контроля, такими как использование катетеризации легочной артерии. Она доступна, сравнительно неинвазивна и обеспечивает более универсальную и всеобъемлющую информацию. Однако, несмотря на то что ЧПЭ в целом является безопасной процедурой, могут возникнуть серьезные осложнения. Частота осложнений зависит от опыта оператора и наличия серьезных болезней пищевода или желудка. Специальное обучение пользователей является обязательным, чтобы избежать неточных толкований.
Ишемию миокарда можно выявить по аномалиям регионарного движения и утолщения стенок. Корреляция между интраоперационной ЧПЭ и ЭКГ является довольно слабой. И изменения сегмента ST, и регионарные нарушения движения стенок могут наблюдаться при отсутствии острой ишемии. Аномалии движения стенок трудно интерпретировать при наличии блокады левой ножки пучка Гиса, желудочкового ритма, ФП или перегрузки правого желудочка.
Ишемия не всегда обнаруживается, если сопровождается оглушением миокарда. У пациентов с высоким уровнем риска, перенесших внесердечное хирургическое вмешательство, новые эпизоды нарушения движения стенки или ухудшение старых возникают сравнительно редко (20 %).Они чаще встречались у больных, подвергшихся операции на аорте. Эпизоды слабо коррелировали с послеоперационными сердечными осложнениями.
По сравнению с предоперационными клиническими данными и интраоперационным мониторингом с использованием ЭКГ в 2 отведениях рутинное мониторирование ишемии миокарда с использованием ЧПЭ или ЭКГ в 12 отведениях при несердечных хирургических вмешательствах имеет мало дополнительного клинического значения в выявлении больных с высоким риском периоперационных ишемических исходов.
ЧПЭ рекомендуется при острых, тяжелых гемодинамически нестабильных или угрожающих жизни нарушениях, развивающихся в ходе или после операции. Основным преимуществом ЧПЭ над катетеризацией легочной артерии является комплексная оценка структуры и функции сердца. Доступна информация о региональной или глобальной, право- и/или левожелудочковой дисфункции, наличии тампонады или сердечных тромбов, и возможна предварительная оценка преднагрузки путем определения конечного диастолического объема. Были предложены многочисленные показатели желудочковой и предсердной функции. Однако большинство параметров зависят от нагрузки.
Роль ЧПЭ для гемодинамического мониторинга пациентов с риском является более спорной. Системы автоматизированного анализа существуют, но пока еще их применение недостаточно обосновано. Не существует никаких доказательств, что гемодинамический мониторинг по ЧПЭ точно стратифицирует риск или предсказывает исход.
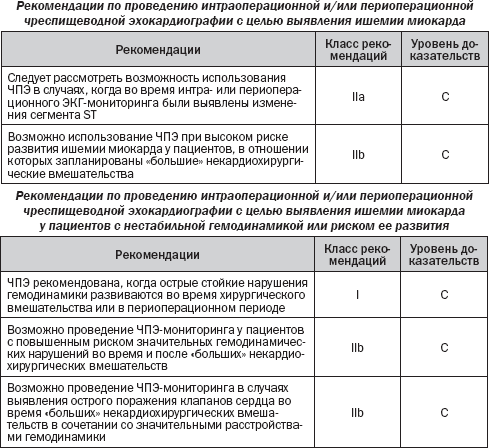
ЧПЭ может быть полезна в операционной у больных с тяжелыми поражениями клапанов. Условия нагрузки во время общей анестезии отличаются от таковых при предоперационной оценке. Функциональная и ишемическая регургитация митрального клапана, как правило, снижается под общим наркозом. Органическая регургитация митрального клапана, наоборот, может увеличиваться. При тяжелой регургитации митрального клапана фракция выброса ЛЖ, изменяет оценку функции ЛЖ и другие параметры могут быть более точными, такие как скорость миокарда или деформация, полученные при тканевой допплеровской визуализации или при 2D-слежении угол-независимым методом. Эти методы перспективны, но необходима проверка, прежде чем они могут быть использованы на регулярной основе. У пациентов с тяжелым аортальным стенозом должная преднагрузка важна во время операции. Мониторинг конечного диастолического объема ЛЖ может быть более точным, чем мониторинг легочного капиллярного давления. Соответствующая ЧСС имеет решающее значение для больных с митральным стенозом и аортальной регургитацией: длинный период диастолы в первом случае и уменьшение продолжительности диастолы — в последнем. При несоответствующем контроле ЧСС должны быть оценены последствия: изменения среднего трансмитрального градиента и давления в легочной артерии при митральном стенозе и изменений в объемах ЛЖ и показателях функции ЛЖ при аортальной регургитации.
5.3. Катетеризация правых отделов сердца
Большинство послеоперационных ишемических эпизодов бессимптомны и не сопровождаются изменениями легочного капиллярного давления заклинивания. Правожелудочковая сердечная катетеризация не рекомендуется для мониторирования пациентов с интраоперационной ишемией. Действительно, и большое обсервационное исследование, и рандомизированное многоцентровое клиническое иссследование не показали преимущества использования правожелудочковой катетеризации после массивной внесердечной операции. Анализ «случай — контроль» был проведен в подгруппе пациентов из обсервационного исследования, которые подверглись катетеризации легочной артерии и были сопоставлены с аналогичным количеством пациентов, которые не подвергались правожелудочковой катетеризации. Пациенты были распределены по группам для хирургической процедуры и для катетеризации. Более высокая частота послеоперационной сердечной недостаточности и внесердечных осложнений отмечалась в группе катетеризации.
В рандомизированном исследовании не было обнаружено никаких различий в показателях смертности и продолжительности госпитализации, но у пациентов, которым предстояла правожелудочковая катетеризация, частота случаев эмболии легочной артерии была выше.
5.4. Нарушение метаболизма глюкозы
Сахарный диабет является важным фактором риска развития периоперационных сердечных осложнений и смерти. Это состояние приводит к развитию атеросклероза, эндотелиальной дисфункции, активации тромбоцитов и провоспалительных цитокинов. Хирургический стресс связан с гемодинамическим стрессом и вазоспазмом и еще больше повышает протромботический статус, ингибируя фибринолиз. Это может привести к нестабильности уже существующих коронарных бляшек, тромбов, сосудистых окклюзий и к ИМ. Кроме того, гипергликемия при отсутствии установленного диабета играет важную роль, подчеркивая необходимость предоперационного лечения гипергликемии, когда это возможно. Об этом свидетельствуют исследования на пациентах с преддиабетическим уровнем глюкозы, которые подвергаются внесердечным или несосудистым хирургическим вмешательствам, показывая приблизительно 2–4-кратное увеличение риска ишемии миокарда, высвобождения тропонина, 30-дневных и долгосрочных сердечных осложнений и риска смерти или сердечно-сосудистой смертности в частности.
Важно отметить, что нарушение толерантности к глюкозе часто выявляется лишь после нагрузки глюкозой. Гипергликемия в стрессовых условиях — это другое состояние, которое характеризуется нарушенным гомеостазом глюкозы (стресс-диабет или диабет повреждения), которое развивается независимо от ранее диагностированного диабета и неоднократно было определено как важный фактор риска заболеваемости и/или смертности.
Данные Международного фонда диабета свидетельствуют о высокой и растущей распространенности диабета в Европе (увеличилась с 7,8 % в 2003 году до 8,4 % в 2007 году, прогнозируемая распространенность в 2025 году — как минимум 9,1 %). Более 30 % случаев не были ранее диагностированы, что указывает на недооценку проблемы. С 48 миллионами больных сахарный диабет стал одной из основных причин заболеваемости и смертности в Европе. По данным Всемирной организации здравоохранения, 50 % этих больных умирают от ССЗ. Было также установлено, что хирургическое лечение у больных с сахарным диабетом связано с большей продолжительностью госпитализации, большим использованием ресурсов здравоохранения и большей периоперационной смертностью. В последнее время акцент сместился с диабета на гипергликемию саму по себе. Вновь начавшаяся гипергликемия по сравнению с гипергликемией у подтвержденных больных сахарным диабетом может иметь гораздо более высокий риск неблагоприятного исхода.
Фактические данные в пользу строгого контроля уровня глюкозы крови у больных без диабета, которые подвергаются внесердечным хирургическим вмешательствам, в основном получены в результате исследований больных в критическом состоянии. В 2001 году проспективное рандомизированное контролируемое исследование Leuven продемонстрировало значительные клинические преимущества у хирургических больных в ОИТ, у которых уровень глюкозы в крови были сохранен в пределах нормы (5,0–5,6 ммоль/л; 90–100 мг/дл) при интенсивной терапии инсулином по сравнению с пациентами, у которых проводили обычное снижение уровня глюкозы и развилась гипергликемия (8,3–8,9 ммоль/л; 150– 160 мг/дл). Эти преимущества включают низкий уровень смертности в ОИТ, а также госпитальной смертности и предотвращение ряда критических, связанных с заболеванием осложнений (тяжелая полинейропатия, тяжелые инфекции, острая почечная недостаточность и длительная зависимость от искусственной вентиляции легких и интенсивной терапии). Кроме того, долгосрочные результаты улучшились, как показано в подгруппе сердечной хирургии. Пять лет спустя в группе Leuven были продемонстрированы результаты из ОИТ, указывая на профилактику заболеваемости, но не было положительного влияния на смертность при интенсивном контроле глюкозы, кроме подгруппы, требующей интенсивной терапии в течение ≥ 3 дней. На основании этих двух исследований были сделаны рекомендации, направленные на жесткий контроль глюкозы. Несколько обзорных исследований по осуществлению жесткого контроля глюкозы или малых рандомизированных исследований в отдельных группах пациентов ОИТ поддерживают клинические преимущества из исследования Leuven. Объединенный анализ исследования Leuven показал снижение смертности и заболеваемости во всех основных клинико-диагностических подгруппах, включая сердечно-сосудистую, респираторную, ЖКТ/гепатологическую, подгруппы активных злокачественных опухолей и сепсиса при поступлении в ОИТ. Пациенты с подтвержденным диабетом, как правило, имеют меньшую заболеваемость, но данные о преимуществе выживания отсутствуют. Все описанные выше исследования начались с контроля уровня глюкозы после поступления в ОИТ. Сроки начала инсулинотерапии являются спорными, но последнее исследование в ОИТ показало лучший результат, когда она была начата в течение первых 48 ч, чем в сроки после 48 ч. Строгий интраоперационный контроль уровня глюкозы может обеспечить дополнительные преимущества, но до сих пор выводы исследований в основном были даны для кардиохирургии. Умеренный интраоперационной гликемический контроль во время АКШ (не продолженный в ОИТ) привел к необходимости снижения частоты проведения кардиостимуляции, частоты возникновения ФП и инфекций, сокращения сроков пребывания в ОИТ и в стационаре, снижения частоты повторных ишемических осложнений в долгосрочной перспективе. В отличие от этого осуществление контроля гликемии во время кардиального оперативного вмешательства, сочетаемое с послеоперационном гликемическим контролем в ОИТ, не способствует уменьшению периоперационной смертности или заболеваемости. По данным обзорного исследования, более строгий контроль уровня глюкозы во время трансплантации печени был связан с более низким уровнем инфицирования и смертности в течение 1 года в сравнении со слабым контролем.
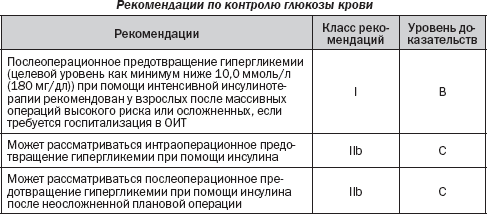
Исследования в области неотложной терапии продемонстрировали негативное воздействие гипергликемии на почечную и печеночную функцию, функцию эндотелия и иммунную реакцию, особенно у больных с неподтвержденным сахарным диабетом. В исследованиях Leuven риск смерти и степень гипергликемии положительно коррелировали. Очевидность того, что гликемический контроль, а не прямые эффекты инсулина опосредовано связан с выживаемостью и снижением заболеваемости при инсулинотерапии, была подтверждена при моделировании критических состояний на кроликах. Несколько факторов риска развития сердечных осложнений после несердечных хирургических вмешательств теряют актуальность при строгом контроле содержания глюкозы в крови в отделениях интенсивной терапии, в том числе повреждение/дисфункция эндотелия, повышение уровня СРБ и асимметричного диметиларгинина, помимо воздействия на митохондриальное повреждение, липидный профиль сыворотки и реакцию кортизола. Не зарегистрировано никакого воздействия (или оно было незначительным) на цитокины, коагуляцию и фибринолиз.
В последнее время рассматривались благоприятные исходы исследования Leuven с помощью жесткого контроля глюкозы. В исследовании NICE-SUGAR более 6000 пациентов (63 % из терапевтического ОИТ и 37 % — из хирургического) были рандомизированы либо для жесткого контроля глюкозы (целевой уровень глюкозы 4,5–6,0 ммоль/л; 81–108 мг/дл), либо для обычного контроля глюкозы (целевой уровень глюкозы 8,0–
10,0 ммоль/л; 144–180 мг/дл). Пациенты были рандомизированы для лечения в течение 24 ч после в/в инфузии инсулина для контроля глюкозы. Частота первичной конечной точки (смерть через 90 дней после рандомизации) была выше при интенсивном контроле глюкозы (27,5 %) по сравнению с обычным контролем (24,9 %). Не было отмечено отличий в заболеваемости между двумя группами исследования, следовательно, и высокая смертность остается необъясненной. Как ожидалось, гипогликемия (40 мг/дл) имела место у большего числа больных в интенсивной контрольной группе, чем в обычной контрольной группе (6,8 против 0,5 %, Р < 0,001). Исследование NICE-SUGAR было крупным многоцентровым, с использованием протокола инфузии инсулина, определяемого компьютером. Однако этот протокол использовал алгоритм «если — то», базирующийся на неточных и нестандартизированных автономных глюкометрах для измерения сахара крови. Кроме того, NICE-SUGAR имел открытый дизайн, был небольшой дисбаланс между группами по отношению к кортикостероидной терапии, а 10 % пациентов, рандомизированных для интенсивного контроля глюкозы, прекратили исследование преждевременно. Различия в результатах двух исследований следует еще объяснить.
I. Исследования Leuven были выполнены в едином центре с унифицированным подходом, который включал раннее дополняющее парентеральное питание, в то время как в NICE-SUGAR преобладало энтеральное питание, что приводило к гипокалорийной диете, в частности, в течение первой недели после поступления в ОИТ.
II. Цель начала инсулинотерапии в группе стандартного лечения была иной: инсулинотерапия в исследовании Leuven начиналась только тогда, когда глюкоза крови превышала почечный порог более 215 мг/дл: этот подход позволяет рассматривать гипергликемию в качестве возможной полезной адаптации, тогда как в NICE-SUGAR целевое значение 144–180 мг/дл было использовано в стандартной группе, в результате 70 % пациентов получали инсулин и достигли среднего уровня глюкозы в крови
8,0 ммоль/л (144 мг/дл).
III. Также в основной группе в исследовании NICE-SUGAR соблюдение терапевтических предписаний было значительно хуже, чем в исследованиях Leuven. Это привело к тому, что средний уровень глюкозы был
6,6 ммоль/л (118 мг/дл), и он значительно совпадал с уровнем в контрольной группе.
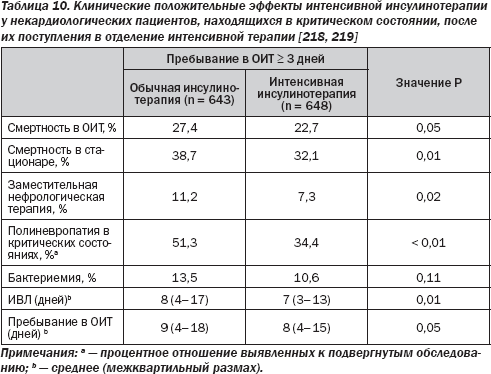
IV. Использование неточных глюкометров в исследовании NICE-SUGAR может привести к ошибочной инсулинотерапии и скрывать гипокалиемию — возможную причину повышенной сердечно-сосудистой смертности, которую можно предотвратить при использовании анализаторов газов крови для измерения глюкозы.
V. Опыт медсестер в NICE-SUGAR был значительно меньшим, чем в исследованиях Leuven, ввиду ограниченного числа набранных пациентов (менее 15 % всех пациентов наблюдались в ОИТ по сравнению с 70–95 % в исследованиях Leuven).
По результатам испытания NICE-SUGAR можно предположить, что интенсивный контроль глюкозы может повредить пациентам, поступившим в ОИТ, обращают на себя внимание показатели смертности, когда уровень глюкозы был ниже диапазона 7,8–10,0 ммоль/л (140–180 мг/дл). Однако доказательства, полученные в предыдущих исследованиях, указывают, что клинически выгодно поддерживать нормогликемию (4,4–
6,1 ммоль/л; 80–110 мг/дл) по сравнению с терпимой гипергликемией до 11,9 ммоль/л (215 мг/дл) у взрослых критически больных пациентов (табл. 10). До того как станут доступны дальнейшие данные, проясняющие причины различных результатов в различных исследованиях, рекомендовано оптимизировать поддержание уровня глюкозы в крови в отделениях интенсивной терапии, избегая крайностей — и гипергликемии, и гипогликемии. Имеющиеся данные указывают, что эта терапия должна быть начата сразу же после поступления в ОИТ. Целесообразно выбрать целевой уровень 8,0 ммоль/л (144 мг/дл) для групп пациентов, сопоставимых с исследованными в NICE-SUGAR.
Оптимальное периоперационное ведение больного зависит от тесного сотрудничества кардиологов, хирургов, пульмонологов и анестезиологов.
6.1. Ведение интраоперационной анестезии
Выбор препарата для анестезии считается малозначимым с точки зрения получения результата у пациента при условии, что жизненно важные функции поддерживаются надлежащим образом. Данные о специфических методах анестезии в клинике сердечной хирургии противоречивы, и нет доказательств преимуществ какого-либо конкретного препарата при анестезии во внесердечной хирургии.
Использование большинства анестезиологических техник позволяет снизить симпатический тонус, что способствует расширению сосудов и снижению системного артериального давления. При этом должно обеспечиваться надлежащее перфузионное давление органов.
6.2. Спинномозговая и эпидуральная анестезия
Спинномозговая и эпидуральная анестезия также вызывают симпатическую блокаду. В зависимости от высоты блокады происходит ее воздействие на симпатическую иннервацию тех или иных структур, например на периферические кровеносные сосуды, что приводит к снижению кровяного давления. При блокаде на уровне грудных дерматомов снижается симпатическая активность сердца с последующим уменьшением сократимости миокарда, ЧСС и изменением условий сердечной нагрузки. Скорость возникновения и сила симпатической блокады будут зависеть от дозировки и выбора препаратов, а также от состояния больного. Существуют противоречивые данные о влиянии блокады на исходы у пациента после несердечных хирургических вмешательств. В одном метаанализе сообщили о значительном улучшении выживаемости и снижении числа послеоперационных тромбоэмболических, кардиальных и легочных осложнений при блокаде по сравнению с общим наркозом.
Недавний анализ большой группы пациентов (10 564 пациентам не проводилась и 2253 проводилась эпидуральная анестезия), которым выполнялась резекция толстой кишки, подтвердил улучшение выживаемости при эпидуральной анестезии на 7-й и 30-й дни после операции, но не было возможности определить причину смерти. Частота равития кардиальных осложнений была одинаковой в обеих группах.
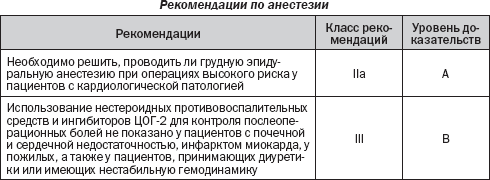
При сравнении результатов местной и общей анестезии в рандомизированных исследованиях и метаанализе нескольких рандомизированных клинических исследований у некардиохирургических пациентов не было получено убедительных доказательств улучшения исходов и снижения послеоперационной заболеваемости и смертности. Было подсчитано, что необходимое для рандомизированного клинического исследования количество пациентов, чтобы определить, как эпидуральная анестезия и аналгезия будут влиять на смертность у пациентов, подвергающихся сосудистой операции высокого риска, будет составлять 24 000, а 1,2 млн пациентам необходимо будет провести процедуры низкого кардиального риска. Таким образом, нынешние исследования недостаточно объемны для серьезного анализа риска смерти при процедурах с низким хирургическим риском. Ни в одном исследовании не продемонстрировано разницы исходов при различных методах мониторинга, стратегиях инфузионной или трансфузионной терапии. Часто подчеркивается важность квалифицированного анестезиологического ведения пациента для поддержания адекватного кровообращения.
6.3. Обезболивание в послеоперационном периоде
Послеоперационный болевой синдром является серьезной проблемой, отмеченной у 5–10 % пациентов. Наиболее эффективным представляется нейроаксиальное обезболивание локальными анестетиками/опиоидами и/или a2-агонистами, в/в опиоидами отдельно или в сочетании с нестероидными противовоспалительными препаратами. Преимущество инвазивных методов аналгезии должно быть сопоставлено с потенциальными рисками. Это имеет особое значение при рассмотрении вопроса об использовании нейроаксиальной блокады у больных с постоянной антитромботической терапией из-за увеличения возможности возникновения нейроаксиальной гематомы. Рекомендации по использованию нейроаксиальной блокады у пациентов с нарушениями коагуляции выходит за рамки данных рекомендаций.
Прием обезболивающих препаратов является альтернативой местной анестезии в послеоперационном периоде. Однако нестероидные противовоспалительные препараты и ингибиторы циклооксигеназы-2 (ЦОГ-2) могут привести к развитию сердечной и почечной недостаточности, а также тромбоэмболии, и их следует избегать у пациентов с ишемией миокарда. Ингибиторы ЦОГ-2 могут вызывать побочные эффекты со стороны желудочно-кишечного тракта и бронхоспазм. Окончательная роль этих препаратов в лечении послеоперационных болей у кардиологических пациентов, перенесших внесердечную операцию, не определена. Этих препаратов следует избегать у пациентов с почечной и сердечной недостаточностью, лиц пожилого возраста, у больных, получающих диуретики, а также у пациентов с нестабильной гемодинамикой.
На рис. 4 представлен алгоритм ступенчатого подхода к ведению пациента (кардиологическое обследование, реваскуляризация коронарных артерий и лечение заболеваний сердечно-сосудистой системы в предоперационном периоде). Для каждого шага комитет представил уровень рекомендаций и силу доказательств в сопроводительной табл. 11.
Шаг 1. Следует оценить ургентность хирургического вмешательства. В экстренных случаях конкретные факторы, связанные с пациентом или с самой операцией, не позволяют продолжать обследование и терапевтические мероприятия до проведения операции. В этих случаях консультант дает рекомендации по периоперационному лечению, контролю кардиальных осложнений и продолжению предшествующей медикаментозной терапии сердечно-сосудистой патологии.
Шаг 2. Если пациент нестабилен (табл. 12), его состояние должно быть уточнено и проведено соответствующее лечение до операции. Примерами являются нестабильные коронарные синдромы, декомпенсированная сердечная недостаточность, тяжелые аритмии или с пороками клапанов сердца с клиническими проявлениями. Вышеуказанное обычно приводит к отмене или откладыванию хирургического вмешательства. Например, пациентам с нестабильной стенокардией необходимо провести коронарную ангиографию с целью оценки терапевтических возможностей. Варианты лечения должны быть обсуждены на междисциплинарном консилиуме с участием всех специалистов, потому что вмешательство может влиять на анестезиологическую и хирургическую помощь. Например, начало двойной антитромбоцитарной терапии после стентирования коронарной артерии может осложнить проведение местной анестезии или конкретных хирургических процедур. В зависимости от результатов этого обсуждения пациенты могут быть направлены на операцию на коронарных артериях (АКШ, баллонная ангиопластика или стентирование) под прикрытием двойной антитромбоцитарной терапии, если показанная хирургическая процедура может быть отложена, либо на операцию без проведения сопутствующей двойной антитромбоцитарной терапии, если хирургическое вмешательство необходимо проводить по жизненным показаниям.
Шаг 3. Определить риск хирургических процедур (табл. 4). Если предполагаемый 30-дневный кардиологический риск данной процедуры у пациентов со стабильным состоянием сердечно-сосудистой системы низкий — менее 1 %, то маловероятно, что результаты обследования изменят тактику ведения, и было бы целесообразно приступить к запланированной хирургической операции. Консультант может определить факторы риска и предоставить рекомендации относительно образа жизни и медикаментозного лечения в соответствии с рекомендациями ESC по послеоперационному уходу для улучшения долгосрочных результатов.
Шаг 4. Изучить функциональные возможности пациента. Если бессимптомный или сердечно стабильный пациент имеет умеренный или хороший функциональный потенциал более 4 MЭT, периоперационное ведение пациента вряд ли может быть изменено на основании результатов тестов независимо от планируемого хирургического вмешательства. Даже при наличии клинических факторов риска целесообразно направить пациента на операцию. У больных с ИБС или с факторами риска терапия статинами и режим титрования низких доз b-блокатора могут быть начаты до операции (табл. 11).
Шаг 5. Рекомендуется продолжить терапию аспирином. Возможность прекращения аспирина следует рассматривать только у тех пациентов, у которых трудно контролировать гемостаз во время операции.
Шаг 6. У пациентов с умеренным или низким функциональным потенциалом определяют риск хирургического вмешательства следующим образом (табл. 4). Пациенты, у которых запланировано проведение хирургического вмешательства промежуточного риска, могут быть направлены на операцию; до операции целесообразно назначение статинов и режим титрования низких доз b-блокатора. У пациентов с систолической дисфункцией ЛЖ, определяемой по снижению фракции выброса менее 40 %, ингибиторы АПФ (или БРА у пациентов с непереносимостью ингибиторов АПФ), рекомендуется перед операцией. У пациентов с одним или более клиническими факторами риска предоперационная ЭКГ является обязательной для наблюдения за изменениями во время периоперационного периода. У пациентов, у которых запланированы операции с высокой степенью риска (табл. 4), отмечены клинические факторы риска (табл. 13). У пациентов с 1–2 клиническими факторами риска перед операцией рекомендуется терапия статинами и режим титрования низких доз b-блокатора. У пациентов с систолической дисфункцией ЛЖ, при фракции выброса 40 %, рекомендуется назначение ингибиторов АПФ (или БРА у пациентов с непереносимостью ингибиторов АПФ). Следует рассматривать возможность неинвазивного обследования у пациентов с 3 клиническими факторами риска (табл. 13). Неинвазивное обследование также может быть рассмотрено до начала любой хирургической процедуры с целью консультирования пациентов или изменения периоперационного ведения пациента в зависимости от типа операции и техники анестезии.

Шаг 7. Интерпретация результатов неинвазивного стресс-тестирования.

Пациенты без стресс-индуцированной ишемии или с ишемией от легкой до умеренной степени (подозревается одно-двухсосудистое поражение) могут быть направлены на плановое оперативное вмешательство. Рекомендуется начать терапию статинами и проводить режим титрования низких доз b-блокатора. У пациентов с обширной стресс-индуцированной ишемией должна быть индивидуальная программа периоперационного ведения с учетом потенциальной пользы от предлагаемого хирургического вмешательства по сравнению с прогнозируемыми неблагоприятными исходами. Кроме того, эффект от медикаментозной терапии и/или коронарной реваскуляризации должен оцениваться не только для немедленных послеоперационных исходов, но и для долгосрочного наблюдения. У пациентов, направленных на чрескожное вмешательство на коронарной артерии, начало и продолжительность антитромбоцитарной терапии будут менять планы проведения хирургических процедур. У больных, направленных на ангиопластику, несердечное вмешательство может быть выполнено в течение 2 недель после ангиопластики с продолжением лечения аспирином. У пациентов с металлическими стентами внесердечная операция может быть выполнена в срок от 6 недель до 3 месяцев после вмешательства. Двойная антитромбоцитарная терапия должна быть продолжена в течение по крайней мере 6 недель, но предпочтительно на срок до 3 месяцев. После указанного периода по крайней мере должно быть продолжено лечение аспирином. У пациентов с недавно поставленным драг-элютинг-стентом несердечная операция может быть выполнена через 12 месяцев после вмешательства, а перед этой операцией рекомендована двойная антитромбоцитарная терапия. После указанного периода по крайней мере должно быть продолжено лечение аспирином.
Список литературы находится в редакции