Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Скринінг, діагностика, лікування та спостереження хворих на колоректальний рак
Авторы: О.О. Крилова, учений секретар, к.м.н., с.н.с., ДУ «Інститут гастроентерології АМН України», м. Дніпропетровськ
Версия для печати
Лікарям практично всіх спеціальностей все частіше доводиться стикатися з хворобами товстої кишки. Встановлення точного діагнозу й проведення диференціальної діагностики між різними захворюваннями товстої кишки та іншою патологією є складним завданням, рішення якого неможливе без застосування додаткових методів обстеження. Стійкий ріст захворюваності на колоректальний рак (КРР), що супроводжується високою летальністю, змушує звернути особливу увагу як на діагностику й лікування передракових захворювань товстої й прямої кишки, так і на виявлення ранніх форм раку кишечника.
В Україні зареєстрований середній рівень поширеності КРР, що становить 36,5 нового випадку на рік на 100 тис. населення. КРР є другою за частотою захворюваності злоякісною пухлиною в чоловіків (після бронхолегеневого раку) і третьою — у жінок (після бронхолегеневого раку й пухлин молочних залоз). Щорічно в Україні виявляється 15–17 тис. нових випадків КРР та вмирає до 8 тис. людей. Виявляється КРР частіше на пізніх стадіях — частота виявлення 3–4-ї стадії становить 70 % всіх випадків [1].
Ризик розвитку КРР протягом усього життя, за даними В.Т. Івашкіна, становить у чоловіків 6,02 %, а в жінок менше ніж 5,77 % [2]. Відзначається суттєвий ріст ризику захворюваності КРР після 50 років і зростання його частоти за останні 20 років на 0,3 % при зменшенні смертності на 15,5 %. П’ятирічна виживаність за останні 5 років зросла з 46 до 62 %, однак величина цього показника цілком визначається стадією хвороби на момент постановки діагнозу. При локальній формі раку вона становить 92 %, при раку з регіональними метастазами — 64 %, при раку з віддаленими метастазами — 7 %. У 41 % випадків діагностика відбувається на стадії неінвазивного раку, у 35 % — раку з метастазами в регіональні лімфатичні вузли, у 16 % — раку з віддаленими метастазами [1, 2]. З огляду на ці цифри доводиться визнати, що в більше ніж половині випадків діагностика запізнюється. У той самий час існують надійні докази того, що зниження рівня смертності від КРР може бути досягнуто шляхом виявлення й лікування ранніх його форм поряд з виявленням і видаленням аденоматозних поліпів [3].
Фактори ризику КРР включають: літній вік, випадки КРР у родині, певні спадкові стани (сімейний аденоматозний поліпоз (САП), спадковий неполіпозний КРР (СНКРР), запальні захворювання кишечника (ЗЗК), аденоматозні поліпи, особливості харчування, відсутність фізичної активності, алкоголь, паління й сидячий спосіб життя. Деякі із цих факторів ризику, такі як вік, не можуть бути змінені; інші, такі як дієта, вимагають великої роз’яснювальної роботи серед широких мас населення для зміни вкорінених звичок [1, 3].
Скринінг безсимптомних осіб. Всім чоловікам і жінкам починаючи з 50 років повинно бути запропоноване проведення скринінгу для виявлення аденоматозних поліпів і раку за допомогою одного з наступних методів [3–9].
Скринінгові тести для виявлення колоректального раку та аденоматозних поліпів у безсимптомних пацієнтів, старших 50 років, поділяють на 2 групи (ACS, 2008):
1. Тести для виявлення аденоматозних поліпів та раку: проведення гнучкої сигмоїдоскопії один раз на 5 років, проведення колоноскопії кожні 10 років, іригоскопія з подвійним контрастуванням кожні 5 років, віртуальна колоно-скопія кожні 5 років.
2. Тести для виявлення переважно раку: дослідження калу на приховану кров із використанням чутливого гваякового тесту 1 раз на рік, дослідження калу на приховану кров з використанням чутливого імунохімічного тесту 1 раз на рік, дослідження ДНК калу (високочутливий тест), періодичність не визначена.
У випадку позитивного тесту на приховану кров у калі або фекального імунохімічного тесту, виявлення поліпів при сигмоскопії або виявлення патології при подвійному рентгеноконтрастному дослідженні товстої кишки з барієм необхідне проведення колоноскопії.
Щорічно треба проводити тест на приховану кров (gFOBT), беручи проби з 3 послідовних випорожнень. Одноразове дослідження не рекомендується. При позитивному результаті будь-якої проби виконують колоноскопію (А).
Сигмоскопія дозволяє успішно діагностувати КРР лівої половини товстої кишки: виявити 70,3–95 % аденом і випадків інвазивного КРР. Однак проксимальні відділи ободової кишки для обстеження цим способом недоступні. Недоліком є й необхідність повторного дослідження — колоноскопії при виявленні патології лівої половини товстої кишки. Доведено, що в 60–80 % випадків можливо знизити ризик смерті від КРР при використанні скринінгової сигмоскопії [10, 11]. Рекомендується проводити сигмоскопію принаймні 1 раз на 3–5 років. Вибір такого проміжку часу між оглядами обумовлено рядом факторів: існують докази, що скринінгова ефективність сигмоскопії однакова при щорічному огляді й при огляді раз на три роки; розвиток злоякісної пухлини з поліпу рідко відбувається швидше ніж за 3 роки. За даними ряду авторів, «захисний ефект» сигмоскопії може тривати до 10 років.
Сигмоскопія виконується кожні 5 років. Комбінація щорічного FOBT і сигмоскопії кожні 5 років можлива, незважаючи на те що додаткова користь від FOBT мінімальна. Якщо обидва дослідження плануються разом, рекомендується спочатку виконання FOBT, тому що його позитивний результат є показанням для колоноскопії (В).
Іригографія з подвійним контрастуванням є досить чутливим методом виявлення КРР й аденом більших розмірів (понад 90 %). Цей метод більш ефективний при інфільтративному рості пухлини. Недоліками іригографії є низький відсоток діагностики раннього КРР, особливо його поверхневих поширених форм, значна кількість хибнопозитивних результатів і неможливість морфологічної верифікації діагнозу. Тому U.S. Preventive Services Task Force (USPSTF) не рекомендує іригографію для скринінгу КРР.
Іригографію рекомендується проводити кожні 5 років. При виявленні будь-яких змін проводиться колоноскопія (D).
Колоноскопія в цей час відіграє провідну роль у встановленні або виключенні колоректальної патології. У National Polyp Study визначено, що у пацієнтів, яким виконувалась колоно-скопія з поліпектомією, КРР розвивався на 76 % рідше порівняно з загальною популяцією та на 90 % рідше порівняно з пацієнтами, яким поліпектомія не виконувалась. Однак не слід вважати колоноскопію методом, який абсолютно, на 100 % виключає патологію товстої кишки. Повідомляється про пропуск 25 % аденом розміром менших 10 мм й 6 % розміром понад 10 мм при стандартній ФКС.
Колоноскопія рекомендується кожні 10 років для безсимптомних осіб (середній ризик). Закінченість огляду і якість підготовки потрібно взяти до уваги для вибору терміну проведення наступної процедури (колоноскопії) (А).
Новим методом діагностики патології товстої кишки є віртуальна колоноскопія, уперше запропонована в 1994 році. Вона дозволяє на основі безлічі зрізів, отриманих за допомогою комп’ютерного томографа й оброблених спеціальною програмою, одержати зображення товстої кишки зсередини. Цей метод дозволяє виявляти утворення понад 10 мм у 90 % випадків, а менше ніж 10 мм — у 70–80 % випадків. Однак можливі й хибнонегативні результати, найчастіше обумовлені неадекватною підготовкою. Великим недоліком віртуальної колоноскопії є неможливість морфологічної верифікації діагнозу. Дані про необхідну частоту виконання віртуальної колоноскопії з метою скринінгу спірні.
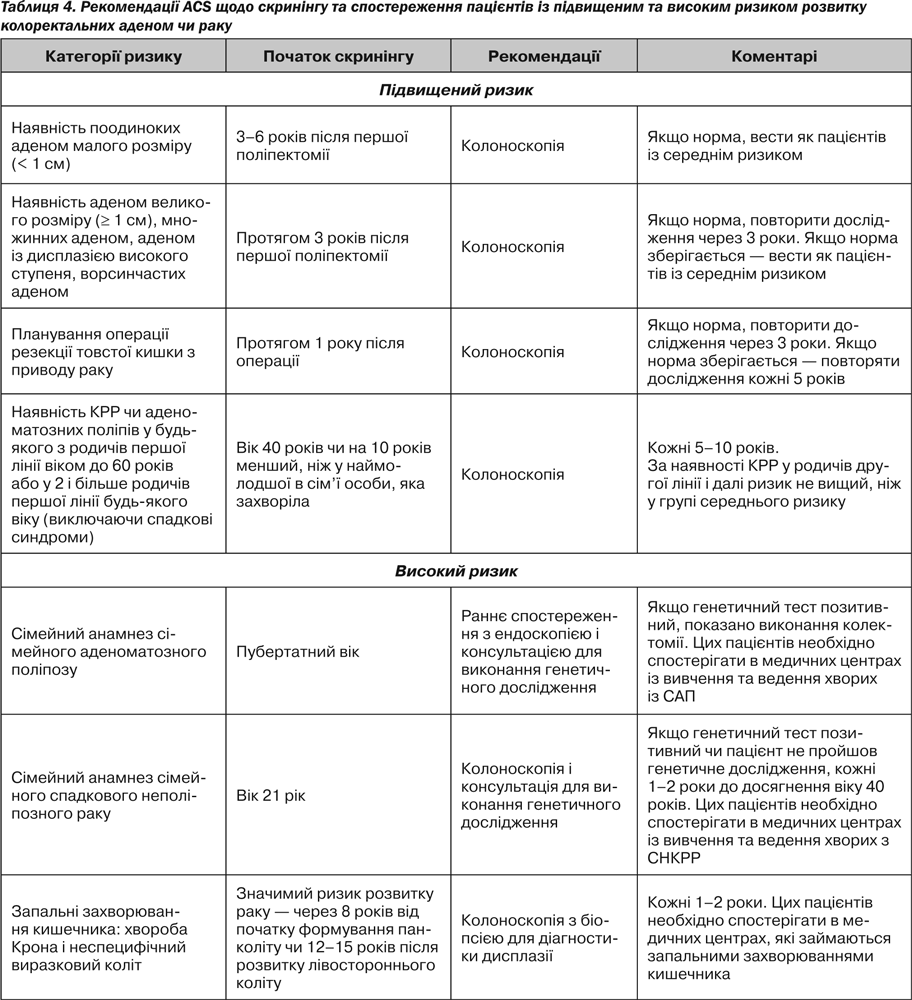
У пацієнтів підвищеної групи ризику за КРР скринінгові методи й частота їх проведення не відрізняються від групи безсимптомних осіб (із середнім ступенем ризику), але починати скринінг треба або з 40 років, або на 10 років раніше від найменшого віку виникнення раку товстої кишки в родича.

Починати скринінг колоректального раку раніше (ніж у безсимптомних осіб — 50 років) і/або частіше проводити тести для скринінгу експерти АСS рекомендують у випадках: наявності в анамнезі КРР або аденоматозних поліпів; сімейного анамнезу КРР або поліпів (рак або поліпи в одного з родичів першої лінії, молодших за 60 років, або у двох родичів першої лінії будь-якого віку); наявності в анамнезі хронічних запальних захворювань кишечника (ЗЗК); сімейного анамнезу спадкового колоректального ракового синдрому (сімейного аденоматозного поліпозу — САП або спадкового неполіпозного раку товстої кишки — СНКРР).
Колоноскопія дозволяє виявити та одночасно видалити поліпи товстої кишки. Колоноскопія повинна виконуватись, якщо при сигмоскопії виявлено хоча б одну аденому великих розмірів. Дотепер не вирішено, чи є необхідність виконувати колоноскопію при виявленні тубулярних аденом розміром < 1 см. Фактори, що підвищують ризик проксимальної неоплазії [1]: вік > 65 років, наявність ворсинчастих структур у дистально розташованих аденомах, наявність аденом, розмір яких ≥ 1 см, наявність множинних дистально розташованих аденом. Пацієнтам, які мають хоча б один із цих факторів, та пацієнтам, у яких виявлено 1 чи більше поліпів розмірами ≥ 1 см під час сигмоскопії, повинна виконуватись колоноскопія [12].
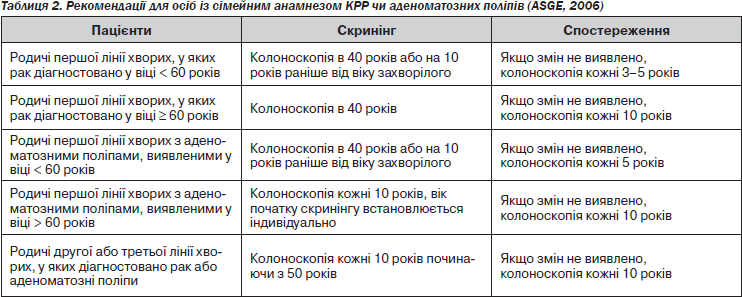
Особи з сімейним анамнезом КРР чи аденоматозних поліпів — це особи, які мають одного чи двох родичів першої лінії, у яких діагностовано КРР чи аденоматозні поліпи. Ризик розвитку КРР у них зростає у 2–4 рази. Рекомендації спостереження осіб із сімейним анамнезом КРР чи аденоматозних поліпів подані в табл. 2.
Пацієнтам з НВК чи хворобою Крона виконується колоноскопія кожні 1 чи 2 роки починаючи з 8–10 років із моменту перших проявів хвороби (D).
У пацієнтів із панколітом біопсія виконується з 4 точок через кожні 10 см від сліпої кишки до прямої (не менше 32 біоптатів) [13]. У пацієнтів із менш протяжним ураженням кишечника забір біоптатів виконується з уражених ділянок. Забір біоптатів також проводиться зі стриктур, об’ємних утворень, макроскопічно змінених ділянок (за винятком псевдополіпів). Хворі на НВК у поєднанні з первинним склерозуючим холангітом мають більш високий ризик розвитку КРР й повинні проходити колоноскопію щорічно. Основною метою виконання множинних біопсій є виявлення поліпоподібних неоплазій, так званих DALM (dysplasіa assocіated lesіons or masses) і неопластичних плоских утворень. Встановлено, що у випадку діагностики DALM або плоских неоплазій високого й низького ступеня при колоноскопії, після виконання колектомії рак був виявлений у 43, 42 й 19 % пацієнтів відповідно. Більше того, у 29 % хворих із дисплазією низького ступеня з часом вона прогресує в дисплазію високого ступеня, DALM.
Аденоматозні поліпи видаляють під час колоноскопії та беруть зразки для біопсії з навколишньої слизової для виключення наявності дисплазії. Якщо у хворих на НВК чи хворобу Крона виявлено поліп із дисплазією поза зоною активного запалення, спостереження треба вести як при спорадичних поліпах, виявлених в осіб загальної популяції. Якщо поліп із дисплазією виявлений у зоні активного запалення (DALM) і виявлені диспластичні зміни навколишньої слизової — показана колектомія.
Хворим із виявленою дисплазією високого ступеня чи мультифокальною дисплазією низького ступеня або DALM рекомендується профілактична колектомія або, за можливості, ендоскопічне видалення патологічного вогнища. Перед втручанням діагноз повинен бути підтверджений двома досвідченими морфологами (D).
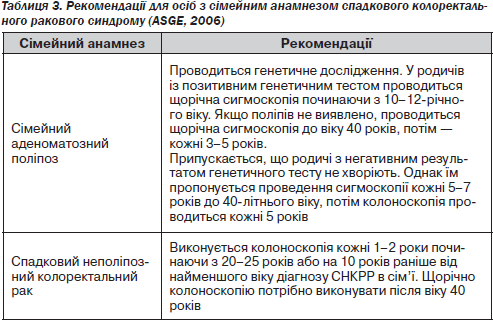
Наявність у родичів САП або СНКРР вимагає проведення генетичної консультації, можливого генетичного тестування й більш інтенсивного спостереження в молодому віці [12] (С) (табл. 3).
Після видалення аденоматозного поліпу повинна бути почата програма колоноскопічного спостереження. Як правило, перша контрольна колоноскопія може проводитись через 3–5 років, строк визначається кількістю вилучених поліпів і ступенем їх патологічних змін. Деяким пацієнтам варто провести колоноскопію раніше, якщо кишка не була добре підготовлена або були множинні поліпи або поліпи з ознаками малігнізації [14].
Рекомендації спостереження пацієнтів з колоректальними поліпами (ACS, AGA, ASGE, 2006)
1. Пацієнти з виявленим гіперпластичним поліпом не належать до осіб із підвищеним ризиком КРР. Наступна колоноскопія їм проводиться через 10 років. Винятком є пацієнти з гіперпластичним поліпозним синдромом, у яких підвищений ризик розвитку аденом та КРР та які потребують інтенсивного спостереження.
2. Пацієнти, у яких виявлено 1 чи 2 невеликі (< 1 см) тубулярні аденоми з низьким ступенем дисплазії, потребують проведення колоноскопії через 5–10 років. Точний вибір часу в межах цього інтервалу повинен бути заснований на інших клінічних факторах (як, наприклад, попередні результати колоноскопій, наявність генетично обумовлених захворювань, рішення лікаря або пацієнта).
3. Пацієнтам, у яких виявлено від 3 до 10 аденом, або аденома ≥ 1 см, або аденома з ворсинчастими елементами, або дисплазія високого ступеня, колоноскопія проводиться не пізніше ніж через 3 роки для підтвердження повного видалення всіх патологічних елементів. Якщо при контрольній колоноскопії змін не виявлено чи виявлено тільки 1 чи 2 невеликі тубулярні аденоми з низьким ступенем дисплазії, то інтервал для наступної колоноскопії — 5 років.
4. Пацієнти, у яких виявлено більше ніж 10 аденом, колоноскопія проводиться з інтервалом < 3 років, який встановлюється індивідуально. Необхідно провести генетичне тестування на наявність САП.
5. Пацієнтам, у яких видалено поліп на широкій основі, необхідно виконувати колоноскопію через 3–6 міс. після поліпектомії. Якщо залишкова тканина поліпа знайдена, то треба провести остаточне видалення та повторити колоно-скопію через 6 міс. Якщо патологічних змін не знайдено (як макроскопічних, так і мікроскопічних) — подальше спостереження за індивідуальними показаннями, якщо патологічну тканину не видалено в межах 2–3 експертиз (колоноскопій) — необхідно вирішувати питання хірургічного лікування.
Після хірургічного лікування раку колоноскопію звичайно проводять через 6–12 місяців, а потім у ті ж строки, що й після поліпектомії [15].
Рекомендації спостереження пацієнтів з колоректальним раком (ACS, AGA, ASGE, 2006)
1. Хворі на КРР чи рак прямої кишки підлягають ретельній доопераційній діа- гностиці. У випадках необструктивної пухлини виконується передопераційна колоноскопія. У випадках обструктивного КРР виконується віртуальна колоноскопія чи іригографія для виявлення неоплазм у проксимальних відділах товстої кишки. Якщо під час операції не виявлено неоперабельних метастазів, колоноскопія проводиться через 3– 6 міс. після резекції. Альтернативно колоноскопія може виконуватись інтраопераційно.
2. Хворим на КРР чи рак прямої кишки, яким проведено хірургічне лікування, виконується колоноскопія на 1-му році після резекції (або через 1 рік після колоноскопії, що виконувалась для виявлення синхронного ураження товстої кишки).
3. Якщо під час колоноскопії, виконаної на 1-му році після оперативного лікування КРР чи раку прямої кишки, патології не виявлено, то інтервал перед наступною колоноскопією становить 3 роки. Якщо під час двох послідовних (після резекції) колоноскопій патологічних змін не виявлено, то інтервал перед наступною колоноскопією становить 5 років.
4. Слід скорочувати інтервали подальших колоноскопій у хворих, які перенесли хірургічне лікування КРР чи раку прямої кишки, якщо вони мають сімейний анамнез неполіпозного КРР чи аденоми, виявлені під час первинної колоноскопії.
5. Після передньої низької резекції при раку прямої кишки проводиться огляд прямої кишки для виявлення рецидиву пухлини з інтервалом 3–6 міс. протягом перших 2 чи 3 років після оперативного лікування. Методи огляду — ректороманоскопія, сигмоскопія, ректальне ендоскопічне ультразвукове дослідження (ЕУЗД). Ці дослідження проводяться додатково до п. 2.
У цей час керуються такою аксіомою: всі виявлені колоректальні поліпи треба видаляти [16]. Винятки з правила: виявлення одиночних поліпів розміром до 0,5 см у діаметрі. У цьому випадку можлива вичікувальна тактика з повторною ендоскопією. При цьому важливо підкреслити, що попередня біопсія поліпів не доцільна. При первинній колоноскопії можуть бути вилучені невеликі (до 1 см), з гладенькою поверхнею, з вираженою ніжкою поліпи без ознак малігнізації (кровоточивість, виразка, наявність ділянок фібрину або некротичних мас на поверхні). Не слід видаляти в амбулаторних умовах великі (понад 2 см), із широкою основою, плоскі ворсинчасті поліпи.
Щодо рецидивів колоректальних поліпів і раку дані досліджень свідчать про зниження ризику їх розвитку при проведенні ендоскопічної поліпектомії. За результатами 3 досліджень «випадок — контроль» відзначалося зниження смертності на 50–79 % від КРР в оглянутих відділах товстої кишки після ендоскопічної поліпектомії. Також було показано, що після видалення аденом товстої кишки контрольну колоноскопію необхідно проводити не раніше ніж через 3 роки, тому що нові аденоми > 1 см з дисплазією високого ступеня чи ознаками малігнізації виявлялися з однаковою частотою 3,3 % при колоноскопії, яка проводилась через 1 і 3 роки після поліпектомії та тільки через 3 роки.
Ендоскопічне УЗД (ультразвукова колоноскопія) — сучасний діагностичний метод, що дозволяє оцінити розміри, структурні особливості, ступінь інвазії неоплазій у стінку товстої кишки. Точність ЕУЗД для визначення стадії КРР становить від 80 до 95 % [17]. ЕУЗД продемонструвало перевагу у визначенні стадії Т (за класифікацією TNM) раку прямої кишки порівняно з КТ [18]. Малігнізована пухлина прямої кишки з обструкцією просвіту може бути складною для оцінки ЕУЗД. У таких випадках застосовують УЗД-датчик, який проводять через канал ендоскопа або через ректоскоп [19].
Висновок
А — prospective controlled trials (якщо для обгрунтування рекомендацій є надійні дані, отримані в рандомізованих контрольованих дослідженнях, до них слід ставитися з більшою увагою).
В — observational studies (якщо через відсутність таких даних рекомендації грунтуються на нерандомізованих популяційних дослідженнях, або дослідженнях типу «випадок — контроль», ними не слід нехтувати. Однак використання таких рекомендацій виправдане лише у випадках, коли впровадження їх може суттєво скоротити витрати або запобігти шкоді пацієнту).
С — expert opinion (якщо рекомендації базуються на «окремих думках», це означає, що провідні фахівці погодилися рекомендувати таку тактику дій саме на підставі загальних уявлень, а не на підгрунті доказових досліджень).
ACS (2008)
Скринінгові тести для виявлення колоректального раку та аденоматозних поліпів у безсимптомних пацієнтів, старших 50 років.
Тести для виявлення аденоматозних поліпів та раку:
— проведення гнучкої сигмоїдоскопії один раз на 5 років;
— проведення колоноскопії кожні 10 років;
— іригоскопія з подвійним контрастуванням кожні 5 років;
— віртуальна колоноскопія кожні 5 років.
Тести для виявлення переважно раку:
— дослідження калу на приховану кров з використанням чутливого гваякового тесту 1 раз на рік;
— дослідження калу на приховану кров з використанням чутливого імунохімічного тесту 1 раз на рік.
ASGE (2005)
— Колоноскопія — високочутливий метод у діагностиці КРР (В).
— Множинні біопсії слід брати з усіх підозрілих ділянок, поліподібні ураження слід видалити (А).
— ЕУЗД є точним методом у передопераційному визначенні стадії раку прямої кишки та корисне для контролю лікування (А).
— Малігнізовану обструкцію товстої кишки можна ефективно лікувати ендоскопічно SEMS чи лазером у випадку інкурабельних хворих чи як І етап хірургічного лікування (В).
— Несприятливі гістопатологічні фактори малігнізованих поліпів товстої кишки асоційовані з високим ризиком метастазів та рецидивом раку після ендоскопічної поліпектомії: незадовільно визначена гістологічна структура, інвазія в судинне русло чи в лімфовузли, виявлення раку в краях видаленого поліпа, незавершена ендоскопічна поліпектомія (В).
— Малігнізовані поліпи на ніжці, обмежені підслизовою, можуть бути успішно видалені ендоскопічно, якщо немає доказів наявності несприятливих гістопатологічних даних (В).
— Малігнізовані поліпи на широкій основі (сидячі), обмежені підслизовою, які не мають доказів наявності несприятливих гістопатологічних даних, мають невеликий ризик метастазів у лімфовузли та рецидивів порівняно з поліпами на ніжці. Ендоскопічне видалення таких поліпів адекватне, якщо резекція виконувалась єдиним блоком. Хірургічне лікування — гарантія завершеності лікування таких поліпів (В).
— Ендоскопічна резекція ефективна для лікування дисплазії високого ступеня (HGD) (В).
ASGE (2006)
— Колоноскопія — метод, якому надається перевага у скринінгу КРР у пацієнтів середнього ризику його розвитку (В).
— Методи скринінгу КРР у пацієнтів середнього ризику включають щорічний тест на приховану кров у калі (FOBT) (A), сигмоскопію кожні 5 років зі щорічним FOBT та сигмоскопію кожні 5 років (B).
— Одноразовий FOBT має низьку чутливість для виявлення КРР і не може бути рекомендованим як скринінговий метод (А).
— Оцінка ефективності застосування віртуальної колоноскопії і фекального ДНК-тесту для скринінгу КРР супе-речлива, і тому ці тести не можуть бути рекомендовані як скринінгові (А).
— Проведення генетичних тестів рекомендоване для осіб зі спадковими формами КРР — САП та СНКРР (С).
— В осіб із позитивним генетичним тестом САП проводиться щорічна сигмоскопія, починаючи з 10–12-річного віку. Виявлення множинних аденом є показанням для тотальної колектомії. Якщо поліпів не виявлено, проводиться щорічна сигмоскопія до віку 40 років, потім — кожні 3–5 років (В).
— В осіб із ризиком СНКРР виконується колоноскопія кожні 1–2 роки починаючи з 20–25 років або на 10 років від найменшого віку діагнозу СНКРР в сім’ї. Щорічно колоноскопію потрібно виконувати після віку 40 років (В).
— Родичам першої лінії хворих з аденоматозними поліпами, виявленими у віці < 60 років, колоноскопія виконується в 40 років або на 10 років раніше, ніж вік захворілого. Якщо змін не виявлено, треба проводити колоноскопію кожні 5 років (В).
— Родичам першої лінії хворих, у яких рак діагностовано незалежно від віку, колоноскопію виконують починаючи з 40 років або на 10 років раніше, ніж вік захворілого. Якщо змін не виявлено, повторна колоноскопія виконується залежно від віку захворілого (якщо вік < 60 років — кожні 3–5 років, якщо ≥ 60 — кожні 10 років) (С).
— Родичам першої лінії хворих з аденоматозними поліпами, виявленими у віці > 60 років, колоноскопія виконується кожні 10 років, вік початку скринінгу встановлюється індивідуально. якщо змін не виявлено, колоноскопія кожні 10 років (С).
— Ризик розвитку КРР підвищений у хворих на НВК та хворобу Крона. Таким хворим виконується колоноскопія кожні 1–2 роки з множинною біопсією для виявлення дисплазії (В).
— Тотальну колоноскопію необхідно виконувати всім хворим, у яких діагностовано КРР, для виключення синхронного раку чи аденоматозних поліпів. Якщо повне дослідження не може бути виконано на момент встановлення діагнозу КРР, колоноскопія повинна бути виконана через 6 міс. після резекції (В).
— При повноцінній резекції пухлини виконується колоноскопія через 1 рік після операції, потім, якщо змін не виявлено, через 3 роки і через 5 років (В).
— Ризик рецидиву раку прямої кишки залежить від його стадії, виду хірургічного лікування та застосування променевої терапії. Пацієнтам, які не отримували променеву терапію чи яким виконана низька передня резекція за відсутності проростання в суміжні органи, сигмоскопія виконується кожні 3–6 місяців протягом 2–3 років (В).
— Пацієнти, які мають в анамнезі поліпектомію, підлягають колоноскопічному спостереженню, строки якого визначаються відповідно до кількості, розмірів, гістологічних даних видалених поліпів, а також залежать від якості та завершеності огляду (В).
— Якщо можливо, всі поліпи розмірами > 0,5 см повинні бути видалені (В).
1. Просоленко К.А., Жукова В.Б. Адекватная курация пациентов с толстокишечными полипами — эффективная профилактика колоректального рака // Здоров’я України. — 2006. — № 21/1.
2. Ивашкин В.Т. Колоректальный рак // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 1999. — № 1. — С. 88-95.
3. Sidney J. Winawer. Изложение позиции OMGE: Колоректальный рак. Скрининг и наблюдение. WGO/OMGE, 2004.
4. ASGE guideline: The role of endoscopy in the diagnosis, staging, and management of colorectal cancer // Gastrointest Endosc. — 2005. — 61. — Р. 1-6.
5. Practice Guidelines colorectal cancer screening. World Gastroenterology Organisation, 2008
6. Winawer S.L., Zauber A.G., Ho M.N. et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup // N. Engl. J. Med. — 1993. — Vol. 329. — Р. 1977-1981.
7. Atkin W.S., Cook C.F., Cuzick J. et al. Single flexible sigmoidoscopyscreening to prevent colorectal cancer: Baseline findings of a UK multicentre randomised trial // J. Lancet. — 2002. — Vol. 359/9314. — P. 1291-1300.
8. Imperiale T.F., Wagner D.R., Lin C.Y. et al. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings // N. Engl. J. Med. — 2000. — Vol. 343. — P. 169-174.
9. Screening for Colorectal Cancer: Recommendation and Rationale U.S. Preventive Services Task Force. — 2002. — Vol. 137/2. — P. 129-131.
10. Winawer S., Fletcher R., Rex D. et al. Colorectal cancer screening and surveillance: clinical guidelines and rationale-Update based on new evidence // Gastrointestinal Consortium Panel Gastroenterology. — 2003. — Vol. 124 (2). — P. 544-60.
11. Cancer reference information (April 1, 2006). http://www.cancer.org (12 мая 2006).
12. Baron J.A., Beach M., Mandel J.S. et al. Calcium supplements for the prevention of colorectal adenomas. Calcium Polyp Prevention Study Group // N. Engl. J. Med. — 1999. — Vol. 340 (2). — P. 101-107.
13. Raquel E. Davila, Elizabeth Rajan et al. ASGE guideline: Colorectal cancer screening and surveillance // Gastrointest. Endoscopy. — 2006. — Vol. 63. — № 4. — 1504-1521.
14. Itzkowitz S.H., Present D.H. Crohn’s and Colitis Foundation of Ame-rica Colon Cancer in IBD Study Group, consensus conference: colorectal cancer screening and surveillance in inflammatory bowel disease // Inflamm. Bowel Dis. — 2005. — Vol. 11. — P. 314-321.
15. Guidelines for Colonoscopy Surveillance after Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society // CA Cancer J. Clin. — 2006. — Vol. 56. — Р. 143-159.
16. Guidelines for Colonoscopy Surveillance after Cancer Resection: A Consensus Update by the American Cancer Society and US Multi-Society Task Force on Colorectal Cancer // CA Cancer J. Clin. — 2006. — Vol. 56. — P. 160-167.
17. Bond J.H. Polyp Guideline: dia-gnosis, treatment, and surveillance for patients with colorectal polyps // Am. J. Gastroent. — 2000. — Vol. 95 (11). — P. 3053-3063.
18. Wiersema M.J., Harewood G.C. Endoscopic ultrasound for rectal cancer // Gastroenterol. Clinics. N. Am. — 2002. — Vol. 31. — P. 1093-1105.
19. Beynon J., Mortesen N.J., Foy D.M. et al.. Pre-operative assessment of local invasion in rectal cancer: digital examination, endoluminal sonography or computed tomography // Br. J. Surg. — 1986. — Vol. 73. — P. 1015-1017.
20. Hunerbein M., Totkas S., Ghadi- mi B. et al. Preoperative evaluation of colorectal neoplasms by colonoscopic miniprobe ultrasonography // Ann. Surg. — 2000. — Vol. 232. — P. 46-50.