Газета «Новости медицины и фармации» 17(340) 2010
Вернуться к номеру
Применение Аугментина™ (амоксициллина/клавуланата) в лечении внебольничных инфекций дыхательных путей: обзор продолжающегося развития инновационного антимикробного средства
Авторы: Anthony R. White, Clive Kaye, GlaxoSmithKline, Harlow, UK, James Poupard, Brian Wynne, GlaxoSmithKline, Collegeville, PA, USA, Rienk Pypstra, Basilea Pharmaceutica, Basel, Switzerland, Gary Woodnutt, Diversa Corp., San Diego, CA, USA
Версия для печати
Введение
Амоксициллин/клавуланат (Аугментин™) доступен для клинического применения вот уже около 20 лет и остается одним из наиболее широко используемых антибиотиков, особенно для лечения инфекций дыхательных путей. В настоящей статье рассматриваются причины, которые привели к разработке амоксициллина/клавуланата, характеристики, благодаря которым данный препарат продолжает использоваться сегодня, и те инновации, благодаря которым он будет использоваться и дальше, несмотря на растущую резистентность к антимикробным средствам.
История создания амоксициллина/клавуланата
От пенициллина к амоксициллину
Первый клинически доступный антибиотик, бензилпенициллин (пенициллин G), был идентифицирован в конце 1920-х и 1930-х гг. и внедрен в клиническую практику во время Второй мировой войны. Несмотря на быстрое и повсеместное проникновение пенициллина в клиническое использование, где потребность в подобных препаратах была просто колоссальной, данный антибиотик был активен лишь в отношении узкого спектра бактерий — клинически значимая эффективность проявлялась в основном в отношении стрептококков, стафилококков и гонококков. Кроме того, пенициллин G был непригоден для перорального применения вследствие нестабильности в кислой среде. С целью преодоления этих ограничений были сделаны попытки создать из молекулы пенициллина новое терапевтическое средство, для чего в процессе ферментации добавляли различные предшественники [1]. Однако данный подход позволял получить лишь ограниченное разнообразие в структуре. Поэтому требовалось разработать новый метод, который бы позволил значительно расширить число получаемых и исследуемых молекул.
В середине 1950-х гг. ученые из лаборатории Beecham Research Laboratories (BRL) идентифицировали ядро пенициллина: 6-аминопенициллановую кислоту (6-AПК) [1, 2]. Пенициллиновое ядро содержит β-лактамное кольцо без каких-либо боковых цепочек. Поскольку образование 6-AПК в процессе традиционной ферментации было низким, был разработан процесс деацилирования готового пенициллина, что позволило получить ядро в больших количествах. Это позволило добавлять к нему боковые цепочки и получать полусинтетические пенициллины. Первичная цель таких работ сводилась к тому, чтобы разработать пенициллины с улучшенной пероральной абсорбцией, равно как и молекулы с более широким спектром активности. Важно отметить, что в начале 1940-х гг. были выделены штаммы Staphylococcus aureus, которые продуцируют β-лактамазу — фермент, инактивирующий пенициллины, доступные в то время [3]. К 1948 г. половина штаммов S.aureus в некоторых больницах и 80 % к 1957 г. были устойчивы к пенициллинам [2]. Поэтому усилия ученых были направлены также на разработку пенициллинов, которые бы не разрушались под действием β-лактамаз S.аureus [1]. В 1960 г. большим прорывом оказалось создание метициллина [1]. Это был первый β-лактамный антибиотик, устойчивый к стафилококковой β-лактамазе и получаемый как спасительное средство при инфекциях, вызванных пенициллин-резистентными штаммами S.aureus, особенно в больницах. Затем были созданы пероральные пенициллины, устойчивые к стафилококковой β-лактамазе: клоксациллин и флукло- ксациллин [1]. Дальнейшие исследования привели к разработке ампициллина, введенного в практику в 1961 г. Он стал первым пероральным пенициллином широкого спектра действия, эффективным против грам- отрицательных организмов, таких как Haemophilus influenzae, Escherichia coli и Salmonella typhi [1]. BRL продолжала разрабатывать различные полусинтетические средства, и одно из изменений в боковой цепочке ампициллина привело к созданию амоксициллина (внедрен в практику в 1972 г.) [1]. Амоксициллин обладал той же самой мощной, с широким спектром, активностью, что и ампициллин, но имел намного лучшую пероральную абсорбцию, обусловливая в плазме крови концентрации примерно в два раза выше, чем ампициллин [1, 2]. Кроме того, амоксициллин проявил более быструю бактерицидную активность против некоторых патогенов по сравнению с ампициллином [1, 2].
β-лактамаза, клавуланат и амоксициллин/клавуланат
Образование β-лактамаз в грамотрицательных бактериях было описано в 1940 г. на примере E.coli [4]. В 1960-х гг. было обнаружено, что β-лактамазы, продуцируемые грамотрицательных бактериями, отличаются от стафилококковых β-лактамаз, поскольку расположены внутриклеточно и потому способны действовать на β-лактамные антибиотики при их проникновении в бактерии. Развитие ампициллина и амоксициллина с их расширенной противомикробной активностью против грамотрицательных организмов означало, что продукция β-лактамаз внутри этих организмов станет важной клинической проблемой. Вдобавок ко всему было обнаружено, что способность продуцировать β-лактамазы передается между E.coli и другими видами бактерий с помощью плазмид при контактировании этих клеток. В результате увеличивается вероятность образования β-лактамаз в бактериях, которые раньше их не продуцировали [5]. Несмотря на то что были разработаны различные пенициллины с хорошей пероральной абсорбцией, расширенным антибактериальным спектром и устойчивостью к β-лактамазам, не было создано средство, которое бы объединяло все эти качества.
Было известно, что клоксациллин, флуклоксациллин и другие устойчивые к β-лактамазам вещества конкурентно ингибируют β-лактамазу, но эти средства не были достаточно эффективны против разных β-лактамаз, чтобы их можно было использовать для защиты пенициллинов широкого спектра. В конце концов в ходе специальной скрининговой программы BRL была обнаружена β-лактамная молекула, продуцируемая Streptomyces clavuligerus, которая оказалась сильным ингибитором β-лактамаз, но обладала низкой антибактериальной активностью. Эту молекулу назвали клавулановой кислотой [1, 6]. Бета-лактамное кольцо клавулановой кислоты необратимо связывается с бактериальной β-лактамазой, что приводит к ингибированию фермента и предотвращению его связывания с β-лактамными антибиотиками. Соответственно антибиотик не инактивируется [7]. Клавуланат проявляет также ряд дополнительных эффектов в патогенных бактериях, однако их клиническая значимость не установлена [8].
Способность клавулановой кислоты ингибировать β-лактамазы [9] скомбинировали с хорошей пероральной абсорбцией и мощной, с широким спектром, антимикробной активностью амоксициллина [1, 10]. Так появились таблетки, содержащие амоксициллина тригидрат и калия клавуланат. В этой форме амоксициллин/клавуланат был впервые выпущен под коммерческим названием Аугментин™ в США в 1981 г. [10], а впоследствии и во всем мире. Чуть позже были разработаны детские формы и формы для внутривенных инъекций, которые сегодня также доступны во многих странах мира.
Амоксициллин/клавуланат сегодня
Показания для амоксициллина/клавуланата. Первоначально амоксициллин/клавуланат был разработан в связи с потребностью в пероральном антибиотике с широким спектром активности, который был бы эффективен против β-лактамазопродуцирующих патогенов. Амоксициллин/клавуланат сохраняет хорошую активность против β-лактамазонегативных штаммов, а также против β-лактамазопродуцирующих штаммов, таких как S.aureus, E.coli и H.influenzae, и в отношении Klebsiella pneumoniae и анаэробных Bacteroides fragilis (большая часть штаммов бактероидов продуцирует β-лактамазу) [10–12]. В самых ранних исследованиях была продемонстрирована эффективность амоксициллина/клавуланата при инфекциях мочевыводящей и дыхательной системы, мягких тканей, вызванных β-лактамазопродуцирующими патогенами [13–19], и при таких заболеваниях, как гонорея и шанкроид [20–21].
В настоящее время амоксициллин/клавуланат наиболее часто используют для эмпирической терапии бактериальных инфекций дыхательного тракта, таких как внебольничная пневмония (ВП), обострение хронического бронхита (ОХБ), острый бактериальный риносинусит (ОБР) и острый средний отит (ОСО). К основным бактериальным патогенам, вызывающим внебольничную инфекцию нижних дыхательных путей (ВП и ОХБ) и ОСО, относятся S.pneumoniae, H.influenzae и Moraxella catarrhalis [22, 23]. Эти три микроорганизма приводят также к развитию бактериального синусита у детей, однако у взрослых с бактериальным синуситом выделяют обычно только S.pneumoniae и H.influenzae [24, 25]. Считают также, что важными патогенами при синуситах и рецидивирующем тонзиллите являются анаэробы [25, 26].
Последние данные свидетельствуют о том, что вероятность клинического успеха амоксициллина/клавуланата при инфекциях дыхательного тракта и ОСО составляет около 90 % [27–31]. Поэтому амоксициллин/клавуланат является ценным лекарственным средством при инфекциях дыхательного тракта, особенно если учесть, что врачи часто не могут установить вид патогена, вызвавшего эту инфекцию, и терапия должна быть эмпирической. По состоянию на конец 2002 г. амоксициллин/клавуланат был доступен в виде разных лекарственных форм более чем в 150 странах мира.
Оптимизация доз амоксициллина/клавуланата исходя из параметров фармакокинетики/ фармакодинамики (ФК/ФД)
Лекарственные формы амоксициллина/клавуланата
Первоначально взрослая форма амоксициллина/клавуланата, выпущенная на рынок под названием Аугментин™, назначалась три раза в день и включала 250 мг амоксициллина (в виде амоксициллина тригидрата) и 125 мг клавулановой кислоты (в виде калия клавуланата) [10]. В последующие годы соотношение амоксициллина и клавуланата варьировало так, чтобы учесть формирующиеся особенности прописывания препарата, повысить удобство его применения и учесть рекомендации по лечению более тяжелых инфекций или вызванных резистентными организмами. Однако в большинстве пероральных форм разовая доза клавуланата осталась на уровне 125 мг для взрослых и 3,2 мг/кг для детей (суточная доза 250–375 мг и 6,4–10 мг/кг). Это количество оказалось достаточным, чтобы ингибировать клинически значимые β-лактамазы и защитить амоксициллиновый компонент [11].
Чтобы соответствовать региональным стандартным дозам амоксициллина, на территории континентальной Европы (впервые в Германии в 1982 г.) и США (в 1986 г.) амоксициллин/клавуланат был зарегистрирован в дозе 500/125 мг (4 : 1), назначаемой три раза в день.
Для лечения более тяжелых заболеваний были введены дозы 875/125 мг (Испания и Италия) и 1000/125 мг (8 : 1) (Франция), также назначаемые три раза в день.
Сегодня во многих странах доступны формы 500/125 мг и 875/125 мг, назначаемые два раза в день. Их применение связано с повышенным удобством и комплайенсом пациентов по сравнению с трехкратным приемом, притом что эффективность сравнима с приемом 250/125 мг три раза в день или 500/125 мг три раза в день соответственно [32]. Взрослая форма 875/125 мг (7 : 1), принимаемая два раза в день, появилась в США и других странах с середины 1990-х годов.
Детские формы амоксициллина/клавуланата в соотношении 4 : 1 (20/5 и 40/10 мг/кг/день), принимаемые три раза в день, зарегистрированы сегодня практически во всем мире. С целью улучшения комплайенса во второй половине 1990-х годов во многих странах были зарегистрированы формы, принимаемые два раза в день [34–36]. Сегодня во многих странах стандартная детская доза амоксициллина/клавуланата для лечения легких и средней тяжести инфекций составляет 25/3,6 мг/кг/день (в виде двух разделенных доз).
При более тяжелых инфекциях, таких как ОСО, доза может быть увеличена до 45/6,4 мг/кг/день (в двух разделенных дозах). В некоторых европейских странах для того, чтобы соответствовать руководствам по назначению амоксициллина при тяжелых инфекциях, амоксициллин/клавуланат доступен в формах вплоть до 80/10 мг/кг/день в виде трех разделенных доз (Франция, Испания и дети до 2 лет в Бельгии и Нидерландах) или 70/10 мг/кг/день в виде двух разделенных доз (Германия, Австрия, Швейцария и Португалия).
Устойчивые к лечению S.pneumoniae чаще встречаются у детей, нежели у взрослых, и могут тяжело поддаваться стандартной антимикробной терапии [23]. Для борьбы с подобной ситуацией в США стала доступна новая высокодозовая детская суспензия 90/6,4 мг/кг/день, принимаемая в виде двух разделенных доз (Аугментин™ ES-600). Ее используют для лечения рецидивирующего ОСО: 1) вызванного S.pneumoniae (МПК пенициллина ≤ 2 мг/л), H.influenzae (включая β-лактамазопродуцирующие штаммы) или M.catarrhalis (включая β-лактамазопродуцирующие штаммы); 2) при неэффективности антибиотикотерапии в течение предшествующих 3 месяцев; 3) развившегося у ребенка в возрасте до 2 лет включительно либо ребенка, посещающего детский сад [37]. Эта форма скоро станет доступной и в других странах.
Стандартная внутривенная доза амоксициллина/клавуланата составляет 1000/200 мг, вводится каждые 8 ч. При необходимости может быть использована более высокая доза 2000/200 мг.
Фармакокинетика амоксициллина/клавуланата
Амоксициллин и клавуланат хорошо всасываются из желудочно-кишечного тракта, максимальная концентрация в плазме крови наблюдается через 60–90 мин и 40–120 мин соответственно после раздельного перорального приема этих средств [39]. Комбинирование обоих средств не влияет на их фармакокинетику [40]. Средняя максимальная концентрация после однократного приема амоксициллина/клавуланата в дозе 250/125 мг составляет 4,2 мг/л для амоксициллина и 2,6 мг/л для клавулановой кислоты [15]. Средняя максимальная концентрация амоксициллина после однократного приема 500/125 и 875/125 мг амоксициллина/клавуланата составляет 7,2 и 11,6 мг/л соответственно. Для амоксициллина в диапазоне 250–2000 мг характерна почти линейная зависимость между дозой и эффектом [41, 42]. Проникновение амоксициллина в секрет дыхательных путей больше, чем, например, ампициллина, несмотря на одинаковые максимальные концентрации в плазме крови [43]. Об этом свидетельствует значительно более высокое содержание амоксициллина в мокроте по сравнению с ампициллином у пациентов, которым оба препарата вводят внутривенно. Исследования амоксициллина/клавуланата свидетельствуют о том, что содержание в мокроте клавуланата сравнимо с таковым амоксициллина, учитывая относительную разницу двух доз [41, 44].
Период полувыведения амоксициллина и клавуланата одинаков: при введении здоровым волонтерам он составляет 63 мин для дозы амоксициллина 500 мг и 60 мин для дозы клавуланата 125 мг [45, 46]. Амоксициллин выводится с мочой почти в неизмененном виде: через 6 ч после перорального приема 50–85 % от введенной дозы препарата обнаруживают в моче [47]. Клавуланат, напротив, хорошо метаболизируется, и образуемые вещества выводятся легкими, а также с калом и мочой [48]. Спустя 6 ч после перорального приема 20–60 % от дозы клавуланата в неизмененном виде выводится с мочой [49].
Фармакодинамическое обоснование для оптимизации доз амоксициллина/клавуланата
Главной целью выбора той или иной антимикробной терапии при инфекциях дыхательных путей является максимальная эрадикация бактерий [50, 51]. Бактериологическая эрадикация важна не только для достижения клинического эффекта, но и для уменьшения потенциала формирования и распространения резистентности [50–52]. Бактериологическая эффективность антимикробных средств зависит от их ФК/ФД свойств [53, 54]. У β-лактамных средств бактериологическая эффективность очень зависит от времени, в течение которого свободная концентрация препарата в плазме крови превышает МПК для данного патогена (T > МПК) [54–56]. Для того чтобы амоксициллин проявил максимальную бактериологическую эффективность против основного респираторного патогена S.pneumoniae при моделировании инфекций у животных, необходимо, чтобы T > МПК составлял 30–40 % от интервала между приемами данного средства [54, 57]. Считается, что для максимальной эрадикации H.influenzae требуется такая же величина ФК/ФД индекса [54, 58]. При использовании β-лактамов, особенно тех, у которых зависимость между дозой и эффектом имеет линейный характер, с увеличением МПК патогенов можно справиться с помощью увеличения разовой дозы, кратности приема и/или улучшения фармакокинетики, что поможет поддерживать адекватный уровень T > МПК [59–61]. Напротив, у макролидов ограничения, связанные с фармакокинетикой и безопасностью, не позволяют увеличивать или модифицировать дозу до такой степени, чтобы справиться с резистентными к макролидам S.pneumoniae или обеспечить бактериологическую эффективность in vivo против H.influenzae [61]. Бактериологическая эффективность фторхинолонов зависит от концентрации. Следовательно, для того чтобы увеличить эффективность, необходимо увеличить общее количество препарата [61]. Фторхинолоны имеют относительно узкое окно безопасности, что ограничивает те дозы, которые могут быть назначены, поэтому большинство средств этой группы не способны поддерживать приемлемый профиль безопасности/переносимости и преодолеть хинолоновую резистентность у S.рneumoniae [61]. Таким образом, модификации ФК/ФД, необходимые для преодоления резистентности, выполнить у макролидов и фторхинолонов практически невозможно, что требует разработки новых, более активных молекул [60, 61].
В табл. 1 представлены равновесные средние T > МПК различных форм амоксициллина/клавуланата для разных МПК патогенов [33, 60–64]. Исходя из ФК/ФД параметров, амоксициллин/клавуланат в дозе 875/125 мг, принимаемый два раза в день, будет достигать максимальной бактериологической эффективности против штаммов, у которых МПК амоксициллина или амоксициллина/клавуланата составит ≤ 2 мг/л, но не ≥ 4 мг/л, хотя амоксициллин/клавуланат в дозе 875/125 мг, принимаемый три раза в день, и в дозе 1000/125 мг, принимаемый три раза в день, будет иметь некоторую эффективность и против штаммов с МПК 4 мг/л.
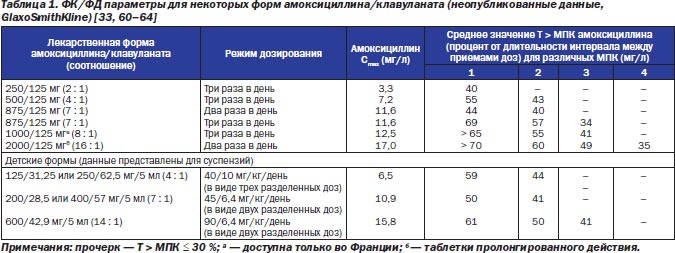
В США была внедрена высокодозовая детская суспензия (Аугментин™ ES-600; амоксициллин/клавуланат 90/6,4 мг/кг/день), принимаемая в виде двух разделенных доз. Это связано с необходимостью иметь под рукой сильное противомикробное средство для терапии рецидивирующих и персистирующих ОСО, инфекций, трудно поддающихся лечению, — то есть когда есть вероятность наличия патогенов, резистентных к лечению антибиотиками. В табл. 1 видно, что, исходя из фармакодинамических параметров, амоксициллин/клавуланат в дозе 90/6,4 мг/кг/день будет эффективен против штаммов бактерий с повышенными МПК пенициллина и амоксициллина [60, 65].
Перевод к.м.н. А.В. Савустьяненко
Продолжение в следующем номере
Печатается при поддержки компании «ГлаксоСмитКляйн»
AGMT/10/UA/25.10.2010/4078
Список литературы находится в редакции
