Газета «Новости медицины и фармации» 17(340) 2010
Вернуться к номеру
Философия радиохирургии
Авторы: Ю.П. Спиженко, академик НАМН Украины, Центр онкологии и радиохирургии «Киберклиника Спиженко», Украина
Версия для печати
 Хирургия достигла совершенства — хирург может удалить все, даже печень… Но, к сожалению, человек этого не выдерживает.
Хирургия достигла совершенства — хирург может удалить все, даже печень… Но, к сожалению, человек этого не выдерживает.
(Из речи хирурга, профессора П.А. Герцена после избрания его членом-корреспондентом АН СССР (1939))
Клиническая онкология сегодня, как и на протяжении всей своей истории, продолжает развиваться и совершенствоваться. Сегодня пересматривают и детализируют многие вчера, казалось бы, незыблемые идеологические концепции диагностической и лечебной тактики. Изменились взгляды на онкогенез, разработаны высокоинформативные способы диагностики и мониторинга опухолевого процесса. На смену традиционным — хирургическим — пришли новые технологии воздействия на злокачественную опухоль, в первую очередь медикаментозные и лучевые. Родились таргетная терапия, радиотерапия, брахитерапия и, наконец, радиохирургия. Прогресс необратим, и как бы вчера не были хороши рутинно используемые способы лечения, сегодня они уже не устраивают ни клиницистов, ни пациентов.
Но не все так просто. Отжившее не сдается без сопротивления. Ортодоксальные ретрограды — приверженцы устаревших технологий лечения с упорством, достойным лучшего применения, не воспринимают происходящее сегодня. Сегодня в онкологии как никогда справедливо мнение Д.Л. Пиковского (2001): «Случилось то же, что в свое время произошло с кибернетикой, — застой, разгон и, как следствие, безнадежное отставание».
К сожалению, ничего необычного в этом нет. Традиционная схема движения любого нового всегда проходит три этапа — замалчивание, неудержимую критику и, наконец, признание. Неизменен и путь возмутителей спокойствия. «Когда в мире появляется новатор, — разъяснял Д. Свифт, — вы можете с легкостью узнать этого человека по многочисленным врагам, которые объединяются вокруг него». Мышление ортодоксов отличается удивительным негативизмом ко всему новому.
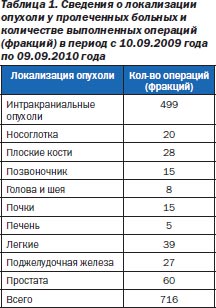
Не претендуя на роль оракула, проповедующего «истину в последней инстанции», мы на основании литературных сведений и анализа непосредственных результатов 716 радиохирургических вмешательств (фракций), проведенных с 10 сентября 2009 по 10 сентября 2010 года (за первый год работы Клиники онкологии и радиохирургии («Киберклиника Спиженко») — единственной онкологической клиники в Восточной Европе и странах бывшего СНГ, использующей комплекс «кибернож» (роботизированная радиохирургическая система CyberKnife® G4 фирмы Accuray, США) (рис. 1)), посчитали возможным поделиться скромным накопленным опытом. Сведения о локализации опухоли у пролеченных больных и количество выполненных операций в период с 10.09.2009 года по 09.09.2010 года представлены в табл. 1.

Радиохирургия — чрезвычайно науко- и техноемкая отрасль медицины. В настоящее время в медицине просто нет более сложного комплекса, чем кибернож. Его основное предназначение — подведение к опухоли тумороцидной дозы излучения при минимально возможной лучевой нагрузке на прилежащие здоровые органы и ткани. Все используемые до появления киберножа комплексы и технологии не обеспечивали этого. Ахиллесовой пятой их было то, что лечение с их помощью неизбежно сопровождалось развитием лучевых осложнений со стороны окружающих опухоль здоровых тканей и органов. Они обеспечивали только «ковровое бомбометание» в отличие от «точечного удара» киберножа.
Само воздействие киберножом — это апофеоз, заключительный акт в многоактовой драме — борьбе со злокачественной опухолью. Ему предшествуют чрезвычайно ответственные этапы диагностики и динамического планирования. Не случайно эксперты ВОЗ считают, что успех лучевого воздействия только на 50 % зависит от радиочувствительности опухоли. Остальные 50 % поровну обеспечивают аппаратное оснащение и создание рационального плана лечения с последующим точным его воспроизведением. Ошибка, допущенная при подготовке к лечению, неизбежно приведет к систематическому отклонению, повторяемому при каждой фракции, а это, в свою очередь, сделает невозможным объективный контроль изодозного распределения и объема облучаемого объекта. Поэтому, как ни одна другая отрасль медицины, радиохирургия требует максимальной точности на всех этапах ее подготовки и проведения.
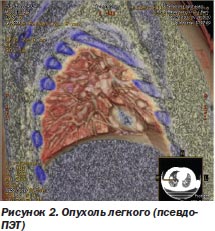
Первое, на чем хотелось бы остановиться, — это требования к диагностическим возможностям современных спиральных компьютерных томографов (КТ) и магниторезонансных томографов (МРТ) с ангиопрограммой для точного определения распространенности опухолевого процесса — локализации, размеров и конфигурации опухолевых очагов. Рассматривается только комплексное применение КТ и МРТ последнего поколения (МРТ Toshiba 1,5 T Vantage Atlas и 16-срезовый спиральный КТ Toshiba) в сочетании с компьютерными программами, обеспечивающими уникальную опцию fusion (слияния) с получением псевдоПЭТ-изображения (аналог позитронно-эмиссионной томографии (ПЭТ)). Это позволило разработать объемное 3D- или 4D-планирование с определением реальных границ опухоли, что особенно важно для подвижных органов-мишеней (легкие, почка, поджелудочная железа, предстательная железа) (рис. 2).
Современное планирование лучевого воздействия подразумевает учет индивидуальной анатомо-топометрической информации, радиобиологических параметров и допустимых уровней нагрузки на критические органы с учетом уровней толерантности окружающих опухоль нормальных тканей. Такая комплексная оценка позволяет выбрать из множества возможных режимов лучевого воздействия их оптимальную комбинацию.
Достижением фундаментальной радиологии, обеспечившим эффективность радиохирургического лечения, стала разработка принципов планирования на системе «Мультиплан» (Accuray, США), позволившей перейти от применяемых ранее расчетов распределения доз по одноплоскостным сечениям — срезам к объемному планированию, что дало возможность создать необходимые распределения дозы по всему объему мишени — опухоли.
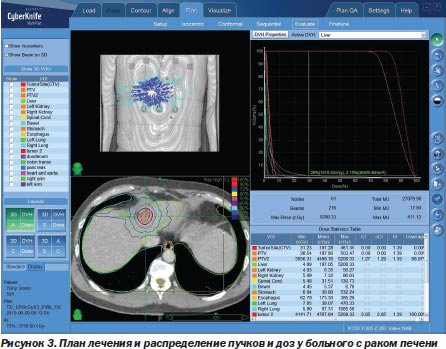
Это позволило добиться, с одной стороны, того, что объект, подвергаемый лечебному воздействию, стал максимально конгруэнтен планируемому, т.к. появилась возможность работать с очагами любой формы, а не только в виде сферы, а с другой — удалось достигнуть максимального по величине градиента дозы на границе «опухоль — здоровая ткань». При этом зона повреждения здоровой ткани при лечении на системе CyberKnife® G4 не превышает 0,2–0,6 мм (S.D. Chang et al., 2003; J.S. Kuo et al., 2003). Такая точность, в свою очередь, сделала реальным увеличение однократной очаговой дозы лучевого воздействия до 15–20 Гр, а суммарной очаговой дозы — до 50–60 и даже 90 Гр без физиологически значимых лучевых повреждений не пораженных опухолевым процессом тканей (B. Wowra et al., 2002; A.E. Radbill et al., 2004) (рис. 3).
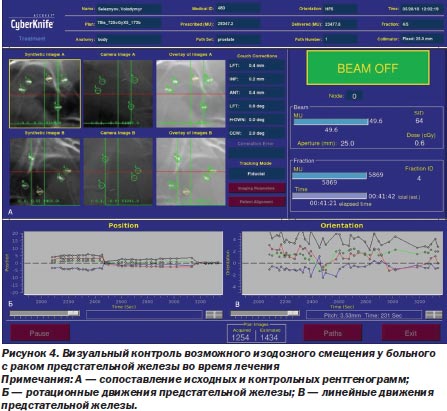
Важно то, что лучевое воздействие на роботизированной радиохирургической системе CyberKnife® G4 происходит под визуальным контролем за возможным смещением изодозного распределения, в режиме реального времени, непосредственно в процессе радиохирургического вмешательства (фракции), что сводит на нет возможность ошибок, связанных с движением опухоли во время дыхания и постоянно происходящего смещения критических органов (J.R. Adler et al., 1999) (рис. 4).
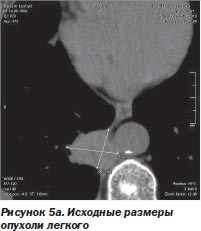
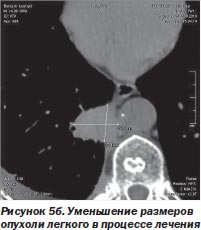
С другой стороны, благодаря высокой точности лучевого воздействия и возможности точного воспроизведения плана лечения после его временной остановки любое количество раз отпала необходимость в однофракционном воздействии во что бы то ни стало. Система CyberKnife в отличие от гамма-ножа позволяет проводить лечение фракциями с уменьшенными дозами (5–15 Гр), распределенными на несколько дней, вместо одной большой дозы за одну фракцию. Такое — гипофракционное — воздействие (ступенчатый режим) в еще большей мере снижает риск повреждения, окружающих опухоль-мишень нормальных тканей (S.D. Chang et al., 2005). К тому же появляется возможность коррекции плана лучевого воздействия при регрессировании опухоли непосредственно в процессе лечения (рис. 5а, 5б).
Накопленный опыт позволяет определить некоторые принципиальные направления использования радиохирургии в онкологии.
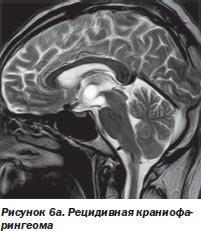
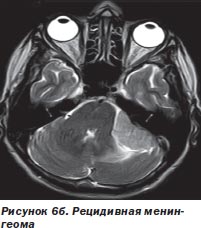
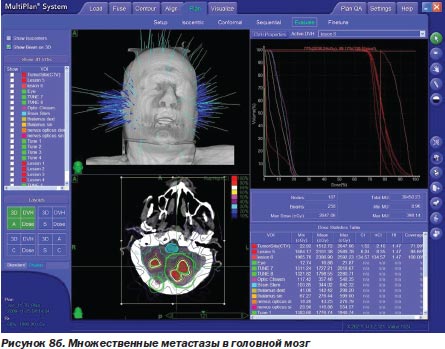
Во-первых, радиохирургия является безальтернативной технологией лечения больных с опухолями, расположенными в недоступном для хирурга месте. У большинства наблюдавшихся нами больных (499 больных) это были интракраниальные опухоли с инвазией в жизненно важные отделы мозга (рис. 6а, 6б).
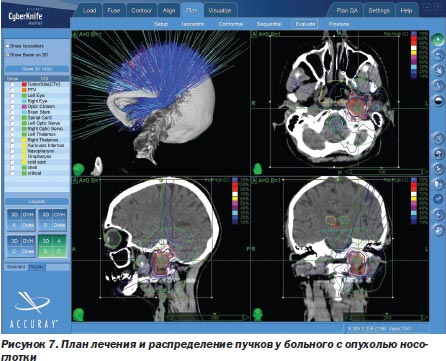
Другая локализация опухоли, абсолютно недоступная хирургам-онкологам, — это опухоли носоглотки с распространением в полость черепа (20 больных) (рис. 7).
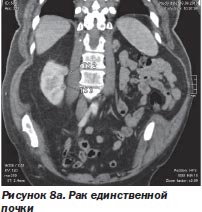
Неоценимо значение радиохирургии и при патологии жизненно важного органа, удалить который нельзя, например при раке единственной почки либо при поражении опухолью обеих долей печени или обоих легких, множественных опухолях мозга (рис. 8а, 8б).
Во-вторых, радиохирургия не имеет альтернативы при лечении больных, у которых ввиду тяжести состояния невозможно проведение традиционного хирургического вмешательства. Критерием же переносимости фракции является, по сути, способность больного пролежать на столе киберножа в положении на спине в течение 30–90 минут.
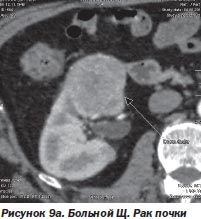
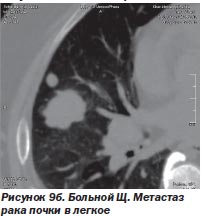
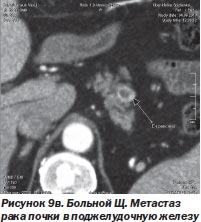
И в-третьих, нет альтернативы радиохирургии при поражении опухолевым процессом нескольких органов, тем более расположенных в разных анатомических областях. Мы располагаем опытом успешного лечения такого больного. Это был больной Щ. с раком единственной почки и метастазами в легкое и поджелудочную железу (рис. 9а, 9б, 9в). После проведенного радиохирургического лечения больной жив на протяжении 4 месяцев. Данных о рецидиве заболевания нет.
Вышеперечисленные категории больных, от которых фактически отказались «традиционные» онкологи, составляли на первом этапе работы клиники абсолютное большинство. Вместе с тем было бы ошибочным ограничивать возможности радиохирургии лечением только такого контингента больных. Еще при целом ряде локализаций опухоли кибернож успешно конкурирует с традиционными вмешательствами, постепенно вытесняя последние.
Так, при раке предстательной железы без распространения опухоли на стенку мочевого пузыря лечение включает всего пять 30-минутных фракций и несоизмеримо с высокотравматичной открытой простатэктомией. При раке поджелудочной железы для киберножа достаточно три 40-минутных фракции в отличие от многочасовой и опасной панкреатодуоденальной резекции. Здесь, как нигде больше, уместно напомнить хирургам-онкологам саркастический завет С.П. Федорова из его знаменитой статьи «Хирургия на распутье»: «В стремлении своем лучше лечить людей… не «зарезывайте» своих современников».
Перечисление групп больных, которых радиохирургия «отвоевывает» у онкологов-хирургов, можно продолжить. Но вряд ли в этом есть необходимость. Сегодня уже понятно, что у традиционной хирургии появился серьезный конкурент.
Вместе с тем было бы необъективным посвятить сообщение только дифирамбам радиохирургии. Эта технология, как и любая другая, имеет свои недостатки и ограничения. Так, киберножу по вполне понятным причинам недоступны полые органы — желудок, кишечник, мочевой пузырь и т.п. Технология неприменима у больных с интракраниальными опухолями объемом более 120 см2 — даже не столько из-за того, что опухоль велика, а в значительно большей мере из-за угрозы постлучевого отека мозга в замкнутом пространстве черепной коробки. Именно эти и другие ограничения и привели к тому, что существующие технологии лечения онкологических больных постепенно переходят от конкуренции к сотрудничеству.
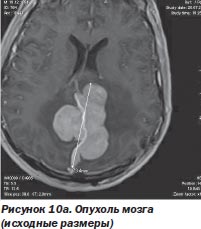
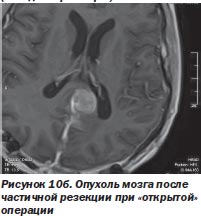
Перспективность такого сотрудничества наглядно иллюстрирует комбинированное лечение менингеом, когда хирург уменьшает объем опухоли при открытом вмешательстве, не стремясь удалить зону роста путем остеотомии, тем более если она расположена в труднодоступном месте. Этот этап операции с успехом выполняется при использовании киберножа. Такая тактика была с успехом использована нами у 11 больных (рис. 10а, 10б).
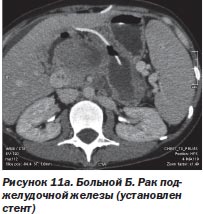
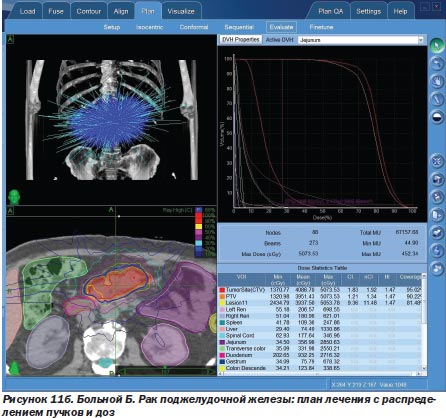
Другой пример. При раке поджелудочной железы первый этап лечения можно ограничить только билиодигестивным шунтированием (стентирование общего желчного протока, создание билиодигестивного анастомоза) или вообще только наружным желчным свищем, а на втором этапе провести радиохирургическое воздействие, что и было использовано у 3 больных (рис. 11а, 11б).
Подводя итоги вышеизложенному, можно утверждать, что радиохирургия сегодня стала полноправным участником лечебного процесса в онкологии. Ее неоспоримыми преимуществами являются отсутствие необходимости в общем обезболивании, отсутствие возможных интра- и послеоперационных осложнений, практическое отсутствие послеоперационной летальности. Важно и то, что пациент не нуждается в пребывании в стационаре.
Следовательно, радиохирургия обладает бесспорной привлекательностью и как самостоятельная технология лечения, и как эффективный способ этапного лечения при комбинированной терапии — даже у тех, кого ранее считали иноперабельными.
1. Пиковский Д.Л. Философия экстренной хирургии. Теория — практика. — М.: Триада-Х, 2001. — 224 с.
2. Федоров С.П. Хирургия на распутье // Хирургия. — 1926. — Т. 10, кн. 1. — С. 16-23.
3. Adler J.R., Murphy M.J., Chang S.D., Hancock S.L. Image-guided robotic radiosurgery // Neurosurgery. — 1999. — Vol. 44. — Р. 1299-1307.
4. Chang S.D., Gibbs I.C., Sakamoto G.T., Lee E., Oyelese A., Adler J.R. Staged stereotactic irradiation for acoustic neuroma // Neurosurgery. — 2005. — Vol. 56. — Р. 1254-1261.
5. Chang S.D., Main W., Martin D.P., Gibbs I.C., Heilbrun M.P. An analysis of the accuracy of the «CyberKnife»: a robotic frameless stereotactic radiosurgical system // Neurosurgery. — 2003. — Vol. 52. — Р. 140-146.
6. Kuo J.S., Yu C., Petrovich Z., Apuzzo M.L. The «CyberKnife» stereotactic radiosurgery system: description, installation, and an initial evaluation of use and functionality // Neurosurgery. — 2003. — Vol. 53. — Р. 1235-1239.
7. Radbill A.E., Fiveash J.F., Falkenberg E.T. et al. Initial treatment of melanoma brain metastases using «gamma knife» radiosurgery: an evaluation of efficacy and toxicity // Cancer. — 2004. — Vol. 101. — Р. 825-833.
8. Wowra B., Siebels M., Muacevic A. et al. Repeated «gamma knife» surgery for multiple brain metastases from renal cell carcinoma // J. Neurosurg. — 2002. — Vol. 97. — Р. 785-793.
