Газета «Новости медицины и фармации» 18(341) 2010
Вернуться к номеру
Применение Аугментина™ (амоксициллина/клавуланата) в лечении внебольничных инфекций дыхательных путей: обзор продолжающегося развития инновационного антимикробного средства
Авторы: Anthony R. White, Clive Kaye, GlaxoSmithKline, Harlow, UK, James Poupard, Brian Wynne, GlaxoSmithKline, Collegeville, PA, USA, Rienk Pypstra, Basilea Pharmaceutica, Basel, Switzerland, Gary Woodnutt, Diversa Corp., San Diego, CA, USA
Версия для печати
Продолжение. Начало в № 17 (340), 2010
Сохранение клинической и бактериологической эффективности амоксициллина/клавуланата в среде растущей резистентности
Устойчивость к антибиотикам, назначаемым при инфекциях дыхательных путей, стала частым явлением во всем мире и угрожает снижением эффективности ряда обычно назначаемых антибиотиков [59, 70–72]. Анализ клинических неудач не выявил опубликованных данных о случаях неэффективности адекватных доз пенициллина вследствие антимикробной резистентности S.pneumoniae. [59]. Однако имеется ряд сообщений о бактериологически подтвержденной неэффективности у пациентов, получающих антибиотики других классов [59, 70, 73–75]. Например, клиническая неэффективность при внебольничных пневмониях (ВБП), вызванных эритромицин-резистентными штаммами S.pneumoniae, была зафиксирована у пациентов, получающих лечение макролидами [59, 70, 73]. Кроме того, появление макролид-резистентных штаммов может происходить непосредственно во время терапии данной группой антибиотиков [74]. Было также опубликовано несколько сообщений о клинической неэффективности левофлоксацина при ВБП, вызванной S.pneumoniae, включая появление резистентности непосредственно во время лечения данным препаратом. Данный феномен связали с субоптимальным ФК/ФД профилем левофлоксацина в дозе 500 мг/день в отношении штаммов S.pneumoniae, когда субингибирующие концентрации препарата стали причиной появления резистентных штаммов in vivo [59, 75].
Поддержание бактериологической эффективности при растущей резистентности зависит от достижения ФК/ФД целей, позволяющих добиться эрадикации бактерий. Уже известные и новые антибиотики, а также оптимизация существующей терапии должны оцениваться именно исходя из этого, а не в клинических исследованиях, единственная задача которых — сравнивать терапевтический эффект разных препаратов [50, 51, 76].
M.catarrhalis и H.influenzae
Амоксициллин/клавуланат был изначально разработан для того, чтобы расширить противомикробный спектр амоксициллина и покрыть β-лактамаз-продуцирующие виды [1]. В течение более чем 20 лет использования амоксициллина/клавуланата это его свойство стало особенно важным, поскольку распространенность β-лактамаз-продуцирующих бактерий увеличилась во многих странах. В бактериальных изолятах, собранных в 2001 г. в рамках Alexander Project (непрерывное мониторинговое исследование, начатое в 1992 г. и оценивающее чувствительность патогенов, вызывающих внебольничные инфекции дыхательного тракта у взрослых, к противомикробным средствам. — Прим. пер.), на долю β-лактамаз-продуцирующих изолятов H.influenzae приходилось 10–20 % от их общего количества, собранного на территории Швейцарии, Испании, России и Великобритании, и 20–30 % и более от тех изолятов, которые были собраны в Гонконге, США, Саудовской Аравии, Сингапуре и Франции (рис. 1) [71]. Наличие β-лактамазной продукции у M.catarrhalis в 2001 г. варьировало от 88,9 % в Германии до 100 % во Франции и Гонконге. Распространенность β-лактамаз-негативных ампициллин-резистентных штаммов H.influenzae (BLNAR; МПК ≥ 4 мг/л) остается низкой во всем мире. В Alexander Project 2001 г. только 14/2240 (0,6 %) штаммов, собранных по всему миру, были BLNAR; из них 11 было из Японии, 1 — из Саудовской Аравии и 2 — из США. В Alexander Project 2001 г. не было собрано ни одного β-лактамаз-позитивного амоксициллин/клавуланат-резистентного штамма H.influenzae (BLPACR) [71].
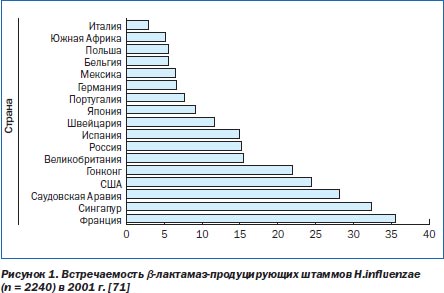
В рамках Alexander Project на территории всего мира была изучена чувствительность H.influenzae в соответствии с контрольными ФК/ФД точками амоксициллина (≤ 2 мг/л) и амоксициллина/клавуланата (для традиционных форм — ≤ 2 мг/л; для высокодозовых форм (2000/125 мг два раза в день взрослым и 90/6,4 мг/кг/день детям) — ≤ 4 мг/л) [71]. Чувствительность к амоксициллину варьировала между 78 % и 86 % в период с 1992 по 2001 г. и в целом отражала распространенность продукции β-лактамаз (83 % в 2001 г.; МПК50 0,5 мг/л, МПК90 > 16 мг/л, диапазон значений МПК 0,12–16 мг/л и более). Чувствительность H.influenzae к традиционным формам амоксицил- лина/клавуланата составила > 97 %, а при использовании высокодозовых форм чувствительными были > 99 % изолятов (98 % и 100 % в 2001 г. соответственно; МПК50 0,5 мг/л, МПК90 1 мг/л, диапазон значений МПК 0,12–16 мг/л). Что касается M.catarrhalis, то в 2001 г. 94 % изолятов этих бактерий продуцировали β-лактамазу, однако чувствительность к традиционным формам амоксициллина/клавуланата составила 99 %, а к высокодозовым — 100 % (МПК50 0,12 мг/л, МПК90 0,25 мг/л, диапазон значений МПК 0,12–4 мг/л). В целом приведенные результаты свидетельствуют об эффективной роли клавуланата в защите амоксициллина от β-лактамаз в H.influenzae и M.catarrhalis.
Бактериологическая эффективность амоксициллина/клавуланата в отношении H.influenzae и M.catarrhalis. Эффективность стандартных доз амоксицилли- на/клавуланата против H.influenzae по сравнению с амоксициллином и макролидами была оценена в модели пневмонии у крыс с использованием профилей противомикробной концентрации, эквивалентных достигаемым в плазме крови человека. Спустя 3 дня лечения β-лактамаз-позитивного штамма H.influenzae амоксициллин/клавуланат (эквивалентный человеческой дозе амоксициллина/клавуланата 500/125 мг, назначаемой два раза в день) достоверно более эффективно снижал количество бактерий по сравнению с амоксициллином (500 мг два раза в день) (p ≤ 0,01). Амоксициллин/клавуланат был также достоверно эффективнее эритромицина (эквивалентного человеческой дозе 500 мг, назначаемой три раза в день) и кларитромицина (250 или 500 мг два раза в день) (p < 0,01). Количество бактерий после лечения любой из приведенных доз кларитромицина не отличалось достоверно от контроля (p > 0,05) [77]. В точно таком же эксперименте с использованием того же штамма H.influenzae осуществили сравнение амоксициллина/клавуланата с амоксициллином и азитромицином. Снова амоксициллин был неэффективен, с результатом, сходным с нелеченным контролем (p > 0,05). Азитромицин (эквивалентный человеческой дозе 500 мг, назначаемой один раз в день) достоверно снижал количество бактерий по сравнению с контролем, но был не настолько эффективен, как амоксицил- лин/клавуланат [77].
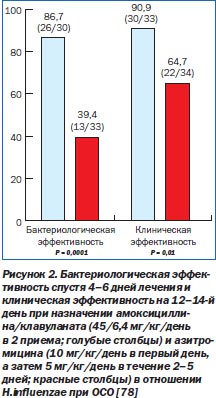 Эти результаты подтверждаются клиническими данными при изучении пациентов с острым средним отитом (ОСО). Повторный тимпаноцентез позволяет сравнить жидкость среднего уха (в норме асептическую) до и после антимикробной терапии. Такой подход позволяет дать очень точную оценку эффекта антимикробной терапии [50, 52]. В одиночном слепом исследовании, включавшем 238 новорожденных и детей с ОСО, амоксициллин/клавуланат (45/6,4 мг/кг/день в два приема в течение 10 дней) сравнили с азитромицином (10 мг/кг в первый день, а затем 5 мг/кг/день в течение 4 дней). Через 4–6 дней лечения среди пациентов, у которых при скрининге была выделена H.influenzae, 26 из 30 (86,7 %) пациентов в группе амоксициллина/клавуланата достигли состояния бактериологической ремиссии по сравнению с 13 из 33 (39,4 %) пациентами в группе азитромицина (р = 0,0001) [78]. Более высокая бактериологическая эффективность амоксициллина/клавуланата обусловила достоверно более высокую клиническую эффективность против H.influenzae и на 12–14-й день (p = 0,01) (рис. 2) [78]. В этом же исследовании назначение амоксициллина/клавуланата привело к 100% частоте бактериологической ремиссии M.catarrhalis (в группе азитромицина не были идентифицированы случаи с M.catarrhalis) [78].
Эти результаты подтверждаются клиническими данными при изучении пациентов с острым средним отитом (ОСО). Повторный тимпаноцентез позволяет сравнить жидкость среднего уха (в норме асептическую) до и после антимикробной терапии. Такой подход позволяет дать очень точную оценку эффекта антимикробной терапии [50, 52]. В одиночном слепом исследовании, включавшем 238 новорожденных и детей с ОСО, амоксициллин/клавуланат (45/6,4 мг/кг/день в два приема в течение 10 дней) сравнили с азитромицином (10 мг/кг в первый день, а затем 5 мг/кг/день в течение 4 дней). Через 4–6 дней лечения среди пациентов, у которых при скрининге была выделена H.influenzae, 26 из 30 (86,7 %) пациентов в группе амоксициллина/клавуланата достигли состояния бактериологической ремиссии по сравнению с 13 из 33 (39,4 %) пациентами в группе азитромицина (р = 0,0001) [78]. Более высокая бактериологическая эффективность амоксициллина/клавуланата обусловила достоверно более высокую клиническую эффективность против H.influenzae и на 12–14-й день (p = 0,01) (рис. 2) [78]. В этом же исследовании назначение амоксициллина/клавуланата привело к 100% частоте бактериологической ремиссии M.catarrhalis (в группе азитромицина не были идентифицированы случаи с M.catarrhalis) [78].
Доступны также данные об эффективности амоксициллина/клавуланата в отношении H.influenzae при обострении хронического бронхита (ОХБ). В открытом рандомизированном исследовании амоксициллина/клавуланата (875/125 мг два раза в день в течение 8 дней) и азитромицина (500 мг один раз в день в течение 3 дней) при ОХБ у 15 пациентов из группы амоксициллина/клавуланата и 26 пациентов из группы азитромицина в начале исследования из мокроты изолировали H.influenzae. В конце лечения (10 дней после начала терапии) H.influenzae не определялись в мокроте всех пациентов, получавших амоксициллин/клавуланат, в то время как в азитромициновой группе H.influenzae персистировали у 13 пациентов (50,0 %) [79].
Приведенные данные из исследований на животных и клинических исследований ОСО и ОХБ свидетельствуют о сохранении высокой эффективности амоксициллина/клавуланата в отношении H.influenzae и M.catarrhalis, включая β-лактамаз-продуцирующие штаммы. И наоборот, неблагоприятный ФК/ФД профиль макролидов может объяснить более низкую частоту бактериологической эрадикации в исследованиях с этим антибиотиком [52].
S.pneumoniae
Развитие и распространение пенициллиновой, макролидной и фторхинолоновой резистентности у S.pneumoniae вызывает особые опасения [59, 72, 84, 85]. В рамках Alexander Project (2001 г.) было обнаружено, что в 10 из 16 стран распространенность пенициллиновой резистентности и в 13 из 16 стран распространенность макролидной резистентности превышает 10 % (рис. 3; для пенициллина МПК50 0,03 мг/л, МПК90 2 мг/л, диапазон значений МПК ≤ 0,015–8 мг/л; для эритромицина МПК50 0,06 мг/л, МПК90 > 32 мг/л, диапазон значений МПК ≤ 0,015– > 32 мг/л) [71]. Распространенность макролидной резистентности превышала пенициллиновую резистентность в 14 из 16 стран. S.pneumoniae является наиболее частым патогеном, изолируемым при инфекциях дыхательного тракта, и развитие клонов, резистентных к множеству классов противомикробных средств, является значительной терапевтической проблемой [23, 86].
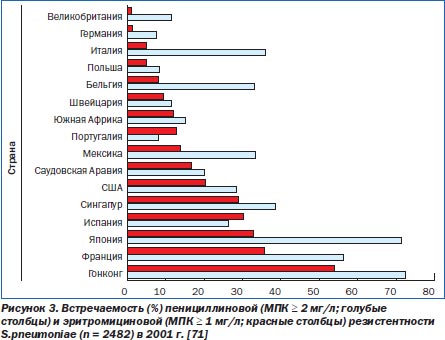
В рамках Alexander Project с 1992 по 2001 г. была зафиксирована высокая распространенность пенициллиновой резистентности у штаммов S.pneumoniae (в целом на уровне 10–24 %, хотя распространенность резистентности сильно варьирует между разными странами) [71].
Бактериологическая эффективность амоксициллина/клавуланата в отношении S.pneumoniae. Эксперименты на животных свидетельствуют о том, что амоксициллин/клавуланат бактериологически эффективен в отношении многих пенициллин-резистентных штаммов S.pneumoniae. Например, в модели пневмонии у крыс дозы, эквивалентные амоксициллину/клавуланату 500/125 мг, назначаемому три раза в день, и 875/125 мг, назначаемому два раза в день, были протестированы в отношении пенициллин-резистентного штамма S.pneumoniae (МПК пенициллина и амоксицил- лина/клавулановой кислоты 2 мг/л). Обе дозы достоверно уменьшали количество бактерий в легких по сравнению с контролем (p < 0,01) [57].
Влияние увеличения МПК пенициллина на бактериологическую эффективность может быть прослежено в исследованиях ОСО с повторным тимпаноцентезом. В ходе одного из таких исследований, включавшего 188 пациентов, сравнили амоксициллин 50 мг/кг/день с цефаклором 40 мг/кг/день [89]. Во время исследования не было отмечено терапевтической неэффективности в группе амоксициллина (0 из 10) в отношении штаммов S.pneumoniae, для которых МПК пенициллина были < 0,1 мг/л, в то время как в группе цефаклора терапевтическая неэффективность была отмечена у 3 из 16 пациентов (18,8 %). Если лечение было направлено на штаммы S.pneumoniae, для которых МПК пенициллина ≥ 2 мг/л, то бактериологическая неэффективность наблюдалась у 14 (28,6 %) пациентов из группы амоксициллина и 11 из 17 (64,7 %) пациентов в группе цефаклора [89].
Детская суспензия амоксицилли- на/клавуланата в дозе 90/6,4 мг/кг/день была разработана для борьбы с рецидивирующим или персистирующим ОСО, вызванным S.pneumoniae с пониженной чувствительностью к пенициллину или β-лактамаз-продуцирующими H.influenzae и M.catarrhalis. Высокая эффективность этой лекарственной формы в отношении пенициллин-резистентных штаммов была показана в несравнительном клиническом исследовании амоксициллина/клавуланата 90/6,4 мг/кг/день, назначаемого в виде двух разделенных доз, у детей с ОСО. В исходных условиях наиболее частыми патогенами, изолируемыми у детей при повторном тимпаноцентезе на 4–6-й день, были S.pneumoniae (122 из 222), затем H.influenzae (58 из 222) или оба этих патогена (37 из 222). Спустя 4–6 дней лечения амоксициллином/клавуланатом 90/6,4 мг/кг/день при повторном тимпаноцентезе эрадикация S.pneumoniae наблюдалась у 97,6 % (122 из 125) пациентов [37]. Причем это было справедливо для разных штаммов с повышенными МПК пенициллина: 87/87 пенициллин-чувствительных (МПК ≤ 0,6 мг/л), 1/1 — с промежуточной чувствительностью к пенициллину (МПК 1 мг/л) и 31/34 пенициллин-резистентных (МПК 2–4 мг/л) (в трех случаях МПК были недоступны) [37]. В целом эрадикация наступила у 95,6 % (172 из 180) пациентов, прошедших бактериологическую оценку. В одном из последних сравнительных исследований амоксициллин/клавуланат 90/6,4 мг/кг/день приводил к эрадикации 96,0 % (72 из 75) S.pneumoniae по сравнению с 80,4 % (74 из 92) на фоне приема азитромицина (p < 0,01). В рамках этого исследования амоксициллин/клавуланат приводил к эрадикации 92,0 % (23 из 25) пенициллин-резистентных S.pneumoniae по сравнению с 54,5 % (12 из 22) в группе азитромицина (p < 0,01) [83]. Таким образом, приведенные исследования свидетельствуют о том, что амоксициллин/клавуланат 90/6,4 мг/кг/день является эффективной терапией в отношении рецидивирующих или персистирующих ОСО, вызванных штаммами S.pneumoniae с пониженной чувствительностью к пенициллину и/или β-лактамаз-продуцирующими H.influenzae и M.Catarrhalis [37, 83]. Сравнительная оценка высокой дозы амоксициллина/клавуланата 90/6,4 мг/кг/день и стандартной дозы амоксицилли- на/клавуланата 45/6,4 мг/кг/день показала, что обе формы в целом хорошо переносятся и что между профилями побочных эффектов обеих форм достоверных различий нет [96].
Амоксициллин/клавуланат и потенциал для его развития при распространении резистентности
Формирование резистентности in vitro
Резистентность к β-лактамным антибиотикам у S.pneumoniae развивается главным образом за счет изменения пенициллин-связывающих белков (ПСБ), что приводит к снижению аффинности к этим средствам [97]. Эти изменения происходят за счет рекомбинации генов из других видов стрептококков и нативных генов, что приводит к образованию мозаичных ПСБ [98].
Бета-лактамы различаются по их способности приводить к мутации чувствительных штаммов S.pneumoniae с нативными генами и увеличивать резистентность у штаммов, уже имеющих в мозаичных генах мутации, ответственные за резистентность. Эти различия исследованы в экспериментах по воспроизведению мутаций, где были показаны различия между пенициллинами (включая амоксициллин ± ± клавулановую кислоту) и различными цефалоспоринами по их способности приводить к формированию резистентных штаммов бактерий [99, 100]. Было выяснено, что для пенициллинов характерна относительно низкая частота формирования мутантов в первом поколении, которые были кросс-резистентны к цефалоспоринам и имели небольшое увеличение в МПК. В противоположность этому некоторые из тестированных цефалоспоринов (цефиксим, цефуроксим, цефподоксим, цефтриаксон, цефотаксим [99] и цефаклор [100]) характеризовались высокой частотой формирования мутаций с различным профилем резистентности и относительно большим увеличением МПК, хотя МПК пенициллинов для этих штаммов оставались низкими или даже снижались [99, 100]. Таким образом, приведенные лабораторные данные подтверждают тот факт, что пенициллины, такие как амоксициллин ± ± клавуланат, имеют более низкий потенциал для формирования резистентности у пневмококков по сравнению с рядом цефалоспоринов.
Резистентность к макролидам и фторхинолонам приобретается посредством иных механизмов, нежели те, которые лежат в основе пенициллиновой резистентности. Однако резистентность к макролидам и фторхинолонам также может формироваться за счет экспозиции субингибирующими антимикробными концентрациями этих средств. Формирование резистентности под влиянием амоксициллина ± клавулановой кислоты по сравнению с азитромицином была изучена Pankuch и соавт. [100]. Субкультивирование с амоксициллином/клавулановой кислотой приводило к увеличению МПК только в одном из шести пенициллин-чувствительных штаммов (МПК амоксициллина увеличивалась с 0,008 до 0,125 мг/л), МПК оставались стабильными во всех четырех тестированных изолятах с умеренной чувствительностью к пенициллину [100]. Для сравнения: азитромицин легко приводил к формированию резистентных штаммов — у восьми из десяти штаммов наблюдалось увеличение МПК азитромицина (увеличение с 0,03–4 до 0,5–256 мг/л и более) [100]. Что касается хинолонов, то Davies и соавт. [101] показали, что ципрофлоксацин, грепафлоксацин, спарфлоксацин и левофлоксацин приводили к повышению МПК во всех десяти тестированных штаммах S.pneumoniae, тровафлоксацин — в восьми из десяти штаммов; во всех штаммах наблюдалось по крайней мере восьмикратное увеличение МПК минимум для трех из этих пяти лекарственных средств. В отличие от этого субкультивирование с субингибиторующими концентрациями амоксициллина/клавулановой кислоты приводило к увеличению МПК только у одного из десяти штаммов после 24 пассажей (с 0,015 до 0,125 мг/л) [101]. Эти исследования свидетельствуют о том, что амоксициллин/клавуланат имеет низкий потенциал для формирования in vitro резистентных штаммов S.pneumoniae по сравнению с азитромицином и хинолонами.
Подобные исследования, выполненные в отношении формирования резистентности у H.influenzae, свидетельствуют о том, что амоксициллин/клавуланат или цефподоксим не приводят к развитию резистентных штаммов, хотя МПК цефподоксима увеличивались до уровня, подобного тому, который наблюдается у β-лактамаз-негативных ампициллин-резистентных штаммов [102]. МПК другого цефалоспорина — цефпрозила — увеличилась у одного β-лактамаз-негативного штамма. В противоположность этому макролиды азитромицин и кларитромицин быстро приводили к формированию резистентных штаммов H.influenzae (азитромицин 10/10 штаммов, кларитромицин 8/10 штаммов) с очень высокими МПК (≥ 256 мг/л для азитромицина и кларитромицина) у 6/10 штаммов [102].
Исследования мутаций, приведенные выше, свидетельствуют о потенциале развития резистентности к фиксированным концентрациям антибиотиков in vitro. Кроме того, ряд других факторов играет роль в формировании резистентности и распространении ее на клинические ситуации: концентрация антибиотика в месте инфекции, длительность экспозиции субингибирующими концентрациями, природная бактерицидная активность антибиотика против патогена (то есть ФК/ФД параметры), наличие полирезистентных патогенов, клональное распространение и биологическая значимость резистентности для организма [103].
ФК/ФД моделирование резистентности in vitro
Влияние ФК/ФД параметров на развитие резистентности было исследовано Thorburn и соавт. [104] в фармакодинамической модели in vitro, воспроизводящей концентрации антибиотиков в плазме крови человека после их перорального приема два раза в день. Цефподоксим в дозе 200 мг был неэффективен против пенициллин-резистентного штамма S.pneumoniae (T > МПК 0 % для 12 ч периода дозирования), в то время как цефуроксим в дозе 500 мг изначально проявил бактерицидную активность, хотя между приемами доз культуры снова вырастали (T > МПК 25 %). Амоксициллин 500 мг с T > МПК 29 % проявлял бактерицидный эффект в отношении этого штамма в течение 6 ч после приема дозы, но к 24 ч отмечался некоторый рост бактерий. Амоксициллин/клавуланат 875/125 мг с T > МПК 42 % быстро проявлял бактерицидное действие и к 48 ч снижал количество бактерий до границы определения, при этом возобновление роста бактерий не наблюдалось вплоть до 54 ч (конец эксперимента) [104]. Субоптимальные ФК/ФД параметры и возобновление роста бактерий при использовании цефподоксима и цефуроксима приводило к появлению штаммов с 4–8-кратным увеличением МПК цефподоксима и 8-кратным увеличением МПК цефуроксима по сравнению с изолятами из нелеченных контрольных культур. Для этих штаммов была характерна кросс-резистентность с цефотаксимом, но не пенициллином G или амоксициллином/клавуланатом. В отличие от этого в изолятах из культур, на которые воздействовали амоксициллином или амоксициллином/клавуланатом, не наблюдалось изменений чувствительности к пенициллину G или цефалоспоринам [104].
Для того чтобы спрогнозировать влияние различных ФК/ФД профилей на резистентность, было использовано также математическое моделирование. Например, модель, использующая различные концентрации амоксициллина и цефиксима в популяции S.pneumoniae со смешанным профилем резистентности, показала, что даже в низких концентрациях (0,12 и 0,25 мг/л) амоксициллин проявлял тенденцию к формированию скорее низко-, чем высокоуровневой резистентности [105]. При более высокой концентрации (0,5 мг/л) повторное назначение амоксициллина приводило к исключению резистентных штаммов. Для сравнения: цефиксим проявлял тенденцию к формированию высокоуровневой резистентности во всех взятых концентрациях [105].
Для того чтобы пероральные цефалоспорины проявляли бактериологическую эффективность, необходимо, чтобы параметр T > МПК составлял по крайней мере 40 % (по сравнению с 30–40 % для пенициллинов) [55]. При сравнении данных, полученных в рамках Alexander Project, с данными о том, какие препараты и как прописываются врачами, было сделано предположение, что увеличение пенициллин-резистентных S.pneumoniae во Франции было связано с пропорциональным увеличением прописывания пероральных цефалоспоринов, которые не достигали требуемых ФК/ФД целей и способствовали распространению новых резистентных клонов [106]. Кроме того, способность новых препаратов из класса макролидов приводить к формированию резистентности, как полагают, связано с длительным временем полувыведения этих средств [24, 107]. Например, азитромицин имеет время полувыведения 68 ч, что означает, что полная элиминация этого препарата из тела человека произойдет через 14–20 дней после его приема. В это время концентрация азитромицина в плазме крови будет ниже МПК, приводя к формированию «окна» для развития резистентных штаммов [24, 105, 107]. При сравнении данных, полученных в рамках Alexander Project, с данными о том, какие препараты и как прописываются врачами, было обнаружено, что наблюдается высокая корреляция между макролидной резистентностью S.pneumoniae и использованием новых, более длительно действующих макролидов, таких как азитромицин и кларитромицин (r = 0,896), однако подобная корреляция отсутствовала для более старых, короткодействующих макролидов (r = 0,099) [107].
Эрадикация бактерий и резистентность
Dagan и соавт. [50] пришли к выводу о том, что недостаточная эрадикация инфекционных организмов может привести к развитию резистентных клонов, которые реколонизируют слизистые оболочки после прекращения антимикробной терапии. Следовательно, абсолютное количество резистентных популяций будет увеличиваться и за пролиферацией внутри организма хозяина следует трансмиссия резистентных клонов другим хозяевам. Это приводит к формированию негативной спирали, по которой резистентные клоны распространяются, делая эрадикацию более трудной, приводя к дальнейшему распространению клона [50].
Применение противомикробных средств, ФК/ФД профиль которых предполагает эрадикацию бактерий, не только максимизирует потенциал элиминации колонизирующих или инфицирующих бактерий, но и минимизирует экспозицию бактериальных патогенов в субингибирующих концентрациях, препятствуя формированию резистентных штаммов [50, 51, 70, 73]. Использование средств с оптимальным ФК/ФД профилем дает дополнительное преимущество эрадикации бактерий, резистентных к другим средствам или дозам [50, 51, 60].
Профиль безопасности
В целом амоксициллин/клавуланат хорошо переносится. Самый крупный анализ безопасности и переносимости амоксициллина/клавуланата был выполнен Neu и соавт. [93]. Авторы оценили данные о безопасности амоксициллина/клавуланата из 374 клинических статей, опубликованных в период с 1979 по 1992 г. (32 440 пациентов). Во всех случаях были использованы лекарственные формы, назначаемые три раза в день. У большей части из 32 440 пациентов не наблюдалось побочных эффектов. Из 13 % пациентов, сообщивших о наличии побочных эффектов, наиболее часто встречались желудочно-кишечные явления (8,4 %). Среди других побочных эффектов, наблюдавшихся с частотой более 1 %, были явления со стороны кожи и ее придатков (1,4 %). Частота побочных эффектов со стороны верхних отделов желудочно-кишечного тракта составила 2,5 %, при этом наиболее часто встречалась тошнота (1,4 %). Среди побочных эффектов со стороны нижних отделов желудочно-кишечного тракта (3,7 %) наиболее часто встречалась диарея (3,4 %).
При сравнении исследований, включавших в общей сложности 1191 взрослого пациента с бронхитами, пневмониями или осложненной инфекцией мочевыводящего тракта, не было обнаружено достоверных различий в частоте побочных эффектов среди больных, получавших амоксициллин/клавуланат в дозе 875/125 мг два раза в день и амоксициллин/клавуланат в дозе 500/125 мг три раза в день. Однако в сравнительном исследовании пациенты, получавшие 875/125 мг два раза в день, менее часто сообщали о развитии умеренной или тяжелой диареи (2,9 %) по сравнению с теми пациентами, которые получали 500/125 мг три раза в день (4,9 %) (p = 0,28) [32].
Результаты трех исследований ОСО свидетельствуют о том, что частота диареи может быть ниже для амоксициллина/клавуланата с двухкратным приемом по сравнению с его формами с трехкратным приемом [35, 36, 116]. При сравнении амоксициллина/клавуланата 70/10 мг/кг/день, назначаемого в виде двух разделенных доз (n = 231), и 60/15 мг/кг/день, назначаемого в виде трех разделенных доз (n = 232), было обнаружено, что диарея развивается в 6,7 и 10,7 % случаев соответственно [35]. Аналогично, в исследовании, оценивавшем более часто используемые формы амоксицил- лина/клавуланата — 45/6,4 мг/кг/день, назначаемую в виде двух разделенных доз (n = 209), и 40/10 мг/кг/день, назначаемую в виде трех разделенных доз (n = 206), было сообщено о развитии диареи у 7,2 и 10,7 % пациентов соответственно [116].
Выводы
Несмотря на то, что развитие и распространение резистентности основных патогенов дыхательного тракта снизило эффективность некоторых часто используемых антибиотиков, особенно с субоптимальными ФК/ФД параметрами [50, 60, 70, 117], эффективность амоксициллина/клавуланата остается стабильной в течение более 20 лет его клинического применения. Оптимизация ФК/ФД профиля с целью оптимизации эрадикации бактерий не только увеличивает вероятность клинического излечения, но также уменьшает появление и распространение резистентности [50, 51, 103]. Для амоксициллина/клавуланата (и других β-лактамов) T > МПК является ключевым ФК/ФД параметром, влияющим на возможность эрадикации бактерий [55, 56, 60]. Амоксициллин/клавуланат обладает благоприятным ФК/ФД профилем, позволяющим сохранить бактериологическую эффективность против β-лактамаз-продуцирующих штаммов H.influenzae и M.catarrhalis, а также многих клинических штаммов S.pneumoniae со сниженной чувствительностью к пенициллину [51, 77, 78, 118]. Улучшение ФК/ФД профиля за счет увеличения дозы амоксициллина (амоксициллин/клавуланат 90/6,4 мг/кг/день) или добавление компонента с пролонгированным действием (амоксициллин/клавуланат 2000/125 мг, принимаемый два раза в день) приводит к увеличению противомикробной эффективности за счет включения большинства пенициллин-резистентных штаммов, включая те, у которых повышены МПК амоксициллина (вплоть до 4 мг/л) [33, 37, 60, 61, 65, 67, 82, 83, 90, 95, 114].
Поскольку большая часть инфекций дыхательных путей лечится эмпирически, при выборе антибиотика важно учесть все основные патогены, включая их резистентные штаммы. Рекомендации по проведению антимикробной терапии при инфекциях дыхательных путей должны базироваться на принципе достижения полной эрадикации бактерий [50, 51] и использовании ФК/ФД предикторов максимальной эрадикации бактерий, плюс должны учитываться местные особенности резистентных штаммов [51]. Несмотря на то, что руководства по лечению инфекций дыхательных путей различаются по всему миру, амоксициллин и амоксициллин/клавуланат, как правило, включаются в эти рекомендации (табл. 1) [22–34, 119–122]. Это связано с высокой клинической и бактериологической эффективностью этих средств в отношении S.pneumoniae и амоксициллина/клавуланата в отношении β-лактамаз-продуцирующих H.influenzae и M.Catarrhalis [27–32, 34–36]. Кроме того, амоксициллин/клавуланат имеет хорошо известный установленный профиль безопасности [93] и широкое клиническое применение более чем у 819 млн пациентов во всем мире.
Появление высокодозовых форм, таких как амоксициллин/клавуланат 90/6,4 мг/кг/день, назначаемый два раза в день, обеспечивает дополнительную эффективность при лечении бактериальных инфекций, включающих патогены с пониженной чувствительностью к другим антибиотикам, и минимизирует формирование новых резистентных штаммов. Инновационные комбинации амоксициллина и клавуланата, ранее и вновь разработанные для борьбы с резистентными бактериями, продолжают быть ценным клиническим инструментом для лечения инфекций дыхательных путей в настоящее время и в будущем.
Перевод к.м.н. А.В. Савустьяненко
Journal of Antimicrobial Chemotherapy (2004) 53, Suppl. S1, i3–i20
Печатается при поддержке компании «ГлаксоСмитКляйн»
Список литературы находится в редакции
