Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Клиническая эффективность фиксированной комбинации амлодипина с лизиноприлом (Экватор) у больных стабильной стенокардией и/или безболевой ишемией миокарда в сочетании с артериальной гипертензией
Авторы: С.Г. Суджаева, О.А. Суджаева, Н.А. Казаева, Н.К. Байрамова, Республиканский научно-практический центр «Кардиология», г. Минск, Беларусь
Версия для печати
Стабильная стенокардия — широко распространенная форма хронической ишемической болезни сердца (ИБС), в том числе среди лиц трудоспособного возраста. По данным Фремингемского исследования, стенокардия напряжения служит первым симптомом ИБС у 40,7 % мужчин и у 56,5 % женщин. Наиболее часто ишемия миокарда при стабильной стенокардии возникает вследствие дисбаланса между потребностью миокарда в кислороде и возможностью его доставки, обусловленного стенозирующим атеросклерозом коронарных артерий. При таком механизме развития стенокардии препаратами первой линии, патогенетически обоснованными, являются бета-адреноблокаторы, снижающие потребность миокарда в кислороде, а также нитраты, повышающие возможность его доставки.
Широкое внедрение коронароангиографии (КАГ), современных методов визуализации миокарда (мультиспиральная компьютерная томография сердца и коронарных сосудов, перфузионная сцинтиграфия миокарда при физической нагрузке и фармакологических пробах) позволило выявить другие механизмы развития коронарной недостаточности. Вследствие этого в Международной классификации болезней 10-го пересмотра появились новые рубрики: бессимптомная ишемия миокарда (I25.6), стенокардия с документально подтвержденным спазмом (I20.8).
Клиницисты большое внимание уделяют патологическому состоянию, относящемуся к разряду кардиалгий, — синдрому Х (синонимы: стенокардия с поражением сосудов малого диаметра, болезнь малых сосудов (small vessel disease), синдром Джорлина — Лайкоффа (Gorlin — Licoff syndrome)). Чаще синдром Х расценивается как микроваскулярная стенокардия, под которой понимают появление боли в левой половине грудной клетки с признаками ишемии миокарда — типичных приступов стенокардии и депрессии сегмента ST ≥ 1,5 мм продолжительностью более 1 мин на фоне отсутствия атеросклероза коронарных артерий и спазма эпикардиальных венечных артерий при коронарографии. Патоморфологическим субстратом такой стенокардии является преходящее уменьшение коронарного кровотока (динамический коронарный стеноз), обычно связанное с изменением сосудистого тонуса, спазмом, дисфункцией эндотелия [3].
Безболевая ишемия миокарда и вазоспастическая стенокардия вызывают наибольшее число вопросов как в диагностике, так и в лечении. В популяции только 40–50 % всех больных стенокардией знают о наличии у них болезни и получают соответствующее лечение, в 50–60 % случаев заболевание остается нераспознанным. Главный вопрос — целесообразность назначения антиангинальных препаратов и оптимизация терапии с точки зрения улучшения качества жизни и прогноза.
Особенного внимания требуют пациенты молодого возраста, у которых распространенность стенокардии составляет от 0,4 до 1,6 %. Вместе с тем у молодых лиц низкая приверженность к постоянному приему препаратов.
Артериальная гипертензия (АГ) — признанный фактор риска развития ИБС. Однако при начальных стадиях АГ артериальное давление (АД) может быть повышено нестойко, при назначении антигипертензивных препаратов есть риск развития гипотензии, что также снижает приверженность больных к лечению.
Известно также, что у лиц с чрезмерным снижением АД в ночное время (например, на фоне традиционной антигипертензивной терапии) возможно развитие ишемических осложнений как церебрального, так и коронарного характера за счет снижения перфузионного давления в заинтересованных артериях локального уровня. Чрезмерная суточная вариабельность АД также приводит к утяжелению поражения органов-мишеней. Повышение среднесуточного пульсового АД расценивают как прогностически неблагоприятный фактор [5].
В ситуации, когда необходимо лечить больного с сочетанной патологией (вазоспастическая стенокардия + АГ), препарат Экватор фирмы «Гедеон Рихтер» (Венгрия) является (в качестве рабочей гипотезы) наиболее перспективным препаратом выбора.
Экватор представляет собой фиксированную комбинацию амлодипина в дозе 5 мг и лизиноприла в дозе 10 мг.
Высокая эффективность и безопасность Экватора у больных с АГ доказана ранее [5].
Влияние фиксированной комбинации лизиноприла и амлодипина на течение АГ в сочетании со стабильной стенокардией и/или безболевой ишемией миокарда с различными патофизиологическими механизмами ее формирования изучено мало.
Влияние Экватора на суточную вариабельность АД у пациентов с верифицированной стенокардией и/или безболевой ишемией миокарда без стойкого повышения АД и/или с начальными проявлениями АГ также изучено недостаточно.
Цель настоящего исследования — изучение влияния препарата Экватор на течение стенокардии (с различными патофизиологическими механизмами ее формирования) и/или безболевой ишемии миокарда в сочетании с артериальной гипертензией, а также переносимости препарата больными.
В исследование не включали пациентов с нестабильной стенокардией, инсультом и/или транзиторной ишемической атакой (ТИА) в предшествующие 3 месяца, гипертрофической кардиомиопатией, хронической сердечной недостаточностью выше НIIА ст. (по классификации Василенко — Стражеско). Исключались лица, имевшие в анамнезе указания на пароксизмы мерцательной аритмии, остановку кровообращения, желудочковую тахикардию, фибрилляцию желудочков, гиперчувствительность к компонентам препарата (амлодипину и/или лизиноприлу), а также больные с экстрасистолией, требующей постоянного приема противоаритмической терапии; с хронической почечной недостаточностью с уровнем креатинина > 200 мг/дл, печеночной недостаточностью с повышением ферментов более чем в 2 раза выше верхней границы нормы, гемодинамически значимыми стенозами клапанов, активным миокардитом, констриктивным перикардитом, блокадой ножек пучка Гиса.
В исследование было включено 35 больных в возрасте от 26 до 71 года (в среднем 48,9 ± 1,7 года). Мужчины составили большинство в изученном контингенте больных — 23 чел. (66 %). Лиц женского пола было 12 (34 %), в том числе 3 из них имели отягощенный гинекологический анамнез: у 1 диагностирован эндометриоз с дисфункциональными маточными кровотечениями, у 1 — фибромиома матки, еще у 1 — кисты молочной железы.
У 9 (26 %) больных диагноз стабильной стенокардии напряжения (ФК I–II по Канадской классификации) был выставлен до включения в исследование. Еще у 19 (54 %) ишемия миокарда носила безболевой характер и была выявлена при рандомизации, по данным теста с физической нагрузкой (велоэргометрическая проба — ВЭП). Под ишемией миокарда физического напряжения понимали возникновение депрессии сегмента ST ≥ 1 мм и/или подъема сегмента ST ≥ 1,5 мм при ВЭП.
Еще 7 (20 %) пациентов, включенных в исследование, предъявляли жалобы на боли в грудной клетке коронарного характера. При проведении ВЭП у этих лиц ишемия миокарда не была выявлена. Ишемия миокарда была диагностирована при проведении холтеровского мониторирования ЭКГ (ХМЭКГ) и выполнении нагрузочного теста с информационной нагрузкой — информационной пробы (ИП).
Артериальная гипертензия с АД ≥ 160/100 мм рт.ст. без приема антигипертензивных препаратов или с АД ≥ 140/90 мм рт.ст. на фоне предшествующего лечения имела место у 22 (63 %) пациентов. У 13 (37 %) пациентов повышение АД носило нестойкий характер. У 2 пациентов АГ носила симптоматический нефрогенный характер: в анамнезе у 1 был гломерулонефрит, у 1 — мочекаменная болезнь с нефроптозом.
Сахарный диабет был у 2 (6 %) обследованных, 2 чел. за год до включения в исследование перенесли ТИА. У 5 из 35 пациентов в анамнезе имелась хроническая дуоденальная язва, у 2 — узловой зоб.
Исходная комплексная оценка функционального состояния системы кровообращения (I тест) проводилась после отмены предшествующей антиангинальной терапии (за исключением короткодействующего нитроглицерина) и гипотензивных препаратов в течение 2 суток.
Затем назначалось лечение Экватором в дозе по 1 таблетке 1 раз в сутки. Через 2 недели приема Экватора при отсутствии улучшения клинического состояния и/или достижения АД ≤ 140/90 мм рт.ст. доза препарата увеличивалась в 2 раза. При снижении систолического АД < 100 мм рт.ст. и/или диастолического АД < 60 мм рт.ст. доза Экватора уменьшалась в 2 раза.
Эффективность курсового лечения Экватором оценивалась через 12 недель после начала приема препарата (II тест).
Объективизация функционального состояния системы кровообращения проводилась с помощью ИП, ВЭП, суточного мониторирования АД (СМАД), ХМЭКГ, трансторакальной эхокардиографии (ТТ ЭхоКГ).
Для оценки субъективной переносимости Экватора использовалась психометрическая шкала оценки побочных эффектов UKU (Udvald for Kliniske Undersogelser Scale) [4], которая содержит список из 26 побочных эффектов и отдельную графу — другие побочные эффекты. Наличие и степень выраженности каждого из них оценивалась в баллах: от 0 (отсутствие) до 3 (тяжелая степень). Выраженность симптомов оценивалась объективно в ходе расспроса, который дополнялся клиническими наблюдениями и информацией, полученной из медицинской документации.
Информационная проба с контролем АД, ЭКГ и центральной гемодинамики (ЦГД) проводилась согласно известной методике [6]. ЭКГ регистрировалась в 12 стандартных отведениях с помощью аппаратно-программного комплекса для записи ЭКГ «Интекард-3» на 1, 3, 5-й минутах предъявления информационной нагрузки и через 1 минуту после прекращения ИП. В аналогичные сроки с помощью аппаратно-программного комплекса для записи реограмм «Импекард-4» записывались и автоматически обрабатывались параметры ЦГД. При ИП выявлялись механизмы формирования психогенной ишемии миокарда. Развитие ишемических изменений ЭКГ при гипокинетическом варианте реагирования параметров ЦГД свидетельствовало о психогенной ишемии миокарда вазоспастического генеза. При гиперкинетическом варианте реагирования ЦГД в процессе теста с психоэмоциональной нагрузкой диагностировали психогенную ишемию миокарда на фоне повышения потребности миокарда в кислороде [8].
Велоэргометрическая проба проводилась в вертикальном положении больного на велоэргометре утром, не ранее чем через 2 часа после приема пищи. Исследование выполнялось при отсутствии общепринятых противопоказаний для проведения нагрузочных тестов [1] с помощью аппаратно-программного комплекса Schiller по непрерывной ступенчато возрастающей методике, начиная с мощности нагрузки 25 Вт с последующим увеличением мощности на 25 Вт каждые 3 минуты, вплоть до появления критериев прекращения нагрузочных исследований [1]. Под толерантностью к физической нагрузке (ТФН) понимали максимально достигнутую при ВЭП мощность.
Суточное мониторирование АД осуществлялось с использованием портативного регистратора фирмы Philips. В дневное время интервал между измерениями составлял 15 мин, в ночное время — 30 мин. Рассчитывали следующие показатели: среднесуточное систолическое АД (ср. сут. САД); среднесуточное диастолическое АД (ср. сут. ДАД); среднее АД (ср. АД); вариабельность САД; вариабельность ДАД — как величину среднеквадратичного отклонения значений АД; индекс времени (ИВ) САД; ИВ ДАД; пульсовое давление (ПД).
При среднесуточном АД > 140/90 мм рт.ст. диагностировали «несомненно повышенное АД». Гипертоническую нагрузку оценивали по показателю ИВ, равному проценту измерений, в которых величины АД превышали нормальные значения (130/80 мм рт.ст.). Общепринятая норма ИВ составляла менее 25 % в течение суток.
Суточный индекс (СИ) характеризовал степень ночного снижения показателей САД и ДАД, которая составляла 10–20 %, что соответствовало оптимальному суточному биоритму АД. В зависимости от СИ пациентов разделили на следующие группы: dipper — пациенты с неизмененным суточным биоритмом; non-dipper — лица с недостаточным снижением АД в ночное время (СИ < 10 %); over-dipper — чрезмерное снижение АД в ночное время (СИ > 20 %); night-peaker — показатели АД в ночное время превышают дневные.
Суточное мониторирование параметров ЭКГ осуществлялось с помощью кардиомониторной системы Medilog FD5 (Oxford Instruments Medical). Пациентам предлагалось соблюдать предписанный двигательный режим, вести дневник самоконтроля.
Расположение электродов осуществлялось в 7 точках, что позволило регистрировать ЭКГ в 3 отведениях. Полученные данные обрабатывались на персональном компьютере с последующей клинической интерпретацией параметров ЭКГ.
При проведении анализа учитывались следующие показатели: паузы более 2 секунд; появление суправентрикулярной и желудочковой экстрасистолии, наджелудочковой тахикардии (минимальная ЧСС для начала эпизода — 130 уд/мин, максимальная ЧСС для конца эпизода — 110 уд/мин); пароксизмальной суправентрикулярной (при внезапном ускорении ритма более 120 уд/мин) и желудочковой тахикардии (более 3 подряд желудочковых комплексов). Диагностически значимыми считались эпизоды депрессии сегмента ST ≥ 1 мм от исходного уровня, длившиеся не менее 1 минуты. Учитывалось количество ишемических изменений в течение суток, средняя амплитуда смещения сегмента ST, продолжительность ишемии миокарда суммарно за сутки и средняя длительность одного эпизода.
Эхокардиографическое исследование выполнялась на приборе VIVID 5 компании GE датчиком 2,5 МГц с использованием М-модального и двухмерного исследований, а также цветного и импульсного допплеровского измерений. Исследование проводилось из парастернального и апикального доступов в положении больного лежа на левом боку. С целью оценки систолической функции миокарда левого желудочка (ЛЖ) определялись следующие показатели: конечный диастолический объем (КДО), конечный систолический объем (КСО), фракция выброса (ФВ) ЛЖ, наличие или отсутствие зон нарушения локальной сократимости миокарда ЛЖ. Для оценки диастолической функции миокарда ЛЖ исследовались основные показатели трансмитрального кровотока: максимальная скорость раннего диастолического наполнения (пик Е), максимальная скорость наполнения в систолу предсердий (пик А), соотношение пиков Е и А, время изоволюмического расслабления ЛЖ — IVRT, время замедления кровотока раннего диастолического наполнения ЛЖ — DT [10]. Оценивалось отсутствие или наличие гипертрофии миокарда ЛЖ. Измерялось среднее давление в легочной артерии (ДЛА ср.).
Статистическая обработка данных проводилась с использованием программы Microsoft Excel 2003. Достоверность оценивалась с помощью парного t-критерия Стьюдента. Различия считали достоверными при р < 0,05.
Исходно тест с физической нагрузкой проведен у 34 пациентов, один больной не смог выполнить ВЭП из-за исходного повышения АД > 180/100 мм рт.ст. У него ишемия миокарда верифицирована при ХМЭКГ и при ИП.
Ишемия миокарда физического напряжения спровоцирована у 23 (68 %) из 34 обследованных лиц (табл. 1).
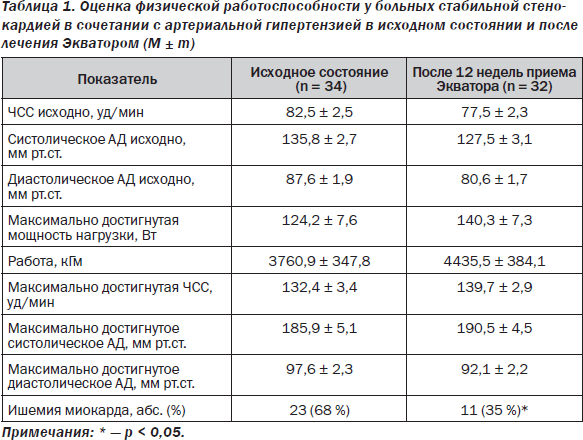
Еще 3 (8 %) пациентов прекратили выполнение ВЭП в связи с достижением частоты сердечных сокращений, составляющей 75 % от максимальной для возраста каждого обследуемого, т.е. проба была расценена как отрицательная. Остальные 8 больных прекратили ВЭП по субъективным причинам (усталость, головная боль, невозможность осваивать нагрузку из-за слабости в ногах). Показатели, характеризующие физическую работоспособность, представлены в табл. 1.
У 11 (32 %) обследованных в процессе выполнения ВЭП отмечалась неадекватная реакция АД в ответ на физическую нагрузку (ФН): 5 больных прекратили выполнение теста из-за критического повышения АД ≥ 230/120 мм рт.ст., у 6 пациентов регистрировался неадекватный прирост АД (на 2-й минуте ВЭП при мощности ФН 100 Вт АД ≥ 180/100 мм рт.ст.).
Большинство пациентов имели высокую толерантность к физической нагрузке: 29 (85 %) из 34 обследованных освоили мощность 100 Вт и более. Высокую ТФН можно объяснить, с одной стороны, молодым возрастом обследованных (у молодых лиц, как правило, имеет место определенная тренированность миокарда и скелетной мускулатуры по отношению к ФН). С другой стороны, высокая толерантность к ФН характерна для лиц с наклонностью коронарных артерий к вазоспазму [8, 9, 11, 12]. Последнее объясняется развитием феномена «рабочей гиперемии» в условиях динамической физической нагрузки (компенсаторной вазодилатацией коронарных артерий в ответ на закономерное увеличение потребности миокарда в кислороде) при отсутствии критического стеноза коронарных артерий [7].
Наличие высокой наклонности коронарных артерий к вазоспазму у включенных в настоящее исследование лиц со стенокардией и АГ подтверждается следующими установленными фактами.
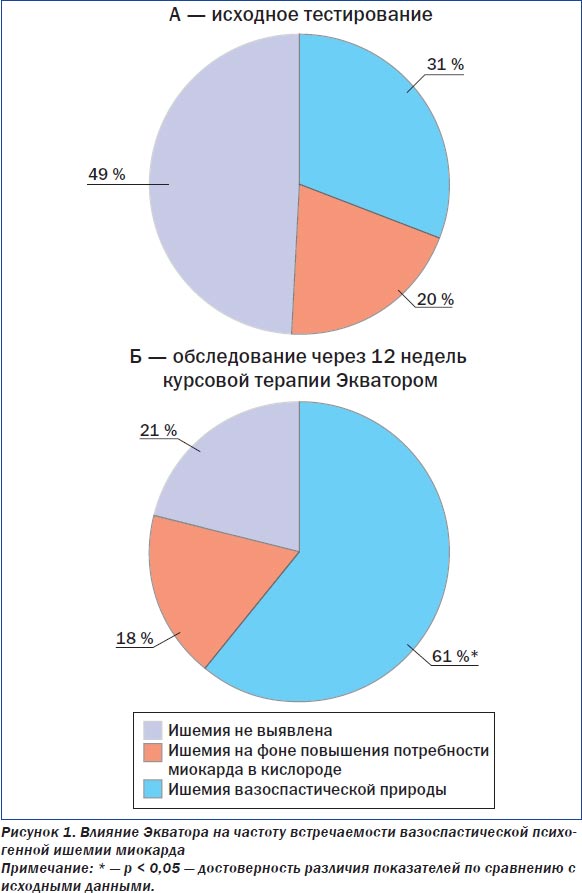
Психогенная ишемия миокарда при тесте с психоэмоциональной (информационной) нагрузкой (ИП) выявлена у 24 (69 %) из 35 обследованных лиц. При этом в структуре психогенной ишемии миокарда преобладал вазоспастический механизм — ишемия миокарда вазоспастического генеза установлена у 17 (49 %) из 35 обследованных пациентов (рис. 1).
Оценка переносимости физической нагрузки после курса терапии Экватором показала, что ишемия миокарда в условиях ВЭП возникала в 2 раза реже, чем при исходном тестировании, — у 11 (35 %) из 31 обследованного (при исходном тестировании — у 23 (68 %) из 34, р < 0,05). Почти в 4 раза возросло число пациентов, которые смогли достичь субмаксимальной ЧСС без изменений на ЭКГ ишемического характера: если при исходном обследовании проба была расценена как отрицательная лишь у 3 (8 %) из 34 обследованных, то после 12 недель приема Экватора — у 11 (35 %) из 31 (р < 0,05).
На фоне терапии Экватором существенно уменьшилось число пациентов с гипертензивной реакцией на физическую нагрузку — от 11 (32 %) из 34 обследованных исходно до 6 (19 %) из 31 пациента при контрольном тестировании (р < 0,05).
Существенного прироста ТФН по данным ВЭП выявлено не было (табл. 1), что связано с исходно высокой ТФН в среднем по группе.
Показательна позитивная динамика толерантности к ФН у больной Б., 43 лет: исходно у пациентки ишемические изменения развились при низкой мощности нагрузки — 25 Вт. После 12 недель приема Экватора при повторной велоэргометрии мощность нагрузки в 75 Вт выполнена без патологического знака: ишемия на нагрузку, в 3 раза более высокую по сравнению с исходным тестированием, не развилась. Критерием прекращения ВЭП стала усталость нижних конечностей.
После курсового лечения Экватором очень низкая ТФН (25 Вт) не выявлена ни у одного из обследованных (при исходном тестировании была отмечена у 2 пациентов).
После 12 недель приема Экватора существенно улучшилась переносимость психоэмоциональной нагрузки по данным ИП (рис. 1). При тесте II психогенная ишемия миокарда отсутствовала у 21 (61 %) из 34 обследованных, что существенно (в 2 раза) чаще, чем в исходном состоянии, — 31 % случаев (р < 0,05). Число ишемических реакций при ИП уменьшилось преимущественно за счет снижения наклонности коронарных артерий к вазоспазму. В структуре механизмов развития психогенной ишемии миокарда частота развития вазоспастической ишемии снизилась от 49 % при тесте I до 21 % при тесте II (р < 0,05).
Удельный вес психогенной ишемии на фоне повышения потребности миокарда в кислороде существенно не изменился: 20 % при тесте I и 18 % — при тесте II (р < 0,05).
Установленные факты свидетельствуют о высокой эффективности лечебного действия композитного препарата Экватор (комбинация лизиноприла с амлодипином) по купированию наклонности коронарных артерий к вазоспазму в условиях психоэмоциональной стрессовой реакции у больных стенокардией в сочетании с АГ.
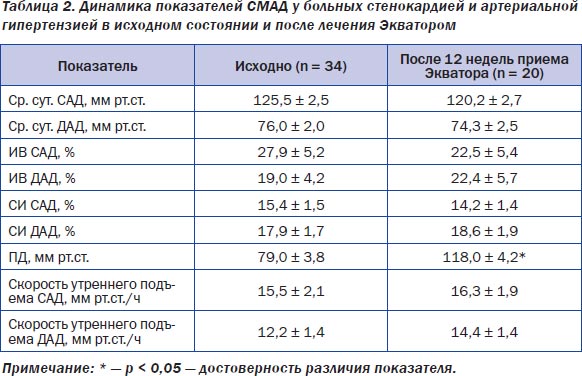
СМАД выполнили исходно у 13 обследованных (табл. 2). К категории dipper отнесены лишь 4 (31 %) из них; суточная вариабельность АД у остальных 69 % обследованных, была менее физиологичной: 5 (38 %) оказались в категории over-dipper, еще 4 (31 %) — non-dipper.
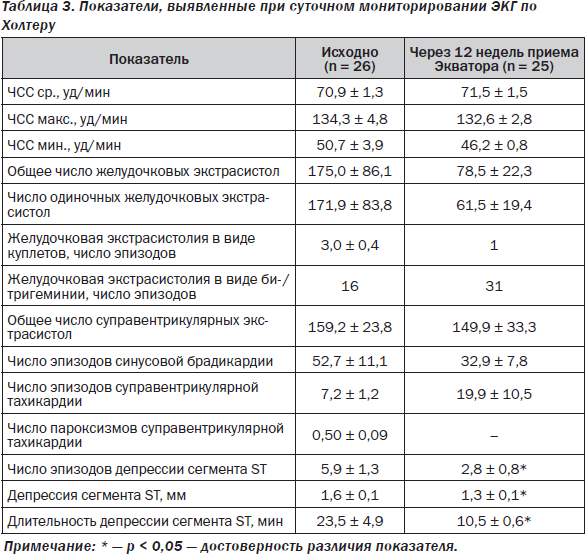
Суточное мониторирование ЭКГ по Холтеру в исходном состоянии выполнили у 26 пациентов, его результаты представлены в табл. 3.
Эпизоды депрессии сегмента ST (от 1 до 30) зарегистрированы при повседневной физической активности у 19 (73 %) из 26 обследованных, еще у одного пациента регистрировались подъемы сегмента ST ≥ 1,5 мм.
Результаты курсового лечения пациентов Экватором
Несмотря на то что у 13 (37 %) из 35 обследованных отсутствовала стойкая АГ, под влиянием терапии Экватором не произошло чрезмерного снижения как САД, так и ДАД (табл. 2).
По данным ХМЭКГ, через 12 недель приема Экватора выявлено уменьшение числа эпизодов депрессии сегмента ST от 5,9 ± 1,3 до 2,8 ± 0,8 (р < 0,05). Степень выраженности депрессии сегмента ST также достоверно уменьшилась от 1,6 ± 0,1 мм до 1,3 ± 0,1 мм (р < 0,05). Длительность депрессии сегмента ST при этом стала меньше: 23,5 ± 4,9 и 10,5 ± 0,6 мин соответственно (р < 0,05).
Кроме того, под влиянием терапии Экватором не произошло достоверного роста ЧСС, числа желудочковых и суправентрикулярных нарушений ритма (табл. 3), что обусловливает преимущество входящего в Экватор амлодипина над антагонистами кальция из группы дигидропиридинов, способствующих развитию тахикардии, а также производных бензодиазепинов и фенилалкиламинов, вызывающих брадикардию и нарушения АВ-проводимости.
До начала лечения ТТ ЭхоКГ выполнена у 33 пациентов. Основные эхокардиографические показатели и их динамика в процессе лечения представлены в табл. 4.
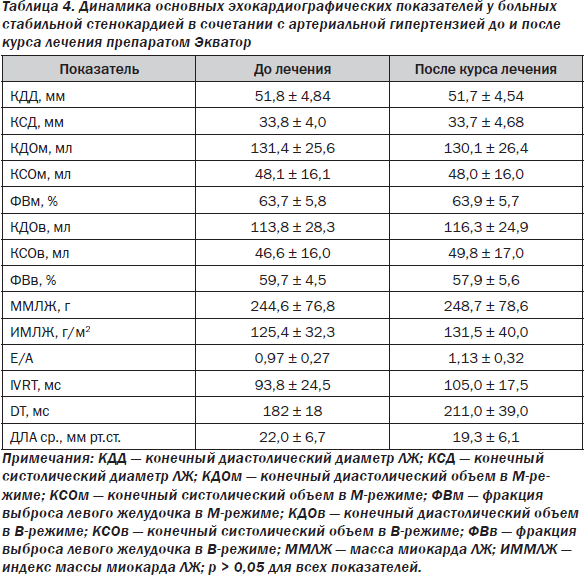
В исходном состоянии (до начала лечения) ни у одного из обследованных пациентов не выявлено гемодинамически значимого поражения клапанного аппарата.
В целом по группе не выявлено снижения глобальной сократительной функции миокарда ЛЖ (средний показатель ФВ составил 63,7 ± 5,8 % при исследовании в М-режиме и 59,7 ± 4,5 % при исследовании по методу Симпсона). Однако при этом у 27,3 % обследованных (9 из 33 человек) выявлены зоны нарушения локальной сократимости миокарда ЛЖ.
У 12 (36,4 %) из 33 обследованных пациентов имело место нарушение диастолической функции миокарда ЛЖ по типу замедленного расслабления ЛЖ (соотношение пиков Е и А < 1,0).
Ни у одного из пациентов не выявлено эхокардиографических признаков легочной гипертензии — показатель ДЛА ср. составил 22,0 ± 6,7 мм рт.ст. при норме до 30 мм рт.ст.
При тесте II (через 12 недель приема препарата) эхокардиографическое обследование выполнено у 31 пациента. В целом по группе не выявлено достоверных различий изучаемых показателей по сравнению с тестом I (табл. 4). Вместе с тем у 4 (44,4 %) из 9 пациентов, у которых при тесте I имело место нарушение локальной сократимости миокарда ЛЖ, после курса лечения отмечалось улучшение последней: у 3 (33,3 %) выявлено уменьшение количества зон гипокинеза, у 1 (11,1 %) не выявлено зон нарушения локальной сократимости миокарда ЛЖ. Для объяснения возможного механизма улучшения локальной сократимости у этих 4 пациентов проанализирована динамика переносимости психоэмоциональных нагрузок. Установлено, что у 3 из 4 пациентов до лечения по результатам ИП выявлялась ишемическая реакция вазоспастической природы. После курса лечения ни у одного из 3 пациентов не выявлена психогенная ишемия миокарда. Таким образом, уменьшение наклонности коронарных артерий к вазоспазму после курса лечения приводит к улучшению коронарной перфузии, что проявляется уменьшением количества зон нарушения локальной сократимости миокарда ЛЖ.
Среди 12 пациентов, до начала лечения имевших нарушение диастолической функции миокарда ЛЖ (Е/А < 1,0), у 3 (25 %) после курса лечения отмечено улучшение диастолической функции миокарда ЛЖ (Е/А > 1,0). Следует отметить, что у этих троих пациентов отсутствовали указания на наличие в анамнезе клинических проявлений стенокардии и стойкого повышения АД. При сопоставлении результатов ТТ ЭхоКГ и суточного мониторирования АД установлено, что среднесуточные значения САД и ДАД у этих пациентов после курса лечения были в пределах нормы. Таким образом, нормализация АД под влиянием терапии у пациентов с «мягкой» гипертонией способствует улучшению диастолической функции миокарда ЛЖ.
Переносимость препарата Экватор в целом была хорошей, тем не менее побочные эффекты появились у 6 (17 %) из 35 пациентов, степень их выраженности варьировала от 1 до 18 баллов по шкале UKU. Отмена препарата из-за плохой переносимости потребовалась лишь у 2 (6 %) из 35 пациентов. У одного из них выраженность побочных действий составила 18 баллов по UKU, что привело к отмене препарата через 1 неделю терапии. У пациента появились выраженные нарушения концентрации внимания (3 балла), астения (3 балла), сонливость (3 балла), внутреннее беспокойство (3 балла), диарея (3 балла), умеренная депрессия (1 балл), умеренные нарушения мышечного тонуса (2 балла). Еще один пациент отказался принимать препарат в связи с выраженным сердцебиением (3 балла) и ощущением слабости, потемнением в глазах при перемене положения тела (1 балл). Ощущение сердцебиения было субъективным, данными ХМЭКГ не подтверждено.
Еще у 4 пациентов отмечено появление незначительно выраженных побочных действий (1 балл по UKU), не потребовавших отмены Экватора: у одного пациента имели место нарушение концентрации внимания, повышенная утомляемость, сонливость, незначительное снижение памяти, внутреннее беспокойство, эмоциональная индифферентность и прибавка массы тела (всего 8 баллов). Еще у одного отмечалась легкая головная боль (1 балл). Один из обследованных отметил появление умеренного дискомфорта в груди (2 балла), еще один — умеренное сердцебиение (2 балла; ощущения не подтверждены данными ХМЭКГ). Одна пациентка отмечала легкую сонливость (1 балл). Суммарные распространенность и выраженность побочных эффектов Экватора представлены в табл. 5.
Ни у одного из включенных в исследование пациентов не развились столь типичные для монотерапии амлодипином отеки нижних конечностей и характерный для всех иАПФ кашель. Таким образом, комбинация лизиноприла с амлодипином является рациональной, так как позволяет снизить вероятность развития побочных эффектов, характерных для монотерапии каждым из составляющих препарата.
Через 12 недель приема Экватора большинство пациентов отметили улучшение самочувствия, уменьшение потребности в нитроглицерине, уменьшение приступов стенокардии, в первую очередь при психоэмоциональных нагрузках. Субъективное улучшение самочувствия подтверждено результатами инструментальных методов обследования, представленными выше.
По данным исследования PREVENT, амлодипин достоверно замедлял прогрессирование коронарного атеросклероза (данные КАГ), каротидного атеросклероза (данные ультразвуковых методов исследования). Кроме того, амлодипин способствовал снижению числа госпитализаций по поводу нестабильной стенокардии и госпитализаций с целью реваскуляризации миокарда [13].
Результаты CAPE II свидетельствуют о том, что амлодипин, как в виде монотерапии, так и в комбинации с атенололом и изосорбид-5-мононитратом, так же как дилтиазем, существенно уменьшал число ишемических эпизодов у больных со стенокардией. Однако амлодипин оказался предпочтительнее у пациентов, пропускающих очередной прием препарата или принимающих препарат нерегулярно.
В исследовании CAPARES при назначении амлодипина у больных стабильной стенокардией за 2 недели до коронарной ангиопластики и в течение 4 месяцев после вмешательства снижалась частота развития смерти, инфаркта миокарда и повторной реваскуляризации [16].
В СASTLE изучена частота развития побочных эффектов при приеме амлодипина и кандесартана. При хорошей гипотензивной эффективности обоих препаратов 9,4 % пациентов досрочно прекратили прием амлодипина из-за развития побочных эффектов. Периферические отеки развились у 1,6 % пациентов на фоне приема амлодипина и ни у одного из принимавших кандесартан, усталость — у 1,6 и 8,9 %, головная боль — у 7 и 6,5 %, головокружение — у 3,9 и 6,5 % обследованных соответственно [17].
В результате настоящего клинического исследования получены данные, косвенно указывающие на позитивное влияние композитного препарата Экватор на состояние коронарного кровотока у больных стенокардией в сочетании с АГ. Доказано лечебное действие препарата на ликвидацию наклонности коронарных артерий к вазоспазму, развивающемуся в условиях психоэмоциональной стрессовой реакции.
Доказано, что Экватор, являющийся фиксированной комбинацией лизиноприла с амлодипином, производства компании ОАО «Гедеон Рихтер» (Венгрия) существенно улучшает переносимость физической и психоэмоциональной нагрузки у больных со стенокардией в сочетании с нетяжелой артериальной гипертензией. При этом препарат безопасен и хорошо переносится.
Улучшение переносимости физической нагрузки достигается за счет уменьшения числа развития дисбаланса между потребностью миокарда в кислороде при физической нагрузке. Сокращается число пациентов с неадекватной гипертензивной реакцией при физической нагрузке.
Улучшение переносимости психоэмоциональной нагрузки достигается за счет уменьшения наклонности коронарных артерий к вазоспазму, что делает перспективным использование Экватора как при вазоспастической стенокардии, так и при кардиальном синдроме Х, в том числе обусловленном спазмом неэпикардиальных коронарных артерий. Уменьшение наклонности коронарных артерий к вазоспазму после курса лечения Экватором приводит к улучшению коронарной перфузии, что проявляется уменьшением количества зон нарушения локальной сократимости миокарда ЛЖ у ряда больных.
Комбинация лизиноприла с амлодипином позволяет снизить вероятность развития побочных эффектов, характерных для монотерапии каждым из них.
Даже у пациентов с нестойко повышенным артериальным давлением удается достичь надежного контроля АД в течение суток без изменения циркадного ритма и чрезмерного снижения АД, которое является потенциально опасным в отношении гипоперфузии головного мозга и сердца.
Большой период полувыведения лизиноприла и амлодипина позволяет достичь стабильного гипотензивного и антиангинального эффекта при приеме Экватора 1 раз в сутки, что, безусловно, повышает приверженность к лечению и делает препарат особенно ценным у лиц молодого возраста.
Результаты проведенного исследования позволили сформулировать новое дополнительное показание к приему Экватора — психогенная ишемия миокарда вазоспастической природы у больных с артериальной гипертензией.
1. Альхимович В.М. Эргометрические тесты в кардиологии // Инструментальные методы исследования в кардиологии / Под ред. Г.И. Сидоренко. — Минск, 1994. — С. 206-224.
2. Карпов Ю.А. // Кардиология. — 2005. — № 2. — С. 91-94.
3. Комитет экспертов ВНОК. Диагностика и лечение стабильной стенокардии: Российские рекомендации // Кардиоваскулярная терапия и профилактика. — 2008. — Т. 7, № 6, при- лож. 4.
4. Смулевич А.Б. Депрессии в общей медицине: Рук-во для врачей — М.: Мединформагентство, 2001. — 256 с.
5. Сорока Н.Ф., Бельская Е.С. // Здравоохранение. — 2007. — № 7. — С. 17-21.
6. Суджаева С.Г., Сидоренко Г.И., Русецкая В.Г., Альхимович В.М. Информационная проба с электрокардиографическим и гемодинамическим контролем для диагностики ИБС, выявления наклонности коронарных артерий к вазоспазму и оценки сократительных резервов миокарда: Инструкция по применению МЗ РБ. № 03-024-871. — МЗ БССР, 1987. — 10 с.
7. Суджаева С.Г., Альхимович В.М., Савченко А.Н. // Кардиология. — 1989. — № 8. — С. 19-21.
8. Суджаева С.Г. Тест «информационная проба» в диагностической практике у больных ишемической болезнью сердца // Инструментальная диагностика сердечно-сосудистых заболеваний: Пособие для практ. врачей. — Минск, 1993. — С. 141-150.
9. Суджаева С.Г. Психофизиологический аспект реабилитации больных инфарктом миокарда: Автореф. дис… д-ра мед. наук. — Минск, 1994. — 55 с.
10. Шиллер Н.Б., Осипов М.А. Клиническая эхокардиография. — М.: Практика, 2005. — 344 с.
11 . Ando J., Kimura S., Kobayashi T. et al. // Jap. Heart J. — 1979. — Vol. 20, № 6. — P. 907-917.
12. Cain R.S., Ferguson R.M., Til- lisch J.H. // Heart & Lung. — 1979. — Vol. 8, № 6. — P. 1122-1226.
