Газета «Новости медицины и фармации» Пульмонология (344) 2010 (тематический номер)
Вернуться к номеру
Ступінчаста антибактеріальна терапія позалікарняних пневмоній: досвід використання цефподоксиму проксетилу
Авторы: І.Г. Палій, С.Г. Заїка, Вінницький національний медичний університет ім. М.І. Пирогова, Н.С. Скічко, Вінницька міська поліклініка № 2, С.В. Косенко, Комунальний заклад «Міська поліклініка № 1»
Версия для печати
Позалікарняні пневмонії відносяться до найбільш частих інфекцій дихальних шляхів. Незважаючи на наявність в арсеналі лікарів великої кількості антибактеріальних засобів, лікування позалікарняних пневмоній викликає певні труднощі, а результати часто незадовільні. Летальність при позалікарняних пневмоніях становить від 3 до 18 % [11, 14, 19].
В Україні захворюваність на пневмонії серед дорослого населення за 1998–1999 роки становить відповідно 469,5 і 403,2, а смертність — 10,0 і 12,7 на 100 тис. населення [7].
Найбільш частими збудниками позалікарняних пневмонії є пневмококи й гемофільна паличка [11]. Зросла роль грамнегативних бактерій та стафілококів, особливо у пацієнтів із супутніми хронічними захворюваннями. Епідеміологічною особливістю є стабільне підвищення частоти пневмоній, викликаних мікоплазмами та хламідіями. Це пояснюється збільшенням міграції населення, зміною звичних місць відпочинку (різко зросло число осіб, які відвідують південні країни) і, відповідно, зростанням епідеміологічних контактів, багатогодинними перельотами і т.д. У почастішанні випадків легеневого хламідіозу, ймовірно, відіграє роль велика кількість міських птахів, інфікованих хламідіями.
Антибіотикотерапія — основний вид лікування пневмоній. У той же час на тлі зростання кількості антибактеріальних препаратів вона все більшою мірою стає мистецтвом, що полягає в умінні в кожній клінічній ситуації точно вибрати необхідний препарат, визначити оптимальні шляхи його введення, терпляче дочекатися ефекту і вчасно припинити лікування після одержання необхідної динаміки.
Складність лікування пневмонії значною мірою пов’язана зі збільшенням резистентності збудників до антибіотиків: S.pneumoniae — до бензилпеніциліну, H.influenzae і Enterobacteriaceae — до амінопеніцилінів і цефалоспоринів I покоління [11].
Особливого значення в умовах ринкової економіки набувають фармакоекономічні підходи до розробки раціональних схем терапії хворих. Актуальність вивчення ефективності різних схем лікування зумовлена значними витратами на антибактеріальні препарати, вартістю витратних матеріалів (одноразові шприци, голки, системи для внутрішньовенних вливань, стерильні розчини). Зарубіжні автори включають у вартість лікування і вартість консультацій [2, 4, 8].
У зв’язку з цим у ряді країн в останні роки стали застосовувати ступінчасту антибактеріальну терапію (sequential therapy, streamline therapy, step-down therapy, switch therapy, follow-on therapy, deescalation therapy) [5, 6].
Ступінчаста терапія — двохетапне застосування антибактеріальних препаратів із переходом із парентерального на непарентеральний (як правило, пероральний) шлях введення в найбільш короткі строки з урахуванням клінічного стану пацієнта.
Основна ідея ступінчастої терапії — очевидні переваги для хворого, лікаря та лікувального закладу (скорочення тривалості госпітального періоду та перехід на лікування у психологічно комфортніших домашніх умовах; мінімізація ризику нозокоміальних інфекцій; зниження витрат, що пов’язано з меншою вартістю пероральних антибіотиків, відмова від додаткових витрат на введення лікарського засобу в парентеральній формі і т.д.) при збереженні високої якості медичної допомоги відповідає сучасним рекомендаціями щодо ведення хворих на позалікарняну пневмонію [8, 9, 17]. У цьому документі справедливо підкреслено, що в даний час надання високоефективної та високоякісної медичної допомоги має здійснюватися найбільш економічним шляхом.
Вартість лікування при застосуванні ступінчастої терапії знижується на 30–60 %, що особливо важливо для соціально малозабезпечених верств населення [5, 6].
Клінічна ефективність ступінчастої терапії при лікуванні позалікарняних пневмоній без шкоди для якості була доведена в ряді досліджень. Перші роботи із ступінчастої терапії з’явилися в медичній літературі ще в 1970-ті роки, коли T. Tetzlaff і співавт. (1978), C. Prober, A. Yaeger (1979) у своїх роботах показали клінічну ефективність ступінчастого підходу при лікуванні остеомієліту та інфекційного артриту, використовуючи різні парентеральні і пероральні β-лактамні антибіотики.
Ступінчаста антибактеріальна терапія пневмонії вперше була проведена в 1985 р. F. Shann і співавт., які використовували у дітей Папуа-Нової Гвінеї тактику послідовного призначення хлорамфеніколу в парентеральній, а потім пероральній медикаментозних формах. Однак лише через два роки R. Quintiliani і співавт. (1987) науково обгрунтували цей новий підхід до застосування антибактеріальних препаратів.
Перелік інфекційних захворювань, при яких проведені контрольовані клінічні випробування й накопичено значний досвід ступінчастої терапії, включає пневмонію, інфекції урогенітального тракту, септицемію, інфекції шкіри та м’яких тканин, остеомієліт, інтраабдомінальні інфекції [18, 20].
У США ступінчаста терапія схвалена FDA (Food and Drug Administration) та викладена у загальних рекомендаціях цієї організації з проведення клінічних випробувань [10].
Таким чином, ступінчаста терапія інфекційної патології авторитетно рекомендується протягом більше ніж двадцяти років. Однак, незважаючи на очевидні переваги ступінчастої терапії, внаслідок різних причин (відсутність пероральних антибіотиків або сумнів щодо їх ефективності, стереотипи, що склалися, і т.д.) вона не завжди застосовується на практиці. За даними R. Quintiliani і співавт. [12], 75 % госпіталізованих пацієнтів із різними інфекціями могли бути переведені з парентерального на пероральний шлях введення антибактеріальних препаратів.
Важливим фактором при ступінчастій терапії є термін переведення пацієнта на пероральний шлях введення антибіотика, орієнтиром тут можуть служити стадії інфекції.
R. Quintiliani і співавт. [13] виділяють три стадії інфекційного процесу в пацієнтів, які знаходяться на стаціонарному лікуванні:
— I стадія триває 2–3 дні і характеризується нестабільною клінічною картиною, збудник і його чутливість до антибіотиків, як правило, невідомі, антибактеріальна терапія носить емпіричний характер, найчастіше призначають препарат широкого спектра дії;
— на II стадії клінічна картина стабілізується або поліпшується, збудник і його чутливість можуть бути встановлені, що дозволяє провести корекцію терапії;
— на III стадії (приблизно через 7 днів від початку захворювання) настає одужання й антибактеріальна терапія може бути завершена.
Оптимальним періодом для переведення пацієнта на пероральну терапію є II стадія інфекційного процесу.
Виділяють клінічні, мікробіологічні та фармакологічні критерії переведення пацієнта на другий етап ступінчастої терапії ([15] із змінами).
Основні (клінічні) критерії:
— температура тіла < 38 °С протягом 24–48 год;
— тенденція до нормалізації клінічного аналізу крові, С-реактивного білка;
— поліпшення/стабілізація клінічної картини;
— можливість перорального прийому їжі й рідини;
— відсутність порушення всмоктування у ШКТ;
— низька ймовірність лікарських взаємодій.
Додаткові критерії
1. Мікробіологічні:
— чи виділений збудник;
— чи відома чутливість збудника до антибіотиків;
— моно- чи комбінована антибіотикотерапія застосовується.
2. Фармакологічні:
— наявність відповідного антибіотика;
— достатня біодоступність антибіотика;
— спектр активності антибіотика.
Вибір оптимального антибіотика для ступінчастої терапії не є простим завданням. Р. Jewesson [21] наводить характеристики «ідеального» перорального антибіотика для другого етапу ступінчастої терапії:
— пероральний антибіотик той же, що і парентеральний;
— доведена клінічна ефективність при лікуванні даного захворювання;
— наявність різних пероральних форм (таблетки, розчини і т.д.);
— висока біодоступність;
— відсутність лікарських взаємодій на рівні всмоктування;
— добра переносимість при пероральному прийомі;
— тривалий інтервал дозування;
— низька вартість.
Залежно від перорального антибіотика виділяють 4 варіанти ступінчастої терапії [21]:
1) парентерально і всередину призначають один і той же антибіотик; пероральний антибіотик має добру біодоступність;
2) парентерально і всередину призначають один і той же антибіотик; пероральний препарат має низьку біодоступність;
3) парентерально і всередину призначають різні антибіотики; пероральний антибіотик має добру біодоступність;
4) парентерально і всередину призначають різні антибіотики; пероральний препарат має низьку біодоступність.
З теоретичної точки зору ідеальним є перший варіант. Це класична ступінчаста терапія. На практиці найчастіше використовується третій варіант, оскільки не всі парентеральні антибіотики мають пероральні форми. Перехід на пероральний шлях введення антибіотика іншої групи отримав назву послідовної ступінчастої терапії.
Ступінчаста терапія забезпечує значне скорочення терміну перебування в стаціонарі при збереженні високої клінічної ефективності лікування. Крім того, розроблено алгоритм організації лікування хворих на негоспітальну пневмонію при проведенні ступінчастої терапії вдома [3], що може бути використаним також і в пацієнтів денних стаціонарів:
I. Перший візит лікаря до пацієнта: постановка діагнозу на підставі клінічної картини, визначення ступеня тяжкості захворювання і показань до госпіталізації; якщо госпіталізація не потрібна, то призначення антибіотиків та об’єктивних методів обстеження (рентгенографія органів грудної клітки, мікробіологічний аналіз харкотиння, клінічний та біохімічні аналізи крові).
II. Другий візит: оцінка рентгенографічних даних та аналізів крові, клінічна оцінка ефективності лікування. При поліпшенні стану — перехід на пероральну форму прийому антибіотика, а якщо стан погіршився — госпіталізація.
III. Третій візит: оцінка ефективності лікування за клінічними критеріями, оцінка мікробіологічних даних (призначення повторних досліджень харкотиння, крові та рентгенографії).
IV. Четвертий візит: оцінка ефективності лікування за клінічними критеріями; заключна оцінка результатів аналізів крові, харкотиння і рентгенограм, виписка.
Матеріали та методи
Нами було поведене клінічне дослідження ефективності Цефодоксу (цефподоксиму проксетилу) — напівсинтетичного цефалоспоринового антибіотика ІІІ покоління для перорального застосування — у хворих на позалікарняну пневмонію. Дослідження проводилося відповідно до затвердженого протоколу і з дотриманням етичних правил. Дизайн дослідження: проспективне, рандомізоване, відкрите.
Критерії включення хворих в дослідження:
1. Вік пацієнтів до 80 років.
2. Наявність підтвердженого діагнозу позалікарняної пневмонії:
а) вогнище інфільтрації на рентгенограмі легень;
б) наявність не менше ніж 2 ознак:
— раптова гарячка;
— кашель із відходженням харкотиння;
— фізикальні ознаки (перкуторна тупість, фокус дрібнопузирчастих хрипів або крепітації, локально вислухане бронхіальне дихання);
— лейкоцитоз > 109/л або паличкоядерний зсув > 10 %.
3. Кількість балів за шкалою CURB < 3.
4. Згода хворого на участь у дослідженні.
5. Відсутність протипоказань до призначення цефалоспорину Цефодоксу.
Критерії виключення з дослідження:
1. Лікарняна пневмонія.
2. Тяжкий перебіг позалікарняної пневмонії (наявність одного великого критерію або не менше ніж 2 малих):
а) великі критерії:
— необхідність проведення штучної вентиляції легень;
— швидке прогресування вогнищево-інфільтративних змін у легенях (збільшення розмірів інфільтрації більш ніж на 50 % протягом найближчих 2 днів);
— септичний шок та необхідність введення вазопресорних препаратів протягом 4 годин і більше;
— гостра ниркова недостатність (рівень креатиніну сироватки крові понад 0,18 ммоль/л за відсутності хронічного захворювання нирок).
б) малі критерії:
— частота дихання 30 за 1 хвилину і більше;
— порушення свідомості;
— систолічний артеріальний тиск < 90 мм рт.ст.;
— двобічне або мультилобарне ураження легень, порожнини розпаду, плевральний випіт.
3. Кількість балів за шкалою CURB ≥ 3.
4. Наявність супутньої бронхолегеневої патології, що, на думку лікаря, може ускладнити клініко-лабораторну оцінку динаміки стану хворого (наприклад, бронхіальна астма, ХОЗЛ, бронхоектатична хвороба, легеневе серце).
5. Наявність тяжкої патології серця (гострий коронарний синдром, хронічна серцева недостатність у стадії декомпенсації), нирок, печінки, цукрового діабету в стадії декомпенсації, злоякісні новоутворення, захворювання щитоподібної залози.
6. Вагітність і годування груддю.
7. Зловживання алкоголем.
У дослідження ввійшли 30 хворих на позалікарняну пневмонію — 15 жінок і 15 чоловіків, у яких діагноз був підтвердженим рентгенологічно. Усім пацієнтам також проведено бактеріологічне дослідження харкотиння з метою виявлення збудника.
Крім рентгенологічного дослідження органів грудної клітки та бактеріологічного дослідження харкотиння хворим на позалікарняну пневмонію виконувався загальний аналіз крові з формулою, визначення рівнів загального білірубіну та його фракцій, АЛТ, АСТ, сечовини та креатиніну, ЕКГ.
Середній вік пацієнтів із позалікарняною пневмонією становив 43,4 ± 2,3 року (від 20 до 70 років). Серед обстежених хворих 26 пацієнтів були працездатного віку, що становило 86,7 %. Розподіл пацієнтів за віком поданий на рис. 1.
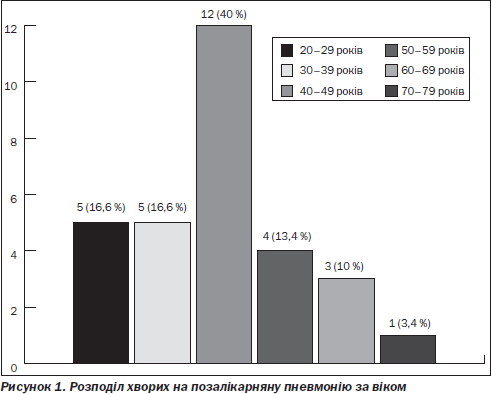
За локалізацією інфільтрату в легенях у 15 (50 %) обстежених процес був правобічним; у 15 (50 %) — лівобічним.
У 6 (19,8 %) хворих, які ввійшли в дослідження, була виявлена супутня патологія в стадії компенсації, що не заважала провести оцінку динаміки лікування позалікарняної пневмонії (табл. 1).
Після рентгенологічного підтвердження діагнозу позалікарняної пневмонії хворим призначалась така ступінчаста терапія: І — цефтріаксон 1,0 г 1 раз на добу внутрішньом’язово протягом 3 днів; ІІ — після завершення лікування цефтріаксоном пацієнтів переводили на прийом перорального Цефодоксу в дозі 0,2 г 2 рази на добу протягом 5 днів.
Контроль ефективності лікування позалікарняної пневмонії проводився на 2, 3 та 4-му візитах від моменту встановлення діагнозу й початку фармакотерапії, під час яких вивчалася динаміка температури тіла, кашлю (частота кашлю, наявність харкотиння), інтоксикаційного синдрому, фізикальних ознак позалікарняної пневмонії. Крім того, вивчалися артеріальний тиск, побічні ефекти фармакотерапії та думка пацієнта щодо ефективності його лікування.
На 2-му візиті (3-тя доба лікування) пацієнтам із позалікарняною пневмонією проводилась оцінка клінічної симптоматики, відмінявся внутрішньом’язовий цефтріаксон і призначався пероральний Цефодокс згідно з дизайном дослідження.
Бактеріологічне дослідження харкотиння з метою оцінки антибактеріальної ефективності ступінчастої терапії проводилося на 3-му візиті (2-й день після завершення прийому Цефодоксу). Також на 3-му візиті хворим виконувався контрольний загальний аналіз крові з формулою, визначення рівнів загального білірубіну та його фракцій, АЛТ, АСТ, сечовини та креатиніну, ЕКГ.
Рентгенологічне дослідження в динаміці лікування проводилося через 3 тижні від моменту початку ступеневої терапії — 4-й візит.
Статистична обробка отриманих результатів проводилася за допомогою t-критерію.
Результати дослідження
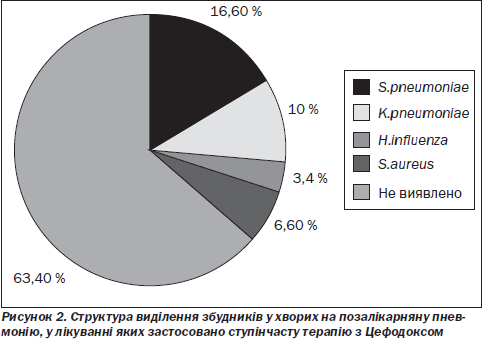
За результатами бактеріологічних посівів харкотиння збудників позалікарняної пневмонії вдалося виявити в 11 (36,6 %) хворих на позалікарняну пневмонію. Серед збудників превалював S.рneumoniae, висіяний у 5 (16,6 %) пацієнтів. У 3 (10 %) хворих виділено K.pneumoniae, у 2 (6,6 %) — S.aureus, H.іnfluenza — в 1 (3,4 %) (рис. 2).
Під час аналізу результатів ступінчастої терапії хворих на позалікарняну пневмонію, нами встановлено високу ефективність такої схеми лікування.
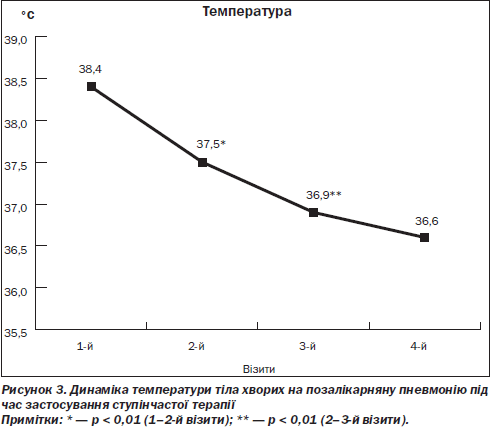
Зокрема, на 2-му та 3-му візитах констатовано вірогідне (р < 0,01) зниження температури тіла (рис. 3). Якщо до лікування температура тіла становила 38,40 ± 0,07 °С, то на другому візиті цей показник був уже 37,50 ± 0,05 °С (р < 0,01). При порівнянні температурних даних нами встановлено, що на третьому візиті температура тіла пацієнтів була вірогідно нижчою (р < 0,01) порівняно із другим (36,90 ± ± 0,05 °С проти 37,50 ± 0,05 °С).
Подібна динаміка спостерігалась і з боку інтоксикаційного синдрому. Якщо до лікування у всіх 30 (100 %) хворих на позалікарняну пневмонію був виражений інтоксикаційний синдром, то вже на 2-му візиті симптоми інтоксикації були відсутніми в 15 (50 %) хворих, а на 3-му візиті у всіх пацієнтів зникли симптоми інтоксикації.
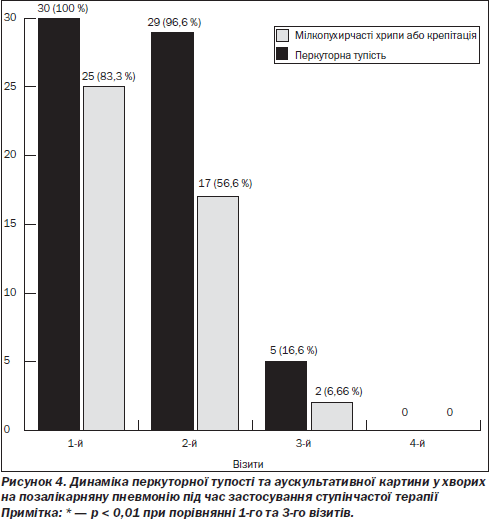
Крім того, нами відзначена позитивна динаміка об’єктивного статусу (перкуторна тупість та аускультативна картина) з боку легень у хворих на позалікарняну пневмонію під час застосування ступінчастої терапії (рис. 4). Уже на 3-му візиті явища перкуторної тупості спостерігалися тільки у 5 (16,6 %) пацієнтів із позалікарняною пневмонією, у 2 (6,66) пацієнтів визначалися сухі дрібнопузирчасті хрипи. Під час 4-го візиту в усіх 30 (100 %) хворих на позалікарняну пневмонію нами констатовано відсутність перкуторної тупості та хрипів у легенях.
За результатами контрольного бактеріологічного посіву харкотиння хворих на позалікарняну пневмонію нами не було виявлено жодного збудника захворювання, що також свідчить про ефективність запропонованого лікування.
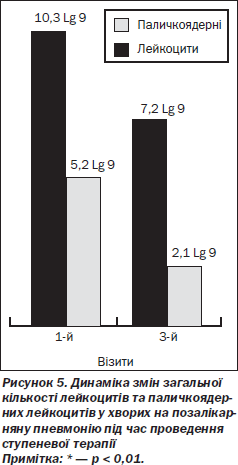
На підставі даних загального аналізу крові з формулою, проведеного під час 3-го візиту, нами встановлено вірогідне зменшення як загальної кількості лейкоцитів, так і їх юних форм у крові (рис. 5).
Контрольне рентгенологічне дослідження через 3 тижні від моменту початку лікування показало, що в усіх 30 (100 %) хворих відбулося розсмоктування інфільтратів у легеневій тканині.
20 (66 %) пацієнтів оцінили ефект від проведеного лікування як дуже добрий, 10 (34 %) хворих дали оцінку «добре». Негативні оцінки при проведенні ступеневої терапії позалікарняної пневмонії були відсутні.
Слід відзначити, що під час прийому препаратів за схемою ступінчастої терапії пацієнти не відзначали ніяких побічних дій ліків, що могли б призвести до відміни лікарських засобів. У хворих не виявлено негативного впливу антибактеріальних фармакопрепаратів на функцію нирок і печінки, що підтверджене відсутністю вірогідних змін біохімічних показників крові (загального білірубіну та його фракцій, АЛТ, АСТ, сечовини та креатиніну).
Висновки
1. Ступінчаста антибактеріальна терапія є актуальною сучасною методикою застосування антбактеріальних препаратів, що дозволяє надати високоефективну та високоякісну медичну допомогу найбільш економічним шляхом.
2. Застосування методики ступінчастої терапії для лікування хворих на позалікарняну пневмонію забезпечує достатню клінічну та лабораторну ефективність.
Цефодокс (цефподоксиму проксетил) є сучасним пероральним цефалоспорином, що може бути з успіхом застосованим у схемі ступінчастої антибактеріальної терапії хворих на позалікарняну пневмонію.
1. Козлов С.Н., Рачина С.Н., Домникова Н.П. и др. Фармакоэпидемиологический анализ лечения внебольничной пневмонии в амбулаторных условиях // Клиническая микробиология и антимикробная химиотерапия. — 2000. — Т. 2, № 3. — С. 74-81.
2. Комарова В.П., Белоусов Ю.Б. Фармакоэкономические аспекты антибактериальной терапии инфекции нижних дыхательных путей у пожилых больных // Клиническая фармакология и терапия. — 1998. — Т. 7. — С. 12-18.
3. Новиков Ю.К. Внебольничные пневмонии // РМЖ. — 1999. — Т. 7, № 17. — С. 725-830.
4. Ноников В.Е., Константинова Т.Д., Ленкова Н.И., Аргентина И.Н. Фармакоэкономические аспекты антибактериальной терапии пневмоний // Инфекции и антимикробная терапия. — 1999. — № 3. – С. 44-46.
5. Синопальников А.И., Страчунский Н.С. Новые рекомендации по ведению взрослых пациентов с внебольничными пневмониями // Клиническая микробиология и антимикробная терапия. — 2000. — Т. 3, № 1. — С. 54-58.
6. Страчунский Л.С., Розенсон О.Л. Ступенчатая терапия: новый подход к применению антибактериальных препаратов // Клиническая фармакология и терапия. — 1997. — Т. 6, № 4. — С. 66-68.
7. Фещенко Ю.І. Порівнянні дані про розповсюдженість хвороб органів дихання і медичну допомогу хворим пульмонологічного профілю в Україні 1998–1999 рр. / Відп. ред. Ю.І. Фещенко. — К.: КАМЕТ, 2000. — 35 с.
8. Bartlett J.G., Breiman R.F., Mandell L.A., File T.M. Community-acquired pneumonia in adults: guidelines for management. Infectious Diseases Society of America // Clin. Infect. Dis. — 1998. — № 26. — Р. 811-838.
9. Bartlett J.G., Dowell S.F., Mandell L.A. Practice guidelines for the management of community-acquired pneumonia in adults. Infectious Diseases Society of America // Clin. Infect. Dis. — 2000. — № 31.— Р. 347-382.
10. Beam T., Gilbert D., Kunin C. General consideration for the clinical evaluation of anti-infective drug products // Clin. Infect. Dis. — 1992. — № 15. — Р. 5-32.
11. Finch R.G. Pneumonia: the impact of antibiotic resistance on its management // Microbiol. Drug Res. — 1995. — № 1. — 149-158.
12. Quintiliani R., Nightingale C., Crowe H. Strategic antibiotic decision-making at the formulary level // Rev. Inf. Dis. — 1991. — № 13. — Р. 770-777.
13. Quintiliani R., Cooper B., Briceland L. Economic impact of streamlining antibiotic administration // Am. J. Med. — 1987. — № 82 (Suppl. 4A). — Р. 391-394.
14. Martin R.E., Bates J.H. Community-acquired pneumonia // Current therapy of infectious diseases / Еd. by D. Schlossberg. — St. Louis: Mosby, 1996. — Р. 93-96.
15. Nathwani D. Cost-effectiveness considerations for combination therapies // Antibiotic combination therapy — the role of ciprofloxacin. — Cambridge Medical Publications, 1997. — Р. 19.
16. Bartlett J.G., Dowell S.F., Mandell L.A. et al. Practice Guidelines for the Management of Community-Acquired Pneumonia in Adults // Clinical Infections Diseases. — 2000. — № 31. — P. 347-382.
17. Mandell L.A., Marrie T.J., Grossman R.F. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society // Clin. Infect. Dis. — 2000. — № 31. — Р. 383-421.
18. Ramirez J. Advances in antibiotic use: switch therapy // Curr. Ther. Res. — 1993. — 55. — Р. 30-34.
19. Van den Brande P., Vondra V., Vogel F. Sequential therapy with cefuroxime followed by cefuroxime axetil in community-acquired pneumonia // Chest. — 1997. — № 112. — Р. 406-415.
20. Janknegt R., Meer J. Sequential therapy with intravenous and oral cephalosporins // J. Antimicrob. Chemother. — 1994. — № 33. — Р. 169-177.
21. Jewesson P. Economic impact of intravenous-to-oral antibacterial step-down therapy // Clin. Drug Invest. — 1996. — № 11 (Suppl. 2). — Р. 1-9.
