Газета «Новости медицины и фармации» Акушерство и гинекология (347) 2010 (тематический номер)
Вернуться к номеру
Запальні захворювання органів малого таза
Авторы: Роберта Несс, Кафедра епідеміології Пітсбурзького університету, Пітсбург (штат Пенсільванія), Дебора Брукс-Нельсон, Центр клінічної епідеміології та біостатистики Пенсільванського університету, Філадельфія (штат Пенсільванія)
Версия для печати
Вступ
Запальні захворювання органів малого таза (ЗЗОМТ) — загальне поняття, що описує клінічно визначену інфекцію, яка маніфестує запаленням жіночих репродуктивних органів, включаючи труби (сальпінгіт), яєчники (оофорит) і внутрішню оболонку матки (ендометрит). Здебільшого запальні захворювання органів малого таза — це результат проникнення мікроорганізмів із нижніх відділів генітального тракту, Chlamydia trachomatis і Neisseria gonorrhoeae є найпоширенішими з них. Помилки в діагностиці запальних захворювань органів малого таза спричинили як недооцінку масштабів цієї патології, так і випадки, що не лікувалися. Зокрема, якщо не проводиться своєчасне лікування, зазначені захворювання призводять до безплідності через непрохідність маткових труб, ектопічної вагітності, хронічного болю та рецидивуючих запальних захворювань органів малого таза. У цій главі ми розглядатимемо частоту, мікробну етіологію, наслідки для здоров’я та медичні витрати, чинники ризику, діагностику, вибір методів лікування і запобігання запальним захворюванням органів малого таза.
Поширеність
Запальні захворювання органів малого таза вражають жінок у всьому світі в епідемічних розмірах. У деяких розвинених країнах показники цих захворювань знизилися, особливо у Скандинавії, але немає жодних доказів такого зрушення в країнах, що розвиваються [1]. У Сполучених Штатах також спостерігалося зниження цієї патології у 1990-х роках, але досі ЗЗОМТ залишаються поширеними в цій країні. Національне дослідження, проведене 1995 року, показало, що 8 % усіх жінок і 11 % афроамериканок повідомили, що вони лікувалися від запальних захворювань органів малого таза у певний період свого репродуктивного життя [2]. Ці дані можна порівняти з результатами Національного дослідження 1988 року, коли майже 11 % усіх жінок і 17 % афроамериканок репродуктивного віку лікувалися від ЗЗОМТ [3].
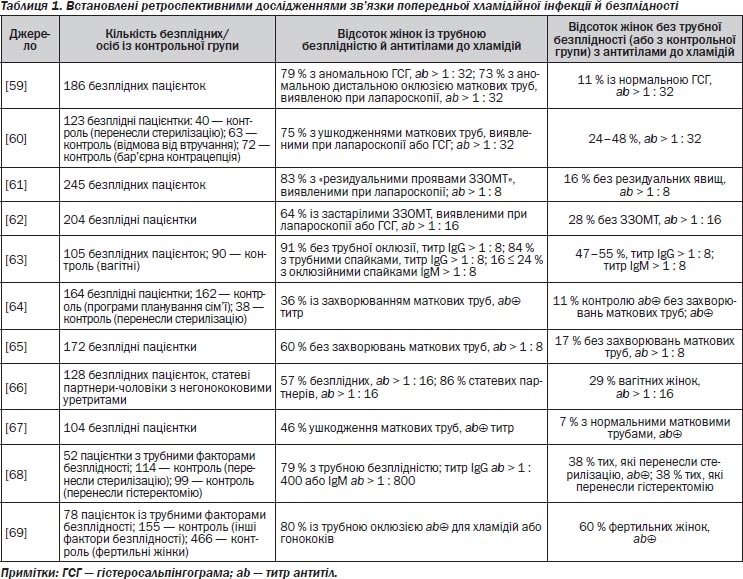
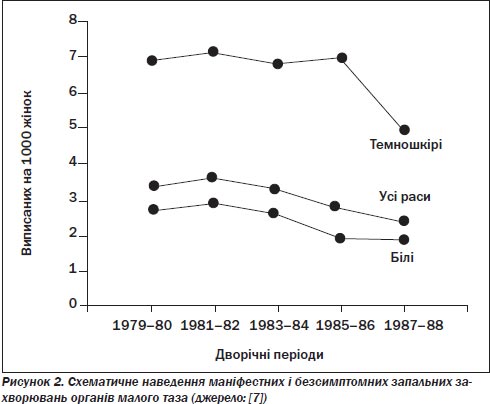
Підраховано, що понад мільйон американок щорічно звертаються по лікування через запальні захворювання органів малого таза. Госпіталізації підлягають приблизно 200 000–300 000 жінок. Третина жінок, госпіталізованих через гострі запальні захворювання органів малого таза, потребують операційного втручання з приводу захворювання, часто через трубно-яєчникові абсцеси [4–6]. Решта жінок з діагнозом ЗЗОМТ звертаються до приватних лікарів (понад 400 000 осіб щорічно), до установ системи громадського здоров’я, відділення невідкладної медичної допомоги (приблизно 140 000 осіб щорічно) [4–7] (рис. 1). Однак показники госпіталізації через запальні захворювання органів малого таза знижуються. Дані аналізу медичної документації із загальної сукупності населення у Сіетлі, штат Вашингтон, показали, що 13 % усіх жінок з діагнозом «запальні захворювання органів малого таза» було госпіталізовано і що найважливішими ознаками, які передували госпіталізації, були звертання по медичну допомогу до установ зі стаціонарами, лихоманка/озноб/потіння, інфекція Neisseria gonorrhoeae і відмова від запобіжних заходів щодо народжуваності. Расові розбіжності у показниках госпіталізації усе ще існують; темношкірих жінок у 2,5 раза частіше госпіталізують через запальні захворювання органів малого таза, ніж білих [6, 8].
Запальні захворювання органів малого таза можуть бути навіть більш поширеними, ніж це виявлено в дослідженнях жінок, які звертаються по медичну допомогою. Передусім ЗЗОМТ — це не той стан, що підлягає реєстрації, і його виявлення ґрунтується на пасивному спостереженні та згадуванні. Попередні епізоди цих захворювань неможливо послідовно пригадати. Крім того, невиявлені або латентні запальні захворювання органів малого таза становлять половину і навіть більше усіх випадків захворювань [7, 9] (рис. 2).
Діагностика
Лапароскопічно підтверджені ознаки еритеми і/або набряку маткових труб, потовщення бахромок маткових труб або наявність трубно-яєчникового абсцесу вважають золотим стандартом у діагностуванні запальних захворювань органів малого таза [10, 11]. Однак, оскільки лапароскопія є процедура інвазивна і не завжди застосовується у жінок із підозрою на ЗЗОМТ, численні випадки цих захворювань встановлюються через клінічні ознаки і симптоми.
Центру контролю та профілактики хвороб (CDC) щодо діагнозу ЗЗОМТ — скарги на біль у животі та клінічні ознаки: зміщення шийки матки, біль унизу живота і болючість придатків [12]. Додаткові критерії, уперше запропоновані Hager і колегами [13], підвищують специфічність діагнозу ЗЗОМТ. Ці критерії включають лихоманку, підвищений рівень С-реактивного протеїну, підвищену швидкість осідання еритроцитів, лабораторне підтвердження ураження шийки матки N.gonorrhoeae або С.trachomatis і/або надмірні цервікальні чи вагінальні виділення. Мінімальні критерії CDC (болі у животі плюс болючість при пальпації живота, шийки матки, придатків) корелюють з лапароскопічно доведеним сальпінгітом лише у від половини до двох третин випадків [12, 14–16]. Наявність додаткових лабораторних маркерів значно підвищує точність діагнозу [17]. Наприклад, лейкоцити у вагінальних і цервікальних виділеннях (лейкорея або цервікальний слиз із гноєм) вважаються досить специфічними щодо запальних захворювань органів малого таза і відносно чутливими. Жінки без таких ознак, навіть якщо вони відчувають біль у ділянці органів малого таза, навряд чи матимуть запальні захворювання цих органів [18].
Дорожчими, але все-таки відносно нетравматичними методами, що зазвичай використовуються для діагностики запальних захворювань органів малого таза, є ультразвукове обстеження і внутрішньоматкова біопсія. Ультразвукове дослідження тазових органів виявляє розширення яєчників і маткових труб [9]. Однак цей метод не є чутливим і специфічним, він корисний у виявленні трубно-яєчникових абсцесів [19–21]. Кращий лабораторний маркер запальних захворювань органів малого таза — ендометрит, виявлений при біопсії ендометрію. Біопсію можна виконувати гнучкою відкритою канюлею (відома назва Pipelle) під місцевою анестезією або без неї. Цю відносно нетравматичну процедуру можна виконати за кілька хвилин в амбулаторних умовах, і вона викликає мінімальний або незначний біль. Виявлення запального інфільтрату в ендометрії загалом є предиктором лапароскопічно діагностованого сальпінгіту з чутливістю 70–93 % і специфічністю 67–89 % [16, 22, 23]. Але одне з досліджень засвідчило значно нижчу чутливість внутрішньоматкової біопсії (39 %) [16]. Згідно з цим дослідженням потрібна була узгодженість діагнозів трьох патологів, щоб поставити діагноз запальних захворювань органів малого таза. Ness і колеги [24] показали, що існує одна проблема у використанні внутрішньоматкової біопсії як діагностичного інструменту, а саме недостатня узгодженість думки різних патологів щодо діагнозу ендометриту. Однак схема, відповідно до якої ЗЗОМТ діагностують на основі виявлення будь-якої кількості плазмоцитів або п’яти чи більше нейтрофілів (замість альтернативної діагностичної схеми, запропонованої Кіviat з колегами [23], що вимагає виявлення будь-яких плазмоцитів ТА 5 чи більше нейтрофілів), підвищує рівень узгодженості діагнозів. Інша проблема в діагностиці запальних захворювань органів малого таза на основі ендометриту полягає в тому, що період отримання результатів аналізу зазвичай триває щонайменше 24 години. Така затримка породжує дві проблеми. По-перше, чим довший період між початком прояву ознак і лікуванням запальних захворювань органів малого таза, тим вищий ризик безплідності [25]. По-друге, деяких пацієнток неможливо розшукати, а інші не повертаються для лікування після того, як дізнаються про позитивні результати внутрішньоматкової біопсії. Тому, хоча внутрішньоматкова біопсія є важливим інструментом дослідження, більш реалістична клінічна стратегія полягає в тому, щоб лікувати всіх осіб, у яких клінічно підозрюється захворювання, розуміючи, що деякі з них не мають запальних захворювань органів малого таза.
Роль мікроорганізмів
Запальні захворювання органів малого таза виникають унаслідок поширення інфекції з нижніх відділів генітального тракту до верхніх, що спричиняє запалення та інфікування матки, труб і яєчників. Численні дослідження довели, що багато різноманітних мікроорганізмів виявлено у верхніх відділах генітального тракту жінок з гострими запальними захворюваннями органів малого таза [26–32]. Здебільшого ці захворювання є результатом поширення інфекції Chlamydia trachomatis і Neisseria gonorrhoeae, яка не лікувалася, з нижніх відділів генітального тракту: однак виявлено анаеробні та факультативно анаеробні бактерії одночасно, включаючи Prevotella sp., Prevotella bivius, Prevotella disiens, Peptostreptococii sp., Gardnerella vaginalis, Eschereschia coli, Haemophilus influenzae, і аеробні стрептококи та мікоплазми (М.hominis і U.urealyticum).
Rice і Schachter зазначали, що більшість доведених випадків запальних захворювань органів малого таза (тобто підтверджених лапароскопією чи внутрішньоматковою біопсією) пов’язані з N.gonorrhoeae або С.trachomatis [33]. Однак, за деякими повідомленнями, у 30 % жінок виявляли лише анаеробні і/або факультативно анаеробні бактерії [34]. Отже, хоча N.gonorrhoeae і С.trachomatis є найпоширенішими мікроорганізмами, пов’язаними із ЗЗОМТ, анаеробні та факультативно анаеробні бактерії вагінальної флори також можуть відігравати важливу роль. Фактично висівання анаеробних і факультативно анаеробних бактерій з верхніх відділів генітального тракту в комбінації з інфекцією N.gonorrhoeae чи С.trachomatis відбувалося у двох третинах випадків госпіталізації пацієнток через запальні захворювання органів малого таза. Дослідження показали, що висхідне обсіменіння N.gonorrhoeae і С.trachomatis верхніх відділів генітального тракту завершується запаленням, що дає змогу звичайно непатогенним анаеробним і аеробним бактеріям далі інфікувати верхні відділи генітального тракту [35, 36]. З іншого боку, порушення нормальної вагінальної флори, яке спостерігається при неспецифічному вагініті, може полегшувати висхідне обсіменіння N.gonorrhoeae і С.trachomatis верхніх відділів генітального тракту.
Роль неспецифічного вагініту, не пов’язаного із зараженням збудниками гонореї чи хламідіями, у спричиненні запальних захворювань органів малого таза є основною сферою дискусій. Ті самі бактерії, виявлені у верхніх відділах генітального тракту жінок із ЗЗОМТ, пов’язані з бактеріальним вагінозом, найпоширенішою інфекційною причиною неспецифічного вагініту [37]. Отримано докази того, що бактеріальний вагіноз, виявлений клінічно за наявності бактерій, які спричинили вагіноз, у верхніх відділах генітального тракту, пов’язаний із сальпінгітом і ендометритом незалежно від наявності інфекції N.gonorrhoeae чи С.trachomatis [31, 38, 39]. Бактеріальний вагіноз характеризується збільшенням кількості вагінальних бактерій в 10 000 разів і порушенням рівноваги нормальної вагінальної мікрофлори таким чином, що звичайно домінуючі штами лактобактерій, які виробляють перекис водню, зменшуються за кількістю, а кількість анаеробних і факультативно анаеробних мікроорганізмів зростає. Вироблення молочної кислоти лактобактеріями тривалий час вважали основою захисної ролі цих організмів від вагінальної інфекції та надмірного розвитку анаеробів [39]. Штами лактобактерій, які виробляють перекис водню, можуть зупиняти розвиток генітальних мікроорганізмів [38]. Лактобактерії, що виробляють перекис водню, показали in vitro, що вони знищують бактерії, включаючи Gardnerella vaginalis, Prevotella bivia та N.gonorrhoeae [40, 41]. У лонгітюдному дослідженні Hawes і колеги показали, що лактобактерії, а особливо ті, що виробляють перекис водню, захищають від розвитку бактеріального вагінозу [42]. Peipert і колеги пов’язали бактеріальний вагіноз із запальними захворюваннями органів малого таза [43], стверджуючи тим самим, що домінування лактобактерій, які не виробляють молочної кислоти, або взагалі відсутність їх у піхві, може бути предиктором розвитку в жінки бактеріального вагінозу, а можливо, і запальних захворювань органів малого таза. З іншого боку, Soper і колеги [44], які провели дослідження з використанням лапароскопії, що передбачало аналіз мікробних ізолятів з верхніх відділів генітального тракту, виявили, що пов’язані з бактеріальним вагінозом мікроорганізми знаходять лише одночасно з N.gonorrhoeae і С.trachomatis. Отже, невідомо, чи можуть мікроорганізми, відповідальні за бактеріальний вагіноз, спричинювати ЗЗОМТ за відсутності захворювань, що передаються статевим шляхом.
До 40 % захворювань нижніх відділів генітального тракту за відсутності лікування можуть розвинутись у запальні захворювання органів малого таза, але неясно, чому в деяких жінок інфекція з нижніх відділів генітального тракту поширюється до верхніх, а в інших — ні [45, 46]. Роль шийки матки, яка створює функціональний бар’єр у запобіганні поширенню мікроорганізмів, вважають менш відчутною протягом овуляції і менструації, коли відсутня слизова пробка, і в періоди інфекції, коли є запалення ендоцервікального каналу [47, 48]. Поширення інфекцій з нижніх відділів генітального тракту також може прискорюватися протягом менструації через ретроградний відтік менструальної крові [49, 50]. Дослідження показали, що ознаки запальних захворювань органів малого таза, спричинених N.gonorrhoeae і С.trachomatis, найімовірніше, починаються у період менструації або одразу після неї [51]. Площа відповідного епітелію також може впливати на швидкість поширення висхідної інфекції. Гонококи та хламідії мають спочатку приєднатися до стовпчастого епітелію, щоб проникнути до верхніх відділів генітального тракту. Такий епітелій виявлено не в піхві, а лише в ділянці, що оточує цервікальний отвір. Дівчата-підлітки взагалі мають велику зону стовпчастого епітелію навколо шийки матки, це називається цервікальною ектопією. Велика зона цервікальної ектопії в дівчат-підлітків може ставити їх перед більшим ризиком поширення вагінальних інфекцій і може пояснювати підвищені показники запальних захворювань органів малого таза серед них порівняно зі старшими жінками [47]. Крім того, передбачувані чинники ризику цих захворювань, включаючи контрацептивні методи й вагітність, через підвищення рівнів естрогенів крові, можуть сприяти поширенню інфекцій, збільшуючи зону цервікальної ектопії або змінюючи нормальне мікросередовище піхви.
Інфекція у верхніх відділах генітального тракту спричиняє запалення й наступне ушкодження тканини. Найкращим описаним зразком цього явища є модель генітальної інфекції С.trachomatis у приматів, за якою одноразове зараження С.trachomatis не є патогенним. Однак повторні зараження інфекцією С.trachomatis викликають хронічну запальну реакцію. Трубні війки, що відповідають за повільне переміщення яйцеклітини вниз матковою трубою до матки до і після запліднення, зникають, а зона в маткових трубах і навколо них наповнюється запальним ексудатом [52]. Як наслідок, можливе порушення функціонування маткових труб і/або ушкодження труб, що проявляється в трубній безплідності, ектопічній вагітності або хронічному болю в тазових органах. Принаймні деякі з повторних запальних захворювань органів малого таза, виявлених серед жінок із патологією, можуть також бути результатом аутоімунного процесу через взаємні антигенні властивості протеїнів теплового шоку хламідій і протеїнів теплового шоку людини молекулярною масою 60 кілодальтон (KDa) [53].
Наслідки для здоров’я та фінансові витрати
Запальні захворювання органів малого таза спричиняють суттєві медичні наслідки. Короткочасні наслідки включають гострий біль у тазових органах, трубно-яєчникові абсцеси, рубцювання та спайки маткових труб [48], довготривалі наслідки — підвищений ризик безплідності, ектопічну вагітність, хронічний біль у тазових органах і рецидиви захворювання. Фактично запальні захворювання органів малого таза, які вважають головною причиною безплідності в усьому світі, можуть бути основною причиною явного зростання кількості випадків ектопічної вагітності у Сполучених Штатах [54–56]. Проводилося лише одне довгострокове дослідження перебігу запальних захворювань органів малого таза. Westrom з колегами спостерігали групу шведських жінок із клінічними ознаками цієї патології у 1960–1984 роках. Усім жінкам проводили лапароскопію й лікування внутрішньовенним уведенням різноманітних антибіотиків, що їх вважали на той час найефективнішими. У ході дослідження було обстежено 2501 жінку, 1844 з яких мали патологічні результати лапароскопїї (пацієнтки із запальними захворюваннями органів малого таза), а 657 — нормальні результати (контрольна група). Ранні повідомлення з цього дослідження показали, що п’ята частина жінок, які мали принаймні один епізод ЗЗОМТ, були безплідними і одна чверть пацієнток жила з хронічним болем у тазових органах [57]. Серед жінок з трьома або більше епізодами ЗЗОМТ понад половини згодом ставали безплідними [48, 58]. Крім того, у понад 20 % пацієнток були повторні епізоди запальних захворювань органів малого таза, і майже кожна десята жінка мала ектопічну вагітність при своєму першому завагітненні після встановлення такого діагнозу порівняно з показником 1/66 для пацієнток без діагнозу ЗЗОМТ в анамнезі [48]. За найостаннішим повідомленням, після вивчення 13 400 жінко-років серед пацієнток із запальними захворюваннями органів малого таза і 3958 жінко-років серед представниць контрольної групи 16 % пацієнток і 2,7 % осіб з контрольної групи були безплідними, 10,8 % пацієнток і 0,0 % осіб з контрольної групи мали діагноз трубної безплідності [57]. Результати досліджень із дизайном «випадок — контроль» підтверджують висновки обстеження скандинавської проспективної когорти (табл. 1). Серологічні ознаки попередньої інфекції С.trachomatis виявили у 36–91 % (у середньому 75 %) жінок із трубною безплідністю порівняно з 7–60 % жінок з контрольної групи [59–69]. Велика кількість жінок з ектопічною вагітністю також мали антитіла до С.trachomatis, що свідчить про інфекцію в минулому [70].
Фінансові витрати, пов’язані із запальними захворюваннями органів малого таза та їхніми наслідками, величезні. Щорічні витрати Сполучених Штатів на нагальне лікування цих захворювань оцінено від $700 мільйонів до $2 мільярдів. Непрямі витрати, пов’язані із запальними захворюваннями органів малого таза, можуть додатково досягати $1 мільярда щорічно [71–73]. У 1990 році загальна вартість лікування ЗЗОМТ становила приблизно $4,2 мільярда, що включало витрати на лікування гострих запальних захворювань плюс прямі й непрямі витрати на лікування безплідності та ектопічної вагітності через ЗЗОМТ. Погіршення функціонування внаслідок хронічного болю в органах малого таза і повторних епізодів надалі ще збільшуватиме економічний тягар. З огляду на постійну інфляцію й постійне зростання захворюваності на ЗЗОМТ передбачається, що до 2000 року загальна вартість хвороби, включаючи як прямі, так і непрямі витрати, сягне понад $9 мільярдів [71].
Нерозпізнані запальні захворювання органів малого таза
Cates стверджував, що жінки з клінічними ознаками й симптомами, типовими для запальних захворювань органів малого таза, становлять менше половини всіх первинних випадків цих захворювань (рис. 2) [7]. Кілька груп доказів свідчать про те, що численні випадки ЗЗОМТ залишаються клінічно нерозпізнаними. По-перше, трубну безплідність вважають прямим наслідком запальних захворювань органів малого таза і усе-таки понад половину жінок з трубною безплідністю та серологічними ознаками попередньої інфекції С.trachomatis не згадують, що їм ставили діагноз ЗЗОМТ або проводили лікування [74]. Так само і жінки з ектопічною вагітністю й антитілами до С.trachomatis часто не згадують про випадки запальних захворювань органів малого таза [75]. Ця група доказів хоч і є важливою, однак не є незаперечною, оскільки медичні втручання, зокрема ті, що не потребують госпіталізації, часто забуваються. Тому неясно, чим спричинена відсутність згадування про запальні захворювання органів малого таза серед жінок із несприятливими репродуктивними наслідками: відсутністю ознак протягом гострого епізоду, нетиповими гострими ознаками або неретельним пригадуванням.
По-друге, Henry-Suchet і колеги повідомили про ізоляцію С.trachomatis з маткових труб жінок із трубною безплідністю, але без будь-яких інших пригаданих ознак запальних захворювань органів малого таза [76]. Patton і колеги засвідчили наявність ДНК С.trachomatis у 79 % жінок з трубною безплідністю внаслідок інфекцій [77]. Patton також показав, що гістологічні прояви ушкодження в маткових трубах подібні до таких у жінок із явними і невиявленими ЗЗОМТ [78]. Хламідії звичайно не висіваються зі здорових верхніх тазових органів. По-третє, у багатьох жінок з непідозрюваною інфекцією верхніх відділів генітального тракту виявлено ендометрит. Sweet і колеги повідомили про постійну наявність С.trachomatis у внутрішньоматкових пробах жінок, які позбавилися болю після лікування запальних захворювань органів малого таза цефалоспоринами (cephalosporin) [28]. Ця знахідка демонструє, що С.trachomatis може спричинювати хронічне запалення оболонок без болю в тазових органах. Paavonen і колеги виявили ендометрит при гістопатологічному дослідженні у 47 % жінок із слизово-гнійним цервіцитом без вираженого болю в тазових органах [79]. У цій вибірці у жінок із позитивними бактеріологічними результатами на С.trachomatis у пробах з цервікального каналу у 65 % виявили ендометрит. Ness із колегами продемонстрували, що серед жінок із нелікованим цервіцитом або серед жінок з інфікованими партнерами 44 % мали ознаки ендометриту [24]. Ці результати свідчать про те, що велика кількість жінок, які, імовірно, мають неускладнені інфекції нижніх відділів генітального тракту, фактично мають супутні нерозпізнані запальні захворювання органів малого таза.
Чинники ризику
Із запальними захворюваннями органів малого таза пов’язані численні демографічні й поведінкові чинники. Ці чинники можуть сприяти зростанню ймовірності зараження N.gonorrhoeae і С.trachomatis або ймовірності того, що інфекція пошириться від нижніх відділів генітального тракту до верхніх або перебуватиме і там і там. І навпаки, деякі чинники не можуть самі по собі змінити ризик, але можуть бути ознаками для збільшення кількості точних діагнозів. Розмаїтість чинників обговорюватиметься нижче з поясненням потенційного механізму(ів), яким кожний із них пов’язаний з ризиком. Жінки з нижчим соціально-економічним статусом, темношкірі жінки та одинокі або розлучені жінки мають найвищий показник як хвороб, що передаються статевим шляхом (ХПСШ), так і запальних захворювань органів малого таза. Дані прийому хворих для госпіталізації, приватних медичних установ і анкетних опитувань послідовно підтверджують вищий показник ЗЗОМТ серед темношкірих жінок. Їх 1988 року було майже втричі більше госпіталізовано через запальні захворювання органів малого таза (порівняно з білими жінками); темношкірі удвічі частіше, ніж білі, повідомляли про запальні захворювання органів малого таза в анамнезі [3, 6, 8]. Одне з потенційних пояснень цієї расової нерівності може полягати в більшій захворюваності на ЗЗОМТ серед темношкірих жінок через більшу поширеність ХПСШ у цій групі [80].
Жінки з нижчим соціально-економічним статусом мають вищий ризик захворіти на ХПСШ і на ЗЗОМТ. Хоча низький соціально-економічний статус причиново не пов’язаний із запальними захворюваннями органів малого таза, характеристики осіб із нижчих соціально-економічних верств збільшують ризик розвитку цих захворювань, тільки-но в них з’являється інфекція шийки матки. Ці характеристики включають знижене розпізнавання ознак і симптомів інфекцій шийки матки і запальних захворювань органів малого таза, відсутність можливих доступних послуг з охорони здоров’я, недотримання режиму терапії антибіотиками й нерегулярні контрольні огляди, а також непроведення антибіотикотерапії для інфікованого статевого партнера [35]. Швидке розпізнавання ознак і симптомів запальних захворювань органів малого таза суттєво знижує наслідки цієї патології, і раннє медичне втручання може запобігати висхідній інфекції N.gonorrhoeae і С.trachomatis.
Вік
Приблизно 70 % жінок із діагнозом запальних захворювань органів малого таза — віком 25 років чи молодше. Більшість досліджень свідчать, що сексуально активні дівчата-підлітки мають найбільшу частоту цих захворювань [81]. Сексуально активним дівчатам-підліткам утричі частіше ставлять діагноз ЗЗОМТ (порівняно з жінками віком 25–29 років) [82]. Одне з досліджень засвідчило, що ризик запальних захворювань органів малого таза серед сексуально активних жінок віком 15 років становить один на вісім випадків, віком 16 років — один на 10 випадків, а віком 24 роки — один на 80 випадків [81].
Висока частота запальних захворювань органів малого таза серед дівчат-підлітків в основному є результатом великої кількості статевих партнерів і підвищеного рівня поширеності ХПСШ у цій віковій групі. Частота гонококової інфекції, за повідомленнями, утричі вища серед жінок віком 15–19 років порівняно зі старшими жінками [83]. Хоча частота випадків гонореї суттєво знизилася серед дорослих жінок протягом 1990-х років, серед дівчат-підлітків це зниження найменше порівняно з будь-якою віковою групою [83]. Серед дівчат-підлітків також виявлено значну поширеність інфекції С.trachomatis. Генітальна хламідійна інфекція перевершила гонорею, ставши хворобою № 1 серед ХПСШ у Сполучених Штатах, з приблизно 41 мільйоном нових випадків щорічно і дівчатами-підлітками, які несуть найбільший тягар цієї хвороби [84].
Біологічні чинники також можуть допомогти пояснити високу частоту запальних захворювань органів малого таза серед дівчат-підлітків. Молодші жінки мають менше захисних антитіл до хламідій і більшу зону цервікальної ектопії, що ставить їх перед вищим ризиком зараження і, можливо, перед загрозою висхідної інфекції з нижніх відділів генітального тракту [7]. Дівчата-підлітки мають меншу кількість овуляційних менструальних циклів, що призводить до станів з високим рівнем естрогену й низьким рівнем прогестерону. Поєднання ендогенного й екзогенного прогестерону сприяє розвитку густого цервікального слизу, який обмежує проникнення сперматозоїдів і бактерій до верхніх відділів генітального тракту; наявність естрогену без прогестерону в дівчат-підлітків, які не мають овуляції, спричинює більшу проникність цервікального слизу для патогенних мікроорганізмів [85].
Сексуальна поведінка
Багато різновидів сексуальної поведінки пов’язано з ризиком розвитку хвороб, що передаються статевим шляхом, а відтак запальних захворювань органів малого таза. Це, зокрема, велика кількість поточних статевих партнерів, а також численні партнери протягом життя, молодий вік при першому статевому контакті та висока частота статевих контактів [86]. Одне з досліджень засвідчило, що жінки, які повідомили про чотирьох або більше статевих партнерів у попередні 6 місяців, найімовірніше, матимуть діагноз запальних захворювань органів малого таза, і таких було в 3,4 раза більше порівняно з жінками, які повідомили лише про одного статевого партнера [87]. Інші епідеміологічні дослідження підтвердили позитивні кореляції між чисельністю статевих партнерів і запальними захворюваннями органів малого таза [51, 88]. Lee і колеги виявили, що жінки, які досить часто мають статеві контакти (шість або більше разів на тиждень), наражаються на підвищений ризик розвитку запальних захворювань органів малого таза порівняно з жінками, у яких такі контакти бувають рідше одного разу на тиждень (відношення шансів 1,6, 95 %і довірчий інтервал 1,1–2,3) [87]. І численні статеві партнери, і часті статеві контакти збільшують ризик інфекційних уражень шийки матки. Дослідження виявили, що кількість поточних статевих партнерів корелює із зараженням N.gonorrhoeae і С.trachomatis [89, 90].
Статеві партнери-чоловіки з нелікованою інфекцією N.gonorrhoeae чи С.trachomatis забезпечують джерело первинного захворювання і повторного зараження хворобами, що передаються статевим шляхом. Одне дослідження, у якому вивчали чоловіків, статевих партнерів жінок, госпіталізованих із приводу гострих запальних захворювань органів малого таза, виявило, що майже 60 % чоловіків були інфіковані С.trachomatis (19 %) або N.gonorrhoeae (4 %) або мали неспецифічний уретрит (36 %) [91]. Дослідження показали, що незважаючи на той факт, що велика кількість чоловіків — статевих партнерів жінок з ознаками запальних захворювань органів малого таза повідомили про уретрит (27–50 %), тільки приблизно 20 % чоловіків зверталися з приводу лікування уретриту до встановлення діагнозу запальних захворювань органів малого таза в їхніх партнерок-жінок [81, 92]. Решта чоловіків з уретритом не мали жодних ознак або симптомів інфекції. Такий брак виявлення і медичних втручань серед чоловіків — статевих партнерів, інфікованих N.gonorrhoeae або С.trachomatis, може пояснювати високу частоту повторних епізодів запальних захворювань органів малого таза серед жінок із первинними епізодами ХПСШ і високу частоту повторного інфікування N.gonorrhoeae або С.trachomatis серед цих жінок.
Попередні інфекції
У жінок із запальними захворюваннями органів малого таза в анамнезі зростає ризик рецидиву захворювання. За даними одного з досліджень, імовірність того, що жінки з діагнозом ЗЗОМТ матимуть в анамнезі випадки ЗЗОМТ, буде вдвічі вищою порівняно із жінками без таких захворювань після статистичної корекції щодо раси, кількості статевих партнерів і використання запобіжних внутрішньоматкових засобів [88]. Крім того, майже у чверті жінок з гострими запальними захворюваннями органів малого таза розвивається другий епізод запалення через повторне зараження від нелікованого статевого партнера або через неадекватне дотримання схеми лікування антибіотиками. Повторенню епізодів ЗЗОМТ важливо запобігти, оскільки кількість епізодів безпосередньо пов’язана з ризиком безплідності. Westrom повідомив, що показник безплідності серед жінок зріс із 13 % у випадках з одним епізодом сальпінгіту до 35 % у випадках з двома епізодами і до 75 % у випадках із трьома або більше епізодами [93].
У жінок із попередньою інфекцією N.gonorrhoeae або С.trachomatis також зростає ризик розвитку запальних захворювань органів малого таза. Дослідження засвідчили відносний ризик ЗЗОМТ за умов перенесеної хвороби, що передається статевим шляхом, у межах від 1,7 до 2,5 [3, 51, 87]. У дослідженні здоров’я жінок із дизайном «випадок — контроль» на базі лікарні жінки, які повідомили про епізод гонореї в анамнезі, наражалися на значно вищий ризик розвитку запальних захворювань органів малого таза порівняно з жінками без випадків гонореї в анамнезі (відкориговане відношення шансів 1,8, 95 % довірчий інтервал 1,4–2,3) [87]. Підвищений ризик розвитку запальних захворювань органів малого таза після гонококової інфекції може бути пов’язаний з повторним зараженням або з раніше перенесеною субклінічною інфекцією маткових труб. Окрема група осіб має високу частоту рецидивів гонореї через повторну інфекцію [94]. Ця група, яку називають основною, вважається резервуаром патогенів, що передаються статевим шляхом, і чим частішими є статеві зв’язки між основною групою й іншими індивідами, тим швидше поширюється інфекція. З іншого боку, дослідження засвідчили, що нова гонококова інфекція може активувати латентну хламідійну інфекцію [95].
Контрацепція
Постійне використання сперміцидних бар’єрних методів контрацепції, включаючи презервативи, діафрагми й цервікальні ковпачки, ймовірно, запобігає як інфекції N.gonorrhoeae і С.trachomatis, так і розвитку запальних захворювань органів малого таза [96, 97]. Дані дослідження здоров’я жінок показали, що в жінок, які повідомляли про постійне використання методів бар’єрної контрацепції, менший ризик щодо першого епізоду запальних захворювань органів малого таза порівняно з жінками, які використовували інші форми контрацепції або взагалі обходилися без контрацепції (відносний ризик 0,6, 95 % довірчий інтервал 0,5–0,9) [96]. З іншого боку, у проспективному дослідженні групи жінок із сукупності пацієнток спеціалізованої клініки з лікування хвороб, що передаються статевим шляхом, в якому оцінювалася валідність повідомлення про використання презервативів протягом 30 днів, було виявлено таке: у 23,5 % жінок, які завжди користувалися презервативами, було діагностовано новий епізод ХПСШ порівняно з майже таким самим відсотком жінок (26,8 %), які ніколи не користувалися презервативами [98]. Це свідчить про те, що презервативи не завжди використовувалися постійно й належним чином; крім того, жінки з високим ризиком розвитку ХПСШ, які повідомляли, що використовували презервативи, насправді ними не користувалися [98, 99].
Використання внутрішньоматкових засобів (ВМЗ) пов’язане з більшим ризиком запальних захворювань органів малого таза, особливо в перші чотири місяці після встановлення, що, можливо, пов’язано з проникненням інфекції з нижніх відділів генітального тракту до верхніх. Велике проспективне дослідження групи жінок засвідчило зростання ризику запальних захворювань органів малого таза в 3,5 раза серед користувачів ВМЗ порівняно з тими, хто ними не користувався [100]. Інше дослідження з дизайном «випадок — контроль» на базі лікарні показало, що користування ВМЗ було незалежним предиктором сальпінгіту і що використання цих засобів подвоює ймовірність хвороби [88]. Однак деякі дослідження засвідчили, що зростання ризику ЗЗОМТ через використання внутрішньоматкових засобів загрожує лише жінкам, які можуть захворіти на ХПСШ, оскільки в жінок з низьким ризиком цих хвороб не спостерігалося значного збільшення показника запальних захворювань органів малого таза, пов’язаного з використанням внутрішньоматкових засобів [101]. Останнім часом експерти стверджують, що такі засоби можуть з успіхом використовувати жінки, які мають моногамні, довготривалі стосунки, особливо якщо вони прийматимуть антибіотики під час встановлення засобу.
Не дивно, що використання внутрішньоматкових засобів пов’язане зі збільшенням показника трубної безплідності, через те що вони спричинюють запальні захворювання органів малого таза. В одному дослідженні з дизайном «випадок — контроль» порівнювали жінок, які в минулому використовували внутрішньоматкові засоби і звернулися по лікування з приводу трубної безплідності, і здорових жінок [102]. Це дослідження показало, що в жінок, які повідомили про попереднє використання внутрішньоматкових засобів, був у 2,6 раза більший ризик трубної безплідності, ніж у жінок, які ніколи не вдавалися до таких засобів (95% довірчий інтервал 1,3–5,2). Найвищий ризик трубної безплідності був пов’язаний з використанням пристрою Dalkon Shield (відношення шансів 6,8, 95% довірчий інтервал 1,8–25,2). Засоби, що містять мідь (найчастіше використовувані внутрішньоматкові засоби) не призводять до зростання частоти трубної безплідності (відносний ризик 1,9; 95% довірчий інтервал 0,9–4,0).
Результати досліджень, у яких оцінювали зв’язок між використанням оральних контрацептивів і запальними захворюваннями органів малого таза хламідійної етіології, виявилися суперечливими. У ретроспективних дослідженнях групи жінок серед тих, хто повідомив про використання оральних контрацептивів, виявлено більшу поширеність хламідійної інфекції порівняно з жінками, які обрали інші методи контрацепції. Дослідження засвідчили зростання ризику хламідійної інфекції у два-три рази серед жінок, які користувалися оральними контрацептивами, порівняно з жінками, які вдавалися до інших типів контрацепції [103–105]. Результати досліджень на тваринах свідчать про те, що дія екзогенного естрогену та прогестерону стимулює розмноження С.trachomatis [106, 107]. Нині неясно, що саме спричинило почастішання випадків інфекції С.trachomatis: поширення її серед користувачів оральних контрацептивів чи фактичне зростання показників зараженості.
Як не парадоксально, але численні епідеміологічні дослідження засвідчили знижений ризик маніфестних запальних захворювань органів малого таза серед користувачів оральних контрацептивів [86, 108]. В одному з досліджень виявлено, що ризик маніфестних запальних захворювань органів малого таза хламідійної етіології був значно нижчий серед жінок, які повідомили про те, що в минулому або й тепер намагаються убезпечити себе від інфекції в такий спосіб порівняно з жінками, які не практикували жодного методу контрацепції (відношення шансів 0,30, 95% довірчий інтервал 0,10–0,89) [109]. Цей захисний ефект був суттєвим після статистичної корекції щодо віку, кількості вагітностей і кількості статевих партнерів протягом життя. Захист, який забезпечує використання оральних контрацептивів, може опосередковуватися через гормональні впливи. Баланс естрогену та прогестерону, який створюють оральні контрацептиви, сприяє утворенню цервікального слизу, що менше захищає від проникнення бактерій. Крім того, короткий часовий період менструації серед користувачок оральних контрацептивів може знижувати ретроградний кровотік, надалі зменшуючи ризик запальних захворювань органів малого таза [81].
Неузгодженість між зростанням показника інфікування нижніх відділів генітального тракту хламідіями при використанні оральних контрацептивів і доведеним зменшенням показника маніфестних запальних захворювань органів малого таза серед користувачок оральних контрацептивів привела дослідників до такої думки, що використання оральних контрацептивів може спричинити невиявлені, безсимптомні захворювання верхніх відділів генітального тракту [33]. Ness і колеги [24] досліджували, чи є поточне використання оральних контрацептивів більш поширеним серед жінок із недіагностованим ендометритом порівняно з жінками з діагностованим ендометритом. Учені виявили, що жінок із недіагностованим ендометритом було у 4,3 раза більше (95% довірчий інтервал 1,6–11,7), ніж жінок з діагностованим ендометритом, які повідомили про поточне використання оральних контрацептивів [24], після статистичної корекції щодо наявності в анамнезі ХПСШ і N.gonorrhoeae. Результати цього дослідження свідчать про те, що поточне використання оральних контрацептивів може бути пов’язане з недіагностованими, безсимптомними випадками запальних захворювань органів малого таза, ймовірно, через ослаблення запальної реакції та відповідної симптоматики серед користувачок оральних контрацептивів.
Вагінальне спринцювання
У Сполучених Штатах вагінальне спринцювання зазвичай практикують деякі групи жінок. Під час проведення національного дослідження жінок віком старше 18 років 32 % опитаних повідомили про вагінальне спринцювання протягом минулого тижня [2]. У цьому дослідженні найвищу частоту і поширеність спринцювання спостерігали серед темношкірих жінок і жінок із низьким соціально-економічним статусом. Метааналіз, проведений з метою визначити зв’язок між вагінальним спринцюванням і запальними захворюваннями органів малого таза, виявив, що після спринцювання ризик цих захворювань зростає на 73 %, а ризик ектопічної вагітності, ускладнення через ЗЗОМТ, — на 76 % [ПО]. Результати дослідження з дизайном «випадок — контроль», у якому порівнювалися жінки з клінічно підтвердженими випадками запальних захворювань органів малого таза і жінки з контрольної групи (випадкова вибірка), показали підвищений ризик цих захворювань серед жінок, які повідомили про вагінальне спринцювання протягом попередніх двох місяців (відношення шансів 1,7; 95% довірчий інтервал 1,0–2,8) [111]. Цей взаємозв’язок виявився суттєвим після статистичної корекції щодо чинників, які вносять плутанину, тобто щодо віку, раси, куріння сигарет, ЗЗОМТ чи ХПСШ в анамнезі, частоти статевих контактів та методу контрацепції. Крім того, у цьому дослідженні виявлено взаємозв’язок між спринцюванням і запальними захворюваннями органів малого таза. Жінки, які повідомили про спринцювання раз чи два рази на місяць, мали відношення шансів 1,6 (95% довірчий інтервал 0,6–4,0), а жінки, які спринцювалися тричі або більше разів на місяць, мали відношення шансів 3,4 (95% довірчий інтервал 1,1–10,4) порівняно з жінками, які спринцювалися рідше одного разу на місяць.
Інше дослідження, у якому вивчався взаємозв’язок між спринцюванням і запальними захворюваннями органів малого таза, засвідчило подвійне зростання частоти цих захворювань серед жінок, які повідомили про поточне спринцювання (відносний ризик після статистичної корекції 2,1, 95% довірчий інтервал 1,2–3,9) [112]. Однак у цьому дослідженні ступінь кореляції між вагінальним спринцюванням і запальними захворюваннями органів малого таза зменшився, коли з’ясували причину спринцювання. Жінки, які повідомили, що вагінальним спринцюванням намагалися зменшити подразнення генітального тракту або усунути інфекцію, наражалися на значно більший ризик запальних захворювань органів малого таза (відносний ризик 7,9; 95% довірчий інтервал 2,6–24,2), а серед жінок, які проводили спринцювання з інших причин, спостерігалося незначне збільшення частоти запальних захворювань органів малого таза (відносний ризик 1,6; 95% довірчий інтервал 0,8–3,0).
Теоретично вагінальне спринцювання може збільшувати ризик запальних захворювань органів малого таза, механічно забезпечуючи поширення інфекції з нижніх відділів генітального тракту до верхніх, змінюючи вагінальне середовище таким чином, що воно зменшує захист від ХПСШ, або вносячи непатогенні аероби й анаероби з нижніх відділів генітального тракту до стерильних верхніх відділів. Необхідні подальші дослідження, щоб визначити, чи насправді вагінальне спринцювання причинно пов’язане із запальними захворюваннями органів малого таза, чи воно є маркером вагінальної інфекції (тобто жінки спринцюються, щоб евакуювати вагінальні виділення, пов’язані з N.gonorrhoeae чи С.trachomatis, які можуть призвести до запальних захворювань органів малого таза навіть за відсутності спринцювання).
Куріння сигарет
Куріння визначають як чинник ризику зараження N.gonorrhoeae і С.trachomatis. У кількох дослідженнях повідомлено про позитивний зв’язок між постійним курінням і запальними захворюваннями органів малого таза [113, 114]. Дані дослідження жіночого здоров’я засвідчили вдвічі більший ризик запальних захворювань органів малого таза як серед жінок, які курять (відношення шансів 1,7; 95% довірчий інтервал 1,1–2,5), так і серед колишніх курців (відношення шансів 2,3; 95% довірчий інтервал 1,3–4,2) [113].
Інші дослідження виявили почастішання випадків ускладнень, пов’язаних із запальними захворюваннями органів малого таза (трубна безплідность та ектопічна вагітность) серед жінок-курців. Chow і колеги повідомили, що жінки, які курили під час зачаття, наражалися на удвічі більший ризик ектопічної вагітності порівняно з жінками, які ніколи не курили, після статистичної корекції показника щодо інтенсивності куріння, маси тіла, раси, використання внутрішньоматкових засобів і вагінального спринцювання (відношення шансів 2,2; 95% довірчий інтервал 1,4–3,4) [115]. Це дослідження не виявило взаємозв’язку типу «доза — реакція», і колишні жінки-курці, які повідомили, що кинули курити перед зачаттям, не показали суттєвого почастішання випадків ектопічної вагітності (відношення шансів 1,6; 95% довірчий інтервал 1,0–2,8). Однак у цьому дослідженні не проводилася статистична корекція щодо наявності в анамнезі хвороб, що передаються статевим шляхом, і воно ґрунтувалося на самозвітах. Інше дослідження з дизайном «випадок — контроль», у якому порівнювали жінок-курців і тих жінок, які ніколи не курили, виявило зростання ризику трубної безплідності до 60 % (відносний ризик 1,6; 95% довірчий інтервал 1,1–2,1) [116]. Це дослідження також показало серед жінок, які курять, почастішання випадків безплідності, пов’язаної з патологією шийки матки, визначеної як аномальний цервікальний слиз або непроникнення сперматозоїдів, однак не спостерігалося поширення безплідності, пов’язаної з порушеннями овуляції або ендометріозом.
Метаболіти складових тютюнового диму виявлено в цервікальному слизу жінок-курців, що може пояснити біологічні механізми, які сприяють взаємозв’язку між курінням і запальними захворюваннями органів малого таза. У невеликому дослідженні збирали зразки цервікального слизу в жінок-курців і в жінок, які не курили: у цервікальному слизу перших виявили нікотин і сліди котиніну [117]. Рівні були однаковими або перевищували рівні, виявлені в сироватці крові. Ці метаболіти потенційно можуть ослаблювати вагінальний імунітет і/або обмежувати рухливість війок і транспортну функцію маткових труб, що може зменшувати ефективність елімінації патогенних мікроорганізмів із шийки матки [86]. Дослідження на тваринах також показали затримку в транспортуванні яйцеклітини до матки, формуванні бластоцистів та імплантації яйцеклітини в пацюків, яких піддавали дії нікотину [118].
Лікування
Мета лікування запальних захворювань органів малого таза полягає в тому, щоб зменшити наслідки захворювань генітального тракту. Незважаючи на розробку й поширення методичних рекомендацій CDC, досягнуто чіткої згоди щодо оптимального підходу до лікування ЗЗОМТ [12, 119]. Сучасні рекомендації цього центру пропонують госпіталізувати жінок, в яких гостра хвороба, ймовірно, більш серйозна або в яких неможливо виключити гостру хірургічну патологію, наприклад апендицит чи трубнояєчниковий абсцес [120]. Амбулаторне лікування пропонують жінкам із легкою чи помірною симптоматикою, до того ж за умови впевненості, що пацієнтки дотримуватимуться режиму лікування антибіотиками [48]. Ці широкого змісту методичні рекомендації засновані радше на консенсусі, аніж на результатах клінічних досліджень, крім того, вони неоднаково інтерпретуються, як це демонструють дуже суперечливі показники госпіталізації з приводу запальних захворювань органів малого таза в різних регіонах і різних медичних установах [121].
Інша проблема, пов’язана з методичними рекомендаціями CDC, полягає в тому, що немає жодного встановленого точного тесту, який би визначав розвиток репродуктивних ускладнень у жінок із запальними захворюваннями органів малого таза. Хоча вираженість запалення за даними безпосереднього огляду тазових органів при лапароскопії є предиктором розвитку безплідності, лапароскопічні результати безпосередньо не корелюють із клінічною картиною. Запальні захворювання органів малого таза, пов’язані з інфекцією С.trachomatis, мають менш яскраву клінічну картину, аніж запальні захворювання, пов’язані з гонококовою інфекцією. Однак інфікування С.trachomatis (як не парадоксально) має своїм наслідком більш високі показники безплідності [26, 122]. Тому рекомендація щодо госпіталізації жінок із більш серйозними симптомами хвороби не може фактично зменшити тягар порушення репродуктивних функцій, що випливає із запальних захворювань органів малого таза. Оскільки розвиток наслідків непередбачуваний, деякі спеціалісти пропонують госпіталізовувати всіх жінок, які бажають обстежити свій потенційний стан плідності [119]. В одному рандомізованому дослідженні (усе ще триває) уперше порівнювалася ефективність амбулаторної протимікробної терапії та стаціонарної терапії хворих [123].
Незалежно від того, проводиться лікування в стаціонарній установі чи амбулаторно, протимікробна терапія при запаленні органів малого таза потребує комбінації лікарських препаратів, які діють на N.gonorrhoeae, C.trachomatis і на потенційно вагінальні анаероби й факультативні аероби. Такі лікувальні курси включають, наприклад, один із цефалоспоринів (cephalosporin) плюс доксициклін (doxycycline) або кліндаміцин (clindamycin) плюс гентаміцин (gentamycin) — для стаціонарних хворих і офлоксацин (ofloxacin) плюс метронідазол (metronidazole) або один із цефалоспоринів плюс доксициклін — для амбулаторних хворих [12]. Питання про те, якою мірою оптимальне лікування має включати препарати, що впливають на анаероби, залишається суперечливим. Лікування сексуальних партнерів — необхідний елемент сучасної медичної допомоги. Воно є важливим, оскільки повторне зараження є звичайним явищем, якщо не лікуються сексуальні партнери, які не мають маніфестних симптомів.
Завершальний важливий момент стосовно лікування запальних захворювань органів малого таза — його своєчасність. Safrin із колегами показали, що зволікання з лікуванням симптомів ЗЗОМТ підвищує ризик наступної безплідності [124]. Цей висновок підтвердили результати скандинавського дослідження групи жінок. Жінки, які не зверталися до лікаря більше трьох днів після початку симптоматики, наражалися на втричі більший ризик стати безплідними через запальні захворювання органів малого таза (порівняно з жінками, симптоми яких піддавалися негайному лікуванню) [25]. Це може відбивати додаткову запальну реакцію, пов’язану з нелікованою, обмеженою в просторі інфекцією тазових органів.
Профілактика
Своєчасне лікування запальних захворювань органів малого таза вважають третинною профілактикою із метою зменшення несприятливих репродуктивних наслідків, пов’язаних з цими захворюваннями. Однак навіть у скандинавському дослідженні, де більшості жінок лікувальну допомогу надавали швидко й усіх жінок лікували антибіотиками (внутрішньовенне введення), частота безплідності була високою. Тому важливо розвивати ефективні програми первинної та вторинної профілактики. Первинна профілактика полягає передусім у зменшенні ризику зараження хворобами, що передаються статевим шляхом, вторинна профілактика — у запобіганні цервіциту через поширення інфекції до верхніх відділів генітального тракту, що закінчується запальними захворюваннями органів малого таза. Підхід до первинної профілактики — утримування від статевих зв’язків або використання бар’єрних методів контрацепції. Підхід до вторинної профілактики полягає в тому, щоб удосконалити процес виявлення безсимптомних інфекцій і гарантувати швидке лікування симптоматичних інфекцій нижніх відділів генітального тракту. Сучасні заходи первинної та вторинної профілактики є ефективними щодо зменшення частоти запальних захворювань органів малого таза. У Скандинавії зменшення кількості випадків хвороб, спричинених гонококами і хламідіями, супроводжується наступним зниженням показника запальних захворювань органів малого таза [1]. У штаті Вашингтон у США рандомізоване клінічне дослідження, проведене в організації медичного забезпечення, засвідчило, що активне обстеження на С.trachomatis молодих жінок без симптомів хвороби, крім забезпечення звичайної медичної допомоги, знизило рівень захворюваності на ЗЗОМТ на 60 % протягом одного року [125]. Це було перше експериментальне дослідження з оцінки ефективності вторинної профілактики запальних захворювань органів малого таза, яке продемонструвало важливість виявлення, діагностики й лікування інфекцій нижніх відділів генітального тракту.
Висновки
Запальні захворювання органів малого таза — дуже поширена патологія, яка уражує жінок репродуктивного віку у Сполучених Штатах і в усьому світі. Хоча ці захворювання спричиняють саме N.gonorrhoeae і С.trachomatis, роль анаеробів і факультативних аеробів вагінальної флори менш ясна, і це зумовлює певну неузгодженість щодо відповідного лікування. Інфікування верхніх відділів генітального тракту спричинює запалення, яке, у свою чергу, призводить до ушкодження тканин, клінічним результатом якого є безплідність, ектопічна вагітність, хронічний біль у ділянці тазових органів і повторні запальні захворювання органів малого таза. Така патологія репродуктивної сфери впливає на рівень функціонування та спричиняє значні витрати. Незважаючи на руйнівні наслідки запальних захворювань органів малого таза для репродуктивної функції та існування кількох відомих чинників, на які можна впливати, ці захворювання залишаються поширеними у Сполучених Штатах. Методи громадської системи охорони здоров’я на кшталт тих, що використовуються у Скандинавії і передбачають активні заходи первинної та вторинної профілактики, можна було б застосовувати і в Сполучених Штатах, аби ефективно зменшувати тягар цих захворювань, яким можливо запобігати.
1. Каnі J., Adier M.W. Epidemiology of pelvic inflammatory disease // Pelvic Inflammatory Disease / G.S. Berger, L.V. Westrom (eds.). — New York: Raven Press, 1992.
2. National Survey of Family Growth «From Vital and Health Statistics. Data from the National Survey of Family Growth». U.S. Department of Health and Human Services, Public Health Service, National Center for Health Statistics, Hyattsville, MD. — 1995.
3. Aral S.O., Mosher W.D., Gates W. Self-reported pelvic inflammatory disease in the U.S.: A common occurrence // J. Am. Med. Assoc. 1991. 266, 2570-2573.
4. Sweet R.L. Pelvic inflammatory disease and infertility in women // Infect. Dis. din. North Am. 1987. 1, 199.
5. Blount J.H., Reynolds G.H., Rice R.J. Pelvic inflammatory disease: Incidence and trends in private practice // Morbid. Mortal. Wkly. Rep. 1983. 32 (4SS), 27SS.
6. Rolfs R.T., Galaid E.I., Zaidi A.A. Pelvic inflammatory disease: Trends in hospitalizations and office visits in the U.S., 1979-88 // Am. J. Obstet. Gynecol. 1992. 166(3), 983-990.
7. Cates W., Rolfs R.T., Aral S.O. Sexually transmitted diseases, pelvic inflammatory disease, and infertility: An epidemiologic update // Epidemiol. Rev. 1990. 12, 199-220.
8. Washington A.E., Cates W., Zaidi A.A. Hospitalizations for pelvic inflammatory disease. Epidemiology and trends in the United States, 1975 to 1981 // J. Am. Med. Assoc. 1984. 251, 2529-2533.
9. Quan M., Roadney W.M., Johnson R.A. Pelvic inflammatory disease // J. Fam. Pract. 1983. 16(1), 131-140.
10. Eschenbach D.A., Wölner-Hanssen P., Hawes S.E., Pavletic A., Paavonen J., Holmes K.K. Acute pelvic inflammatory disease: Association of clinical and laboratory findings with laparoscopic findings // Obstet. Gynecol. 1997. 89, 184-192.
11. Morcos R., Frost N., Hnat M.L., Petrunak A., Caldito G. Laparoscopic versus clinical diagnosis of acute pelvic inflammatory disease. J. Reprod. Med. 1993. 38(1), 53-56.
12. Centers for Disease Control and Prevention Guidelines for treatment of sexually transmitted diseases // Morbid. Mortal. Wkly. Rep. 1998. 47(RR-1), 79-86.
13. Hager W.D., Eschenbach D.A., Spence M.R., Sweet R.L. Criteria for diagnosis and grading of salpingitis // Obstet. Gynecol. 1983. 61, 113.
14. Kahn J.G., Walker C.K., Washington E., Landers D.V., Sweet R.L. Diagnosing pelvic inflammatory disease. A comprehensive analysis and considerations for developing a new model // J. Am. Med. Assoc. 1991. 266, 3594.
15. Paavonen J., Aine R., Teisala K., Heinonen P., Punnonen R. Comparison of endometrial biopsy and peritoneal fluid cytologic testing with laparoscopy in the diagnosis of acute pelvic inflammatory disease // Am. J. Obstet. Gynecol. 1985. 151(5), 645.
16. Sellors J., Mahony J., Goldsmith C, Rath D., Mander R., Hunter B., Taylor C, Groves D., Richardson H., Chemesky M. The accuracy of clinical findings and laparoscopy in pelvic inflammatory disease // Am. J. Obstet. Gynecol. 1991. 164, 113-120.
17. Peipert J.Р., Boardman L., Hogan J.W., Sung J., Mayer K.H. Laboratory evaluation of acute upper genital tract infection // Obstet. Gynecol. 1996. 87, 730-736.
18. Ness R.B., Soper D.E., Peipert J., Bass D., Hemsell D., Shepherd S. for the PEACH Study Group Mucopurulent cervicitis predicts the diagnosis of pelvic inflammatory disease (PID) in the absence of vaginal white blood cells excludes diagnosis // Abstr. Int. Congr. Sex. Transm. Dis. 1997. P457, 138. Seville, Spain.
19. Pattern R.M., Vincent L.M., Wölner-Hanssen P., Thorpe E. Pelvic inflammatory disease endovag-inal sonography and laparoscopic correlation // J. Ultrasound Med. 1990. 9, 681.
20. Bulas D.I., Ahlstrom A., Sivit C.J., Blask A.R.N., O’Donnell R.M. Pelvic inflammatory disease in the adolescent: Comparison of transabdominal and transvaginal sonographic evaluation // Radiology 1992. 183, 435-439.
21. Mikkelsen A.L., Felding C. Laparoscopy and ultrasound examination of women with acute pelvic pain // Gynecol. Obstet. Invest. 1990. 30, 162.
22. Wasserheit J. N., Bell T.A., Kiviat N.B., Wölner-Hanssen P., Zabriskie V., Kirby B., Prince E.C., Holmes K.K., Stamm W.E., Eschenbach D.A. Microbial causes of proven pelvic inflammatory disease and efficacy of Clindamycin and Tobramycin // Ann. Intern. Med. 1986. 104, 187.
23. Kiviat N.B., Wölner-Hanssen P., Eschenbach D.A., Wasserheit J.N., Paavonen J.A., Bell T.A., Critchlow C.W., Stamm W.E., Moore D.E., Holmes K.K. Endometrial histology in patients with culture-proved upper genital tract infection laparoscopically diagnosed acute salpingitis // Am. J. Surg. Pathol. 1990. 14, 167.
24. Ness R.B., Keder L.M., Soper D.E., Amortegui A.J., Gluck J., Weisenfeld H., Sweet R.L., Rice P.A., Peipert J.E., Donegan S.P., Shakir A.K. Oral contraception and the recognition of endometritis // Am. J. Obstet. Gynecol. 1997. 176, 580-585.
25. Hillis S.D., Joesoef M.R., Marchbanks P.A., Wasserheit J.N., Cates W., Westrom E. Delayed care of pelvic inflammatory disease as a risk factor for impaired fertility // Am. J. Obstet. Gynecol. 1993. 168, 1503-1509.
26. Brunham R.C., Binns B., Guijon P., Danforth D. Etiology and outcome of acute pelvic inflammatory disease // J. Infect. Dis. 1988. 158, 510.
27. Sweet R.E., Draper D.E., Schachter J., James J., Hadley W.K., Brooks G.F. Microbiology and pathogenesis of acute salpingitis as determine by laparoscopy. What is the appropriate site to sample? // Am. J. Obstet. Gynecol. 1980. 138, 985.
28. Sweet R.E., Schachter J., Robbie M.O. Failure of beta-lactam antibodies to eradicate Chlamydia trachomatis in the endometrium despite apparent clinical cure of acute salpingitis // J. Am. Med. Assoc. 1983. 250, 2641-2645.
29. Wasserhiet J.N., Bell T.A., Kiviat N.B., Wölner-Hanssen P., Zambriskie V., Kisby B.D., Prince E.C., Holmes K.K., Stamm W.E., Eschenbach D.A. Microbial causes of proven pelvic inflammatory disease and efficacy of Clindamycin and Tobramycin // Ann. Intern. Med. 1986. 104, 187.
30. Heinonnen P.K., Teisala K., Punnonen R., Miettinen A., Lehtinen M., Paavonen J. Anatomic sites of upper genital tract infection // Obstet. Gynecol. 1985. 66, 384-390.
31. Paavonen J., Teisala K., Heinonen P.K., Aine R., Eaine S., Eehtinen M., Miettinen A., Punnon R., Gronroos P. Microbiological and histopatholog-ical findings in acute pelvic inflammatory disease // Br. J. Obstet. Gynecol. 1987. 94, 454-460.
32. Soper D.E., Brockwell N.J., Dalton H.P. Microbial etiology of urban emergency room acute salpingitis: Treatment with ofloxacin // Am. J. Obstet. Gynecol. 1992. 167, 653.
33. Rice P.A., Schachter J. Pathogenesis of pelvic inflammatory disease: What are the questions? // J. Am. Med. Assoc. 1991. 266, 2587-2593.
34. Jossens M.O.R., Schachter J., Sweet R.E. Risk factors associated with pelvic inflammatory disease of different microbial etiologies // Obstet. Gynecol. 1994. 83, 989-997.
35. Eschenbach D.A. Epidemiology and diagnosis of acute pelvic inflammatory disease // Obstet. Gynecol. 1980. 55 (Suppl.), 142S-151S.
36. Wasserheit J.N. Pelvic inflammatory disease and infertility // Md. State Med. J. 1987. 36, 58-63.
37. Thomason J.E., Gelbart S.M., Scaglione N.J. Bacterial vaginosis: Current review with indications for asymptomatic therapy // Am. J. Obstet. Gynecol. 1991. 165, 1212-1217.
38. Eschenbach D.A., Hillier S.L., Critchlow C.W., Stevens C., De-Rouen T., Holmes K.K. Diagnosis and clinical manifestations of bacterial-vaginosis // Am. J. Obstet. Gynecol. 1988. 158, 19-28.
39. Hillier S.L., Krohn M.A., Rabe L.K., Klebanoff S.J., Eschenbach D.A. The normal vaginal flora H2O2 producing lactobacilli, and bacterial vaginosis in pregnant women // Clin. Infect. Dis. (1993). 16, S272-S281.
40. Klebanoff S.J., Hillier S.L., Eschenbach D.A., Waltersdorph A.M. Control of the microbial flora of the vagina by H2О2 — generating lactobacilli // J. Infect. Dis. 1991. 164, 94-100.
41. Zheng H.Y., Alcom T.M., Cohen M.S. Effects of H2O2 — producing lactobacilli on Neisseria gonorrhoeae growth and catalase activity // J. Infect. Dis. 1994. 170, 94-100.
42. Hawes S.E., Hillier S.L., Benedetti J., Steven C.E., Koutsky L.A., Wölner-Hanssen P., Holmes K.K. Hydrogen peroxide-producing lactobacilli and acquisition of vaginal infections // J. Infect. Dis. 1996. 174, 1058-1063.
43. Peipert J.R., Montagno A.B., Cooper A.S., Sung C.J. Bacterial vaginosis as a risk factor for upper genital tract infection // Am. J. Obstet. Gynecol. 1997. 177, 1184-1187.
44. Soper D.E., Brockwell N.J., Dalton H.P. Microbial etiology of urban emergency department acute salpingitis: Treatment with ofloxacillin // Am. J. Obstet. Gynecol. 1992. 167, 653-660.
45. Piatt R., Rice P.A., McCormack W.M. Risk of acquiring gonorrhea and prevalence of abnormal adnexal findings among women recently exposed to gonorrhea // J. Am. Med. Assoc. 1983. 250(23), 3205-3209.
46. Stamm W.E., Guinan M.E., Johnson C., Starcher T., Holmes K.K., McCormack W.M. Effect of treatment regimens for Neisseria gonorrhoeae on simultaneous infection with Chlamydia trachomatis // N. Engl. J. Med. 1984. 313, 545-549.
47. Expert Committee on Pelvic Inflammatory Disease Pelvic inflammatory disease. Research directions in the 1990s // Sex. Transm. Dis. 1991. 18, 46-64.
48. Westrom L., Mardh P.-A. Acute pelvic inflammatory disease (PID) // Sexually Transmitted Diseases / K. K. Holmes, P.-A. Mardh, P. F. Sparling (eds.). — 2nd ed. — New York: McGraw-Hill, 1990. — Р. 593.
49. Haime J., Hammond M.G., Hulka J.P., Shailaja G.R., Talbert L.M. Retrograde menstruation in healthy women and in patients with endometriosis // Obstet. Gynecol. 1984. 64, 151.
50. Lee N.C., Rubin G.L., Ory H.W., Burkman R.T. Type of IUD and the risk of PID // Obstet. Gynecol. 1983. 62, 1.
51. Eschenbach D.A., Hamish J.P., Holmes K.K. Pathogenesis of acute pelvic inflammatory disease: Role of contraception and other risk factors // Am. J. Obstet. Gynecol. 1977. 128, 838.
52. Patton D., Wölner-Hanssen P., Cosgrove S.J., Holmes K.K. The effects of Chlamydia trachomatis on the female reproductive tract of the Macaco nemestrina after a single tubal challenge following repeated cervical inoculations // Obstet. Gynecol. 1990. 76, 643-650.
53. Soper D.E. Pelvic inflammatory disease // Infect. Dis. Clin. North Am. 1994. 8, 821-840.
54. Gates W., Jr., Farley T.M.M., Rowe P.J. Worldwide patterns of infertility: Is Africa different? // Lancet 1985. 2, 596-598.
55. Spence M.R., Genadry R., Rafael L. Randomized prospective comparison of ampicillin and doxy-cycline in the treatment of acute pelvic inflammatory disease in hospitalized patients // Sex. Transm. Dis. 1981. 8, 164.
56. Ory H.W. The Women’s Health Study: Ectopic pregnancy and intrauterine contraceptive devices: New perspectives // Am. J. Obstet. Gynecol. 1981. 57, 137.
57. Westrom L.V., Joesoef R., Reynolds G., Hogdu A., Thompson S.E. Pelvic inflammatory disease and fertility. A cohort study of 1,844 women with laparoscopically verified disease and 657 control women with normal laparoscopic results // Sex. Transm. Dis. 1992. 19, 185-192.
58. Westrom L. Incidence, prevalence and trends of acute pelvic inflammatory disease and its consequences in industrialized countries // Am. J. Obstet. Gynecol. 1980. 138, 880.
59. Moore D.E., Foy H.M., Baling J.R., Spadoni L.R., Wang S.P., Kuo C.C., Grayston J.T., Eshenbach D.A. Increased frequency of serum antibodies to Chlamydia trachomatis in infertility due to distal tubal disease // Lancet 1982. 2, 574-577.
60. Conway D., Caul E.O., Hull M.G.R., Glazenen C.M.A., Hodgson J., Clarke S.K.R., Stirrat G.M. Chlamydial serology in fertile and infertile women // Lancet 1984. 1, 191-193.
61. Guderian A.M., Trobough G.E. Residues of pelvic inflammatory disease in intrauterine device users: A result of the intrauterine device or Chlamydia trachomatis infection? // Am. J. Obstet. Gynecol. 1986. 154, 497-503.
62. Gump D.W., Gibson M., Ashikaga T. Evidence of prior pelvic inflammatory disease and its relationship to Chlamydia trachomatis antibody and intrauterine contraceptive device use in infertile women // Am. J. Obstet. Gynecol. 1983. 146, 153-156.
63. Anestad G., Lunde O., Moen M., Dalaker K. Infertility and chlamydial infection // Fertil. Steril. 1987. 48, 787-790.
64. Kane J.L., Woodland R.M., Forsey T., Darougar S., Elder M.G. Evidence of chlamydial infection in infertile women with and without fallopian tube obstruction // Fertil. Steril. 1984. 42, 843-848.
65. Jones R.B., Ardery B.R., Hui S.L., Clery R.E. Correlation between serum antichlamydial antibodies and tubal factor as a cause of infertility // Fertil. Steril. 1982. 38, 553-558.
66. Punnonen R., Terho P., Nikkanen V., Meurman O. Chlamydial serology in infertile women by immunofluorescence // Fertil. Steril. 1979. 31, 656-659.
67. Miettinen A., Heinonen P.K., Teisala K., Hakkarainen K., Punnonen R. Serologic evidence for the role of Chlamydia trachomatis, Neisseria gonorrhoeae, and Mycoplasma hominis in the etiology of tubal factor infertility and ectopic pregnancy // Sex. Transm. Dis. 1990. 17, 10-14.
68. Sellers J.W., Mahony J.B., Chesnesky M.A., Rath D.J. Tubal factor infertility: An association with prior chlamydial infection and asymptomatic salpingitis // Fertil. Steril. 1988. 49, 451-457.
69. World Health Organization Task Force on the Prevention and Management of Infertility Tubal infertility: Serologic relationship to past chlamydial and gonococcal infection // Sex. Transm. Dis. 1995. 22, 71-77.
70. Chow J.M., Yonekura L., Richard G.A., Greenland S., Sweet R.L., Schachter J. The association between Chlamydia trachomatis and ectopic pregnancy // J. Am. Med. Assoc. 1990. 263, 3164-3167.
71. Washington A.E., Katz P. Cost of and payment for pelvic inflammatory disease. Trends and projections, 1983 through 2000 // J. Am. Med. Assoc. 1991. 266, 2565.
72. Curran J.W. Economic consequences of pelvic inflammatory disease in the United States // Am. J. Obstet. Gynecol. 1980. 138, 848.
73. Rendtorff R.C., Curran J.C., Chandler R.W. Economic consequences of gonorrhea in women // J. Am. Vener. Dis. Assoc. 1974. 1, 40.
74. Gates W., Joesoef M.R., Goldman M.B. Atypical pelvic inflammatory disease: Can we identify clinical predictors? // Am. J. Obstet. Gynecol. 1993. 169, 341-346.
75. Svensson L., Mardh P.A., Ahlgren, M., Nordenskjuld F. Ectopic pregnancy and antibodies to Chlamydia trachomatis // Fertil. Steril. 1985. 44, 313.
76. Henry-Suchet J., Catalan Р., Loffredo V., Sanson M.J., Debache C., Pigeau F., Coppin R. Chlamydia trachomatis associated with chronic inflammation in abdominal specimens from women selected for tuboplasty // Fertil. Steril. 1981. 36, 599.
77. Patton D.L., Askienazy-Elbhar M., Henry-Suchet J., Campbell L., Cappuccio A., Tannais W., Wang S., Kuo L. Detection of Chlamydia trachoma-tis in fallopian tube tissue in women with postinfectious tubal infertility // Am. J. Obstet. Gynecol. 1994. 171, 95-101.
78. Patton D.L., Moore D.E., Spadoni L.R., Soules M.R., Halbert S.A., Wang S.-P. A comparison of the fallopian tube’s response to overt and silent salpingitis // Obstet. Gynecol. 1989. 73, 622-630.
79. Paavonen J., Kiviat N., Brunham R.C., Stevens C.E., Kuo C., Stamm W.E., Miettinen A., Soules M., Eschenbach D.A., Holmes K.K. Prevalence and manifestations of endometritis among women with cervicitis // Am. J. Obstet. Gynecol. 1985. 152, 280-286.
80. Aral S.O., Holmes K.K. Descriptive epidemiology of sexual behavior and sexually transmitted diseases // Sexually Transmitted Diseases / K. K. Holmes, P.-A. Mardh, P.F. Sparling (eds.). — 2nd ed. — New York: McGraw-Hill, 1990. — Р. 19-36.
81. Arenas J.M.B., Lowe C.R. Epidemiologic overview // Pelvic Inflammatory Disease: Epidemiology, Etiology, Management, Complications H.H. Handsfield (ed.). — New York: HP Publishing Company, 1990. — Р. 4-7.
82. Bell T.A., Holmes K.K. 1984. Age-specific risks of syphilis, gonorrhea and hospitalized PID in sexually experienced women // Sex. Transm. Dis. — 11, 291-295.
83. Igra V., Ellen J., Shafer M.-A. Pelvic inflammatory disease in the adolescent female // Pelvic Inflammatory Disease / D.V. Landers, R.L. Sweet (eds.). — New York: Springer-Verlag, 1997. — Р. 116-138.
84. Gates W., Wasserheit J.N. Genital chlamydial infections: Epidemiology and reproductive sequela // Am. J. Obstet. Gynecol. 1991. 164, 1771-1781.
85. Enhoming G., Huldt L., Melen B. Ability of cervical mucus to act as a barrier against bacteria // Am. J. Obstet. Gynecol. 1970. 108, 532-537.
86. Eschenbach D.A. Epidemiology of pelvic inflammatory disease // Pelvic Inflammatory Disease / D.V. Landers, R.L. Sweet (eds.). — New York: Springer-Verlag, 1997. — Р. 1-20.
87. Lee N.C., Rubin G.L., Grimes D.A. Measures of sexual behavior and the risk of pelvic inflammatory disease, act // J. Obstet. Gynecol. 1991. 77(3), 425-430.
88. Flesh G., Weiner J.M., Corlett R.C., Boice C., Mishell D.R., Wolf R.M. The intrauterine contraceptive device and acute salpingitis, act // J. Obstet. Gynecol. 1979. 135(3), 402-408.
89. Handsfield H.H. Criteria for selective screening for Chlamydia trachomatis infection in women attending family planning clinics // J. Am. Med. Assoc. 1986. 255, 1730-1735.
90. Schachter J., Stoner E., Moncada J. Screening for chlamydial infections in women attending family planning clinics // West. J. Med. 1983. 138, 375-379.
91. Kamwendo F., Johansson E., Moi H., Forslin L., Danielsson D. Gonorrhea, genital chlamydial infection, and nonspecific urethritis in male partners of women hospitalized and treated for acute PID // Sex. Transm. Dis. 1993. 20(3), 143-146.
92. Eschenbach D.A., Buchanan T.M., Pollock H.M. Polymicrobial etiology of acute pelvic inflammatory disease // N. Engl. J. Med. 1975. 293, 166-171.
93. Westrom L. Effect of acute pelvic inflammatory disease on fertility // Am. J. Obstet. Gynecol. 1975. 121, 707.
94. Brooks, G. F., Darrow, W. W., and Day, J. A. (1978). Repeated gonorrhea: An analysis of importance and risk factors // J. Infect. Dis. 137, 161-169.
95. Betteiger B.E., Fraiz J., Newhall W.J., Katz B.P., Jones R.B. Association of recurrent chlamydial infection with gonorrhea // J. Infect. Dis. 1989. 159, 661-669.
96. Lee N.C., Rubin G.L., Grimes D.A. Measures of sexual behavior and the risk of pelvic inflammatory disease // Am. J. Obstet. Gynecol. 1991. 77, 425-430.
97. Kelaghan J., Rubin G.L., Ory H.W., Layde P.M. Barrier-method contraceptives and PID // J. Am. Med. Assoc. 1982. 248, 184-187.
98. Zenilman J.M., Weisman C.S., Rompalo A.M., Ellish N., Upchurch D.M., Hook E.W., Celentano D. Condom use to prevent incident of STD’s: The validity of self-reported condom use // Sex. Transm. Dis. 1995. 22(1), 15-21.
99. Nelson D.B., Ness R.B., Peipert J.F., Soper D.E., Amortegui A.J., Gluck J., Weisenfeld H., Rice P.A. Factor predicting upper genital tract inflammation among women with lower genital tract infection // J. Women’s Health 1998. 7, 1033-1040.
100. Vessey M.P., Doll R., Peto R. A long term follow-up study of women using different methods of contraception — an interim report // J. Biosoc. Sci. 1976. 8, 373-426.
101. Lee N.C., Rebin G.Li, Bonick R. The intrauterine device and pelvic inflammatory disease revisited: New results from the women’s health study // Am. J. Obstet. Gynecol. 1988. 72, 1-6.
102. Daling J.R., Weiss N.S., Voigt L.P., McKnight B., Moore D.E. The untrauterine device and primary tubal infertility // N. Engl. J. Med. 1992. 326(3), 203-204.
103. Cromer A., Heald F.P. Pelvic inflammatory disease associated with Neisseria gonorrhoeae and Chlamydia trachomatis: Clinical correlates // Sex. Transm. Dis. 1987. 14, 125-129.
104. Louv W.C., Austin H., Perlman J., Alexander W.J. Oral contraceptive use and the risk of chlamydial and gonococcal infection // Am. J. Obstet. Gynecol. 1989. 160, 396-402.
105. Avonts D., Sercu M., Heyerick P., Vandermeeren I., Meheus A., Piot P. Incidence of uncomplicated genital infections in women using oral contraception or an IUD: A prospective study // Sex. Transm. Dis. 1990. 17, 23-29.
106. Mardh P.A., Paavonen J., Puolakkainen M. Chlamydia. Plenum. — New York, 1989.
107. Rank R.G., White H.J., Hough A.J., Jr., Pasley J.N., Barren A.L. Effect of estradiol on chlamydial genital infection of female guinea pigs // Infect. Immun. 1982. 38, 699-705.
108. Svensson L., Westrom L., Mardh P.A. Contraceptives and acute salpingitis // J. Am. Med. Assoc. 1984. 251, 2553-2555.
109. Spinillo A., Gorini G., Piazzi G., Baltaro F., Monaco A., Zara F. The impact of oral contraception on chlamydial infection among patients with pelvic inflammatory disease // Contraception 1996. 54,163-168.
110. Zhang J., Thomas G., Leybovich E. Vaginal douching and adverse health effects: A meta-analysis // Am. J. Public Health 1997. 87(7), 1207-1211.
111. Wölner-Hanssen P., Eschenbach D.A., Paavonen J., Stevens C.E., Kiviat N.B., Critchlow C., DeRouen R., Koutsky L., Holmes K.K. Association between vaginal douching and acute pelvic inflammatory disease // J. Am. Med. Assoc. 1990. 263, 1936-1941.
112. Scholes D., Dating J.R., Stergachis A., Weiss N.J., Wang S.P., Grayston J.T. Vaginal douching as a risk factor for acute pelvic inflammatory disease // Obstet. Gynecol. 1993. 81, 601-606.
113. Marchbanks P.A., Lee N.C., Peterson H.B. Cigarette smoking as a risk factor for pelvic inflammatory disease // Am. J. Obstet. Gynecol. 1990. 162, 639-644.
114. Buchan H., Villard-Mackintosh L., Vessey M., Yeates D., McPherson K. Epidemiology of pelvic inflammatory disease in parous women with special reference to intrauterine device use // Br. J. Obstet. Gynecol. 1990. 97, 780-788.
115. Chow W.-H, Daling J.R., Weiss N.S., Voigt L.F. Maternal cigarette smoking and tubal pregnancy // Obstet. Gynecol. 1988. 71(2), 167-170.
116. Phipps W.R., Albrecht B., Cramer D.W., Gibson M., Schiff I., Berger M.J., Belisle S., Wilson E., Stillman R. The association between smoking and female infertility as influence by cause of the infertility // Fertil. Steril. 1987. 48(3), 377-382.
117. Sasson J.M., Haley N.J., Hoffman D., Wynder E.L., Hellbom D., Nilsson S. Cigarette smoking and neoplasia of the uterine cervix: Smoke constituents in cervical mucus // N. Engl. J. Med. 1985. 312, 315-319.
118. Yoshinaga K., Rice C., Krenn J., Pilot R.L. Effects of nicotine on early pregnancy in rat // Biol. Reprod. 1979. 20, 294.
119. Peterson H.B., Walker C.K., Kahn J.G., Washington A.E., Eschenbach D., Faro S. Pelvic inflammatory disease: Key treatment issues and options // J. Am. Med. Assoc. 1991. 266, 2605.
120. Ness R.B., Delaney K., Rolfs R.T., Gale J.L. Practice variability in the inpatient treatment of pelvic inflammatory disease // J. Women’s Health 1995. 4, 51-59.
121. Freeman W.L., Green L.A., Becker L.A. Pelvic inflammatory disease in primary care // Fam. Med. 1988. 20, 192.
122. Svensson L., Mardh P.-A., Westrom L. Infertility after acute salpingitis with special reference to Chlamydia trachomatis // Fertil. Steril. 1985. 40, 322.
123. Ness R.B., Soper D.E., Peipert J., Sondheimer S.J., Holley R.L., Sweet R.L., Hemsell D.L., Randall H., Hendrix S.L., Bass D.C., Kelsey S.E., Songer T.J., Lave J.R. for the PID Evaluation and Clinical Health (PEACH) Study Investigators Design of the PID Evaluation and Clinical Health (PEACH) Study // Controlled din. Trials 1998. 19, 499-514.
124. Safrin S., Schactiter J., Dahrouge D., Sweet R.L. Long-term sequelae of acute pelvic inflammatory disease // Am. J. Obstet. Gynecol. 1992. 166, 1300.
125. Scholes D., Stergachis A., Heidrich F.E., Andrilla I.L., Holmes K.K., Stamm W.E. Prevention of pelvic inflammatory disease by screening for cervical chlamydial infection // N. Engl. J. Med. 1996. 334, 1362-1366.