Газета «Новости медицины и фармации» Акушерство и гинекология (347) 2010 (тематический номер)
Вернуться к номеру
Генітальний герпес
Авторы: Анна Валд, Кафедра медицини та епідеміології, Університет штату Вашингтон Сіетл (штат Вашингтон), США, Джоел М. Браун, Кафедра біостатистики, Каліфорнійський університет Берклі (штат Каліфорнія), США
Версия для печати
Вступ
Інфекції, спричинені вірусом простого герпесу (ВПГ), досить поширені серед населення. Ідентифікувавши його спочатку як причину гарячкових пухирців або застудних болячок, у XIX сторіччі вірус простого герпесу визнали генітальною інфекцію [1]. Однак клінічні прояви й наслідки генітального герпесу до 1970-х років не описувалися, а епідеміологічні особливості цієї інфекції не були окреслені до впровадження точних серологічних аналізів у 1980-х роках. Отже, незважаючи на своє тривале існування серед людей, захворюваність, пов’язану з вірусом простого герпесу, визнали відносно недавно.
Існують два типи вірусу простого герпесу: ВПГ-1 і ВПГ-2 [2, 3]. ВПГ-1 — причина застудних болячок і виразок, і він часто набувається в дитинстві від близького (нестатевого) контакту з членами родини. Навпаки, ВПГ-2 — переважна причина генітального герпесу — майже завжди передається через статевий контакт. Однак ВПГ-1 також може бути причиною генітального герпесу, і частота ізоляції ВПГ-1 від цієї інфекції зросла.
Вірус простого герпесу викликає зараження, яке залишається постійним у житті носія й, імовірно, може передаватися багато років після зараження [4, 5]. Вплив інфікування вірусом простого герпесу на здоров’я та психосексуальне функціонування надзвичайно коливається. Найсерйозніші наслідки інфекції спостерігаються в немовлят, де фатальний результат не є рідким навіть при адекватному лікуванні. Особи з ослабленим імунітетом, включаючи ВІЛ-інфікованих, також можуть часто хворіти, що спричинюється вірусом простого герпесу. Хоча більшість людей не усвідомлюють наявності в них цієї інфекції, ті, хто відчуває її, мають неприємні рецидивні генітальні виразкоподібні утворення. Наявний зв’язок генітальних виразок узагалі і спричинених ВПГ-2 зокрема з передачею ВІЛ-інфекції підсилив важливість запобігання генітальним ураженням, пов’язаним з вірусом герпесу. На жаль, тривале поширення ВПГ-2-інфекції свідчить про те, що прогрес у запобіганні відбуватиметься повільно. Як і з багатьма іншими хворобами, що передаються статевим шляхом (ХПСШ), генітальні ураження, пов’язані з вірусом герпесу, виникають у жінок непропорційно й кількома шляхами. По-перше, інфекція більш поширена серед жінок, незалежно від рівня статевої активності. По-друге, хвороба має тенденцію бути клінічно серйознішою серед жінок, в яких, найімовірніше, розвинеться системна хвороба і виникнуть неврологічні ускладнення при первинному зараженні інфекцією. Нарешті, через загрозу потенційних ускладнень протягом вагітності й інфікування немовляти наслідки генітального герпесу впливають більше на жінок. У цій статті розглядатимуться сучасні дані про епідеміологію, розвиток хвороби та важливість уражень, пов’язаних з вірусом герпесу, для системи охорони здоров’я.
Епідеміологія
А. Поширеність і захворюваність
Генітальний герпес — найпоширеніша у Сполучених Штатах хвороба, що передається статевим шляхом. Незважаючи на зменшення кількості бактеріальних хвороб, що передаються статевим шляхом, починаючи з 1980-х років кількість інфекційних уражень, пов’язаних з вірусом ВПГ-2 — найпоширенішою причиною генітального герпесу, — зросла. Оцінки поширеності цієї інфекції серед населення засновані на кількості вперше встановлених клінічних діагнозів і позитивних серологічних аналізів. За оцінками CDC, які ґрунтуються на кількості відвідувань уповноважених лікарів стосовно нових випадків генітального герпесу, щорічно діагностується приблизно 210 000 нових інфекційних випадків [6]. Однак оскільки більшість інфікованих осіб не знають про наявність у них генітального герпесу, імовірна його поширеність у п’ять-десять разів більша.
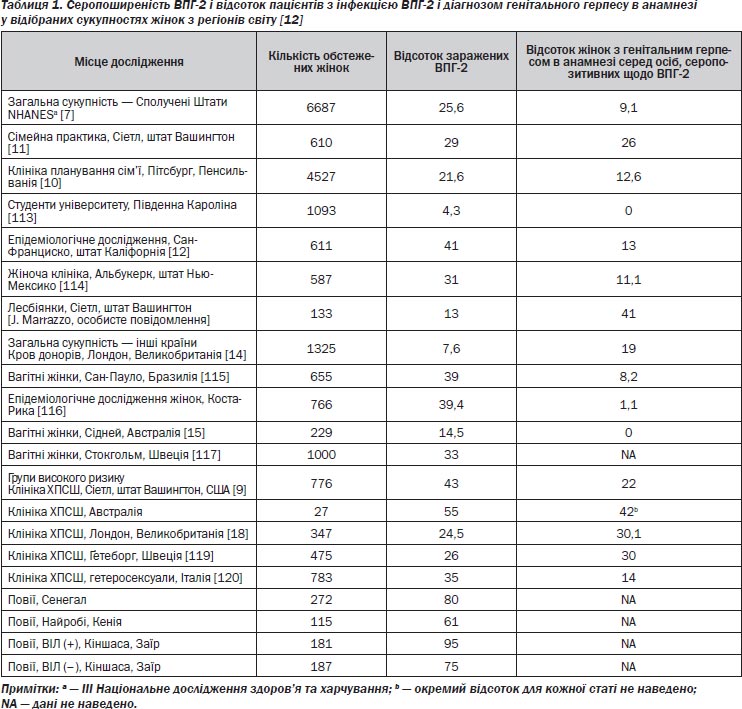
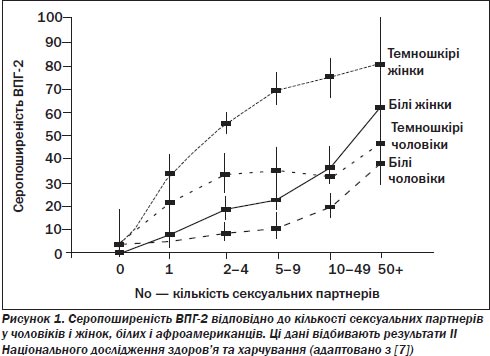
Більш надійні оцінки поширеності ВПГ-2 отримано на базі серологічних досліджень, які використовують типоспецифічні аналізи на антитіла до ВПГ-2. Нині найкращими доступними даними є результати III Національного дослідження здоров’я та харчування (NHANES) випадкової вибірки негоспіталізованих цивільних громадян Сполучених Штатів [7]. Це дослідження, проведене у період з 1988 до 1994 року, показало, що 22 % осіб віком від 12 років і старше у Сполучених Штатах мають ВПГ-2-інфекцію. Як видно з рис. 1, ця інфекція частіше виявляється серед жінок, аніж серед чоловіків, і серед афроамериканців частіше, ніж серед білих. Порівняння цього дослідження 1988–1994 років з дослідженням NHANES, проведеним 12 років до того, засвідчує зростання показника поширеності ВПГ-2 на 30 %. Особливе занепокоєння викликає п’ятикратне збільшення цього показника серед білих підлітків, що вказує на зменшення віку зараження ВПГ-2.
Подібно до результатів недавнього дослідження NHANES, менші за обсягом дослідження, проведені в спеціалізованих клініках з лікування хвороб, що передаються статевим шляхом, у клініках репродуктивного здоров’я та серед загальної сукупності населення, засвідчили, що жінки частіше за чоловіків інфіковані ВПГ-2 (табл. 1) [8–12]. Не дивно, що показники зараженості найвищі в осередках з високим ризиком, особливо серед осіб, які відвідують клініки з лікування статевих хвороб, і серед жінок, які ідентифікують себе як повії.
Дослідження, в яких оцінювалася поширеність ВПГ-2 серед жінок з популяцій з меншим рівнем ризику, показали, що від 13 до 41 % жінок інфіковані ВПГ-2. Із цих серопозитивних жінок лише від 0 до 41 % повідомили про наявність генітального герпесу в анамнезі. Наприклад, одне дослідження, проведене серед жінок, які відвідують клініку з планування сім’ї у Сполучених Штатах, показало, що 22 % жінок інфіковано ВПГ-2; однак лише 13 % з цих ВПГ-2-серопозитивних жінок знали про наявність у них вірусу герпесу [10]. Ці результати свідчать про те, що більшість жінок, інфікованих ВПГ-2, не усвідомлюють свого захворювання.
З інших частин світу доступні лише вибіркові оцінки домінування серотипу ВПГ-2. На наш погляд, ВПГ-2-інфекція менше поширена в Канаді, Західній Європі та Австралії, ніж у Сполучених Штатах [13, 14]. Обмежені дані з Екваторіальної Африки, Південно-Східної Азії (Таїланд) і Карибського регіону (Гаїті) говорять про те, що показники інфекції дуже високі [15–17]. У країнах, що розвиваються, показники позитивних серологічних проб на ВПГ-2 серед сексуально активних дорослих коливаються від 60 до 90 %. Хоча ці цифри можуть частково відбивати фокус на популяціях високого ризику, вони усе ж свідчать про те, що інфекції ВПГ-2 досить поширені в усьому світі.
Захворюваність на розлади, спричинені ВПГ, важко оцінити, оскільки більшість інфекцій починається на субклінічному рівні. Унікальне проспективне дослідження шведських дівчаток, що тривало протягом 15 років, продемонструвало показники зараження вірусом ВПГ-1 у 2,9; 3,5, і 1,5 % на рік відповідно для груп 14–19 років, 19–23 років і 24–30 років [18]. Показники зараження вірусом ВПГ-2 становили 0,5; 2,4 і 2,3 % на рік у тих самих вікових групах. У венерологічній клініці в Сіетлі показник зараження вірусом ВПГ-2 серед жінок становив 3 % на рік наприкінці 1980-х років [Anna Wald, неопубліковане спостереження].
Б. Кореляції зараження вірусом ВПГ-2
Поширеність зараження вірусом ВПГ-2 зростає прямо пропорційно залежно від віку, рівня бідності й нижчого рівня освіти. Згідно з даними усіх досліджень, поширеність цієї інфекції приблизно у 1,5 раза вища серед жінок, аніж серед чоловіків. Причини цієї тендерної невідповідності, ймовірно, криються в анатомії (відмінностях генітального епітелію у чоловіків і жінок) і поведінці (молодші жінки, найімовірніше, матимуть секс зі старшими чоловіками, що, таким чином, збільшує ймовірність наявності вірусу).
У Сполучених Штатах серед афроамериканців інфекція ВПГ-2 більше поширена, ніж серед білих [7]. Показники інфекції ВПГ-2 залишаються високими серед афроамериканців навіть після коригування щодо сексуальної поведінки і, ймовірно, відбивають високу основну поширеність інфекції ВПГ-2 серед сексуальних партнерів в афроамериканській спільноті. Іншими поведінковими чинниками ризику, пов’язаними з позитивними серологічними реакціями на ВПГ-2, є кількість статевих партнерів упродовж життя і молодий вік на початку сексуального життя. У дослідженні NHANES вживання кокаїну також корелює з рівнем позитивних серологічних реакцій на ВПГ-2.
Оскільки ризик інфекції ВПГ-2 добре корелює з кількістю статевих партнерів упродовж життя, виявлення антитіл до ВПГ-2 запропоновано як серологічний маркер сексуальної активності в різних популяціях [14]. Ця кореляція може бути точною для деяких популяцій, але може бути неточною в осередках з дуже високими та дуже низькими показниками поширеності ВПГ-2. Наприклад, ризик розвитку інфекції ВПГ-2 вирівнюється в афроамериканських жінок, які повідомляють про двох чи більше сексуальних партнерів упродовж життя, тоді як ризик різко зростає серед білих жінок (див. рис. 1). В іншій крайності показники позитивних серологічних реакцій настільки низькі (3 %) серед молоді Нової Зеландії віком 21 рік, що не виявлено зв’язків між сексуальною активністю і ризиком зараження ВПГ-2 [19]. Крім того, характеристики сексуальних партнерів можуть бути важливим чинником ризику зараження ВПГ-2. Вибір сексуальних партнерів відносно стану серологічних реакцій на ВПГ-2 активно не досліджувався. Одне дослідження засвідчило, що особи з позитивними серологічними реакціями на ВПГ-2 частіше повідомляють про пошук сексуальних партнерів, які належать до демографічної групи з вищим ризиком розвитку хвороб, що передаються статевим шляхом, ніж особи з негативними серологічними реакціями на ВПГ-2 [20].
В. Передача ВПГ-2
Як і при всіх хворобах, що передаються статевим шляхом, сексуальний контакт з людиною, яка має генітальний герпес, не обов’язково закінчується передачею ВПГ-2. Стать і попередня інфекція ВПГ-1, на наш погляд, змінюють ризик розвитку інфекції ВПГ-2. Серонегативні жінки мають найбільший ризик зараження ВПГ-2 [21, 22]. Серед інших чинників, що можуть впливати на передачу ВПГ-2, — частота рецидивів у потенційного партнера-джерела, статевий контакт за наявності явних ушкоджень, використання бар’єрних контрацептивів і постійне вживання антивірусних засобів партнером з герпесом. Приблизно у 25 % пар, які вважають, що в них різний статус щодо генітального герпесу, серологічні аналізи показують, що обоє мають інфекцію ВПГ-2. Це свідчить про те, що інфекцію передано несвідомо або, можливо, отримано від попередніх партнерів [23]. У пар з різним статусом щодо антитіл до ВПГ-2 середній показник зараження становить приблизно 12 % на рік [21]. Однак ефективність передачі, на наш погляд, широко коливається, оскільки деякі люди дістають ВПГ-2 після єдиного статевого акту, тоді як інші пари не передають вірус, незважаючи на роки незахищеного статевого контакту [24]. Ця варіабельність показників передачі вивчена недостатньо.
Г. ВПГ-2 як чинник ризику зараження ВІЛ і передачі ВІЛ-інфекції
Вірус простого герпесу — найзагальніша причина генітальних виразок у всьому світі: це добре задокументовано в розвинених країнах і спостерігається в країнах, що розвиваються [17, 25, 26]. Наявність цих генітальних виразок є потенційним чинником ризику зараження ВІЛ починаючи з початку епідемії ВІЛ [27, 28]. Численні епідеміологічні дослідження підтверджують зв’язок генітальних виразок узагалі й генітального герпесу зокрема з ВІЛ-інфекцією [16, 29–31]. Наприклад, проспективне когортне дослідження [31], в якому вивчалося питання щодо ризику зараження ВІЛ серед чоловіків з генітальними виразками та без них, показало, що в першому випадку втричі більший ризик сероконверсії щодо ВІЛ. Крім того, як звичайні [16, 27, 28, 30, 32], так і «гніздові» дослідження з дизайном «випадок — контроль» [33, 34] показали, що ВПГ-2-інфекція корелює із зараженням ВІЛ. Масштаби оцінок відносного ризику ВІЛ-інфекції коливаються від 1,2 до 8,5 [35]. Виявлено підвищений ризик при передачі від чоловіка до чоловіка, від чоловіка до жінки і від жінки до чоловіка.
Припускають існування двох біологічних механізмів, які відповідають за те, як наявність генітального герпесу може бути чинником ризику розвитку ВІЛ-інфекції. По-перше, зараження ВІЛ полегшується ушкодженням слизової оболонки, що супроводжує генітальний герпес. По-друге, оскільки герпетичні утворення пов’язані зі зростанням кількості лімфоцитів, які несуть CD4 (через локальну запальну реакцію), у генітальних шляхах осіб з генітальним герпесом присутня більша кількість клітин-мішеней для приєднання і проникнення ВІЛ [36, 37]. І ушкодження слизової оболонки, і наявність збільшеної кількості активованих СD4-клітин свідчать про те, що особи з генітальним герпесом мають більший ризик зараження ВІЛ.
Оцінка ВПГ-2 як чинника ризику передачі ВІЛ (на відміну від зараження ВІЛ) навіть менш вивчена, оскільки люди, які передають ВІЛ-інфекцію, не досліджуються настільки активно, як ті особи, які заражаються ВІЛ-інфекцією. В одному повідомленні про ефективну передачу ВІЛ описано чоловіка з історією генітального герпесу, який передавав ВІЛ своїм численним сексуальним партнерам [38]. Інше дослідження (вивчення сімейних пар) засвідчило відносний ризик у 1,9 для зараження ВІЛ у жінок, чиї чоловіки мали генітальний герпес [29]. Цей результат підтверджує те, що така ефективність передачі ВІЛ серед людей з ВПГ-2-інфекцією відбувається шляхом переміщення активованих лімфоцитів до генітальних ушкоджень, спричинених герпесом. Серед людей з ВІЛ-інфекцією внаслідок цього переміщення можливе прискорення локальної реплікації ВІЛ на поверхнях слизової оболонки. Це припущення підтверджується фактом, що ВІЛ було висіяно з генітальних виразок (згідно з результатами досліджень, проведених в Африці) [40], а виявлення ВІЛ-віріонів підтверджують понад 95 % випадків генітального герпесу у ВІЛ-інфікованих чоловіків [41]. Оскільки в багатьох ВІЛ-інфікованих осіб часто знову активізується вірус простого герпесу [42], прискорення локальної реплікації ВІЛ у вогнищах генітальних ушкоджень може пояснити те, як генітальні виразки полегшують передачу ВІЛ.
Ґ. Генітальна інфекція ВПГ-1
Дослідження осіб, в яких інфекція ВПГ-1 або ВПГ-2 одночасно уразила слизові оболонки ротової порожнини і генітальної сфери, показали, що серйозність повторної інфекції залежить від взаємодії типу вірусу з місцем анатомічної локалізації інфекції. Так, показники рецидиву вищі для генітальної інфекції ВПГ-2, ніж для ротової інфекції ВПГ-1 і генітальної інфекції ВПГ-1, і найнижчі для ротової інфекції ВПГ-2 [43]. Незважаючи на те що ВПГ-1 є нечастою причиною повторного генітального герпесу, він стає дедалі поширенішою причиною першого епізоду цієї хвороби. У Великобританії ВПГ-1 частіше за ВПГ-2 виявляють в осіб з первинним зараженням вірусом генітального герпесу [44–46]. Інші географічні зони з високою пропорцією генітального ВПГ-1, звідки отримано дані, включають Сінгапур і Японію [47, 48]. У Сіетлі ВПГ-1 спричинює приблизно 30 % первинних випадків генітального герпесу [49].
Причина почастішання випадків ВПГ-1 як чинника первинного генітального герпесу не цілком зрозуміла. Одне пояснення, на яке часто посилаються, полягає в поширеній практиці орально-генітального сексу. Наприклад, одне з досліджень з дизайном «випадок-контроль» ідентифікувало оральний секс як чинник ризику інфікування вірусом генітального герпесу, найчастіше ВПГ-1 [50]. Інше пояснення дедалі більшої частоти ВПГ-1 як причини первинного генітального герпесу — зменшення показників зараження ВПГ-1 у дитинстві. Як наслідок, дедалі більше молоді досягає дорослого віку серонегативними, і їхнє перше зіткнення з ВПГ-1 може відбутися під час орального сексу.
Клінічна епідеміологія
А. Спектр хвороб серед осіб, серопозитивних щодо ВПГ-2
Серед осіб, серопозитивних шодо ВПГ-2, лише у незначної кількості діагностовано генітальний герпес. Наприклад, в дослідженні NHANES лише 9,1 % жінок і 9,2 % чоловіків з антитілом ВПГ-2 повідомили про випадки генітального герпесу в анамнезі [7]. Однак 12,2 % білих знали, що вони мали інфекцію (порівняно з 3,7 % афроамериканців). Оскільки немає жодних свідчень того, що клінічний прояв ВПГ-2 залежить від раси чи етнічного походження, доступ до системи охорони здоров’я, імовірно, відіграє роль у розпізнаванні інфекції [8]. З іншого боку, показники повторної інфекції ВПГ-1 вищі серед афроамериканців, і попередня ВПГ-1-інфекція може утруднити клінічну діагностику ураження вірусом ВПГ-2 [52]. Біологічні особливості ВПГ-2 в осіб, які не усвідомлюють наявності інфекції, не цілком визначені. Однак епідеміологічні дослідження показують, що особи без клінічних проявів генітального герпесу в анамнезі представляють головне джерело зараження, а попередні дані свідчать про те, що вірус активізується фактично в усіх інфікованих осіб [24, 53, 54].
Багато людей з генітальним герпесом мають неприємні повторні генітальні виразкові утворення протягом тривалого періоду після зараження. Як правило, рецидиви пов’язані з помірним фізичним дискомфортом; однак деякі пацієнти відчувають серйозні або часті рецидиви, що явно шкодять здоров’ю. На додаток до фізичного дискомфорту повторної хвороби генітальний герпес спричиняє значну психосоціальну дисфункцію [55, 56]. Кілька досліджень засвідчили, що генітальний герпес пов’язаний з депресією, ізоляцією та відчуттям соціальної стигми. У багатьох пацієнтів ці відчуття посилюються під час рецидивів. Порівняння пацієнтів із генітальним герпесом і пацієнтів із гонореєю або дерматологічними захворюваннями показує, що психосоціальна дисфункція більше виражена в осіб із генітальним герпесом [57]. Для більшості пацієнтів із генітальним герпесом найбільше занепокоєння викликає острах передачі інфекції своїм сексуальним партнерам. Нові відносини часто тяжкі, оскільки люди з герпесом мають розповісти про інфекцію іншим і бояться відмови [58].
Б. Клінічні прояви
Клінічні та вірусологічні особливості генітальної інфекції, спричиненої вірусом простого герпесу, перебувають під впливом імунного статусу носія. Первинна генітальна герпетична інфекція, визначена як інфекція, що спостерігається в осіб, серонегативних як до ВПГ-1, так і до ВПГ-2, є найсерйознішою інфекцією [52, 59]. Ці первинні інфекції пов’язані з тривалими клінічними ознаками і передачею вірусу (2–3 тижні). Непервинна початкова інфекція, визначена як інфекція не-ВПГ-типу в особи з існуючими раніше антитілами до гетерогенного вірусу, має тенденцію бути менш серйозною. Рецидивуючий генітальний герпес, спричинений реактивацією вірусу з латентного стану, пов’язаний з найкоротшими термінами ушкоджень і передачі вірусу (2–8 днів).
Хоча імунний статус особи впливає на клінічні прояви генітальних герпетичних уражень, спостерігається значний збіг між клінічною серйозністю первинних, непервинних і рецидивуючих інфекцій. Через цей збіг у клінічних ознаках вірусологічна та серологічна лабораторна оцінка потрібна для того, щоб встановити діагноз кожному окремому пацієнту. Наприклад, близько 25 % пацієнтів з першим клінічним епізодом генітального герпесу вже мають антитіла до типу вірусу, висіяного з генітальної області, що вказує таким чином на попередню інфекцію. Ці перші клінічні епізоди являють собою перший визнаний рецидив попередньої інфекції, спричиненої вірусом генітального герпесу.
Первинний і непервинний початковий генітальний герпес часто супроводжується системними симптомами на додаток до генітальних виразкових ушкоджень. Неврологічні ускладнення, гарячка, недуга, міалгії, головний біль досить поширені, особливо серед жінок. На ранніх стадіях хвороби можлива дизурія, а у 25 % жінок було виявлено випадки асептичного менінгіту, що потребував госпіталізації [60]. Генітальні ознаки часто розпочинаються з неспецифічного свербіння і поколювання в області вульви, але швидко розвиваються до уражень тканин. Початкові ушкодження при первинному генітальному герпесі везикулярні, хоча пухирці в жінок можуть швидко розриватися і залишатися непоміченими. Наслідками ушкоджень є множинні, двосторонні, поверхневі виразки з еритематозною основою. Ці ранки можуть зливатися, формуючи великі виразкові утворення на вульві. Шийка матки також уражається у 80 % випадків первинного герпесу, й іноді вона може визнаватися клінічно єдиним місцем локалізації інфекції. Герпесний цервіцит може бути тяжким з великими зонами некрозу ектоцервікального епітелію. У таких жінок може бути вагінальна кровотеча або виділення як єдина причина скарги. У пацієнтів, які не отримують антивірусної терапії, нова маса пухирців може знову з’явитися через тиждень-два. Виразки заживають повністю через два-три тижні і звичайно не пов’язані з рубцюванням.
Хвороба має схожий клінічний перебіг і у чоловіків. Хоча ушкодження у чоловіків мають тенденцію бути більш численними, аніж у жінок, загалом вони пов’язані з меншою болючістю [61]. Везикулярні ушкодження звичайно зберігаються довше, іноді підсихають, утворюючи струпи без виразкової стадії. Системні та неврологічні прояви спостерігаються рідше, за винятком чоловіків-гомосексуалістів, в яких може виникати герпесний проктит [62]. Цей синдром часто пов’язується з порушенням функції вегетативної нервової системи, і в пацієнтів можуть виникати затримка сечі, запор і сексуальна дисфункція. Симптоми з боку автономної нервової системи майже завжди тимчасові, і вони мають тенденцію не повторюватися протягом наступних епізодів повторної активізації інфекції.
Перебіг рецидивів генітального герпесу подібний до перебігу перших і повторних епізодів хвороби, однак помірніші й коротші у представників обох статей [59]. Для багатьох людей рецидив починається з комплексу попередніх ознак (який називається продромом), що передують розвиткові генітальних ушкоджень [63]. Продромальні ознаки звичайно включають свербіння та поколювання в генітальній області та віддалену від місця локалізації ушкоджень невралгію (тобто в ділянці сідниці або стегна). Ці продромальні ознаки часто турбують більше, аніж дискомфорт, спричинений ушкодженнями. Середня тривалість повторного епізоду — від чотирьох до семи днів, хоча термін епізоду в різних пацієнтів широко коливається, так само як і в одного пацієнта від одного епізоду до іншого. Повторні епізоди часто проявляються розвитком лише кількох ушкоджень у чітко визначеній зоні. Нові ушкодження утворюються рідше, ніж при першому епізоді. Хоча локальний біль у статевих органах є звичайним у жінок протягом рецидивів, системні розлади та неврологічні ускладнення нечасті. У деяких пацієнтів рецидиви можливі у вигляді ушкоджень поза генітальною областю (найчастіше на сідницях і ногах) [64].
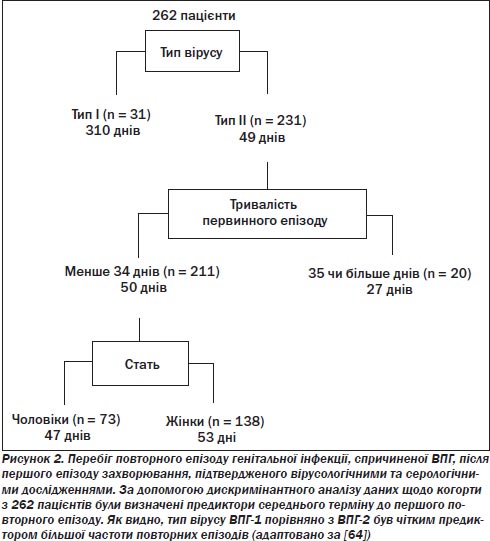
Перебіг генітального герпесу в осіб з серологічно підтвердженим першим випадком цієї хвороби добре вивчений. Майже всі пацієнти (89 %) з тільки-но набутою генітальною інфекцією ВПГ-2 мають принаймні один випадок повторення в перший рік захворювання [65]. Тридцять вісім відсотків мають шість і більше рецидивів і 20 % — понад 10 рецидивів у рік початку. Особи, в яких спостерігається тривалий перший епізод (понад 35 днів), мають коротший середній термін до першого рецидиву, аніж ті, хто має коротший перший епізод (27 проти 50 днів) (рис. 2).
Дивно, але чоловіки, імовірно, мають коротший період до першого рецидиву, аніж жінки (47 проти 53 днів). Отже, середня кількість рецидивів становить чотири епізоди в жінок і п’ять у чоловіків протягом першого року після інфікування ВПГ-2. Частота рецидивів повільно знижується з часом у більшості пацієнтів. Однак у частини пацієнтів спостерігається зростання частоти рецидивів, іноді впродовж певного періоду після первинної інфекції.
В. Нетиповий генітальний герпес
Вищеописані ознаки й симптоми, на наш погляд, торкаються лише меншості осіб, інфікованих ВПГ-2. Однак ретельні дослідження ВПГ-2-серопозитивних осіб показують, що в більшості наявні генітальні симптоми й ознаки, однак вони мають тенденцію бути помірними або нетиповими, а отже, залишаються нерозпізнаними. Наприклад, після індивідуалізованої навчальної сесії 50 % ВПГ-2-серопозитивних жінок, які не відчували раніше проявів генітального герпесу, визнали наявність у них типових рецидивів [66]. Слід зазначити: прояви рецидиву генітального герпесу були найчастішою скаргою щодо сечостатевої системи в цій групі жінок протягом наступних шести місяців спостереження. Невиявлена інфекція ВПГ-2 може бути причиною генітальних ушкоджень або виразкоподібних висипань, що нетипово проявилися або з’явилися в нетиповому місці [9]. Нетипові прояви включають тріщини, папули на статевих органах або поверхневі цервікальні виразкоподібні утворення. Ушкодження, що з’являються в періанальній області, часто приписують геморою або анальним тріщинам. У пацієнтів із генітальним герпесом досить часто діагностують рецидивуючу інфекцію дріжджевими грибками, або «жокейську сверблячку», інфекційні хвороби сечового шляху, екзему або контактний дерматит. Ці діагнози часто підтверджуються очевидною реакцією на терапію, що може видаватися ефективною, оскільки при генітальному герпесі загоєння відбувається природно. Наявність типоспецифічних серологічних методів дослідження полегшує діагноз ВПГ-2-інфекції в осіб з нетиповими проявами.
Г. Вірусне обсіменіння
Вірус простого герпесу можна висіяти з генітальної області протягом первинного зараження та рецидиву, так само як і періодично між клінічно визнаними епізодами. Протягом першого і повторного епізодів генітальної інфекції вірусне обсіменіння має тенденцію тривати коротший час, ніж ушкодження. При первинній інфекції вірус можна висіяти приблизно впродовж двох тижнів, а при повторних епізодах — упродовж двох-чотирьох днів. Дослідження показали, що вірус простого герпесу може бути наявний у генітальній області також у період між клінічно явними рецидивами. Вірусне обсіменіння за відсутності генітальних ушкоджень називається безсимптомним або субклінічним. З точки зору епідеміології субклінічне обсіменіння має значення в більшості випадків як при статевій, так і при перинатальній передачі вірусу простого герпесу і, ймовірно, є ключовим елементом у профілактиці генітального герпесу [24, 67–70]. Хоча секс під час рецидиву генітального герпесу може бути пов’язаний з більшим ризиком зараження, безсимптомна передача має велике значення в більшості випадків обсіменіння вірусом простого герпесу, тому що малоймовірно, що за відсутності ушкоджень здійснюватиметься безпечний секс.
Безсимптомне обсіменіння досліджувалося шляхом навчання пацієнтів щодня брати мазок з генітальних виділень [71]. Оскільки вірусне обсіменіння — нечастий випадок, дослідження, проведені впродовж короткого періоду, мають тенденцію недооцінювати кількість людей, в яких обсіменіння ВПГ відбувається безсимптомно, так само як і частоту обсіменіння. Безсимптомне обсіменіння є поширеним явищем у період, близький до зараження генітальним герпесом [68, 72]. У перші два роки ВПГ-2-інфекції вірус можна ізолювати з генітальної сфери у 10 % з усіх днів і у 6 % у дні без наявності ушкоджень (рис. 3) [73]. У подальшому частота обсіменіння скорочується, хоча й повільно. Загалом середня частота обсіменіння у субклінічний фазі в жінок становить приблизно 2,4 % дня [72]. Однак наявна значна розбіжність: у деяких жінок спостерігається нечасте обсіменіння, а в інших вірус може висіватися до 25 % днів.
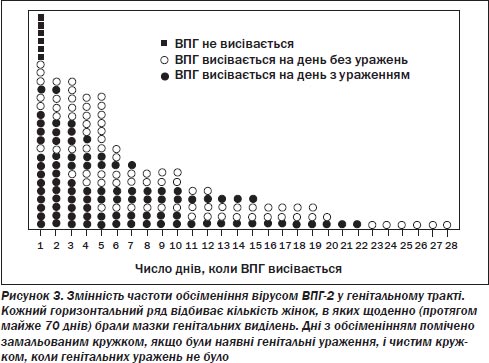
У жінок найпоширенішими місцями безсимптомного обсіменіння є періанальна область і вульва, а за нею шийка матки. Чоловіки також мають безсимптомне обсіменіння в генітальній сфері, переважно на шкірі статевого органу та в періанальній області [74]. І у чоловіків, і у жінок обсіменіння, найімовірніше, відбувається протягом тижня до або після клінічного рецидиву інфекції простого герпесу. Середня частота обсіменіння в субклінічній фазі — 2,4 % днів, але за тиждень до рецидиву показник висипання такий самий, як і в 10 % днів. Оскільки продром може пояснювати деякі випадки обсіменіння у цей період, ознаки, що його визначають, у багатьох пацієнтів неспецифічні й не можуть змусити їх утриматися від статевого контакту.
Ґ. Генітальна ВПГ-1-інфекція
Випадки генітальної інфекції, спричиненої вірусом ВПГ-1, почастішали в багатьох регіонах розвиненого світу, і в деяких місцях вони становлять 50 % випадків первинного генітального герпесу. Початкові прояви первинного герпесу не відрізняються при генітальній інфекції, спричиненій ВПГ-1 і ВПГ-2. Однак на відміну від генітальної ВПГ-2-інфекції генітальна ВПГ-1-інфекція рецидивує нечасто [43, 65], отже, визначення типу вірусу має прогностичне значення. Як видно з рис. 2, середній час до першого рецидиву після набуття генітальної інфекції ВПГ-1 — 310 днів. Крім того, ВПГ-1 рідко висівається у безсимптомній фазі. Отже, пацієнти з генітальною ВПГ-1-інфекцією можуть бути переконані, що перебіг захворювання, імовірно, буде помірний. Невідомо, як часто генітальна ВПГ-1-інфекція набувається при оральному сексі порівняно з генітальним контактом.
Неонатальний герпес
У вагітних жінок з генітальною інфекцією, спричиненою вірусом герпесу, можливість передачі інфекції новонародженим викликає найбільше занепокоєння. Інфікування новонароджених вірусом простого герпесу — нечаста, але дуже серйозна хвороба. Захворюваність новонароджених на герпес коливається залежно від регіону, і тихоокеанські північно-західні та скандинавські країни, на наш погляд, мають найвищі показники у світі. У Медичному центрі університету штату Вашингтон неонатальний герпес спостерігається приблизно в одному випадку на 2200 народжень. Не дивно, що захворюваність на герпес новонароджених нижча на європейському континенті (тобто один випадок на 35 000 народжень у Нідерландах), оскільки поширеність ВПГ-2 також нижча [75]. Цікаво, що рівень захворюваності на неонатальний герпес також нижчий у групах населення, в яких ВПГ-2-інфекція дуже поширена. Такий низький рівень захворюваності може пояснюватися тим, що в цих групах населення інфікування вірусом герпесу відбувається в молодому віці, одразу після початку статевої активності, а тому діагноз встановлено на час настання вагітності. Найчастіше новонароджені інфікуються під час народження через контакт з інфікованими генітальними виділеннями матері. Приблизно 15 % інфекцій набуто після народження, часто через потрапляння ВПГ-1 оральним шляхом від близьких членів родини [76]. Незважаючи на наявність противірусної терапії, випадки неонатального герпесу дають високі показники смертності, а в більшості тих, хто виживає, погіршується фізичний та розумовий розвиток [53].
Дослідження пояснюють чинники ризику передачі ВПГ під час народження і пропонують можливість запобігання. По-перше, більшість епізодів неонатальної передачі відбуваються в жінок без клінічних проявів генітального герпесу в анамнезі. По-друге, деякі дослідники виявили, що інфікування ВПГ під час останніх місяців вагітності пов’язане з високим ризиком неонатальної передачі. У когорті 15 923 жінок, яких вивчали під час розродження, вірус простого герпесу було висіяно в 56, а позитивні серологічні проби були наявні у 52 [77]. Із 34 жінок з вірусом простого герпесу, які раніше мали антитіла до того самого типу вірусу, одна передала інфекцію своїй дитині. Навпаки, з 18 жінок з вірусом, які не мали антитіл до того самого типу вірусу, шість передали інфекцію новонародженим. Отже, рецидиви генітального інфікування вірусом простого герпесу пов’язані з незначним ризиком появи герпесу в новонароджених, навіть якщо вірусне обсіменіння відбувається під час розродження [78]. Навпаки, генітальне зараження вірусом простого герпесу незадовго до пологів пов’язане з надзвичайно високим ризиком (30–50 %) неонатального герпесу. Нарешті, ризик передачі також зростає в разі використання скальпових електродів для дослідження плоду, оскільки пункція шкіри полегшує проникнення вірусу простого герпесу [77]. Ці результати свідчать про те, що з метою уникнути неонатального герпесу необхідно запобігти генітальному зараженню вірусом простого герпесу в останній період вагітності, а також уникати непотрібного використання інвазивних методів обстеження під час народження.
Цікаво, що набуття генітального герпесу на ранніх етапах вагітності, імовірно, не збільшує ризику герпесу новонароджених. У процесі вивчення 7046 жінок з ризиком зараження ВПГ-2 показник сероконверсії ВПГ-2, відкоригований щодо терміну вагітності, становив 3,7 % для ВПГ-1-серонегативних жінок і 1,7 % для ВПГ-1-серопозитивних жінок [79]. У жінок, які поміняли серотип протягом вагітності, не спостерігалося несприятливих результатів під час вагітності, і жодна з них не передала інфекцію своїй дитині. Отже, пасивно набуте антитіло, імовірно, захищає дитину від зараження вірусом герпесу.
Сучасні інструкції в Сполучених Штатах рекомендують застосовувати під час розродження кесаревий розтин (черевне розродження), якщо пологи супроводжувалися ушкодженням у генітальній області [80]. На жаль, захворюваність на генітальний герпес зростає в жінок, яким зроблено кесаревий розтин, щоб запобігти передачі вірусу простого герпесу новонародженому. Фактично аналіз результатів показав, що кесаревий розтин для жінок з поточним генітальним герпесом на момент пологів має наслідком материнську захворюваність, смертність і потенційні витрати, що, імовірно, перевищує вигоду для новонародженого [81]. Отримано небагато даних, які показують, що ця практика дає змогу зменшити показник зараження новонароджених вірусом простого герпесу. У деяких країнах від практики кесаревого розтину в разі рецидиву генітального герпесу на момент пологів відмовилися, хоча й не спостерігалося очевидного збільшення неонатального зараження вірусом герпесу [75]. Крім того, при кесаревому розтині при генітальних ушкодженнях також ігнорується потенційний ризик передачі вірусу від вогнищ безсимптомного обсіменіння під час пологів. Отже, треба дослідити інші методи запобігання неонатальній передачі вірусу простого герпесу.
Використання антивірусних засобів типу ацикловіру (acyclovir) у період вагітності досліджувалося як метод запобігання неонатальній передачі вірусу простого герпесу. У трьох роботах, включаючи два невеликих рандомізованих клінічних дослідження, вивчалася ефективність використання ацикловіру незадовго до пологів, щоб запобігти рецидивам під час пологів [82, 83]. Дані неостаточні, а тому необхідні подальші дослідження, щоб визначити доцільність, так само як і безпеку противірусної терапії в акушерській практиці. Хоча ацикловір безпечний для вагітних [85, 86], залишається занепокоєння щодо можливої токсичності противірусних засобів для цієї категорії жінок. Документація щодо контролю результатів вагітності, у період якої жінки приймали ацикловір, не засвідчила зростання частоти випадків патології у плода (порівняно з фоновим показником), не спостерігалося жодних стабільних форм патології, що повторюються [86]. І хоча ці дані заспокоюють, усе ж кількість жінок занадто мала, щоб остаточно переконатися в безпеці прийому ацикловіру в перший триместр вагітності. До кінця вагітності ацикловір міг потенційно викликати токсичне ураження нирок плода, і деякі експерти не вважають, що отримано відповідні дані щодо безпеки, щоб рекомендувати широке використання цього препарату.
Діагноз
Оскільки більшість інфікованих не мають типових ознак і симптомів інфекцій герпесу і не усвідомлюють своєї інфікованості, клінічний діагноз генітального герпесу не відповідає ситуації. Однак в осіб з характерними генітальними виразковими утвореннями, мешканців тих частин світу, де інші причини генітальної виразки — а саме шанкроїд і сифіліс — встановлюються нечасто, клінічний діагноз звичайно надійний. Навіть якщо інші причини генітальних виразок малопоширені, дуже корисно отримати культуру вірусу. По-перше, рекомендувати лікування пацієнту, який тільки-но набув хронічну хворобу, яка передається статевим шляхом, легше, якщо є лабораторне підтвердження діагнозу. По-друге, як описано вище, визначення типу вірусу простого герпесу має прогностичне значення. На жаль, навіть якщо в індивіда первинний епізод генітального герпесу, вірус простого герпесу виявляють лише приблизно у 80 % проб [87]. Невдача в отриманні культури ВПГ може бути пов’язана з неякісним збиранням проб і зі зволікання зі збиранням і обробкою проби. Показник отримання культури вірусу простого герпесу навіть нижчий при рецидивах, коли лише приблизно у 50 % епізодів виявляють вірус. Щоб оптимізувати отримання культури вірусу, пацієнта треба оглянути одразу на початку епізоду, коли ушкодження, імовірно, будуть везикулярними або виразковими, оскільки реплікація вірусу найвища саме в цей час.
На додаток до вирощування культури вірусу існує кілька тестів з антигенами, які за чутливістю можна порівняти з культурою вірусу, але більшість із них не ідентифікують тип вірусу [88]. У кількох дослідженнях також оцінювалась полімеразна ланцюгова реакція (PCR) ДНК вірусу простого герпесу для діагностики вірусної інфекції [26, 89, 90]. Не дивно, що PCR-тест чутливіший за культуру вірусу при виявленні ВПГ в генітальних ушкодженнях. Однак цей тест недоступний для використання в практиці, а роль PCR у діагнозі генітальної виразкової хвороби не визначено.
Серологічні дослідження є основним методом діагностики інших хронічних вірусних інфекцій, таких як ВІЛ, цитомегаловірус і гепатит В. Серологічні дослідження можуть також використовуватися для діагностування інфекції, спричиненої вірусом простого герпесу, оскільки інфіковані особи виробляють антитіла, які, як встановлено, залишаються на все життя носія. Перехресна реактивність між ВПГ-1 і ВПГ-2 робить типоспецифічні серологічні аналізи при цій інфекції складними за виконанням. Сучасні аналізи чітко не розрізняють інфекцій ВПГ-1 і ВПГ-2, незважаючи на заяви виробників цих тестів про протилежне [91]. Це насправді так, особливо при діагностуванні ВПГ-2-інфекції в осіб з попередньою ВПГ-1-інфекцією.
На відміну від сучасного покоління аналізів, тест «західної плями» може надійно розрізнити ВПГ-1- і ВПГ-2-інфекції і є золотим стандартом у визначенні серологічного типу вірусу простого герпесу [92]. Однак він дорогий, трудомісткий і потребує розшифровки висококваліфікованим персоналом, а отже, непристосований до широкого практичного використання. Розроблено новітні типоспецифічні серологічні аналізи, імовірно, вони стануть доступними для широкої практики в 1999 році [93, 94]. Більшість із цих аналізів спираються на антигенні відмінності в глікопротеїні G у ВПГ-1 і ВПГ-2 і за точністю наближаються до «західної плями», що засвідчили результати порівняльних досліджень. Ці типоспецифічні аналізи можуть бути корисними в клініках з лікування ХПСШ для діагностики нетипових генітальних уражень і визначення інфекції в партнерів пацієнтів з генітальним герпесом. Ці аналізи можуть також використовуватися як інструмент перевірки, щоб ідентифікувати інфікованих ВПГ-2, які не усвідомлюють своєї хвороби, або жінок з ризиком зараження вірусом простого герпесу протягом вагітності, особливо ВПГ-серонегативних жінок, які мають ВПГ-2-серопозитивних партнерів.
Лікування
Хоча немає жодного засобу для лікування інфекцій ВПГ, ефективна противірусна терапія доступна, щоб пом’якшити ознаки генітального герпесу. На жаль, сучасне лікування не знищує латентну вірусну інфекцію, і лікування епізодів активної симптоматики не впливає на характер наступної активізації вірусу [97]. Оскільки терапія є дорогою й неефективною, вона використовується недостатньо.
Ацикловір, єдиний широко використовуваний противірусний засіб, застосовується в лікуванні генітального герпесу починаючи з 1980-х років; він існує у вигляді оральних таблеток, внутрішньовенних ін’єкцій та у формі ліків для місцевого використання [98]. Це аналог нуклеозиду, який для активізації потребує фосфорилювання вірусною тимідін-кіназою. Отже, ацикловір є активним лише в уражених вірусом клітинах; ця особливість, імовірно, пояснює незвичайно безпечний профіль цього препарату.
Ацикловір зменшує вірусне обсіменіння, тривалість ушкоджень і пом’якшує симптоми, якщо він використовується під час першого епізоду генітального герпесу [99]. У великих клінічних дослідженнях перевірено, що цей препарат попереджує розвиток неврологічних ускладнень, пов’язаних з первинним генітальним герпесом. Однак якщо ацикловір застосовують для лікування повторного генітального герпесу, він зменшує вірусне обсіменіння і скорочує тривалість ушкоджень на один-два дні. Отже, перевага епізодичної терапії є незначною для індивідів з рецидивуючими ушкодженнями.
Більш ефективним способом лікування рецидивуючої генітальної інфекції вірусом простого герпесу є пригнічувальна терапія, описана як постійна щоденна доза ацикловіру. При щоденному прийомі ацикловір попереджує 70 % рецидивів [100, 101], і багато хто з індивідів не мають жодних рецидивів генітального герпесу. Якщо рецидив відбувається, коли індивід приймає ацикловір, епізод зазвичай помірний і короткотривалий.
Незважаючи на потенційні переваги пригнічувальної терапії ацикловіром, його краще призначати лише пацієнтам з частими рецидивами. По-перше, для проведення пригнічувальної терапії потрібна згода пацієнта, і коштує ця процедура дорого. По-друге, клінічні дослідження показали перевагу пригнічувальної терапії лише у пацієнтів принаймні з шістьма рецидивами на рік. Однак терапія також, імовірно, є ефективною і для пацієнтів з меншою кількістю рецидивів на рік. Незалежно від кількості рецидивів на рік деякі пацієнти часто переживають психологічний стрес протягом рецидивів, отже вони є підхожими кандидатами для пригнічувальної терапії. Наприклад, одне дослідження засвідчило покращання соціально-психологічного функціонування пацієнтів, які приймають ацикловір щодня [102]. Проте багато клініцистів не пропонують пригнічувальної терапії пацієнтам, в яких відбувається менше шести рецидивів на рік.
Резистентність до препарату і питання безпеки наводяться як потенційні перешкоди для більш частого проведення пригнічувальної терапії. Однак в імунокомпетентних пацієнтів постійний прийом ацикловіру не спричинює появи резистентних до ацикловіру штамів вірусу герпесу [103]. Резистентність до ацикловіру описано в осіб із тяжким пригніченням імунітету, пов’язаним з ВІЛ-інфекцію, зі злоякісними утвореннями, з хіміотерапією або трансплантацією кісткового мозку [108, 109]. Клінічні прояви зараження вірусом герпесу, резистентного до ацикловіру, трапляються нечасто, але він значно підвищує захворюваність на герпес. Безпека ацикловіру оцінювалася довготривалими (до десяти років) дослідженнями, і не було виявлено (клінічно або лабораторно) жодних аномалій, що були б пов’язані з його тривалим прийомом.
Щодо доз і режимів прийому противірусних препаратів, останнім часом рекомендованих до вжитку, читача відсилаємо до інструкцій з лікування хвороб, що передаються статевим шляхом, Центру контролю та профілактики хвороб, які доступні в друкованому вигляді, а також в електронній версії на сайті www.cdc.gov/rchstp/dstd [110].
Профілактика
Універсальна імунізація в дитинстві ефективною вакциною проти інфекції ВПГ-2, імовірно, є найефективнішою стратегією контролю генітального герпесу. Така стратегія довела ефективність щодо інших хронічних вірусних інфекцій, зокрема гепатиту В. На жаль, малоймовірно, що ефективна вакцина з’явиться протягом наступних кількох років. Вакцина проти генітального герпесу перебуває в центрі уваги протягом багатьох десятиліть, і було перевірено кілька експериментальних вакцин [111]. Обнадійливими є результати дослідження препарату, отриманого рекомбінацією глікопротеїнів D і В [112]. Цей препарат стимулює вироблення нейтралізуючих антитіл, які за кількістю дорівнюють або перевищують ті, що спостерігаються при природній інфекції. Однак результати клінічних досліджень щодо ефективності невтішні, оскільки вакцина не змогла захистити від ВПГ-2-інфекції сприйнятливих дорослих [113].
Також досліджуються на ефективність інші вакцини-кандидати: вакцина на основі глікопротеїну, інші варіанти, включаючи вакцини на основі ДНК вірусу простого герпесу і генетично послаблених вірусів [114–116]. Тим часом неефективність попередніх вакцин проливає світло на складності імунної реакції на вірус простого герпесу і на чинники захисту.
Як і з іншими хворобами, що передаються статевим шляхом, консультування з питань запобігання передачі інфекції сексуальним партнерам є суттєвою частиною профілактики генітального герпесу [110]. На жаль, не зовсім ясно, які рекомендації треба давати. Нині заохочується використання презервативів з метою запобігання передачі генітального герпесу, незважаючи на мінімальні дані щодо їхньої ефективності в запобіганні передачі ВПГ. З огляду на широку (анатомічно) зону реактивізації цього вірусу в генітальному тракті презервативи, ймовірно, менше захищають від ВПГ, аніж від статевих хвороб, які характеризуються виділеннями. Хоча доцільно рекомендувати презервативи для сексуально активних дорослих з огляду на те, що вони захищають від інших хвороб, що передаються статевим шляхом, і ВІЛ, ступінь згоди щодо використання презервативів низький, зокрема у стабільних моногамних пар. У нашому дослідженні 107 пар, у кожній з яких тільки один партнер мав ВПГ-2-інфекцію, лише чотири з них використовували презервативи з метою запобігти передачі вірусу простого герпесу, а для інших 15 це був єдиний засіб обмежити народжуваність. Інші засоби, які закривають велику частину слизової оболонки статевих органів, наприклад бактерицидні засоби й жіночі презервативи, можуть забезпечувати кращий захист, аніж чоловічі презервативи; але бракує даних шодо демонстрації їхньої ефективності в запобіганні інфекції ВПГ-2.
У нашій клініці рекомендації щодо хвороб, які передаються статевим шляхом, розроблюються відповідно до індивідуальних потреб пацієнтів. Особам з новими сексуальними партнерами рекомендують поінформувати їх про те, що в них виявлено генітальний герпес. Тоді кожна пара може прийняти рішення щодо того, як уникнути передачі. Пацієнтам також радять уникати статевих контактів під час рецидивів, оскільки в той час зростає ризик передачі.
У майбутньому пацієнтам з генітальним герпесом, яких непокоїть передача вірусу своєму партнерові, можна запропонувати пригнічувальну терапію. Дослідження, які показують, що противірусні ліки запобігають безсимптомному обсіменінню, свідчать про те, що вони можуть бути ефективними в зменшенні ризику передачі генітального герпесу статевим шляхом [73]. Триває дослідження, в якому оцінюється здатність валацикловіру (valaciclovir) перервати передачу інфекції статевим шляхом у моногамних пар, в яких тільки один партнер має ВПГ-2-інфекцію. У цьому дослідженні партнер з генітальним герпесом отримує щодня пригнічувальну терапію. Якщо клінічне дослідження продемонструє ефект противірусної терапії, це стане вибором для деяких пар, стурбованих передачею вірусу простого герпесу. Однак такий захід навряд чи матиме загальне визнання.
Виконання будь-якої програми запобігання, за винятком універсального щеплення, вимагає ідентифікації людей з ВПГ-2-інфекцією. Такого відбору найкраще досягти за допомогою типоспецифічних серологічних тестів. Однак неясно, чи змінить особа без клінічних симптомів, але з позитивною серологічною реакцією на ВПГ-2, свою сексуальну поведінку, щоб зменшити ймовірність передачі інфекції своїм партнерам. Знання серологічного статусу щодо ВІЛ сприяло позитивним змінам у поведінці високого ризику в деяких людей [117]. Останнім часом існує перевага ранньої ідентифікації ВІЛ-інфекції, тоді як така процедура не була доступною до середини 1980-х років, коли запровадили добровільну перевірку на ВІЛ. Останнім часом ситуація щодо виявлення вірусу простого герпесу така сама, оскільки інфекцію можна ідентифікувати за відсутності клінічних симптомів, однак ефективність втручань треба довести і зробити їх доступними. Отже, до традиційного «скринінгу» ВПГ-2-інфекція не входить. Однак знання про наявність інфекції, ймовірно, сприяє певним поведінковим змінам.
Широке застосування серологічних тестів може викликати заперечення в лікарів, оскільки потрібно чимало часу для консультування людей із безсимптомною ВПГ-2-інфекцією. Отже, необхідно впроваджувати тест, подібний до тесту на ВІЛ, організовувати відповідне консультування й розширювати можливості для проведення аналізу на ВПГ-2. Існує певне занепокоєння щодо психологічного впливу на індивіда несподіваного повідомлення про позитивний результат аналізу на ВПГ-2-інфекцію, оскільки з’ясування того, що особа має інфекцію ВПГ-2 після передачі її партнерові, також є сильною психотравмою. Нині у клініках з лікування ХПСШ пацієнтів намагаються запевнити в тому, що в них не виявлено інфекції, якщо виключено бактеріальні синдроми. Однак ВПГ-2-інфекція, ймовірно, у цих закладах є однією з найпоширеніших хвороб, що передаються статевим шляхом, і перевірка на неї усе ще не пропонується. Потреби пацієнтів, імовірно, зумовлять ширше використання серологічних тестів, коли вони стануть доступними.
Серологічні тести також відіграватимуть роль у веденні вагітних жінок. У регіонах, де показник бактеріальних хвороб, що передаються статевим шляхом, знизився, неонатальне зараження вірусом простого герпесу стало найпоширенішою причиною захворюваності й смертності серед новонароджених. Виявлення жінок групи ризику проведенням серологічних тестів і консультування — єдиний спосіб зменшити негативні наслідки, пов’язані з інфікуванням новонароджених вірусом простого герпесу. Жінок з позитивними серологічними тестами на ВПГ-2 треба переконати, що ризик передачі інфекції від неї новонародженому мінімальний, і вони можуть отримувати пригнічувальну терапію майже до кінця вагітності. Жінок із ризиком зараження вірусом генітального герпесу в період вагітності зараз можна виявляти і необхідно рекомендувати їм уникати сексуальних контактів наприкінці вагітності (генітально-генітальний і орально-генітальний контакт). Якщо противірусна терапія є ефективною щодо зменшення передачі вірусу генітального герпесу, то це дає потенційну альтернативну стратегію в запобіганні передачі ВПГ-2 у період вагітності.
Інформаційні ресурси для осіб із генітальним герпесом
Наявні численні інформаційні ресурси, що забезпечують підтримку людей із генітальним герпесом за принципом «рівний — рівному». Оскільки патогенез хвороби складний і індивідуальний перебіг занадто змінний, багато хто з пацієнтів вважає, що спеціалісти, які надають їм послуги, нездатні забезпечити їх сучасною інформацією щодо перебігу інфекції й можливостей лікування. За спонсорства Американської асоціації суспільного здоров’я (ASHA) 1979 року було організовано Центр допомоги хворим на герпес. Центр видає щоквартальний інформаційний бюлетень The helper, в якому друкуються новини в галузі дослідження методів лікування герпесу й обговорюється багато загальних питань. ASHA контролює діяльність локальних груп підтримки людей з герпесом. Видано кілька популярних книг, що пояснюють природу генітального герпесу. Серед таких книг Managing Herpes C. Ebel і The Truth About Herpes S. Sacks [118, 119]. В Інтернеті є кілька сайтів, присвячених лікуванню генітального герпесу, що надають медичну інформацію і можливість для обміну досвідом. Адреси сайтів: www.cafeherpes.com, www.viridae. com, www.advicecenter.com і www.ashastd.org.
Швидке розширення вищезгаданих ресурсів підтверджують результати досліджень, які засвідчують, що пацієнти з герпесом часто незадоволені медичним обслуговуванням [55]. Так, для багатьох пацієнтів зараження герпесом — досвід, що змінює життя, більшість же лікарів сприймають це як тривіальний розлад. Через таку відмінність у сприйнятті варто створювати альтернативні джерела інформації й підтримки людей з герпесом.
1. Hutfield D.С. History of herpes genitalis // Br. J. Verier. Dis. 1996, 42, 263.
2. Nahmias A.J., Dowdle W.R. Antigenic and biologic differences in Herpesvirus hominis // Prog. Med. Virol. 1968, 10, 110.
3. Nahmias A.J., Josey W.E., Naib Z.M., Luce C.F., Guest B.A. Antibodies to herpesvirus hominis types 1 and 2 in humans: Patients with genital infections // Am. J. Epidemiol. 1970, 92, 547-552.
4. Baringer J., Swoveiand P. Recovery of herpes-simplex virus from human trigeminal ganglions // N. Engl. J. Med. 1973, 288, 648-650.
5. Baringer J. Recovery of herpes simplex virus from human sacral ganglions // N. Engl. J. Med. 1974, 291, 828-830.
6. Centers for Disease Control and Prevention. Sexually Transmitted Disease Surveillance. CDC, Atlanta, GA, 1996.
7. Fleming D., McQuillan G., Johnson R., Nahmias A., Aral S., Lee P., St. Louis M. Herpes simplex virus type 2 in the United States, 1976 to 1994 // N. Engl. J. Med. 1997, 337, 1105-1111.
8. Koutsky L.A., Ashley R.L., Holmes K.K., Stevens C.E., Critchlow C.W., Kiviat N., Lipinski C.M., Wolner-Hanssen P., Corey L. The frequency of unrecognized type 2 herpes simplex virus infection among women: Implications for the control of genital herpes // Sex. Transm. Dis. 1990, 17, 90-94.
9. Koutsky L., Stevens C., Holmes K., Ashley R., Kivat N., Critchlow C., Corey L. Underdiagnosis of genital herpes by current clinical and viral-isolation procedures // N. Engl. J. Med. 1992, 326, 1539-1553.
10. Breinig M.K., Kingsley L.A., Armstrong J.A., Freeman D.J., Ho M. Epidemiology of genital herpes in Pittsburgh: Serologic, sexual and racial correlates of apparent and inapparent herpes simplex infections // J. Infect. Dis. 1990, 161, 299-305.
11. Oliver L., Wald A., Mihee K., Zeh J., Selke S., Ashley R., Corey L. Seroprevalence of herpes simplex virus infections in a family medicine clinic // Arch. Fam. Med. 1995, 4, 228-232.
12. Siegel D., Golden E., Washington A., Morse S., Fullilove M., Catania J., Marin B., Hulley S. Prevalence and correlates of herpes simplex infections: The population-based AIDS in Multiethnic Neighborhoods Study // JAMA. 1992, 268, 1700-1708.
13. Sacks S.L. Genital HSV infection and treatment // Clinical Management of Herpes Viruses / S.L. Sacks, S.E. Strauss, R.J. Whitley, P.D. Griffiths, eds. — IOS Press, Amsterdam, 1995.
14. Cowan R., Johnson A., Ashley R., Corey L., Mindel A. Antibody to herpes simplex virus type 2 as serological marker of sexual lifestyle in populations // Br. Med. J. 1994, 309, 1325-1329.
15. Quinn T.C., Piot P., McCormick J.B., Feinsod F.M., Taelman H., Kapita B., Stevens W., Fauci A.S. Serologic and immunologic studies in patients with AIDS in North America and Africa. The potential role of infectious agents as cofactors in human immunodeficiency virus infection // JAMA. 1987, 257, 2617-2621.
16. Boulos R., Ruff A.J., Nahmias A., Holt E., Harrison L., Magder L., Wiktor S.Z., Quinn T.C., Margolis H., Halsey N.A. Herpes simplex virus type 2 infection, syphilis, and hepatitis В virus infection in Haitian women with human immunodeficiency virus type 1 and human T lymphotropic virus type 1 infections // Infect. Dis. 1992, 166, 418-420.
17. Beyrer C., Jitwatcharanan K., Natpratan C., Kaewvichit R., Nelson K.E., Chen C.Y., Weiss J.B., Morse S.A. Molecular methods for the diagnosis of genital ulcer disease in a sexually transmitted disease clinic population in northern Thailand: Predominance of herpes simplex virus infection // J. Infect. Dis. 1998, 178, 243-246.
18. Christenson B., Bottiger M., Svensson A., Jeansson S. A 15 year surveillance study of antibodies to herpes simplex virus types 1 and 2 in a cohort of young girls // J. Infect. 1992, 25, 147-154.
19. Eberhart-Phillips J., Dickson N., Paul C., Fawcett J., Holland D., Taylor J., Cunningham A. STI 1997/173 — Herpes simplex type 2 infection in a cohort aged 21 years // Sex. Transm. Infect. 1998, 74, 216-218.
20. Catania J.A., Binson D., Stone V. Relationship of sexual mixing across age and ethnic groups to herpes simplex virus-2 among unmarried heterosexual adults with multiple sexual partners // Health Psychol. 1996, 15, 362-370.
21. Mertz G.J., Benedetti J., Ashley R., Seike S.A., Corey L. Risk factors for the sexual transmission of genital herpes // Ann. Intern. Med. 1992, 116, 197-202.
22. Bryson Y. J., Dillon M., Bernstein D.I., Radolf J., Zakowski P., Garratty E. Risk of acquisi- ‘ tion of genital herpes simplex virus type 2 in sex partners of persons with genital herpes: A Prospective Couple Study // J. Infect. Dis. 1993, 167, 942-946.
23. Mertz G.J., Coombs R.W., Ashley R., Jourden J., Remington M., Winter C., Fahnlander A., Guinan M., Ducey H, Corey L. Transmission of genital herpes in couples with one symptomatic and one asymptomatic partner: A Prospective Study // J. Infect. Dis. 1988, 157, 1169-1177.
24. Mertz G.J., Schmidt O., Jourden J.L., Guinan M.E., Remington M.L., Fahnlander A., Winter C., Holmes K.K., Corey L. Frequency of acquisition of first-episode genital infection with herpes simplex virus from symptomatic and asymptomatic source contacts // Sex. Transm. Dis. 1985, 12, 33-39.
25. Bogaerts J., Ricart C.A., van Dyck E., Piot P. The etiology of genital ulceration in Rwanda // Sex. Transm. Dis. 1989, 16, 123-126.
26. Morse S.A., Trees D.L., Htun Y., Radebe F., One K.A., Dangor Y., Beck-Sague C.M., Schmid S., Fehler G., Weiss J.B., Ballard R.C. Comparison of clinical diagnosis and standard laboratory and molecular methods for the diagnosis of genital ulcer disease in Lesotho: Association with human immunodeficiency virus infection // J. Infect. Dis. 1997, 175, 001-007.
27. Stamm W.E., Handsfield H.H, Rompalo A.M., Ashley R.L., Roberts P.L., Corey L. Association between genital ulcer disease and acquisition of HIV infection in homosexual men // JAMA. 1988, 260, 1429-1433.
28. Greenblatt R.M., Lukehart S.A., Plummer F.A., Quinn T.C., Critchlow C.W., Ashley R.L., D’Costa L.J., Ndinya-Achola J.O., Corey L., Ronald A.R., Holmes K.K. Genital ulceration as a risk factor for human immunodeficiency virus infection // AIDS. 1988, 2, 47-50.
29. Latif A., Katzenstein D., Bassett M., Houston S., Emmanuel J., Marowa E. Genital ulcers and transmission of HIV among couples in Zimbabwe // AIDS. 1989, 3, 519-523.
30. Hook E., Cannon R., Nahmias A., Lee F., Campbell J.C.H., Glasser D., Quinn T. Herpes simplex virus infection as a risk factor for human immunodeficiency virus infection in heterosexuals // J. Infect. Dis. 1992, 165, 251-255.
31. Holmberg S.D., Stewart J.A., Gerber R., Byers R.H., Lee F.K., O’Malley P.M., Nahmias A.J. Prior herpes simplex virus type 2 infection as a risk factor for HIV infection // JAMA. 1988, 259, 1048-1050.
32. Gwanzura L., McFariand W., Alexander D., Burke R.L., Katzenstein D. Association between human immunodeficiency virus and herpes simplex virus type 2 seropositivity among male factory workers in Zimbabwe // J. Infect. Dis. 1998, 177, 481-484.
33. Keet I.P.M, Lee F.K., van Griensven G.J.P., Lange J.M.A., Nahmias A., Coutinho R.A. Herpes simplex virus type 2 and other genital ulcerative infections as a risk factor for HIV-1 acquisition // Genitourin. Med. 1990, 66, 330-333.
34. Telzak E.E., Chiasson A., Bevier P.J., Stoneburner R.L., Castro K.G., Jaffe H.W. HIV-1 seroconversion in patients with and without genital ulcer disease: A Prospective Study // Ann. Intern. Med. 1993, 119,1181-1186.
35. Dickerson M.C., Johnston J., Delea T.E., White A., Andrews E. The causal role for genital ulcer disease as a risk factor for transmission of human immunodeficiency virus: An application of the Bradford Hill criteria // Sex. Transm. Dis. 1996, 23, 429-440.
36. Cunningham A.L., Turner R.R., Miller A.C., Para M.R., Merigan T.C. Evolution of recurrent herpes simplex lesions: An Immunohistologic Study // J. din. Invest. 1985, 75, 226-233.
37. Koelle D.M., Abbo H., Peck A., Ziegweld K., Corey L. Direct recovery of herpes simplex virus (HSV) — specific T lymphocyte clones from recurrent genital HSV-2 lesions // J. Infect. Dis. 1994, 169, 956-961.
38. Clumneck N., Taelman H., Hermans P., Piot P., Schoumacher M., DeWit S. A cluster of HIV infection among heterosexual people without apparent risk factors // N. Engl. J. Med. 1989, 321, 1460-1462.
39. Cameron D.W., Simonsen J.N., D’Costa L.J., Ronald A.R., Maitha G.M., Gakinya M.N., Cheang M., Ndinya-Achola J.O., Piot P., Bumham R.C., Plummer F.A. Female to male transmission of human immunodeficiency virus type 1: Risk factors for seroconversion in men // Lancet. 1989, 403-407.
40. Kreiss J.K., Coombs R., Plummer F., Holmes K.K., Nikora B., Cameron W., Ngugi E., Ndinya-Achola J.O., Corey L. Isolation of human immunodeficiency virus from genital ulcers in Nairobi prostitutes // Infect. Dis. 1989, 160, 380-384.
41. Schacker T., Ryncarz A., Goddard J., Shaughnessy M., Corey L. Frequent recovery of HIV from genital herpes simplex virus lesions in HIV infected persons // JAMA. 1998, 280, 61-66.
42. Schacker T., Zeh J., Hu H., Hill J., Corey L. Frequency of symptomic and asymptomatic HSV-2 reactivations among HIV-infected men // J. Infect. Dis. 1998, 178, 1616-1622.
43. Lafferty W.E., Coombs R.W., Benedetti J., Critchlow C., Corey L. Recurrences after oral and genital herpes simplex virus infection: Influence of anatomic site and viral type // N. Engl. J. Med. 1987, 316, 1444-1449.
44. Rodgers C.A., O’Mahony C. High prevalence of herpes simplex virus type 1 in female anogenital herpes simplex // Int. J. STD AIDS. 1995, 6, 144-146.
45. Ross J.D.C., Smith I.W., Elton R.A. The epidemiology of herpes simplex types 1 and 2 infection of the genital tract in Edinburgh 1978–1991 // Genitourin. Med. 1993, 69, 381-383.
46. Tayal S.C., Pattman R.S. High prevalence of herpes simplex virus type 1 in female anogenital herpes simplex in Newcastle upon Tyne 1983–92 // Int. J. STD AIDS. 1994, 5, 359-361.
47. Cheong W.K., Thirumoorthy T., Doraisingham S., Ling A.E. Clinical and laboratory study of first episode genital herpes in Singapore // Int. J. STD AIDS. 1990, 1, 195-198.
48. Hashido M., Lee F.K., Nahmias A.J., Tsugami H., Isomura S., Nagata Y., Sonoda S., Kawana T. An epidemiologic study of herpes simplex virus type 1 and 2 infection in Japan based on type-specific serological assays // Epidemiol. Infect. 1998, 120, 179-186.
49. Wald A., Benedetti J., Davis G., Remington M., Winter C., Corey L. A randomized, double-blind, comparative trial comparing high and standard dose oral acyclovir for first-episode genital herpes infections // Antimicrob. Agents Chemother. 1994, 38, 174-176.
50. Berry J., Crowley T., Homer P., Harvey I. Orogenital sex as risk factor for the development of primary genital herpes; a case-control study // 12th Meet. Int. Soc. Sex. Transm. Dis. Res., Seville, Spain, 1997.
51. Lafferty W., Wald A., Celum C. Anogenital HSV type and sexual orientation // 12th Meet. Int. Soc. Sex. Transm. Dis. Res., Seville, Spain, 1997.
52. Corey L., Adams H.G., Brown Z.A., Holmes K.K. Clinical course of genital herpes simplex virus infections in men and women // Ann. Intern. Med. 1983, 48, 973.
53. Whitley R.J., Alford C.A., Lirsch M.S., Schooley R.T., Luby J.P., Aoki F.Y., Hanley D., Nahmias A.J., Soong S. Vidarabine versus acyclovir therapy in herpes simplex encephalitis // N. Engl. J. Med. 1986, 314, 144-149.
54. Wald A., Kim M., Catlett L., Seike S., Ashley R., Corey L. Genital HSV-2 shedding in women with HSV-2 antibodies but without a history of genital herpes // Programs Abstr., 36th Intersci. Conf. Antimicrob. Agents Chemother., New Orleans, 1996.
55. Catotti D., Clarke P., Catoe K. Herpes revisited: Still a cause of concern // Sex. Transm. Dis. 1993, 20, 77-80.
56. Bierman S. Recurrent genital herpes simplex infection: A trivial disorder // Arch. Dermatol. 1985, 121, 513-517.
57. Carney O., Ross E.L., Bunker C., Ikkos G., Mindel A. A prospective study of the psychological impact on patients with a first episode of genital herpes // Genitourin. Med. 1994, 70, 40-45.
58. Limandri B.J. Disclosure of stigmatizing conditions: The discloser’s perspective // Arch. Psychiatr. Nurs. 1989, 3, 69-78.
59. Corey L., Spear P.G. Infections with herpes simplex viruses (part 1) // N. Engl. J. Med. 1986, 314, 686-691.
60. Bernstein D., Lovett M., Bryson Y. Serologic analysis of first episode nonprimary genital herpes simplex virus infection // Am. J. Med. 1984, 77, 1055-1060.
61. Sacks S.L., Tyrrell L.D., Lawee D., Schlech W.I., Gill M.J., Aoki F.Y., Martel A.Y., Singer J., and the Canadian Cooperative Study Group. Randomized, douDleblind, placebo-controlled, clinic-initiated, Canadian multicenter trial of topical edoxudine 3,0% cream in the treatment of recurrent genital herpes // J. Infect. Dis. 1991, 164, 665-672.
62. Quinn T.C., Corey L, Chaffee R.G., Schuffler M.D., Brancato F.P., Holmes K.K. The etiology of anorectal infection in homosexual men // Am. J. Med. 1981, 71, 395-406.
63. Sacks S.L. Frequency and duration of patient-observed recurrent genital herpes simplex virus infection: Characterization of the nonlesional prodrome // J. Infect. Dis. 1984, 150, 873-877.
64. Benedetti J.K., Zeh J., Selke S., Corey L. Frequency and reactivation of nongenital lesions among patients with genital herpes simplex virus // Am. J. Med. 1995, 98, 237-242.
65. Benedetti J., Corey L., Ashley R. Recurrence rates in genital herpes after symptomatic first-episode infection // Ann. Intern. Med. 1994, 121, 847-854.
66. Langenberg A., Benedetti J., Jenkins J., Ashley R., Winter C., Corey L. Development of clinically recognizable genital lesions among women previously identified as having «asymptomatic» HSV-2 infection // Ann. Intern. Med. 1989, 110, 882-887.
67. Barton S.E., Davis J.M., Moss V.W., Tyms A.S., Munday P.E. Asymptomatic shedding and subsequent transmission of genital herpes simplex virus // Genitourin. Med. 1987, 63, 102-105.
68. Koelle D.M., Benedetti J., Langenberg A., Corey L. Asymptomatic reactivation of herpes simplex virus in women after first episode of genital herpes // Ann. Intern. Med. 1992, 116, 433-437.
69. Rooney J.F., Felser J.M., Ostrove J.M., Straus S.E. Acquisition of genital herpes from an asymptomatic sexual partner // N. Engl. J. Med. 1986, 314, 1561-1564.
70. Yeager A.S. Genital herpes simplex infections: Effect of asymptomatic shedding and latency on management of infections in pregnant women and neonates // Invest. Dermatol. 1984, 83, 53s-56s.
71. Brock B.V., Seike S., Benedetti J., Douglas J.M., Corey L. Frequency of asymptomatic shedding of herpes simplex virus in women with genital herpes // JAMA, J. Am. Med. Assoc. 1990, 263, 418-420.
72. Wald A., Zeh J., Seike S., Ashley R.L., Corey L. Virologic characteristics of subclinical and symptomatic genital herpes infections // N. Engl. J. Med. 1995, 333, 770-775.
73. Wald A., Zeh J., Bamum G., Davis L.G., Corey L. Suppression of subclinical shedding of herpes simplex virus type 2 with acyclovir // Ann. Intern. Med. 1996, 124, 8-15.
74. Wald A., Taylor L., Warren T., Remington M., Seike S., Zeh J., Corey L. Subclinical shedding of herpes simplex virus in men with genital herpes // Programs Abstr., 35th Intersci. Conf. Antimicrob. Agents Chemother., San Francisco, 1995.
75. Van Everdingen J.J., Peeters M.R, ten Have P. Neonatal herpes policy in The Netherlands. Five years after a consensus conference // Perinat. Med. 1993, 21, 371-375.
76. Sullivan-Bolyai J., Hull H.R, Wilson C., Corey L. Neonatal herpes simplex virus infection in King County, Washington: Increasing incidence and epidemiological correlates // JAMA. 1983, 250, 3059-3062.
77. Brown Z.A., Benedetti J., Ashley R., Burchett S., Seike, S., Berry S., Vontver L.A., Corey L. Neonatal herpes simplex virus infection in relation to asymptomatic maternal infection at the time of labor // N. Engl. J. Med. 1991, 324, 1247-1252.
78. Prober C.G., Sullender W.M., Yasukawa L.L., Au D.S., Yeager A.S., Arvin A.M. Low risk of herpes simplex virus infections in neonates exposed to the virus at the time of vaginal delivery to mothers with recurrent genital HSV infections // N. Engl. J. Med. 1987, 316, 240-244.
79. Brown Z.A., Selke S.A., Zeh J., Kopelman J., Maslow A., Ashley R.L., Watts D.H., Berry S., Herd M., Corey L. Acquisition of herpes simplex virus during pregnancy // N. Engl. J. Med. 1997, 337, 509-515.
80. Prober C.G., Corey L., Brown Z. A., Hensleigh P.A., Frenkel L.M., Bryson Y.J., Whitley R.J., Arvin A.M. The management of pregnancies complicated by genital infections with herpes simplex virus // Clin. Infect. Dis. 1992, 15, 1031-1038.
81. Randolph A.G., Washington A.E., Prober C.G. Cesarean delivery for women presenting with genital herpes lesions // JAMA. 1993, 270, 77-82.
82. Scott L.L., Sanchez P.J., Jackson G.L., Zeray F., Wendel G.D. Jr. Acyclovir suppression to prevent cesarean delivery after first-episode genital herpes // Obstet. Gynecol. 1996, 87, 69-73.
83. Smith J.R., Cowan F.M., Munday P. The management of herpes simplex virus infection in pregnancy // Br. J. Obstet. Gynaecol. 1998, 105, 255-268.
84. Randolph A.G., Hartshorn R.M., Washington A.E. Acyclovir prophylaxis in late pregnancy to prevent neonatal herpes: A cost-effectiveness analysis // Obstet. Gynecol. 1996, 88, 603-609.
85. Frenkel L.M., Brown Z.A., Bryson Y.J., Corey L., Unadkat J.D., Hensleigh P.A., Arvin A.M., Prober C.G., Connor J.D. Pharmacokinetics of acyclovir in the term human pregnancy and neonate // Am. J. Obstet. Gynecol. 1991, 164, 569-576.
86. Andrews E.B., Yankaskas B.C., Cordero J.F., Schoeffler K., Hampp S., and the Acyclovir in Pregnancy Registry Advisory Committee. Acyclovir in pregnancy registry: Six years’ experience // Obstet. Gynecol. 1992, 19, 7-13.
87. Ashley R. Laboratory techniques in the diagnosis of herpes simplex infection // Genitourin. Med. 1993, 69, 174-83.
88. Cone R.W., Swenson P.D., Hobson A.C., Remington M., Corey L. Herpes simplex virus detection from genital lesions: A comparative study using antigen detection (HerpChek) and culture // J. Clin. Microbiol. 1993, 31, 1774-1776.
89. Safrin S., Shaw H., Bolan G., Cuan J., Chang C.S. Comparison of virus culture and the polymerase chain reaction for diagnosis of mucocutaneous herpes simplex virus infection // Sex. Transm. Dis. 1997, 24, 176-180.
90. Cone R.W., Hobson A.C., Palmer J., Remington M.L., Corey L. Extended duration of herpes simplex DNA in genital lesions detected by the polymerase chain reaction // J. Infect. Dis. 1991, 164, 757-760.
91. Ashley R., Cent A., Maggs V., Corey L. Inability of enzyme immunoassays to discriminate between infections with herpes simplex virus type 1 and 2 // Ann. Intern. Med. 1991, 115, 520-526.
92. Ashley R.L., Militoni J., Lee P., Nahmias A., Corey L. Comparison of Western blot (Immu-noblot) and G-specific immunodot enzyme assay for detecting antibodies to herpes simplex virus types 1 and 2 in human sera // J. Clin. Microbiol. 1988, 26, 662-667.
93. Ashley R., Wu L., Pickering J., Tu M., Schnorenberg L. Premarket evaluation of a commercial glycoprotein-G based enzyme immunoassay for herpes simplex virus type-specific antibodies // J. Clin. Microbiol. 1998, 36, 294-295.
94. Ashley R., Eagleton M. Evaluation of a novel point-or-care test for antibodies to herpes simplex virus type 2 // Sex. Transm. Infect. 1999 (in press).
95. Fairley I., Monteiro E. Patient attitudes to type specific serologic tests in the diagnosis of genital herpes // Genitourin. Med. 1997, 73, 259-262.
96. Ashley R., Corey L. HSV type specific antibody tests: Patients are ready, are clinicians? // Genitourin. Med. 1997, 73, 235-236.
97. Corey L., Mindel A., Fife K.H., Sutherland S., Benedetti J., Adier M.W. Risk of recurrence after treatment of first episode genital herpes with intravenous acyclovir // Sex. Transm. Dis. 1985, 12, 215-218.
98. Whitley R.J., Gnann J.W. Jr. Acyclovir: A decade later // N. Engl. J. Med. 1992, 327, 782-789.
99. Corey L., Benedetti J., Critchlow C., Mertz G., Douglas J., Fife K., Fahnlander A., Remington M.L., Winter C., Dragavon J. Treatment of primary first-episode genital herpes simplex virus infections with acyclovir: Results of topical, intravenous and oral therapy // Antimicrob. Chemother. 1983, 12(Suppl. B), 79-88.
100. Mindel A., Carney O., Freris M., Faherty A., Patou G., Williams P. Dosage and safety of long term suppressive acyclovir therapy for recurrent genital herpes // Lancet. 1988, 1, 926-928.
101. Goldberg L.H., Kaufman R., Kurtz T., Conant M.A., Eron L.I., Batenhorst R.I. Long-term suppression of recurrent genital herpes with acyclovir: A 5-year benchmark // Arch. Dermatol. 1993, 129, 582-587.
102. Carney O., Ross E., Ikkos G., Mindel A. The effect of suppressive oral acyclovir on the psychological morbidity associated with recurrent genital herpes // Genitourin. Med. 1993, 69, 457-459.
103. Fife K.H., Crumpacker C.S., Mertz G.J., Hill E.L., Boone G.S., and the Acyclovir Study Group. Recurrence and resistance patterns of herpes simplex virus following cessation of ≥ 6 years of chronic suppression with acyclovir // Infect. Dis. 1994, 169, 1338-1341.
104. Reitano M., Tyring S., Lang W., Thoming C., Worm A.M., Borelli S., Chambers L.O., Robinson J.M., Corey L., and the International Valaciclovir HSV Study Group. Valaciclovir for the suppression of recurrent genital herpes simplex virus infection: A Large-scale Dose Range-finding Study // J. Infect. Dis. 1998, 178, 603-610.
105. Diaz-Mitoma F., Sibbald R.G., Shafran S.D., Boon R., Saltzman R.L., for the Collaborative Famciclovir Genital Herpes Research Group. Oral famciclovir for the suppression of recurrent genital herpes: A Randomized Controlled Trial // JAMA. 1998, 280, 887-892.
106. Meyers J.D., Wade J.C., Mitchell C.D., Saral R., Lietman P.S., Durack D.T., Levin M.J., Segreti A.C., Balfbur H.H. Multicenter collaborative trial of intravenous acyclovir for treatment of mucocutaneous herpes simplex virus infection in the immunocompromised host // Am. J. Med. 1982, 73, 229-235.
107. Conant M.A. Prophylactic and suppressive treatment with acyclovir and the management of herpes in patients with acquired immunodeficiency syndrome // J. Am. Acad. Dermatol. 1988, 18, 186-188.
108. Crumpacker C.S., Schnipper L.E., Marlowe S.I., Kowalsky P.N., Hershey B.J., Levin M.J. Resistance to antiviral drugs of herpes simplex virus isolated from a patient treated with acyclovir // N. Engl. J. Med. 1982, 306, 343-346.
109. Pottage J.C., Kessler H.A. Herpes simplex virus resistance to acyclovir: Clinical relevance // Infect. Agents Dis. 1995, 4, 115-124.
110. Centers for Disease Control and Prevention. CDC 1998 guidelines for treatment of sexually transmitted diseases // Morbid. Mortal. Wkly. Rep. 1998, 47, 1-118.
111. Burke R.L. Current developments in herpes simplex virus vaccines // Virology. 1993, 4, 187-197.
112. Langenberg A.G., Burke R.L., Adair S.R., Sekulovich R., Tigges M., Dekker C.L., Corey L. A recombinant glycoprotein vaccine for herpes simplex virus type 2: Safety and immunogenicity // Ann. Intern. Med. 1995, 12, 889-898.
113. Corey L., Ashley R., Sekulovich R., Izu A., Douglas J., Handsfield H.H., Warren T., Marr L., Tyring S., DiCarlo R., Adimora A., Leone P., Dekker C., Burke R.L., Langenberg A. Lack of efficacy of a vaccine containing recombinant gD2 and gB2 antigens in MF59 adjuvant for the prevention of genital HSV-2 acquisition // Programs Abstr., 37th Intersci. Conf. Antimicrob. Agents Chemother., Toronto, Canada, 1997.
114. Bourne N., Stanberry L.R., Bernstein D.I., Dew D. DNA immunization against experimental herpes simplex virus infection // J. Infect. Dis. 1996, 173, 800-807.
115. Boursnell M.E., Entwisle C., Blakeley D., Roberts C., Duncan I.A., Chisholm S.E., Martin G.M., Jennings R., Ni-Challana’in D., Sobek I., Inglisk S.C., McLean C.S. A genetically inactivated herpes simplex virus type 2 (HSV-2) vaccine provides effective protection against primary and recurrent HSV-2 diseas // J. Infect. Dis. 1997, 175, 16-25.
116. Kriesel J.D., Spruance S.L., Daynes R.A., Araneo B.A. Nucleic acid vaccine encoding gD2 protects mice from herpes simplex virus type 2 disease // Infect. Dis. 1996, 173, 536-541.
117. Higgins D.L., Galavotti C., O’Reilly K.R., Schnell D.J., Moore M., Rugg D.L., Johnson R. Evidence for the effects of HIV antibody counseling and testing on risk behaviors // JAMA. 1991, 266, 2419-2429.
118. Ebel C. Managing Herpes: How to Live and Love with a Chronic STD. American Social Health Association, Research Triangle Park, NC, 1998.
119. Sacks S.L. The Truth about Herpes. Gordon Soules Book Publishers Ltd., West Vancouver, Canada, 1997.
120. Corey L., Wald A. Genital herpes // Sexually Transmitted Diseases / K. Holmes (ed.). — 3rd ed. McGraw-Hill, New York, 1999.
121. Gibson J., Carlton A., Alexander G., Lee R., Potts W., Nahmias A. A cross-sectional study of herpes simplex virus types 1 and 2 in college students: Occurrence and determinants of infection // J. Infect. Dis. 1990, 162, 306-312.
122. Becker T., Blount J., ME G. Genital herpes infections in private practice in the United States, 1966 to 1981 // JAMA. 1985, 253, 1601-1603.
123. Weinberg A., Canto C., Pannuti C., Kwang W., Garcia S., Zugaib M. Herpes simplex virus type 2 infection in pregnancy: Asymptomatic viral excretion at delivery and seroepidemiologic survey of two socioeconomically distinct population in Sao Paulo, Brazil // Rev. Inst. Med. Trop. Sao Paulo. 1993, 35, 285-290.
124. Oberle M.W., Rosero-Bixby L., Lee P.K., Sanzchez-Braverman M., Nahmias A.J., Guinan M.E. Herpes simplex virus type 2 antibodies: High prevalence in monogamous women in Costa Rica // Am. J. Trop. Med. Hyg. 1989, 41, 224-218.
125. Cunningham A., Lee R., Ho D., Field P., Law C., Packham D., McCrossin I., Sjogren-Jansson E., Nahmias A. Herpes simplex virus type 2 antibody in patients attending antenatal or STD clinics // Med. J. Aust. 1993, 158, 525-528.
126. Forsgren M.F., Skoog E., Jeansson S., Olofsson S., Giesecke J. Prevalence of antibodies to herpes simplex virus in pregnant women in Stockholm in 1969, 1983 and 1989: Implications for STD epidemiology // Int. J. STD AIDS. 1994, 5, 113-116.
127. Pasquini P., Mele A., Franco E., Ippolito G., Svennerholm B. Prevalence of herpes virus type 2 antibodies in selected population groups in Italy // Eur. J. Clin. Microbiol. Infect. Dis. 1988, 7, 54-57.
128. Cowan R., Johnson A., Ashley R., Corey L., Mindel A. Relationship between antibodies to herpes simplex virus (HSV) and symptoms of HSV infection // Infect. Dis. 1996, 174, 470-475.
129. Bassett I., Donovan B., Bodsworth N., Field P., Ho D., Jeansson S., Cunningham A. Herpes simplex virus type 2 infection of heterosexual men attending a sexual health center // Med. J. Aust. 1994, 160, 697-700.
130. Lowhagen G., Jansen E., Nordenfelt E., Lycke E. Epidemiology of genital herpes infections in Sweden // Acta Derm-Venereol. 1990, 70, 330-334.
131. Mele A., Franco E., Caprilli P., Gentili G., Capitanio B., Crescimbeni E., Di Napoli A., Zaratti L., Conti S., Corona R., Rezza G., Pana A., Pasquini P. Genital herpes infection in outpatients attending a sexually transmitted disease clinic in Italy // Eur. J. Epidemiol. 1988, 4, 386-388.