Газета «Новости медицины и фармации» Антимикробная терапия (343) 2010 (тематический номер)
Вернуться к номеру
Внебольничная пневмония у взрослых
Авторы: А.И. Синопальников, Кафедра пульмонологии Государственного института усовершенствования врачей МО РФ, г. Москва
Версия для печати
Последнее десятилетие ознаменовалось гигантскими усилиями по разработке и активному внедрению в клиническую практику практических рекомендаций по ведению пациентов с различными заболеваниями и патологическими состояниями. В частности, касаясь внебольничной пневмонии (ВП) у взрослых, следует упомянуть рекомендации, подготовленные экспертами таких авторитетных научных обществ, как Британское торакальное общество (BTS, 2001, 2004) [1, 2], Европейское респираторное общество (ERS, 1998, 2005) [3, 4], Американское общество инфекционных болезней (IDSA, 2000, 2003) [5, 6], Американское торакальное общество (ATS, 2001) [7], Канадское общество инфекционных болезней/Канадское торакальное общество (CIDS/CTS, 2000) [8], Центры по контролю и профилактике заболеваний США (CDC, 2000) [9]. Основными целями данных документов являются: на уровне пациента — достижение оптимального клинического исхода и сокращение ущерба от неразборчивого применения антибиотиков; на уровне общества — уменьшение распространенности лекарственно-устойчивых возбудителей заболевания и минимизация стоимости лечения.
В 2003 г. вышло в свет первое издание согласительных национальных рекомендаций по ведению взрослых пациентов с ВП, подготовленное экспертами Российского респираторного общества (РРО), Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Альянса клинических химиотерапевтов и микробиологов [10]. Но уже тогда авторы рекомендаций отчетливо сознавали, что в силу стремительно меняющихся представлений о ВП (углубление и расширение современных данных об эпидемиологии респираторных инфекций, появление новых методов диагностики и др.) необходимо регулярно пересматривать и обновлять этот документ. Поэтому в начале 2006 г. было опубликовано второе издание рекомендаций РРО и МАКМАХ, в котором содержались данные о распространенности заболевания в нашей стране, новые сведения о резистентности ключевых респираторных возбудителей в России (Streptococcus pneumoniae и Haemophilus influenzae), были дополнены разделы по этиологии и диагностике ВП, а также появились новые главы, посвященные характеристике основных классов антимикробных препаратов, анализу реальной практики лечения ВП и индикаторам качества ведения пациентов.
Эпидемиология
Согласно официальной статистике2, в 1999 г. в России среди лиц в возрасте > 18 лет было зарегистрировано 440 049 случаев заболевания (3,9 %), а в 2003 г. во всех возрастных группах показатель заболеваемости составил 4,1 %. Сходными с федеральными данными оказываются и показатели заболеваемости в отдельных регионах нашей страны: Республика Татарстан (2004 г.) — 2,8 %, Свердловская область (2004 г.) — 3,5 %, Санкт-Петербург (2003 г.) — 2,96 %. Очевидно, однако, что эти цифры не отражают истинной заболеваемости ВП в России. Так, для сравнения, в США, население которых лишь немногим более чем вдвое превышает население нашей страны3, ежегодно диагностируется до 5–6 млн случаев заболевания.
Согласно данным Минздравсоцразвития РФ, в 2003 г. в нашей стране от пневмонии умерли 44 438 человек, что составляет 31 случай на 100 тыс. населения. Смертность от ВП в Республике Татарстан в 2002 г. составила 23,0, в Санкт-Петербурге в 2003 г. — 34,4, в Екатеринбурге с 2000 по 2004 гг. — 35,8–39,9 на 100 000 населения.
Летальность при ВП оказывается наименьшей у лиц молодого и среднего возраста без сопутствующих заболеваний. Напротив, у пациентов старше 60 лет при наличии серьезной сопутствующей патологии (хроническая обструктивная болезнь легких, злокачественные новообразования, алкоголизм, сахарный диабет, заболевания почек и печени, сердечно-сосудистой системы и др.), а также в случаях тяжелого течения ВП (мультилобарная инфильтрация, вторичная бактериемия, частота дыхания > 30/мин, гипотензия, острая почечная недостаточность) этот показатель достигает 15–30 %.
Анализ российских данных в отдельных регионах свидетельствует, что наиболее высокая смертность от ВП регистрируется у мужчин трудоспособного возраста.
Определение
Ключевым с практической точки зрения является подразделение пневмоний на внебольничные и нозокомиальные1.
Следует подчеркнуть, что такое подразделение никак не связано с тяжестью течения заболевания, а основным и единственным критерием разграничения является то окружение, в котором развилась пневмония.
Согласно современным представлениям, под ВП следует понимать острое заболевание, возникшее во внебольничных условиях — то есть вне стационара, или диагностированное в первые 48 ч от момента госпитализации, или развившееся у пациента, не находившегося в домах сестринского ухода/отделениях длительного медицинского наблюдения ≥ 14 сут., сопровождающееся симптомами инфекции нижних отделов дыхательных путей (лихорадка, кашель, выделение мокроты, возможно гнойной, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы.
Этиология
Этиология ВП непосредственно связана с нормальной микрофлорой, колонизующей верхние отделы дыхательных путей. Из многочисленных микроорганизмов лишь некоторые, обладающие повышенной вирулентностью, способны при попадании в нижние отделы дыхательных путей вызывать воспалительную реакцию. Таким типичным возбудителем ВП является S.pneumoniae (30–50 % случаев заболевания).
Существенное значение в этиологии ВП имеют так называемые атипичные микроорганизмы, на долю которых в сумме приходится от 8 до 30 % случаев заболевания:
— Chlamydophila pneumoniae;
— Mycoplasma pneumoniae;
— Legionella pneumophila.
К редким (3–5 %) возбудителям ВП относятся:
— Haemophilus influenzae;
— Staphylococcus aureus;
— Klebsiella pneumoniae, еще реже — другие энтеробактерии.
В очень редких случаях ВП может вызывать Pseudomonas aeruginosa (у больных муковисцидозом, при наличии бронхоэктазов).
Важно подчеркнуть, что нередко у взрослых пациентов, переносящих ВП, выявляется смешанная или коинфекция. Так, например, едва ли не у каждого второго больного с пневмококковой этиологией заболевания одновременно удается обнаружить серологические признаки активной микоплазменной или хламидийной инфекций.
Среди других возбудителей ВП нередко упоминаются респираторные вирусы (вирусы гриппа типа А и B, парагриппа, аденовирус и респираторный синцитиальный вирус), но в действительности они нечасто вызывают непосредственное поражение респираторных отделов легких. Вирусные респираторные инфекции, и прежде всего эпидемический грипп, безусловно, рассматриваются как ведущий фактор риска воспаления легких, являясь своеобразным «проводником» бактериальной инфекции. Однако вызываемые вирусами патологические изменения в легочной ткани называть пневмонией не следует и, более того, необходимо четко от нее отграничивать, поскольку подход к лечению этих двух состояний принципиально различен. С этой точки зрения представляется не вполне удачным распространенный термин «вирусно-бактериальная пневмония», поскольку собственно бактериальная пневмония качественно отличается от чаще всего интерстициального вирусного поражения легких.
Следует помнить о том, что ВП может быть связана с новыми, ранее неизвестными возбудителями, вызывающими вспышки заболевания. К выявленным в последние годы возбудителям ВП можно отнести ТОРС-ассоциированный коронавирус, вирус птичьего гриппа, метапневмовирус [12–14].
Для некоторых микроорганизмов нехарактерно развитие бронхолегочного воспаления. Их выделение из мокроты, скорее всего, свидетельствует о контаминации материала флорой верхних отделов дыхательных путей, а не об этиологической значимости этих микробов. К таким микроорганизмам относятся:
— Streptococcus viridans;
— Staphylococcus epidermidis и другие коагулазонегативные стафилококки;
— Enterococcus spp.;
— Neisseria spp.;
— Candida spp.
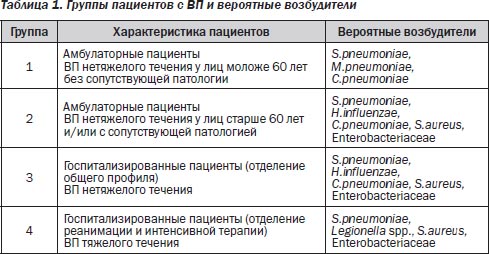
С практических позиций целесообразно выделять группы пациентов с ВП с учетом возраста, сопутствующей патологии и тяжести заболевания. Между этими группами могут наблюдаться различия не только в этиологической структуре, но и в прогнозе (табл. 1).
Резистентность
Данные мониторинга в РФ резистентности клинических штаммов S.pneumoniae — основного возбудителя ВП — в рамках многоцентрового исследования ПеГАС с 1999 по 2005 гг. представлены в табл. 2. Как показывает исследование, уровень устойчивости пневмококков к пенициллину в нашей стране остается стабильным и не превышает 10 %, при этом в большинстве случаев выявляются умеренно резистентные штаммы. Все пенициллинорезистентные пневмококки сохраняют чувствительность к амоксициллину/клавуланату, а резистентность к цефтриаксону варьирует от 0 до 2 %.
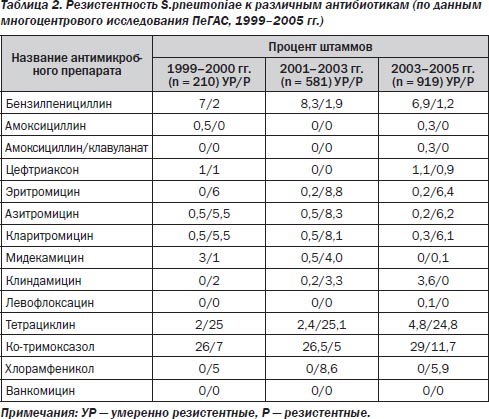
Резистентность S.pneumoniae к макролидам также остается невысокой — частота выявления штаммов, нечувствительных к 14- и 15-членным макролидам (эритромицин, кларитромицин, азитромицин), составляет 6–9 %. Уровень устойчивости к 16-членным макролидам (спирамицин, мидекамицин) и линкозамидам еще ниже (≤ 4,5 %).
Высокую активность в отношении S.pneumoniae сохраняют респираторные фторхинолоны (резистентность пневмококков к левофлоксацину в 2003–2005 гг. составила 0,1 %) и ванкомицин.
Следует отметить тенденцию к росту устойчивости пневмококков к тетрациклину и ко-тримоксазолу, несмотря на отмечающееся в последние годы существенное сокращение их использования при респираторных инфекциях в амбулаторной практике.
Критерии диагноза
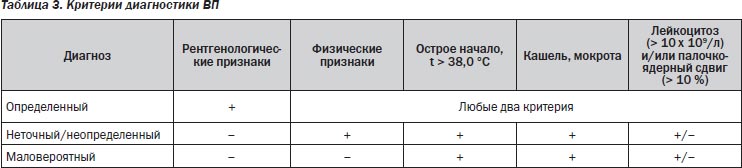
Диагноз ВП является определенным при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и по крайней мере двух клинических признаков из числа следующих: острая лихорадка в начале заболевания (t > 38,0 °С); кашель с мокротой; физические признаки очагового легочного процесса (фокус крепитации и/или мелкопузырчатых хрипов, жесткое бронхиальное дыхание, укорочение перкуторного звука и пр.); лейкоцитоз (> 10 × 109/л) и/или палочкоядерный сдвиг (> 10 %) (табл. 3). В связи с этим следует по возможности стремиться к клинико-рентгенологическому подтверждению диагноза пневмонии.
Отсутствие или недоступность рентгенологического подтверждения очаговой инфильтрации в легких делает диагноз ВП, основывающийся на учете данных эпидемиологического анамнеза, жалоб и соответствующих локальных симптомов, неточным/неопределенным.
Если же в процессе обследования больного с лихорадкой, жалобами на кашель, одышку, отделение мокроты и/или боли в груди рентгенологическое исследование органов грудной клетки оказывается недоступным и при этом отсутствует соответствующая локальная симптоматика, то предположение о внебольничной пневмонии становится маловероятным.
Диагностика ВП, основывающаяся на результатах физического и рентгенологического обследования, может быть приравнена лишь к синдромному диагнозу; нозологическим же он становится после определения возбудителя заболевания.
Определенную помощь в прогнозировании этиологии ВП может оказать тщательное изучение эпидемиологического анамнеза (табл. 4).
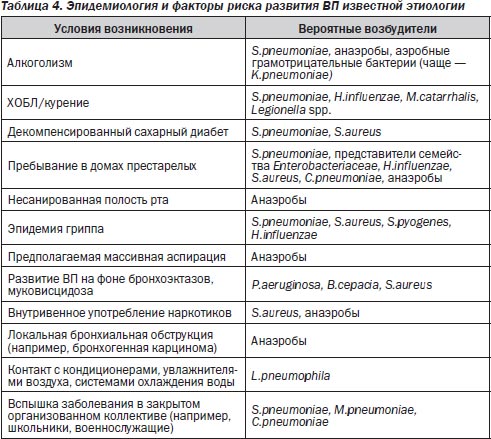
Необходимо также учитывать особенности клинического течения ВП в зависимости от ее этиологии. Так, для пневмококковой ВП характерны острое начало, высокая лихорадка, боли в грудной клетке; для легионеллезной — диарея, неврологическая симптоматика, тяжелое течение заболевания, нарушения функции печени; для микоплазменной — мышечные и головные боли, симптомы инфекции верхних дыхательных путей.
Несмотря на то что в отдельных случаях прослеживается связь между возбудителем ВП и ее клиническими и рентгенологическими проявлениями, особенности клинико-рентгенологического течения ВП не могут считаться адекватными предикторами этиологии заболевания. При этом конкретные клинические проявления чаще связываются не с биологией возбудителя, а с такими факторами макроорганизма, как возраст, наличие или отсутствие сопутствующих заболеваний. В связи с этим разделение ВП на «типичную» (вызываемую прежде всего S.pneumoniae) и «атипичную» (обусловленную M.pneumoniae, C.pneumoniae, L.pneumophila) лишено клинического смысла.
Для установления этиологии ВП проводятся бактериоскопия окрашенного по Граму мазка мокроты и культуральное исследование мокроты. Такое исследование является обязательным в стационаре и необязательным в амбулаторных условиях. Однако ввиду ограниченной чувствительности методов бактериологического исследования этиологию ВП не удается установить в 25–60 % случаев.
При этом следует особо подчеркнуть, что никакие диагностические исследования не должны быть причиной задержки с началом антибактериальной терапии.
Антибактериальная терапия
Для выбора адекватной антимикробной химиотерапии ВП необходимо учитывать следующие ключевые положения:
— ВП характеризуется значительной распространенностью и высокими показателями смертности;
— диагностические тесты, направленные на этиологическую верификацию пневмонии, имеют весьма ограниченную ценность — по меньшей мере в 30–50 % случаев этиологию ВП установить не удается;
— антибактериальная терапия ВП носит эмпирический характер;
— чрезвычайно важным (нередко определяющим) для прогноза ВП является выбор инициальной антимикробной терапии;
— относительно небольшое число видов микроорганизмов вызывает абсолютное большинство случаев заболевания — основными возбудителями ВП являются S.pneumoniae, а также «атипичные» возбудители (M.pneumoniae, C.pneumoniae);
— в развитии ВП доказан реальный вклад копатогенной или смешанной инфекции (например, S.pneumoniae и M.pneumoniae или C.pneumoniae);
— все более острой становится проблема распространения резистентных штаммов актуальных респираторных патогенов.
Выбор эмпирической антибактериальной терапии (когда результаты бактериоскопии и посева недоступны или отсутствуют) основывается на учете таких факторов, как степень тяжести заболевания, возраст пациента, непереносимость или нежелательные эффекты антибиотиков, особенности клинического течения, сопутствующие заболевания и сопутствующая медикаментозная терапия, а также эпидемиологический анамнез и стоимость препарата.
Определение места лечения пневмонии (на дому, в отделении общего профиля или ОРИТ) — один из ключевых вопросов, обсуждаемых на страницах настоящих рекомендаций. Объясняется это прежде всего стремлением осуществлять помощь (без ущерба конечной эффективности лечения) наиболее экономичным путем.
В соответствии с современными подходами к ведению взрослых пациентов с ВП, значительное их число может лечиться на дому. В связи с этим особое значение приобретает определение критериев или показаний к госпитализации. Принятие решения о целесообразности госпитализации предполагает учет стабильности клинического состояния пациента, его психосоциального статуса, риска смерти и развития осложнений заболевания, наличия или отсутствия иных медицинских проблем.
Определенную помощь при решении вопроса о выборе места лечения могут оказать прогностические шкалы — PSI (Pneumonia Severity Index) [15] и CURB-65 (Сonfusion — нарушения сознания, Urea — азот мочевины крови > 7,0 ммоль/л, Rate — частота дыхания ≥ 30/мин, Вlood — снижение диастолического ≤ 60 мм рт.ст. или систолического артериального давления < 90 мм рт.ст., 65 — возраст ≥ 65 лет) [16].
Однако следует помнить, что любая из прогностических шкал является только ориентиром в выборе места лечения, в каждом конкретном случае этот вопрос должен решаться лечащим врачом пациента индивидуально. Иными словами, определение места лечения пациента с ВП остается «искусством медицины», которое неспособен подменить ни один из имеющихся алгоритмов оценки прогноза заболевания.
Переходя непосредственно к обсуждению вопросов антимикробной химиотерапии ВП, необходимо упомянуть следующие основополагающие принципы: предпочтение следует отдавать антибиотикам направленного спектра действия, избегая по возможности использования препаратов широкого спектра; следует иметь в виду значение «атипичных» возбудителей в каждой выделенной группе пациентов с ВП, в том числе и в форме смешанной или коинфекции; первая доза антибиотика должна быть введена как можно раньше, не позже 4 ч с момента поступления пациента в стационар, поскольку задержка с началом антибиотикотерапии коррелирует с более высокой летальностью.
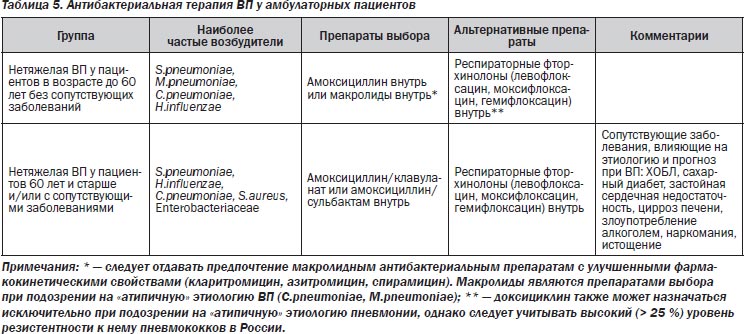
Рекомендации по эмпирической терапии ВП у амбулаторных больных представлены в табл. 5. Среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии.
В первую группу включены пациенты в возрасте до 60 лет без сопутствующей патологии. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов. В качестве препаратов выбора рекомендуются амоксициллин или макролидные антибиотики. Несмотря на то что in vitro аминопенициллины не перекрывают весь спектр потенциальных возбудителей, в ходе клинических исследований не выявлено различий в эффективности этих антибиотиков, а также отдельных представителей класса макролидов или респираторных фторхинолонов.
Макролидам следует отдавать предпочтение в первую очередь при непереносимости β-лактамов или подозрении на «атипичную» этиологию заболевания (микоплазма, хламидии). В качестве альтернативных препаратов у этой группы пациентов рекомендуются респираторные фторхинолоны.
Во вторую группу включены лица пожилого возраста (60 лет и старше) и/или пациенты с сопутствующими заболеваниями, которые оказывают влияние на этиологию и являются факторами риска неблагоприятного прогноза при ВП: ХОБЛ, сахарный диабет, застойная сердечная недостаточность, хроническая почечная недостаточность, цирроз печени, алкоголизм, наркомания, дефицит массы тела.
У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в том числе обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуется амоксициллин/клавуланат или амоксициллин/сульбактам. У пациентов данной категории возможно проведение комбинированной терапии β-лактамами и макролидами в связи с возможной хламидийной этиологией ВП. Альтернативой комбинированной терапии β-лактамами и макролидами может быть применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин, гемифлоксацин).
Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях (например, предполагаемой низкой комплайентности при приеме пероральных препаратов, отказе или невозможности своевременной госпитализации). В подобных клинических ситуациях предпочтение следует отдавать цефтриаксону; возможно его сочетание с макролидами или доксициклином.
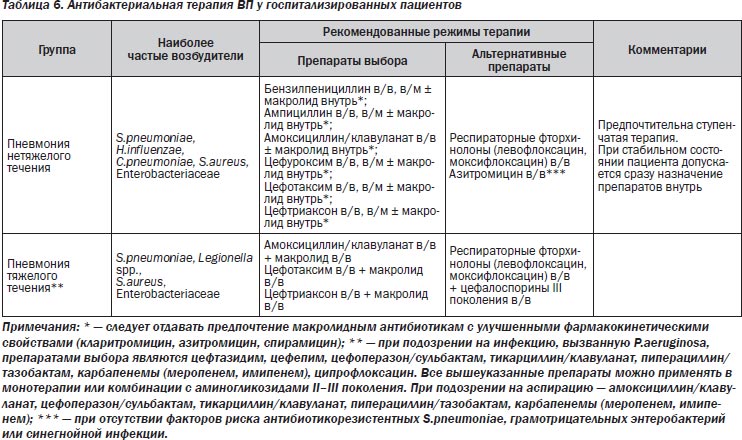
У госпитализированных пациентов подразумевается более тяжелое течение ВП, поэтому целесообразно начинать терапию с парентеральных антибиотиков. Через 3–4 дня лечения при нормализации температуры, уменьшении интоксикации и других симптомов заболевания возможен переход с парентерального на пероральное применение антибиотика до завершения полного курса терапии. При легком течении ВП у госпитализированных больных допускается сразу назначение антибиотиков внутрь.
Рекомендации по эмпирической терапии ВП у госпитализированных пациентов представлены в табл. 6.
У госпитализированных пациентов с нетяжелой ВП рекомендуется парентеральное применение бензилпенициллина, ампициллина, ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат) или цефалоспоринов II–III поколения. По данным ряда исследований, наличие в стартовом режиме терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре, что делает оправданным применение комбинированной терапии — β-лактам + макролид. Альтернативой им могут являться респираторные фторхинолоны (левофлоксацин, моксифлоксацин).
Согласно результатам ряда клинических исследований, ступенчатая монотерапия азитромицином по клинической и микробиологической эффективности сопоставима с комбинированной терапией — цефуроксим ± эритромицин, что дает основание использовать этот лечебный подход у госпитализированных пациентов с нетяжелой ВП и отсутствием факторов риска антибиотикорезистентных S.pneumoniae, грамотрицательных энтеробактерий или синегнойной инфекции1.
При тяжелой ВП назначение антибиотиков должно быть неотложным (категория доказательств В); отсрочка в их назначении на 4 ч и более существенно ухудшает прогноз. Препаратами выбора являются внутривенные цефалоспорины III поколения или ингибиторозащищенные пенициллины (амоксициллин/клавуланат) в комбинации с макролидами для внутривенного введения (эритромицин, кларитромицин, спирамицин, азитромицин). Указанные комбинации перекрывают практически весь спектр потенциальных возбудителей (как типичных, так и «атипичных») тяжелой ВП.
Ранние фторхинолоны (ципрофлоксацин и др.) характеризуются слабой антипневмококковой активностью, описаны случаи неэффективности терапии пневмококковой ВП.
Из препаратов группы фторхинолонов предпочтение следует отдавать респираторным фторхинолонам (левофлоксацин, моксифлоксацин), которые вводятся внутривенно. Они обладают повышенной антипневмококковой активностью и перекрывают практически весь спектр возможных возбудителей. Имеются данные контролируемых исследований о сравнимой со стандартным режимом терапии (комбинация β-лактамного антибиотика и макролида) эффективности монотерапии респираторными фторхинолонами при тяжелой ВП. Однако подобные исследования немногочисленны, поэтому более надежной является их комбинация с цефалоспоринами III поколения (цефотаксим, цефтриаксон).
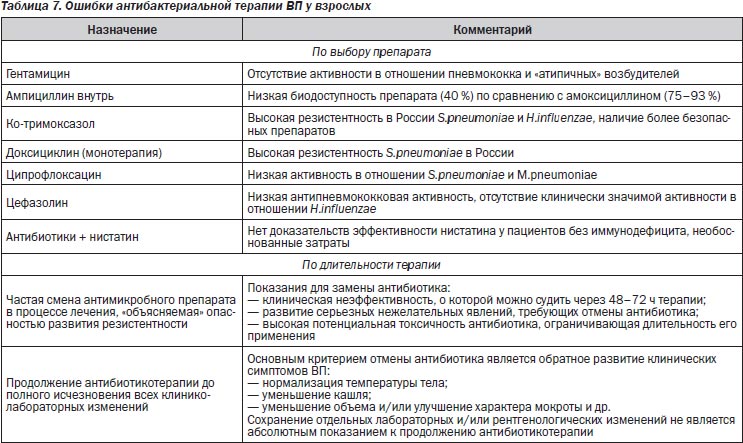
Ошибки антибактериальной терапии
Наиболее распространенные ошибки антибактериальной терапии ВП у взрослых представлены в табл. 7.
Индикаторы качества ведения пациентов
Для оценки качества оказания медицинской помощи пациентам с ВП в РФ рекомендуется использовать следующие критерии:
— рентгенография органов грудной клетки всем пациентам с клиническими признаками ВП;
— бактериологическое исследование мокроты (у всех госпитализированных пациентов), крови (при тяжелом течении ВП) до назначения антибиотиков;
— начало антибактериальной терапии у всех госпитализированных пациентов с ВП в первые 4 ч с момента поступления;
— соответствие стартового режима антибактериальной терапии национальным рекомендациям или составленным на их основе локальным рекомендациям/стандартам терапии;
— использование ступенчатой терапии у госпитализированных пациентов, нуждающихся в парентеральном введении антибиотиков;
— ежегодная вакцинация против гриппа пациентов из группы риска;
— рекомендации по вакцинации пневмококковой вакциной пациентов из группы риска.
Традиционно применяющиеся параметры оценки качества лечения некоторых заболеваний (летальность, частота госпитализаций в ОРИТ, длительность пребывания в стационаре, частота осложнений и др.) характеризуются низкой чувствительностью при ВП, их использование в качестве индикаторов не рекомендуется.
Заключение
На своем пути — от создания до внедрения — практические рекомендации преодолевают несколько ступеней: разработка авторитетной группой экспертов современных рекомендаций в форме, удобной для потенциального пользователя (практикующего врача, организатора здравоохранения); распространение рекомендаций в профессиональной среде (публикация в медицинских журналах, размещение в компьютерных информационных системах, проведение научных конференций и пр.); внедрение рекомендаций, нередко требующее существенных изменений в уже сложившейся медицинской практике. При этом критерием эффективности рекомендаций является достижение прогнозируемого улучшения результатов лечения и снижение затрат на его проведение.
Впервые опубликовано: Клиницист, 2006, № 2, с. 3-12
Печатается при поддержке ГлаксоСмитКляйн
1. British Thoracic Society Guidelines for the management of community-acquired pneumonia in adults // Thorax. — 2001. — 56 (Suppl. 4). — 1-64.
2. British Thoracic Society Guidelines for the management of community-acquired pneumonia in adults — 2004 update. Available from: http://www.brit-thoracic.org.uk/c2/uploads/MACAPrevisedApr0 4.pdf
3. Huchon G., Woodhead M. and the ERS Task Force. Guidelines for management of adult community-acquired lower respiratory tract infections // Eur. Respir. J. — 1998. — 11. — 986-91.
4. Woodhead M., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections // Eur. Respir. J. — 2005. — 26. — 1138-80.
5. Bartlett J.G., Dowell S.F., Mandell L.A. et al. Practice guidelines for the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2000. — 31. — 347-82.
6. Mandell L., Bartlett J., Dowell S. et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults // Clin. Infect. Dis. — 2003. — 37. — 1405-33.
7. Niederman M.S., Mandell L.A., Anzueto A. et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention // Am. J. Respir. Crit. Care Med. — 2001. — 163. — 1730-54.
8. Mandell L.A., Marrie T.J., Grossman R.F. et al., the Canadian Community-Acquired Pneumonia Working Group. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by Canadian Infectious Diseases Society and the Canadian Thoracic Society // Clin. Infect. Dis. — 2000. — 31. — 383-421.
9. Heffelfinger J.D., Dowell S.F., Jorgensen J.H. et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drug-Resistant Streptococcus pneumoniae Therapeutic Working Group // Arch. Intern. Med. — 2000. — 160. — 1399-408.
10. Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике // Клин. микробиол. антимикроб. химиотер. — 2003. — (5). — 198-224.
11. Craven D.E., Palladino R., McQuillen D.P. Healthcareassociated pneumonia in adults: management principles to improve outcomes // Infect. Dis. Clin. North Am. — 2004. — 18. — 929-62.
12. Синопальников А.И., Воробьев А.В., Белоцерковская Ю.Г. и др. Тяжелый острый респираторный синдром (ТОРС, SARS) // Клин. микробиол. антимикроб. химиотер. — 2003. — (5). — 225-42.
13. Синопальников А.И., Воробьев А.В. Тяжелый острый респираторный синдром: новые фрагменты головоломки // Клин. микробиол. антимикроб. химиотер. — 2004. — (6). — 108-23.
14. Синопальников А.И., Белоцерковская Ю.Г. Диагностика, профилактика и лечение гриппа // Клиницист. — 2006. — 1. — 23-33.
15. Fine M.J., Smith M.A., Carson C.A. et al. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis // JAMA. — 1996. — 275. — 134-41.
16. Lim W.S., van der Eerden M.M., Laing R. et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study // Thorax. — 2003. — 58. — 377-82.