Газета «Новости медицины и фармации» Антимикробная терапия (343) 2010 (тематический номер)
Вернуться к номеру
Характеристика основных групп антибактериальных препаратов, применяемых в медицине критических состояний
Авторы: В.И. Черний, А.Н. Колесников, И.В. Кузнецова и соавт., Кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний факультета последипломного образования Донецкого национального медицинского университета им. М. Горького
Версия для печати
Антибиотики классифицируют по результату воздействия на микрофлору, химическому строению и механизму действия.
Основой классификации антибактериальных препаратов (АБП) является их химическое строение. Классификация антибиотиков в соответствии с их химическим строением приведена в табл. 1.
Формально под термином «антибиотики» понимают только те вещества, которые вырабатываются микробами. Следовательно, такие антибактериальные или противомикробные средства, как сульфаниламиды, хинолоны и триметоприм, строго говоря, не антибиотики.
Если исходить из общетеоретических понятий бактерицидности и бактериостатичности, то эти понятия относительные, так как обе группы препаратов нарушают синтез белка в различных структурах клетки. Разница лишь в том, что бактерицидная активность зависит от величины концентрации препарата в биологических жидкостях, а бактериостатическая — не зависит или мало зависит от нее. По результату воздействия на микроорганизмы выделяют бактерицидные антибиотики — уничтожающие микробную клетку, и бактериостатические – подавляющие ее рост и размножение (табл. 2). Бактерицидные препараты используются при тяжелых острых инфекционных процессах. Острый инфекционный процесс обусловливается интенсивным делением клеток. Действие на делящиеся клетки с нарушением синтеза белка — процесс не длительный, поэтому препараты бактерицидного действия — недлительного применения, их используют до получения клинического эффекта.
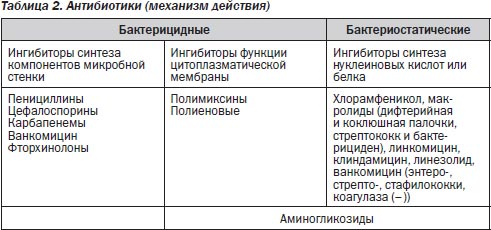
Бактериостатические препараты — препараты длительного использования для лечения хронического течения или инфекций в стадии утихания острых процессов. Однако к макролидам, рифампицину, линкомицину, фузидину быстро развивается устойчивость, поэтому их рекомендуют применять короткими курсами до 5 дней. По механизму действия антибиотики, как правило, делят на 3 группы.
I группа — антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины (ЦС), карбапенемы, монобактамы (азтреонам), ристомицин, фосфомицин, гликопептидные препараты (ванкомицин, тейкопланин). По фармакологическому эффекту препараты этой группы являются бактерицидными антибиотиками.
II группа — антибиотики, нарушающие функцию цитоплазматической мембраны: полимиксины, полиеновые препараты (нистатин, леворин, амфотерицин В и др.).
По фармакологическому эффекту они также являются бактерицидными.
III группа — антибиотики, нарушающие синтез белков и нуклеиновых кислот: левомицетин, тетрациклины, линкозамиды (линкомицин, клиндамицин), макролиды (эритромицин, рокситромицин, азитромицин и др.), рифамицины, фузидин, гризеофульвин, аминогликозиды (АГ) (канамицин, гентамицин, нетилмицин и др.).
По фармакологическому эффекту они являются бактериостатическими. Исключение составляет амикацин, который действует бактерицидно независимо от концентрации.
В последнее время принято разделение антибиотиков по механизму действия на 5 основных групп (табл. 3).
Характеристика основных групп АБП
С целью систематизации использования АБП существует перечень жизненно важных лекарственных средств ВОЗ (WHO Model List of essential Drugs) [11]. Представленный ВОЗ перечень является примерной моделью разработки такого списка в каждой стране с учетом особенностей местного здравоохранения. Как показывает практика, количество антимикробных препаратов примерно совпадает в разных странах. В своем обзоре мы хотим представить основные АБП, которые используются в медицине критических состояний.
Пенициллиназостабильные пенициллины. Спектр антимикробной активности оксациллина близок к природным пенициллинам (грамположительные бактерии), однако уровень активности против стрептококков и пневмококков в несколько раз ниже; не действует на энтерококки, гонококки и анаэробные бактерии. Основным отличием оксациллина от природных и других полусинтетических пенициллинов является устойчивость к стафилококковым бета-лактамазам — ферментам, разрушающим бета-лактамное кольцо пенициллинов.
Оксациллин — высокоактивное средство в отношении золотистого и коагулазонегативных стафилококков, однако не действует на стафилококки с другим механизмом устойчивости, так называемые метициллин- или оксациллинрезистентные стафилококки. Основные показания для оксациллина — инфекции, вызванные стафилококками, чувствительными к оксациллину, а также при предполагаемой стафилококковой этиологии (острый артрит, острый остеомиелит, неосложненные инфекции кожи и мягких тканей, эндокардит трикуспидального клапана). Адекватный режим дозирования оксациллина при госпитальных стафилококковых инфекциях — 2 г внутривенно с интервалом 4–6 ч. При пероральном приеме оксациллин плохо всасывается в пищеварительном тракте, поэтому предпочтительнее использовать клоксациллин или диклоксациллин.
Аминопенициллины обладают более широким спектром активности по сравнению с природными пенициллинами за счет некоторых грамотрицательных бактерий — E.coli, Shigella spp., Salmonella spp., Proteus mirabilis, Haemophilus influenzae (преимущественно внебольничные штаммы); препараты проявляют также активность в отношении анаэробных микроорганизмов, но уровень резистентности к ним высокий. В то же время аминопенициллины гидролизуются β-лактамазами стафилококков и грамотрицательных бактерий, поэтому не имеют в настоящее время существенного значения при лечении внутрибольничных инфекций.
Ампициллин применяется парентерально (при пероральном приеме низкая биодоступность) при внебольничной пневмонии, инфекционном эндокардите, менингите. Амоксициллин применяется при нетяжелых внебольничных респираторных инфекциях, а также может назначаться для замены ампициллина при ступенчатой терапии.
Ингибиторзащищенные аминопенициллины не разрушаются большинством бета-лактамаз грамотрицательных бактерий, в результате чего их спектр антимикробной активности по сравнению с незащищенными препаратами более широкий в отношении некоторых грамотрицательных бактерий (Klebsiella spp., Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus) и анаэробов (Bacteroides fragilis). Основное показание для применения ингибиторзащищенных пенициллинов в стационаре — интраоперационная профилактика послеоперационных гнойно-септических осложнений. С этой целью препарат вводится в однократной дозе за 30–60 мин до операции (амоксициллин/клавуланат 1,2 г (аугментин, амоксиклав), ампициллин/сульбактам (амписульбин) 3 г, уназин). Ингибиторзащищенные пенициллины высокоэффективны при абсцедирующей пневмонии и нетяжелых инфекциях малого таза. Амоксициллин/клавуланат (аугментин) также является базовым средством для лечения госпитализированных больных с внебольничной пневмонией среднетяжелого течения или обострением хронического бронхита. При госпитальных инфекциях (пневмония, перитонит, кожи и мягких тканей) значение этих препаратов невелико из-за существенного уровня резистентности основных возбудителей [4, 9, 14, 43, 45, 47, 48, 50, 52, 61, 83, 84, 91, 99].
Карбоксипенициллины и уреилопенициллины. Эти препараты обычно объединяют одним названием — антипсевдомонадные пенициллины. Они обладают более широким спектром активности по сравнению с аминопенициллинами (чувствительны к большинство бактерий семейства Enterobacteriaceae, Pseudomonas aeruginosa), однако эти препараты разрушаются β-лактамазами грамотрицательных бактерий и стафилококков, поэтому применение их в настоящее время ограничено. Основное показание — псевдомонадные инфекции, однако следует учитывать возросший уровень устойчивости P.aeruginosa к карбокси- и уреидопенициллинам. При псевдомонадной инфекции назначение этих препаратов (при установленной чувствительности!) следует комбинировать с аминогликозидами, использовать адекватные дозировки: карбенициллин внутривенно 4–5 г с интервалом 4 ч, пиперациллин внутривенно 2–4 г с интервалом 6–8 ч. При использовании антипсевдомонадных пенициллинов (особенно карбоксипенициллинов!) необходимо контролировать электролиты в крови и показатели свертываемости крови.
Защищенные антипсевдомонадные пенициллины. Имеют более широкие показания при внутрибольничных инфекциях, однако следует учитывать увеличившуюся в последние годы устойчивость грамотрицательных бактерий к этим препаратам. Тикарциллин/клавуланат (тиментин) и пиперациллин/тазобактам применяются в основном при смешанных аэробно-анаэробных инфекциях — интраабдоминальные и гинекологические инфекции, легочные нагноения. Целесообразно сочетание этих препаратов с аминогликозидами, особенно при тяжелых инфекциях. Режим дозирования тикарциллин/клавуланата составляет 3,2 г внутривенно с интервалом 6–8 ч, пиперациллин/тазобактама — 2,5–4,5 г с интервалом 8 ч. Наиболее интересен в клиническом плане тикарциллин/клавуланат (тиментин). Тикарциллин устойчив к действию цефалоспориназ, в т.ч. вырабатываемых бактериями семейства Enterobacteriacea. Клавулановая кислота (рис. 1) обеспечивает защиту тикарциллина от распада под действием β-лактамаз:

— стафилококковых β-лактамаз;
— хромосомных β-лактамаз грамотрицательных бактерий класса А;
— плазмидных β-лактамаз широкого и расширенного спектра.
Только тиментин активен в отношении Stenotrophomonas maltophilia, имеющей природную множественную лекарственную устойчивость, в том числе к карбапенемам.
Тиментин может быть использован в качестве средства стартовой монотерапии:
— при абдоминальных инфекциях;
— инфекциях кожи и мягких тканей;
— септицемии;
— инфекциях костей и суставов;
— инфекциях дыхательных путей;
— инфекциях мочевыделительных путей;
— гинекологических инфекциях, эндометрите.
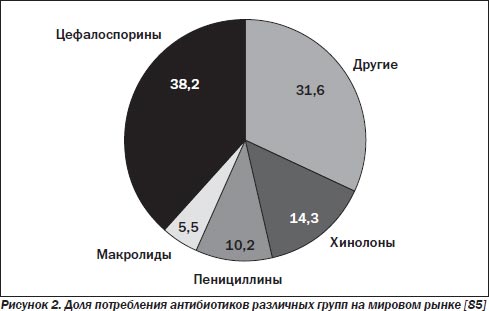
Цефалоспорины. Потребление цефалоспоринов «так резко возросло, что можно сравнить его с первоначальной реакцией на появление пенициллина» [85]. Они считаются самыми назначаемыми в отделениях интенсивной терапии (ОИТ) антибактериальными препаратами в мире (рис. 2).
В эту группу входят препараты с различным спектром антимикробной активности, поэтому в зависимости от спектра их разделяют на поколения. Общим для всех цефалоспоринов (кроме цефоперазон/сульбактама — сульперазон) является слабая активность в отношении анаэробных микроорганизмов (поэтому при смешанных инфекциях их следует комбинировать с метронидазолом или линкозамидами). Все ЦС не активны в отношении энтерококков, метициллинрезистентных стафилококков, листерий и атипичных микроорганизмов (легионелла, хламидии, микоплазма).
Цефалоспорины I поколения. Обладают преимущественной активностью в отношении грамположительных бактерий (стафилококки, стрептококки, пневмококки) и некоторых грамотрицательных — E.coli, Shigella spp., Salmonella spp., P.mirabilis. Однако в связи с широким распространением приобретенной устойчивости госпитальных штаммов грамотрицательных бактерий клиническое значение цефалоспоринов I поколения при этих инфекциях невелико. Основная область клинического применения цефазолина в стационаре — установленная стафилококковая инфекция различной локализации.
Цефалоспорины II поколения, представителем которых является цефуроксим (зинацеф, кимацеф), обладающие более широким спектром активности против грамотрицательных бактерий, находят более широкое применение при внутрибольничных инфекциях, однако в большинстве случаев их целесообразно сочетать с аминогликозидами. Цефуроксим эффективен при неосложненной внебольничной пневмонии. Препарат выбора для профилактики инфекционных осложнений после операций.
Цефалоспорины III поколения характеризуются высокой активностью в отношении грамотрицательных энтеробактерий, причем цефотаксим и цефтриаксон превосходят цефтазидим и цефоперазон. Принципиальное различие между этими препаратами заключается в действии на синегнойную палочку: цефотаксим и цефтриаксон не обладают значимой активностью против P.aeruginosa (их целесообразно выделить в подгруппу IIIа), цефтазидим и цефоперазон активны в отношении P.aeruginosa (цефтазидим несколько превосходит цефоперазон) — подгруппа IIIб. Соответственно различается и место этих цефалоспоринов при внутрибольничных инфекциях. Цефтазидим (фортум, цефтум) и цефоперазон (гепацеф, цефобид) являются базовыми препаратами при лечении установленных псевдомонадных инфекций или заболеваний с высоким риском наличия P.aeruginosa.
Одной из важнейших характеристик, определяющих эффективность антибактериальной терапии при гнойно-воспалительных заболеваниях, является резистентность возбудителей. Очевидно, что с ростом резиcтентности микроорганизмов к антибактериальным препаратам будет снижаться и эффективность стандартных режимов дозирования, что стимулирует разработку новых схем терапии.
С современных позиций, чтобы понять зависимость между дозой АБП и его эффективностью, необходимо в совокупности рассматривать фармакокинетические — ФК (всасывание, распределение, метаболизм и экскреция АБП) и фармакодинамические — ФД (воздействие препарата на возбудителя в очаге инфекции, зависимость антимикробного эффекта от концентрации и времени воздействия АБП) показатели. Важнейшими из них в системе ФК/ФД, влияющими на исход лечения, являются:
— период времени (Т), в течение которого концентрация препарата в сыворотке крови превышает минимальную подавляющую концентрацию (МПК);
— отношение пиковой концентрации АБП (Сmax) и МПК;
— отношение площади под фармакокинетической кривой (ПФК) и МПК (рис. 3).
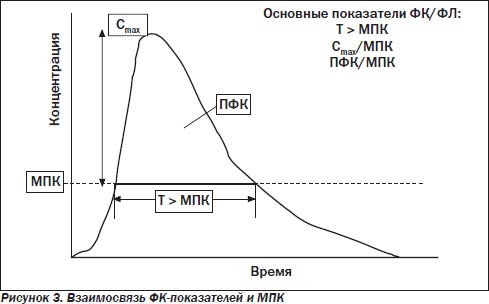
Среди многих классов АБП выделяют два основных типа антимикробной активности: времязависимый и концентрациязависимый.
К концентрациязависимым АБП относятся фторхинолоны (ФХ), аминогликозиды, кетолиды, азитромицин, метронидазол. Они обладают длительным постантибиотическим эффектом (ПАЭ), предотвращающим размножение микроорганизмов в течение некоторого времени после удаления АБП из среды, где растут бактерии. Основными ФК/ФД-показателями, определяющими клиническую и микробиологическую активность этих АБП, являются Сmax/МПК (наибольшая эффективность достигается при значениях > 10–12) и ПФК/МПК (хорошие результаты отмечены при значениях e = 25–30 у пациентов с нормальным функционированием иммунной системы и для Streptococcus pneumoniae, а при > 100–125 — у иммунокомпрометированных пациентов и для грамотрицательных бактерий).
Времязависимая активность характерна для β-лактамов (пенициллины, цефалоспорины, монобактамы, карбапенемы), макролидов (кроме азитромицина), гликопептидов, ко-тримоксазола, клиндамицина, тетрациклинов, линезолида.
Определяющий показатель ФК/ФД — время, в течение которого концентрация АБП превышает МПК. В опытах in vitro и на животных показано, что β-лактамы обладают максимальной антимикробной активностью при концентрациях, превышающих МПК возбудителя в 4–5 раз, а дальнейшее повышение концентрации не ведет к увеличению бактерицидного эффекта.
Разные классы β-лактамов имеют неодинаковый показатель Т > МПК, требуемый для достижения максимальной и поддерживающей бактерицидной концентрации. Его параметры зависят от вида возбудителя (киллинг Pseudomonas aeruginosa происходит при более высоких значениях временного интервала выше МПК), локализации очага инфекции (в тканях предстательной железы, костях создаются недостаточные концентрации β-лактамов), возраста пациентов (у пожилых больных на фоне угнетения экскреторных функций замедляется выведение из организма и возрастает концентрация АБП) и наличия или отсутствия у антибиотика ПАЭ в отношении конкретного микроорганизма. У пенициллинов и цефалоспоринов отсутствует ПАЭ на грамотрицательные бактерии.
У больных с иммунодефицитами для получения клинического эффекта необходимо стремиться, чтобы концентрация АБП превышала 5 МПК в течение 100 % длительности интервала дозирования.
Оптимальные процентные значения Т > МПК β-лактамов можно достигнуть за счет повышения (до известного предела) разовой дозы, уменьшения интервала между выделениями или увеличения продолжительности внутривенной инфузии суточной дозы антибиотика.
При стандартных режимах дозирования β-лактамов, основанных на интермиттирующем введении препарата с пиковыми подъемами и падениями концентраций в плазме соответственно выше и ниже МПК, может возобновляться размножение микроорганизмов с повышенной устойчивостью к антибиотику, который и осуществляет селекцию резистентных клеток в бактериальной популяции за счет возникающего после каждой инъекции «окна селекции резистентности», когда концентрация АБП в очаге выше уровня МПК чувствительных штаммов, но ниже концентрации, препятствующей селекции мутантных штаммов с повышенной резистентностью. Особое значение приобретает эффект инокулума, которому особенно подвержены антисинегнойные β-лактамы.
Режим продленной инфузии (ПИ) заключается в создании превышающей МПК концентрации β-лактама в плазме на постоянном уровне, что позволяет получить максимальный бактерицидный и клинический эффект и сократить «окно селекции», оставляя его только при первом и последнем введении антибиотика. Для достижения оптимальной концентрации > 4–5 МПК и снижения селекции резистентных штаммов в начале инфузии с первых минут терапии необходимо использовать нагрузочную дозу, которую вводят струйно (болюсно).
Во многих исследованиях было показано, что значения ФК/ФД-показателей сходны у разных видов животных и у человека, поэтому результаты экспериментов на животных моделях могут быть полезными при разработке режимов дозирования АБП в тех ситуациях, когда сложно собрать достаточное количество клинических данных, в частности при появлении нового антибиотикорезистентного штамма.
В исследованиях по изучению клинической эффективности β-лактамов при ПИ большинство работ посвящено цефтазидиму.
При выборе β-лактама для ПИ следует учитывать его стабильность в растворе при комнатной температуре в течение 12–24 ч, что чрезвычайно важно для сохранения активности препарата и снижения риска побочных эффектов, обусловленных продуктами распада антибиотика. Например, в растворе бензилпенициллина за 24 ч остается только 53 % активной формы антибиотика, а продукты его деградации при ПИ могут вызвать реакцию гиперчувствительности. Поэтому применение его в режиме ПИ возможно при условии приготовления раствора каждые 12 ч.
По той же причине для меропенема рекомендовано готовить свежие растворы каждые 8 ч.
Вследствие нестабильности растворов при комнатной температуре аминопенициллины и имипенем целесообразно назначать в интермиттирующем режиме.
Важное значение имеет физико-химическая совместимость β-лактама с параллельно назначаемыми препаратами других групп при комплексном лечении больного. К примеру, нельзя объединять их с аминогликозидами в одной инфузионной системе.
Преимущества ПИ более ощутимы для антибиотиков с коротким периодом полувыведения (у фортума 2 часа), требующим частого введения в течение суток, поэтому практически отсутствуют исследования по изучению цефтриаксона, у которого Т1/2 = 8,5 ч.
Суммируя преимущества ПИ, следует подчеркнуть, что в течение всего интервала дозирования можно поддерживать оптимальную плазменную концентрацию > 4–5 МПК, обеспечивающую лучшее проникновение антибиотика в очаг инфекции, которую при необходимости легче контролировать во избежание передозировки у пациентов с нарушением выделительных функций почек.
Клиническая эффективность ПИ не уступает назначению АБП в стандартном режиме, но при этом уменьшается риск селекции резистентных штаммов и снижается стоимость терапии в связи с более низкой суточной дозой препарата и сокращением трудовых затрат медперсонала, связанных с приготовлением растворов, выполнением инъекций и т.д.
Дозирование препарата фортум при назначении в режиме продленной инфузии: 1 г в/в в течение 30 мин в виде нагрузочной дозы, затем по 2 г в виде в/в инфузии в течение 12 часов 2 раза в сутки.
Цефоперазон, в высоких концентрациях проникающий в желчь, также показан для лечения инфекций желчевыводящих путей. Цефотаксим и цефтриаксон являются в настоящее время базовыми препаратами при лечении различных госпитальных инфекций. Уровень активности у этих цефалоспоринов одинаков, различия между ними связаны со скоростью элиминации: период полувыведения цефтриаксона составляет около 8 ч, поэтому препарат назначается в дозе 2 г с интервалом 24 ч, цефотаксим выводится быстрее, поэтому обычно дозируется 2 г с интервалом 6–8 ч.
Цефалоспорины IV поколения. Представлены в настоящее время одним препаратом — цефепимом (квадрицеф), обладающим наиболее широким и сбалансированным спектром антимикробной активности среди цефалоспориновых антибиотиков. Клинически важно, что цефепим может сохранять активность в отношении некоторых штаммов Enterobacteriaceae (прежде всего Enterobacter spp., Serratia spp., Morganella morganii, Providencia rettgeri, C.freundii, являющихся гиперпродуцентами хромосомных бета-лактамаз класса С), резистентных к цефалоспоринам III поколения. Цефепим проявляет активность в отношении некоторых штаммов Klebsiella spp., продуцирующих бета-лактамазы расширенного спектра, однако ряд штаммов устойчив. Основная область применения цефепима в клинике — тяжелые внутрибольничные инфекции, особенно в случае резистентных к цефалоспоринам III поколения энтеробактерий. Цефепим может применяться в клинике в схемах ротации, т.е. для временной замены в схемах эмпирической терапии цефалоспоринов III поколения в случае высокой к ним резистентности. Показано, что периодическая ротация цефалоспоринов III поколения на цефепим в отделениях реанимации и интенсивной терапии (ОРИТ) позволяет ограничить рост устойчивых штаммов микроорганизмов и даже восстановить чувствительность микробов к цефалоспоринам III поколения.
Ингибиторзащищенные цефалоспорины. Комбинация антипсевдомонадного цефалоспорина III поколения цефоперазона и ингибитора бета-лактамаз сульбактама — цефоперазон/сульбактам (сульперазон) — обладает более широким спектром действия, чем ЦС III поколения, за счет сохранения активности против энтеробактерий и анаэробов, продуцирующих β-лактамазы, в том числе расширенного спектра (ESBL), и разрушающих другие ЦС. Препарат применяется при лечении тяжелых госпитальных инфекций различной локализации, причем при смешанных аэробно-анаэробных инфекциях — в режиме монотерапии.
Цефоперазон/сульбактам:
— достигает высоких терапевтических концентраций в различных тканях и жидкостях при в/в, в/м введении и сохраняет;
— нет данных об аккумулировании при многократном введении;
— может применяться у пожилых пациентов, детей и индивидуально у пациентов с умеренной и средневыраженной почечной недостаточностью;
— имеет низкий уровень взаимодействия с другими препаратами;
— сульбактам меньше индуцирует β-лактамазу, чем клавулановая кислота.
Цефоперазон/сульбактам обладает активностью против широкого спектра возбудителей:
— грамположительные аэробы;
— Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pneumoniae, Streptococcus pyogenes;
— грамотрицательные аэробы;
— Haemophilus influenzae, Moraxella catarrhalis, Enterobacteriaceae (Klebsiella pneumoniae, Enterobacter spp., Proteus spp., Escherichia coli);
— анаэробы;
— Bacteroides fragilis, Bacteroides spp., Fusobacterium и Peptostreptococcus spp.
Цефоперазон/сульбактам (сульперазон) подходит в качестве эмпирической терапии при многих инфекционных заболеваниях:
— инфекции дыхательных путей (верхних и нижних отделов);
— перитонит, холецистит, холангит и другие инфекции брюшной полости;
— септицемия;
— менингит;
— инфекции кожи и мягких тканей;
— инфекции костей и суставов;
— воспалительные заболевания малого таза, эндометриты, гонорея и другие инфекции половых органов.
Карбапенемы [4]. На украинском фармрынке представлены четырьмя антибиотиками — имипенемом/циластатином (тиенам, ластинем, пропенем), меропенемом (меронем, ронем, мезонекс), дорипеном (дорибакс) и эртапенемом (инванз).
Характеризуются наиболее широким спектром антимикробной активности среди всех бета-лактамных антибиотиков — грамположительные и грамотрицательные аэробные бактерии, анаэробы. Из возбудителей внутрибольничных инфекций природную устойчивость к карбапенемам (но не к дорибаксу) проявляют только три микроорганизма: Enterococcus faecium, Stenotrophomonas maltophilia, а также метициллинрезистентные штаммы Staphylococcus spp. Клинически важно, что вторичная устойчивость госпитальных штаммов микроорганизмов к карбапенемам развивается крайне редко (исключение — P.aeruginosa). Резистентность P.aeruginosa к карбапенемам выше и в ОРИТ может достигать 15–20 % (исключение — дорибакс). Карбапенемы сохраняют активность в отношении штаммов Enterobacteriaceae, резистентных к цефалоспоринам III и IV поколений, аминогликозидам и фторхинолонам. Имипенем характеризуется несколько более высокой активностью in vitro в отношении грамположительных микроорганизмов, меропенем проявляет более высокую активность в отношении грамотрицательных бактерий (клинически эти различия, вероятно, не значимы); активность препаратов против анаэробов одинакова и превосходит таковую у метронидазола и линкозамидов. Новый карбапенем — эртапенем, MSD (инванз), характеризуется отсутствием действия на P.aeruginosa и назначается 1,0 г 1 раз в сутки; способ введения: внутримышечно и внутривенно. Уникальный карбапенем дорипенем (дорибакс) обладает высокой активностью как в отношении грамположительных, так и в отношении грамотрицательных микроорганизмов и в 2–4 раза активнее в отношении P.aeruginosa по сравнению с другими карбапенемами. Кроме того, дорибакс (дорипенем) имеет самый низкий потенциал развития резистентности со стороны патогенов нозокомиальных инфекций по сравнению с другими карбапенемами, что позволяет препарату оставаться эффективным длительное время.
Карбапенемы применяются для лечения тяжелых внутрибольничных инфекций, вызванных полирезистентной и смешанной микрофлорой, прежде всего при неэффективности препаратов первого ряда — цефалоспоринов или фторхинолонов. В контролируемых клинических исследованиях показано, что карбапенемы равноэффективны или превосходят стандартные комбинированные режимы антибактериальной терапии на основе цефалоспоринов (или полусинтетических пенициллинов) и аминогликозидов.
Основные показания для карбапенемов: интраабдоминальные инфекции, послеоперационные раневые инфекции, внутрибольничная пневмония, в том числе связанная с искусственной вентиляцией легких (ИВЛ), легочные нагноения (абсцесс, эмпиема), инфекции органов малого таза, осложненные инфекции мочевыводящих путей с сепсисом, остеомиелит, менингит (только меропенем). Следует подчеркнуть, что при жизнеугрожающих инфекциях карбапенемы следует рассматривать не как резервные средства, а как антибиотики первого ряда, так как прогноз у тяжелых больных может быть улучшен только в случае более раннего назначения адекватной антибактериальной терапии. К таким ситуациям прежде всего следует отнести инфекционные осложнения у больных в ОРИТ, находящихся на ИВЛ (особенно при APACHE II > 20), инфекции, вызванные P.aeruginosa и Acinetobacter spp., грамотрицательными бактериями (прежде всего Klebsiella spp., P.vulgaris), продуцирующими бета-лактамазы расширенного спектра, инфекции у больных с иммунодефицитом (фебрильная нейтропения), гнойный послеоперационный менингит, вызванный грамотрицательными бактериями или P.aeruginosa.
Аминогликозиды. Выделяют препараты трех поколений. АГ I поколения (стрептомицин, канамицин) в настоящее время применяются исключительно во фтизиатрии. АГ II поколения (гентамицин, тобрамицин) и III поколения (нетилмицин, амикацин (амикин, амицил)) широко применяются в клинической практике. АГ обладают широким спектром природной антимикробной активности, однако препараты слабо действуют на стрептококки и пневмококки и не активны в отношении анаэробных бактерий. Наиболее высокие значения МПК in vitro против грамотрицательных бактерий отмечаются у амикацина, однако это компенсируется более высокими дозами амикацина по сравнению с другими аминогликозидами и, соответственно, более высокими сывороточными концентрациями. Уровень приобретенной резистентности грамотрицательных бактерий существенно варьирует и различается между различными аминогликозидами. Устойчивость к аминогликозидам нарастает в следующем порядке: амикацин < нетилмицин < гентамицин = тобрамицин, т.е. штаммы грамотрицательных бактерий, резистентные к амикацину, будут также резистентны к другим аминогликозидам; штаммы, резистентные к нетилмицину, могут сохранять чувствительность к амикацину, но всегда будут устойчивы к гентамицину и тобрамицину. В отношении стафилококков эталонным аминогликозидом является гентамицин: при устойчивости стафилококков к гентамицину другие АГ также будут не активны.
К недостаткам аминогликозидов, ограничивающим их применение, следует отнести токсичность (нейротоксичность, ототоксичность, нефротоксичность), плохое проникновение в ткани бронхолегочной системы, снижение активности при гнойных процессах. С целью уменьшения нефротоксических эффектов целесообразно однократное введение суточной дозы аминогликозидов (данный подход не применяется при инфекционном эндокардите, нейтропении, у новорожденных). Учитывая указанные недостатки, АГ при внутрибольничных инфекциях следует применять только в комбинации с другими антибиотиками. В стационаре оптимально использовать два аминогликозида — гентамицин и амикацин. Первый рациональнее применять в отделениях общего профиля; амикацин из-за невысокого к нему уровня резистентности — в ОИТ, а также при псевдомонадных инфекциях. Нетилмицин не имеет существенных преимуществ по сравнению с амикацином, но стоимость его выше.
АГ применяются также в базовых схемах этиотропной терапии некоторых инфекций: Enterococcus faecalis: гентамицин + ампициллин (бензилпенициллин); Enterococcus faecium: гентамицин + ванкомицин (тейкопланин); Streptococcus viridans (эндокардит): гентамицин + бензилпенициллин (цефтриаксон); Pseudomonas aeruginosa: амикацин (гентамицин) + цефтазидим (цефоперазон, цефепим).
Фторхинолоны. Обладают широким спектром антимикробной активности. Наиболее высокую активность проявляют в отношении грамотрицательных бактерий, включая P.aeruginosa. Активность «старых» фторхинолонов в отношении стафилококков менее выражена, в отношении стрептококков и пневмококков — слабая. «Старые» ФХ характеризуются невысокой природной активностью в отношении анаэробов, поэтому при смешанных инфекциях целесообразна их комбинация с линкозамидами (линкомицин или далацин С) или метронидазолом. В последние годы появились ФХ с повышенной активностью против грамположительных и анаэробных бактерий (моксифлоксацин, гатифлоксацин (бигафлон), левофлоксацин (лефлоцин)).
В последние годы отмечается рост устойчивости госпитальных штаммов грамотрицательных бактерий к «старым» фторхинолонам, прежде всего у P.aeruginosa. Уровень устойчивости грамотрицательных бактерий к «ранним» фторхинолонам условно можно расположить в следующей последовательности: ципрофлоксацин (цифран) < офлоксацин (заноцин) = пефлоксацин < ломефлоксацин.
С «новыми» же фторхинолонами ситуация иная. По данным исследования TRUST, с 2000 по 2005 г. резистентность пневмококков к левофлоксацину изменилась с 0 до 0,5 %, в то время как к клиндамицину она возросла в 1,5 раза (с 12,1 до 18,6 %), а к амоксициллину/клавуланату — в 2 раза (с 6,5 до 12,9 %) [107]. Более того, если у S.pneumoniae выявлялась множественная резистентность, 99,1 % из них сохраняли чувствительность к левофлоксацину (к цефуроксиму — только 18,3 %, к азитромицину — 16,8 %) [107].
«Новые» фторхинолоны как уникальный класс антибактериальных препаратов имеют перед другими классами АБП определенные преимущества. Благодаря уникальному механизму действия (воздействие на генетический аппарат микробной клетки) бактерицидный эффект фторхинолонов не приводит к массивному высвобождению эндотоксинов (в отличие от АБП, разрушающих стенку микроорганизма), что чрезвычайно важно при лечении генерализованных инфекций, при которых массивное высвобождение эндотоксинов может привести к эндотоксическому шоку. «Новые» фторхинолоны (лефлоцин, бигафлон) обладают длительным периодом полувыведения и выраженным постантибиотическим эффектом, что позволяет назначать их 1 раз в сутки.
«Новые» фторхинолоны в отличие от β-лактамов эффективны в отношении как внеклеточных, так и внутриклеточных возбудителей и даже L-форм микроорганизмов, что позволяет использовать их для эмпирической АБТ в режиме монотерапии.
Моксифлоксацин (авелокс) — фторхинолон IV поколения, обладающий высокой активностью к грамположительным и грамотрицательным аэробным микробам, атипичным микроорганизмам и анаэробам, имеет наиболее сбалансированный антимикробный спектр среди всех антибактериальных препаратов в отношении внебольничных инфекций дыхательных путей, в режиме ступенчатой монотерапии может с успехом применяться для лечения внебольничной пневмонии, осложненной интраабдоминальной инфекции различной локализации, осложненной инфекции кожи и мягких тканей, воспалительных заболеваний органов малого таза. Моксифлоксацин обладает хорошим профилем безопасности и переносимостью.
Гатифлоксацин (бигафлон) — фторхинолон IV поколения, обладает повышенной активностью относительно анаэробов, сохраняя при этом высокую активность относительно спектра микроорганизмов, присущего ФХ более ранних поколений, что позволяет эффективно использовать его для лечения тяжелых госпитальных инфекций.
Благодаря хорошему проникновению практически во все органы и ткани «новые» фторхинолоны эффективно используются для лечения инфекций практически любой локализации.
Сравнительная характеристика «ранних» фторхинолонов представлена в приложении. ФХ в настоящее время рассматриваются как препараты второго ряда (после цефалоспоринов) при лечении различных госпитальных инфекций. При высоком же уровне устойчивости в стационаре грамотрицательных бактерий к цефалоспоринам ФХ используются в качестве средств первого ряда.
Гликопептиды. К гликопептидам относятся природные антибиотики — ванкомицин и тейкопланин. Ванкомицин применяется в клинической практике с 1958 г., тейкопланин — с середины 1980-х. В последние годы возрос интерес к гликопептидам в связи с увеличением частоты госпитальных инфекций, вызванных грамположительными микроорганизмами. В настоящее время гликопептиды являются препаратами выбора при инфекциях, вызванных метициллинрезистентными стафилококками, а также энтерококками, резистентными к ампициллину. В качестве средств эмпирической терапии гликопептиды применяются при катетер-ассоциированном сепсисе и у больных с фебрильной нейтропенией (на втором этапе терапии).
Гликопептиды обладают бактерицидным действием, однако в отношении энтерококков, некоторых стрептококков и коагулазонегативных стафилококков они действуют бактериостатически. Гликопептиды обладают активностью в отношении грамположительных аэробных и анаэробных микроорганизмов: стафилококков (включая метициллинрезистентные штаммы), стрептококков, пневмококков (включая штаммы, резистентные к пенициллину), энтерококков, пептострептококков, листерий, коринебактерий, клостридий (включая C.difficile). В отношении грамотрицательных микроорганизмов гликопептиды не активны, так как не проникают через их клеточную стенку. Спектр антимикробной активности ванкомицина и тейкопланина сходен, однако имеются некоторые различия в уровне природной активности и приобретенной резистентности. Тейкопланин проявляет in vitro более высокую активность в отношении золотистого стафилококка (в том числе штаммов, резистентных к метициллину), различных видов стрептококков (включая S.pneumoniae) и энтерококков. Ванкомицин in vitro более активен в отношении коагулазонегативных стафилококков. В отношении анаэробных кокков и клостридий активность препаратов одинаковая.
Приобретенная резистентность к гликопептидам у грамположительных бактерий развивается редко. В то же время в процессе применения тейкопланина может отмечаться снижение чувствительности к нему стафилококка и даже развитие резистентности. Период полувыведения ванкомицина составляет 6–8 ч, тейкопланина — от 40 до 120 ч в зависимости от метода его определения. Большой период полувыведения объясняет возможность назначения тейкопланина однократно в сутки. Ванкомицин и тейкопланин выводятся почками путем гломерулярной фильтрации, поэтому у больных с почечной недостаточностью требуется коррекция их режима дозирования. Препараты не удаляются при гемодиализе. Диапазон терапевтических концентраций гликопептидов в крови: ванкомицин — максимальные (через 0,5 ч) — 20–50 мг/л, минимальные (перед очередным введением) — 5–10 мг/л; тейкопланин — максимальные — 20–40 мг/л, минимальные — 5–15 мг/л.
Побочные эффекты гликопептидов. Нефротоксичность: обратимое нарушение функции почек (увеличение креатинина и мочевины в крови, анурия) наблюдается при применении ванкомицина в 5 % и более случаев; частота зависит от дозы и длительности применения препарата, возраста больных; риск увеличивается при сочетанном применении с аминогликозидами или петлевыми диуретиками и при превышении концентраций ванкомицина в крови свыше 10 мг/л. При применении тейкопланина нарушение функции почек отмечается реже. Ототоксичность: снижение слуха, вестибулярные нарушения (у больных с нарушенной функцией почек). Нейротоксичность: головокружение, головная боль.
Реакции при внутривенном введении: покраснение лица и верхней части туловища, кожный зуд, боль за грудиной и тахикардия, иногда — гипотензия в результате высвобождения гистамина из тучных клеток, наблюдающегося при быстром внутривенном введении ванкомицина. На фоне применения тейкопланина эти реакции практически не наблюдаются.
Возможны также другие нежелательные реакции: флебиты, боль, жжение в месте введения, обратимая лейкопения, тромбоцитопения, транзиторное повышение трансаминаз, щелочной фосфатазы. Наиболее хорошо изученным и широко применяемым является ванкомицин. Ванкомицин применяется в следующих случаях:
— документированная инфекция различной локализации, вызванная метициллинрезистентными стафилококками (пневмония, инфекция кожи и мягких тканей, мочевыводящих путей, костей и суставов, перитонит, инфекционный эндокардит, сепсис);
— стафилококковые инфекции различной локализации при аллергии к пенициллинам и цефалоспоринам;
—тяжелые инфекции, вызванные чувствительными штаммами Enterococcus faecium, Enterococcus faecalis, Corynebacterium jejkeium;
— инфекционный эндокардит, вызванный Streptococcus viridans и S.bovis (при аллергии к бета-лактамным антибиотикам), E.faecalis (в комбинации с гентамицином);
— менингит, вызванный пенициллинрезистентными штаммами S.pneumoniae;
— в качестве средства эмпирической терапии жизнеопасных инфекций при подозрении на стафилококковую этиологию;
— инфекционный эндокардит трикуспидального клапана или протезированного клапана (в сочетании с гентамицином);
— катетер-ассоциированный сепсис;
— посттравматический или послеоперационный менингит (в сочетании с цефалоспоринами III поколения или фторхинолонами);
— перитонит при перитонеальном диализе;
— фебрильная нейтропения (при неэффективности стартовой терапии).
Ванкомицин назначается также внутрь при антибиотик-ассоциированной диарее, вызванной Clostridium difficile. Ванкомицин назначается только внутривенно в виде медленной инфузии в течение 60–120 мин. У взрослых ванкомицин назначают по 1 г с интервалом 12 ч. У больных с нарушенной функцией почек дозу ванкомицина корректируют с учетом клиренса креатинина. При терминальной почечной недостаточности препарат вводят в дозе 1 г с интервалом 7–10 дней. При лечении псевдомембранозного колита, вызванного C.difficile, ванкомицин назначают внутрь в дозе 0,125 г каждые 6 ч (для приготовления раствора препарата порошок разводят в 30 мл воды; возможно использование сиропов или других добавок для улучшения вкусовых качеств).
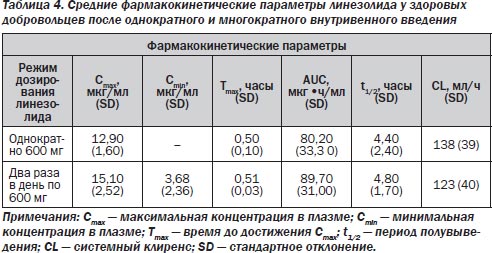
Оксазолидиноны. Линезолид (зивокс) — первый представитель нового класса синтетических антимикробных средств — оксазолидинонов. Механизм действия связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, зивокс воздействует на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъединицей рибосом), в результате чего нарушается процесс образования 70S-комплекса и формирования пептидной цепи. Благодаря уникальному механизму действия не отмечается перекрестной устойчивости микроорганизмов к зивоксу и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, АГ, тетрациклины и хлорамфеникол).
Принципиальным моментом в назначении линезолида является наличие в отделении метициллинрезистентного стафилококка (MRSA-штаммов), резистентность к гликопептидам (ванкомицину), наличие ванкомицинрезистентных штаммов энтерококков. Линезолид применяется при тяжелых нозокомиальных и вентилятор-ассоциированных пневмониях. Постантибиотический эффект (ПАБЭ) in vitro для Staphylococcus aureus составляет примерно 2 часа. На экспериментальных моделях у животных ПАБЭ in vivo составлял 3,6–3,9 часа для Staphylococcus aureus и Streptococcus pneumoniae соответственно.
К линезолиду чувствительны такие микроорганизмы:
— грамположительные аэробы: Corynebacterium jeikeium, Enterococcus faecalis (включая гликопептидрезистентные штаммы, Enterococcus faecium (гликопептидрезистентные штаммы), Enterococcus casseliflavus, Enterococcus gallinarum, Listeria monocytogenes, Staphylococcus aureus (включая MRSA-штаммы), Staphylococcus epidermidis, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus intermedius, Streptococcus pneumoniae (включая штаммы с перекрестной чувствительностью к пенициллину и пенициллинрезистентные штаммы); Streptococcus pyogenes, стрептококки группы Viridans, стрептококки группы С;
— грамотрицательные аэробы: Pasteurella canis, Pasteurella multocida;
— грамположительные анаэробы: Clostridium perfringens, Peptostreptococcus anaerobius, Peptostreptococcus spp.;
— грамотрицательные анаэробы: Bacteroidesfragilis, Prevotella spp.;
— другие: Chlamydia pneumoniae.
Умеренно чувствительные микроорганизмы: Legionella spp., Moraxella catarrhalis, Mycoplasma spp.
Резистентные микроорганизмы: Neisseria spp., Pseudomonas spp.
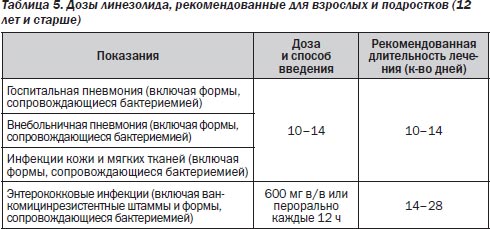
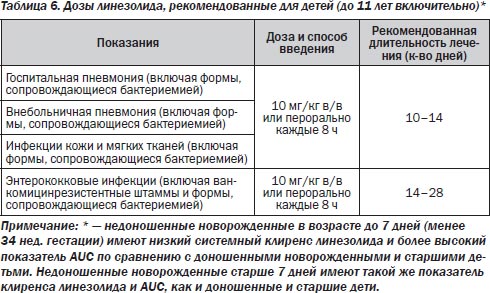
Линезолид метаболизируется в печени путем окисления с образованием двух метаболитов, обладающих очень слабой антибактериальной активностью. Применяется для лечения инфекций различной локализации у взрослых и детей, вызванных грамположительными микроорганизмами (стафилококками, пневмококками, энтерококками):
— тяжелая внебольничная или госпитальная пневмония;
— осложненные инфекции кожи и мягких тканей;
— неосложненные инфекции кожи и мягких тканей в амбулаторной практике;
— осложненные инфекции мочевыводящих путей;
— бактериемия или сепсис;
— интраабдоминальные инфекции;
— инфекционный эндокардит.
Линезолид оказывает слабое действие на грамотрицательные бактерии, поэтому при выделении последних следует к лечению присоединить цефалоспорин III–IV поколения или фторхинолон. В качестве средства эмпирической терапии может рассматриваться как средство выбора при тяжелых инфекциях — остеомиелите, эндокардите или протезировании клапана, катетер-ассоциированной бактериемии или сепсисе, перитоните у больных на постоянном амбулаторном перитонеальном диализе. У больных с нейтропенической лихорадкой может назначаться на втором этапе лечения при неэффективности стартовой терапии. В стационарах с высокой частотой MRSA линезолид может рассматриваться в качестве средства эмпирической терапии тяжелых больных (ОРИТ, пневмония на ИВЛ, гемодиализ, ожоговая травма).
Особыми показаниями для назначения линезолида в качестве средства этиотропной терапии являются:
— инфекции любой локализации, вызванные MRSA;
— инфекции, вызванные энтерококками, устойчивыми к ампициллину;
— инфекции, вызванные E.faecium, устойчивым к ванкомицину;
— тяжелые инфекции, вызванные S.pneumoniae, устойчивым к пенициллину и цефалоспоринам III поколения, прежде всего менингит и сепсис.
Бактерицидные макролиды
Макролиды-азалиды — азитромицин: наименее токсичный антибиотик, активность в отношении грамположительных кокков и внутриклеточных возбудителей — хламидий, микоплазм, кампилобактерий, легионелл.
Макролиды-кетолиды — эритромицин-ацистрат: высокая активность против энтерококков, в том числе нозокомиальных, ванкомицинрезистентных штаммов, микобактерий, бактероидов.
Бактериостатические макролиды: препараты широкого спектра, имеют длительный период полувыведения, можно вводить 1–2 р/сут, широкое применение в лечении токсоплазмоза и профилактики менингита, активность в отношении хламидий и легионелл.
I поколение — эритромицин, олеандомицин.
II поколение — спиромицин, рокситромицин, мидекамицин, джозамицин, диритромицин, кларитромицин (клацид), китазамицин.
Общие свойства макролидов:
1. Преимущественно бактериостатическое действие.
2. Активность против грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы).
3. Высокие концентрации в тканях (в 5–10–100 раз выше плазменных).
4. Низкая токсичность.
5. Отсутствие перекрестной аллергии с β-лактамами.
Среди макролидов особого внимания заслуживает кларитромицин (клацид) как единственный из новых макролидов, имеющий внутривенную форму введения. Данное обстоятельство позволяет его использовать при лечении неосложненной внегоспитальной пневмонии или как препарат 2-го ряда при терапии госпитальной пневмонии. Однако, по последним сообщениям, детального рассмотрения заслуживает проблема устойчивости S.pneumoniae к макролидным антибиотикам. Устойчивость пневмококков к макролидам (также как и пиогенных стрептококков) может быть обусловлена либо ферментативной модификацией мишени действия (метилированием рибосомальной РНК), либо активным выведением препаратов из микробной клетки. При первом механизме наблюдают полную перекрестную устойчивость между всеми макролидами, при втором — пневмококки проявляют устойчивость к 14- и 15-членным макролидам при чувствительности к 16-членным. Между всеми включенными в Alexander Project макролидами наблюдали полную перекрестную резистентность. Вторым практически важным фактом является наличие ассоциации между устойчивостью к пенициллину и макролидам. Это наблюдение находит полное подтверждение во всех исследованиях, посвященных антибиотикорезистентности пневмококков. Тревожным фактом является также стабильный рост устойчивости к макролидам (в некоторых европейских странах устойчивость к макролидам выше, чем к пенициллину). Причем нарастание устойчивости коррелирует с увеличением потребления современных макролидов с пролонгированной фармакокинетикой (азитромицина и кларитромицина). Для макролидов традиционные и фармакодинамически обоснованные критерии чувствительности совпадают. Следовательно, есть все основания предполагать наличие у этих антибиотиков высокой бактериологической эффективности при пневмококковых инфекциях, вызванных чувствительными штаммами. Имеющиеся клинические данные находятся в полном соответствии с этим предположением. В то же время нерешенным является вопрос о клинической эффективности 14- и 15-членных макролидов при инфекциях, вызываемых пневмококками с устойчивостью, обусловленной активным выведением. Ряд наблюдений свидетельствует о том, что при пневмониях, вызываемых такими микроорганизмами, клиническая эффективность 14- и 15-членных макролидов сохраняется. Обсуждаются предложения о пересмотре критериев чувствительности пневмококков к макролидам (увеличение значения пограничной МПК эритромицина от 1 до 8 или 16 мкг/мл). Таким образом, как для β-лактамов, так и для макролидов микробиологическая устойчивость далеко не всегда означает неудачу в лечении.
Список литературы находится в редакции