Журнал «Медицина неотложных состояний» 1-2(32-33) 2011
Вернуться к номеру
Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии
Авторы: Никонов В.В., Савицкая И.Б., Харьковская медицинская академия последипломного образования, кафедра медицины неотложных состояний и медицины катастроф
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
В статье рассмотрены современные взгляды на патогенез постгипоксической энцефалопатии и возможности ее лечения. Проведено комплексное обследование 73 больных с постгипоксической энцефалопатией. Изучены клинико-неврологические проявления, показано превалирование когнитивных нарушений. Представлен сравнительный анализ эффективности холина альфосцерата (Глиатилина) и стандартной терапии в лечении постгипоксической энцефалопатии. Показаны преимущества Глиатилина: вызывает заметное субъективное улучшение у пациентов, уменьшение эмоциональных и когнитивных нарушений, приводит к реституции патологической неврологической симптоматики.
Постгипоксическая энцефалопатия, когнитивные нарушения, холина альфосцерат, Глиатилин.
Постгипоксическая энцефалопатия представляет собой совокупность неврологических и психических нарушений, которые возникают после воздействия гипоксии различной длительности и выраженности.
Гипоксия может возникнуть как при недостаточном содержании кислорода в окружающей атмосфере, так и при некоторых патологических состояниях: при нарушениях мозгового кровообращения, шоковых состояниях, острой сердечно-сосудистой недостаточности, поперечной блокаде сердца, отравлении окисью углерода и при асфиксии различного происхождения. Гипоксия головного мозга может возникать как осложнение при операциях на сердце и магистральных сосудах, а также в раннем послеоперационном периоде. Наиболее тяжело она протекает у лиц, перенесших остановку системного кровотока с последующей реанимацией, терминальное состояние с частичной или полной остановкой кровообращения.
Свободно-радикальные процессы и структурно-функциональные изменения свойств биомембран являются базисными механизмами реанимационной и постреанимационной патологии, требующей ранней коррекции (В.А. Неговский, A.M. Гурвич, Е.С. Золотокрылина, 1986). Известно, что в мозге 90 % энергии, необходимой как для поддержания его функциональной активности, так и для осуществления пластических процессов, обеспечивается за счет аэробного гликолиза и только 10 % — за счет анаэробного гликолиза. На 100 г своей массы в 1 мин мозг потребляет от 20,5 до 35,8 % общего расхода кислорода в организме (В.В. Сучков, 1982). Величина потребления кислорода мозгом, равная 20 мл/(100 г • мин), является критической и находится на грани несовместимости с жизнью. Собственные запасы кислорода в мозге ничтожны. Нейроны весьма чувствительны к дефициту кислорода. Так, ткань головного мозга переносит полную гипоксию в течение 3–5 мин, малые пирамидные клетки мозжечка — 8 мин, клетки Пуркинье — 13 мин, клетки центров продолговатого мозга — 20–30 мин, спинного мозга — 60 мин, симпатических узлов — 60 мин, нервных сплетений кишечника — 180 мин (К.П. Иванов, 1974). Через 190 с после прекращения поступления кислорода в мозг возникают его необратимые изменения (В.И. Салалыкин, А.И. Арутюнов, 1978).
В клинической практике встречаются следующие виды постгипоксической энцефалопатии:
— первичные диффузные (снижение уровня О2 вследствие дыхательной недостаточности, расстройств альвеолярной диффузии и оксигенации, клинической смерти);
— вторичные циркуляторные (нарушение циркуляции и объема циркулирующей крови — низкий сердечный выброс, гипотензия, кровопотеря);
— вторичные токсические (эндо- и экзотоксины, тяжелые соматические заболевания);
— локальные ишемии и вторичные гипоксии.
Являясь типовым и неспецифическим патологическим процессом, гипоксия в той или иной степени сопровождает многие формы патологии мозга. При ишемии и сопутствующей гипоксии возникает сложный комплекс патологических изменений, включающих отсутствие снабжения глюкозой и действие местно образующихся веществ, которые «не убираются» кровотоком. В популяции нейронов возникают взаимосвязанные экстра- и внутриклеточные процессы, являющиеся триггерным механизмом запуска событий, приводящих в итоге к дегенерации и гибели нейронов (Г.Н. Крыжановский, 1997), быстро наступают критические изменения метаболизма нейронов. В условиях гипоксии ингибируется цикл Кребса, энергодефицит быстро приводит к повреждению трансмембранного транспорта ионов. Высвобождается токсичный для мозга глутамат, избыток его усугубляет нарушение ионного транспорта, возникают условия для развития цитотоксического отека мозга. Альтерация мембран способствует выходу протеаз из клеточных органелл. Начинается аутолиз, образуется порочный круг. Гипоксия запускает оксигеназный путь утилизации кислорода, возникают чрезвычайно агрессивные синглетные формы кислорода — свободные радикалы. Процесс становится лавинообразным. Повышается вязкость мембран, утрачивается их пластичность. Это еще более усиливает нарушения оксигенации. Наряду с этим альтерация вызывает и активацию генов, ответственных за программируемую гибель клетки — апоптоз. Все названные процессы перекрещиваются, повторяются и взаимозависимы (Д.В. Садчиков, 2007).
В формировании патологических изменений в мозге при постгипоксической энцефалопатии участвуют все уровни его организации и молекулярные механизмы, способные осуществлять фиксацию патологической информации за счет активации быстро и длительно действующих систем коммуникации нейронов и реализации их в тех или иных клинических синдромах.
Клинические синдромы постгипоксической энцефалопатии являются чаще всего результатом дезинтеграции совокупного ионотропного (ГАМК-рецепторы и никотиновые, ацетилхолиновые рецепторы) и метаболитотропного (катехоламиновые, серотониновые, мускариновые рецепторы) воздействия, характеризующегося формированием генераторов патологического нейронального возбуждения, которое может носить как кратковременный, так и длительный характер и являться, по мнению Г.Н. Крыжановского (1997), ключевым звеном в процессе образования устойчивых патологических систем мозга. В постаноксическом периоде создаются структурно-метаболические предпосылки изменения условий интегративно-пусковой деятельности нейронов.
В клинической картине у лиц, перенесших гипоксическое поражение мозга, в ходе критического состояния можно выделить ряд основных синдромов неврологических расстройств. К ним относят: неврозоподобный синдром, синдром нейроциркуляторной дистонии, интеллектуально-мнестические нарушения, мозжечковый, пирамидный, экстрапирамидный, эпилептиформный, психоорганический синдромы, акинетический мутизм, персистирующее вегетативное состояние. Наиболее частый и ранний симптомокомплекс представлен когнитивными нарушениями.
Реальным способом коррекции и предупреждения этих расстройств является соблюдение основных стратегических принципов терапии:
— контроль и лечение неврогенных дыхательных расстройств;
— контроль и лечение внутричерепной гипертензии;
— ранняя диагностика и эффективная терапия расстройств интегративной деятельности мозга;
— диагностика и лечение основных неосложненных неврологических расстройств;
— лечение тяжелых неврологических осложнений вследствие поражения внутренних органов.
В настоящее время в арсенале практического невролога и реаниматолога для лечения постгипоксической энцефалопатии в структуре различных критических состояний есть большой спектр сосудистых, вазоактивных препаратов. Однако при критических уровнях гипоксии эта терапия несостоятельна и требует введения нейрометаболических препаратов, которые повышают выживаемость нейронов, воздействуя на непосредственные механизмы церебрального повреждения (процессы перекисного окисления липидов, эксайтотоксичность и др.). К препаратам нейрометаболического действия относятся производные пирролидона (пирацетам и др.), пептидергические и аминокислотные препараты (актовегин, церебролизин, кортексин, семакс), предшественники нейромедиаторов (холина альфосцерат).
Одним из наиболее известных и широко применяемых нейрометаболических средств является фармакологический представитель холина альфосцерат — Глиатилин. Глиатилин выпускают в капсулах (400 мг холина альфосцерата) и в растворе для инъекций по 4 мл в ампулах (1 ампула содержит 1000 мг холина альфосцерата).
Препарат представляет собой соединение, которое способно проникать через гематоэнцефалический барьер. Механизм действия препарата основан на том, что при попадании в организм под действием ферментов происходит его расщепление на холин и глицерофосфат: холин участвует в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения; глицерофосфат является предшественником фосфолипидов (фосфатдихолина) мембраны нейронов. Кроме того, Глиатилин участвует в анаболических процессах, ответственных за мембранный фосфолипидный и глицеролипидный синтез, оказывая положительное влияние на функциональное состояние мембранных структур клеток, улучшает цитоскелет нейронов и увеличивает массу нейрональных органелл (М.М. Одинак и соавт., 2009).
Глиатилин улучшает передачу нервных импульсов в холинергических нейронах, положительно воздействует на пластичность нейронных мембран и функцию рецепторов.
При введении Глиатилина в среднем абсорбируется практически 88 % дозы. Препарат накапливается преимущественно в головном мозге (45 % от концентрации препарата в крови), легких и печени. Выведение препарата происходит главным образом через легкие, только 15 % — через почки и кишечник. При применении Глиатилина, по данным многочисленных международных исследований, улучшалось настроение, исчезала эмоциональная неустойчивость, раздражительность и апатия. Глиатилин активизирует умственную деятельность, улучшает состояние когнитивных функций, а также ряда поведенческих и познавательных функций у больных мягкой и умеренной деменцией альцгеймеровского типа.
Эффективность препарата была показана во многих мультицентровых международных исследованиях при лечении больных с острыми нарушениями мозгового кровообращения, черепно-мозговой травмой и с когнитивными нарушениями сосудистого и нейродегенеративного генеза.
Цель настоящей работы — исследование эффективности препарата Глиатилин (капсулы) у больных с постгипоксической энцефалопатией, возникшей в результате различных критических ситуаций.
Обследовано 73 больных, которые находились на лечении в отделениях общей реанимации и реанимации политравмы. Причиной постгипоксической энцефалопатии в 58 % случаев послужила длительная гипотензия (травматический шок), связанная с травматическим поражением скелета и внутренних органов, в 18 % случаев — выраженная дыхательная недостаточность (тяжелые внегоспитальные и госпитальные пневмонии). В 15 % случаев гипоксическая кома была связана с общим длительным переохлаждением, и у 9 % больных постгипоксическая энцефалопатия возникла после проведения успешных реанимационных мероприятий (остановка эффективного кровообращения разной этиологии). Диагноз устанавливался по модифицированной классификации Е.В. Шмидта, все больные были с проявлениями легкой (компенсированной) постгипоксической энцефалопатии. Возраст обследованных больных составлял 48,4 ± 3,6 года, то есть лица трудоспособного возраста. Преобладали мужчины (63,8 %).
Обследованные больные были разделены на две группы. В первую (основную) группу вошли 38 больных, которые, кроме общепринятой терапии, получали Глиатилин по 1200 мг в сутки внутрь. Вторую (контрольную) группу составили 35 больных с аналогичными по тяжести проявлениями постгипоксической энцефалопатии, получавших стандартную терапию.
Всем пациентам проводили клинические неврологические обследования, в процессе которых обращали внимание на жалобы, анамнез, наличие органической микросимптоматики и умеренных неврологических синдромов, свидетельствующих о признаках недостаточности кровообращения. Для оценки неврологического статуса в целом использовали шкалу Е.И. Гусева и В.И. Скворцовой.
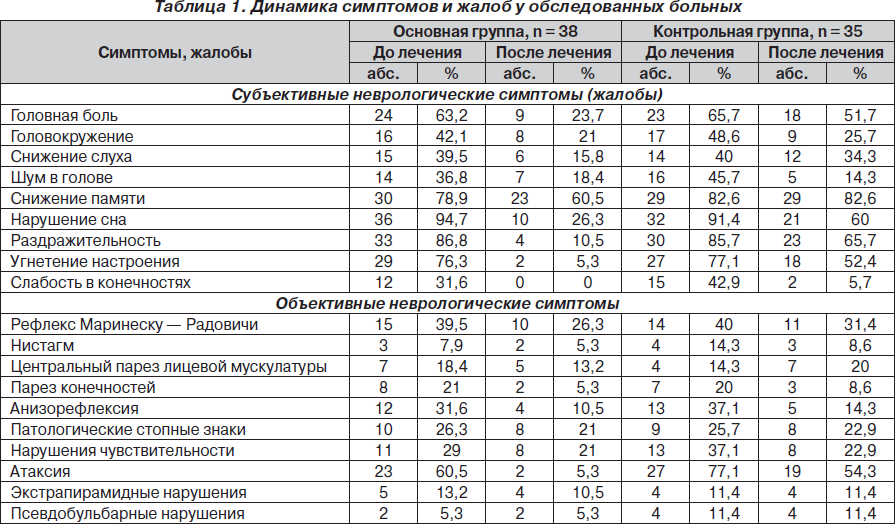
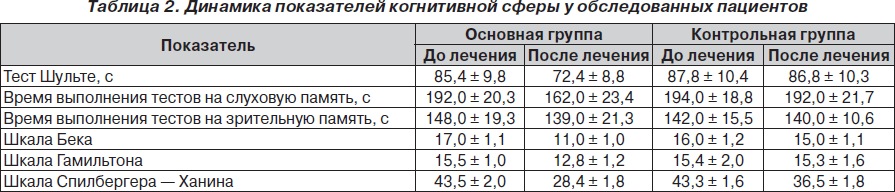
Обследование больных проводили тщательно, с использованием клинико-неврологических и инструментальных методов исследования (табл. 1). Эффективность лечения оценивали с учетом восстановления неврологических и когнитивных функций. Общее нейропсихологическое исследование проводили по общепринятой методике А.Р. Лурия. Память исследовали в динамике с помощью тестов на запоминание и воспроизведение списка из 15 слов, на непроизвольное запоминание при предъявлении, на запоминание и воспроизведение двух серий не связанных между собой элементов в зрительной и слуховой рецепции. Умственную работоспособность оценивали с помощью пробы Шульте, в том числе учитывали время, затраченное на выполнение предложенных заданий. Для оценки депрессивных расстройств использовали шкалы Бека и Гамильтона, а для оценки тревожности — шкалу Спилбергера — Ханина.
Записи ЭЭГ осуществляли по общепринятой методике на компьютерном комплексе.
В неврологическом статусе у всех пациентов с относительно компенсированной постгипоксической энцефалопатией имели место микроочаговая симптоматика в виде нарушений черепной иннервации (ослабление конвергенции, горизонтальный нистагм, сглаженность носогубных складок, девиация кончика языка, гипестезия лица), симптомы орального автоматизма, координаторные и пирамидные нарушения. Анализ жалоб и неврологического статуса показал, что наиболее показательными были жалобы на головную боль, головокружение, шум в ушах, снижение памяти, раздражительность. Обращали на себя внимание расстройства когнитивной сферы.
При нейропсихологическом исследовании у больных обеих групп выявлено достоверное снижение кратковременной памяти. Особенно это было выражено у пациентов, перенесших остановку эффективного кровообращения (табл. 2).
Анализ неврологического статуса больных, получавших Глиатилин, показал, что у всех пациентов на фоне лечения достоверно регрессировала выраженность жалоб на раздражительность, снижение памяти, снижение фона настроения, нарушения сна, головную боль, головокружение, а также значительно уменьшились депрессивные ощущения, эмоциональная неустойчивость.
Динамика объективных неврологических симптомов (табл. 1) свидетельствует о статистически достоверном уменьшении пирамидных, атактических, чувствительных нарушений, однако сохранялись псевдобульбарные, экстрапирамидные нарушения, что, вероятно, можно объяснить стойкими морфологическими изменениями вещества головного мозга под воздействием гипоксии, особенно выраженными у больных, перенесших остановку эффективного кровообращения.
Когнитивные нарушения достоверно нивелировались при применении Глиатилина в основной группе, что подтверждено статистически достоверным уменьшением времени выполнения пробы Шульте, улучшением выполнения теста на объем свободного запоминания, уменьшением результирующего времени выполнения тестов на память как в зрительной, так и слуховой рецепции, увеличением речевой активности больных, что существенно ускорило процесс выздоровления.
При анализе ЭЭГ оценивали изменения как визуально, так и с помощью компьютерной обработки полученных результатов. Исследования проводились не менее двух раз (до и после лечения). В отдельных случаях, при наличии показаний, количество динамических контрольных исследований увеличивалось.
Анализ полученных данных включал характеристику всех ритмов, выявленных на ЭЭГ, с оценкой регулярности фонового ритма, равномерности, частоты и амплитуды последних, определение наличия зональных различий, синхронизации и латерализации ритма, наличия нарушений реактивности, а также наличия или отсутствия патологических колебаний и пароксизмальной активности. Исходя из оценки структуры и регулярности основных волновых процессов ЭЭГ, для обобщенной характеристики биоэлектрической активности головного мозга при визуальном анализе мы воспользовались единой классификацией неизмененной и измененной ЭЭГ, предложенной Е.А. Жирмунской. Выявленные изменения на ЭЭГ у обследованных больных представлены в табл. 3.
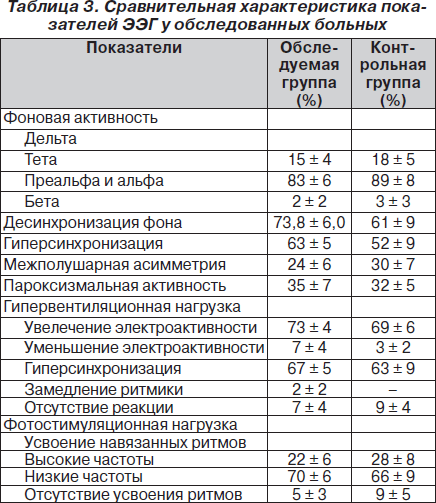
Фоновая активность была представлена преимущественно альфа-диапазоном (у 83 % пациентов). У части больных (17 %) на фоновой кривой преобладали волны тета-диапазона.
Однако у большинства обследованных (73,8%) значительное количество преобладающих волн на фоновой кривой носило дезорганизованную форму, что указывает на функциональные нарушения биоэлектрической активности головного мозга. Такая дезорганизация основного ритма сочеталась с увеличением вольтажа в 1,8 раза по сравнению с нормальными показателями, характерными для каждой группы, заострением ритмики и наличием пароксизмальной активности. Это сочетание расценивалось нами как диффузные изменения биоэлектрической активности головного мозга различной степени выраженности. Определенное значение мы придавали и показателям межполушарной асимметрии. В большинстве случаев величина межполушарной асимметрии по всем диапазонам (76 %) не превышала 10 %, что, по данным ряда авторов, является допустимым пределом для констатации отсутствия очаговости изменений электроэнцефалографических характеристик (р < 0,005). Следует отметить при этом, что межполушарная асимметрия в подавляющем большинстве наиболее была выражена в диапазоне, преобладающем на фоновой кривой, что в некоторой степени может указывать на функциональные сдвиги в нормальном взаимодействии лимбических структур головного мозга в условиях гипоксии головного мозга.
Учитывая, что в отдельных случаях в условиях обычной записи патологические формы колебаний могут не обнаруживаться, нами уделялось не меньшее внимание и анализу функциональных нагрузок. При проведении трехминутной гипервентиляционной нагрузки уровень электроактивности в 93,7 % случаев увеличивался на 5–15 % от уровня фона с явлениями заостренности основного ритма и явлениями гиперсинхронизации, а также отмечалось появление билатерально-синхронных вспышек медленных волн преимущественно в теменно-височных отведениях, что, по нашему мнению, связано с повышением активирующего влияния ретикулярной формации. С другой стороны, эти изменения характеризуют усиление активности в синхронизирующих структурах мозга. Другими словами, наблюдается сложная мозаичность взаимодействий синхронизирующих и десинхронизирующих структур мозга на подкорковом уровне, что обусловлено, по нашему мнению, воздействием гипоксии того или иного генеза на головной мозг.
При проведении фотостимуляционной нагрузки выявлено наибольшее усвоение навязанных ритмов световых мельканий с перемещением акцента в сторону низких частот с преимущественным пространственным перемещением в передние отделы головного мозга (в зоне проекции неспецифической таламической системы), что также отражает патологическое состояние стволово-диэнцефальных структур мозга и является следствием вторичных патологических влияний на кору головного мозга.
На основе визуального анализа ЭЭГ в контрольной группе у 68 % больных доминировали 1, 2 и 3-я группы ЭЭГ, нередко (у 20 %) встречались кривые 4–6-й группы, еще реже (у 12 %) — 9-я и 11-я группы, межполушарной асимметрии при этом не отмечалось. Чаще всего выявлялся первый хорошо организованный тип ЭЭГ (у 78 % пациентов). Медленные формы активности (дельта- и тета-), имея малую амплитуду, обнаруживались лишь в передних отделах мозга, бета-активность, как правило, отсутствовала (у 88 %). Зональные различия выражены были хорошо у 92 % обследуемых больных. Отсутствие реакции при функциональных нагрузках практически не наблюдалось и было выявлено лишь у 8 испытуемых. Таким образом, обнаруженные изменения на ЭЭГ свидетельствуют преимущественно о стволовой локализации диффузных изменений биоэлектрической активности головного мозга и характеризуют неравномерность и дисбаланс активирующих влияний в различных подсистемах диэнцефальных структур головного мозга больных постгипоксической энцефалопатией.
Анализ фоновой ритмики показал значительное уменьшение явлений дезорганизации с формированием устойчивых зональных различий и оптимизацией относительной мощности спектра ритмов биоэлектрической активности головного мозга после проведения лечения.
На представленных ЭЭГ достоверно чаще появлялись ритмы, характерные для вариантов нормы. Отмечалось формирование регулярного альфа-ритма, уменьшение количества острых волн, тенденцией к исчезновению генерализованных билатерально-синхронных вспышек острых волн, уменьшение индексов пароксизмальной активности. Отмечалось адекватное усвоение навязанных ритмов световых мельканий.
Имеющиеся изменения биоэлектрической активности головного мозга на фоне гипервентиляционной нагрузки свидетельствовали о сохранности признаков дисфункции срединно-стволовых структур мозга. Время восстановления обычной фоновой ритмики значительно уменьшалось (р < 0,05), что может подтверждать нормализацию биоэлектрической активности головного мозга в процессе лечения.
Таким образом, электроэнцефалографические изменения у больных постгипоксической энцефалопатией в зависимости от степени гипоксического поражения мозга при отсутствии выраженных клинических проявлений поражения ЦНС могут иметь большое диагностическое значение при обследовании, а также могут свидетельствовать об эффективности проводимой терапии.
Таким образом, холина альфосцерат (Глиатилин):
— вызывает заметное субъективное улучшение у пациентов с постгипоксической энцефалопатией: улучшение общего состояния, увеличение общей двигательной активности, уменьшение и исчезновение головных болей и головокружения, уменьшение эмоциональных и депрессивных нарушений;
— приводит к реституции патологической неврологической симптоматики: вестибулярных, чувствительных, пирамидных нарушений;
— вызывает перестройку функциональных систем, генерирующих альфа-, бета-, дельта-, тета-ритмы, качественно различную у больных с различными исходными типами ЭЭГ-нарушений.
Все эти влияния Глиатилина, на наш взгляд, создают благоприятную основу для проведения физической, психической и социальной реабилитации больных, находящихся в критическом состоянии. Вот почему столь убедительно звучит высказывание В.А. Неговского (1986 г.) о том, что «значение полноценного восстановления функций центральной нервной системы столь велико, что современную реанимацию с достаточным основанием можно назвать также и неврологической наукой».
Восстановление функций мозга является основной и наиболее сложной задачей реаниматологии. Профилактику и терапию патологии мозга реанимационных больных следует начинать как можно раньше и осуществлять практически одновременно с мерами, направленными на восстановление функций дыхания и кровообращения. Нейрометаболическая терапия (с включением в программу лечения холина альфосцерата) должна быть максимально ранней и максимально активной и должна рассматриваться как церебропротекторная стратегия при критических состояниях.
1. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция / Под ред. Н.Н. Яхно. — М., 2002. — С. 85.
2. Левин О.С., Дамулин И.В. Диффузные изменения белого вещества (лейкоареоз) и проблема сосудистой деменции // Достижения в нейрогериатрии / Под ред. Н.Н. Яхно, И.В. Дамулина. — М.: Изд-во ММА им. И.М. Сеченова, 1995. — С. 189-231.
3. Преображенская И.С., Яхно Н.Н. Сосудистые когнитивные нарушения: клинические проявления, диагностика, лечение // Неврологический журнал. — 2007. — Т. 12, № 5. — С. 45-50.
4. Селезнева Н.Д., Колыхалов И.В., Герасимов Н.П., Жариков Г.А., Гаврилова С.И. Применение глиатилина для лечения деменций альцгеймеровского типа // Социальная и клиническая психиатрия. — 1998. — № 4. — С. 42-51.
5. Яхно Н.Н., Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии // Неврологический журнал. — 2004. — № 2. — С. 30-35.
6. Лужников Е.А., Костомарова Л.Г. Острые отравления. — М.: Медицина, 1989. — 432 с.
7. Рябов Г.А. Синдромы критических состояний. — М.: Медицина, 1994. — 368 с.
8. Новиков Г.Д., Суворов А.В., Макаров И.А. Затянувшиеся комы при острых отравлениях // Клинические аспекты постгипоксических энцефалопатий. Реабилитация коматозных и посткоматозных состояний: Мат. науч.-практ. конф. — М. — 1992. — С. 95-96.
9. Неговский В.А., Гурвич А.М., Золотокрылина Е.С. Постреанимационная болезнь. — М.: Медицина, 1987. — 479 с.
10. Смирнов А.В., Криворучко Б.И. Гипоксия и ее фармакологическая коррекция — одна из ключевых проблем анестезиологии и интенсивной терапии // Анестезиология и реаниматология. — 1997. — № 3. — C. 97-98.
11. Рябов Г.А. Гипоксия критических состояний. — М.: Медицина, 1988. — 287 с.
12. Зильбер А.П. Медицина критических состояний. — Петрозаводск: Издательство ПГУ, 1995. — 359 с.
13. Dubois B., Slachevsky A., Litvan I., Pillon B. The FAB: a frontal assessement battery at bedside // Neurology. — 2000. — V. 55. — P. 1621-1626.
14. Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment // Stroke. — 2004. — Vol. 35. — P. 1010-1017.
15.Erkinjuntti T., Roman G., Gauthier S. Treatment of vascular dementia-evidence from clinical trials with cholinesterase inhibitors // J. Neurol. Sci. — 2004. — Vol. 226. — P. 63-66.
16. Golomb J., Kluger A., Garrard P., Ferris S. Clinician’s manual on mild cognitive impairment. — London: Science Press, 2001.
17. Hachinski V.C., Lassen N.A., Marshall Y. Multi-infarct dementia: a cause of mental deterioration in the elderly // Lancet. — 1974. — V. 2. — P. 207.
18. Petersen R.S., Touchon J. Consensus on mild cognitive impairment // Research and practice in AD. EADS-ADCS joint meeting. — 2005. — V. 10. — P. 24-32.