Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Влияние нуклеотидов ЦМФ и УМФ на развитие усталости у крыс при физической нагрузке
Авторы: Gella A., Ponce J., Durany N. International University of Catalonia Faculty of Health Science, Barcelona, Spain Cusso R., Department of Biochemistry, University of Barcelona, Spain
Рубрики: Неврология
Версия для печати
Этиология мышечной слабости до конца не ясна. Для лечения нейромышечных нарушений у людей часто назначают два нуклеотида — цитидинмонофосфат (ЦМФ) и уридинмонофосфат (УМФ). У пациентов, получавших ЦМФ/УМФ, происходило восстановление нарушенных неврологических функций и ослабление боли, вследствие чего возник интерес к изучению влияния данных нуклеотидов на утомляемость после физической нагрузки. С этой целью у крыс, выполняющих физическую нагрузку и получающих ЦМФ/УМФ, мы определили физическую выносливость, содержание молочной кислоты, глюкозы и гликогена и активность нескольких метаболических ферментов, таких как креатинкиназа, лактатдегидрогеназа и аспартатаминотрансфераза. Полученные нами результаты свидетельствуют о том, что крысы, получавшие ЦМФ/УМФ, способны более длительное время выдерживать физическую нагрузку (бег на тредмиле). До выполнения физической нагрузки уровень глюкозы в мышцах был достоверно выше у леченых крыс, что свидетельствует о том, что прием ЦМФ/УМФ способствует поступлению глюкозы в мышцы. Уровень гликогена в печени не менялся во время физической нагрузки, что позволяет думать о том, что нуклеотиды ЦМФ/УМФ могут быть вовлечены в поддержание постоянного уровня гликогена в печени во время выполнения физической нагрузки. Лактатдегидрогеназная и аспартатаминотрансферазная активность была достоверно снижена в печени леченых крыс. Таким образом, результаты, полученные в ходе нашего исследования, свидетельствуют о том, что прием ЦМФ/УМФ увеличивает физическую выносливость крыс за счет изменения ряда метаболических показателей.
Физическая нагрузка, цитидинмонофосфат, уридинмонофосфат, мышцы, усталость.
Мышечную усталость определяют как неспособность выполнять физическую нагрузку, которая успешно выполнялась до этого, неспособность генерировать требуемую или ожидаемую мощность/силу, что приводит к снижению физических возможностей, или как временную утрату способности делать усилие после только что прекратившейся мышечной работы [12, 16, 34].
Этиология мышечной утомляемости до конца не известна. Много факторов вовлечено в этот процесс, и относительная важность каждого из них зависит от состава мышечных волокон, интенсивности, типа и длительности сокращения, физической подготовки человека [30]. Некоторые из этих факторов включают быстрое истощение запасов гликогена и глюкозы [8, 18], накопление катаболитов, таких как молочная кислота [23], повышение содержания ионов Н+ и Pi (неорганического фосфата. — Прим. перев.) [14, 29, 32, 34, 37], неспособность поддерживать продукцию АТФ на скорости, достаточной для удовлетворения энергетических потребностей [14, 15, 32], увеличение скорости потребления кислорода, приводящее к развитию оксидативного стресса и повреждению тканей [3, 8, 20, 24, 35], недостаточное высвобождение ионов Ca2+ из саркоплазматического ретикулума [2, 15]. Все эти факторы по отдельности или в комбинации снижают способность выполнять физическую нагрузку при развитии усталости. Было показано, что гликоген мышц и глюкоза плазмы крови являются первичным источником энергии во время умеренной и тяжелой длительной физической нагрузки. В исследованиях, выполненных на собаках, было выяснено, что после обильного приема пищи, содержащей углеводы, животные были способны бежать на тредмиле в два раза дольше без признаков усталости и что физическая нагрузка вызывает увеличение транспорта глюкозы в мышцы [6, 9]. В исследованиях у людей было продемонстрировано, что употребление глюкозы (в том числе в жидком виде) во время физической нагрузки улучшает ее выполнение. Это свидетельствует о том, что углеводы могут отсрочивать развитие усталости во время длительного выполнения физической нагрузки, но не могут полностью предотвратить ее развитие [10, 17]. Было сообщено также об изменении активности ферментов и связывающих взаимодействий в мозге, печени и мышцах рыб при выполнении физической нагрузки. Эти изменения зависят от интенсивности физической нагрузки [26].
Нуклеотиды по типу цитидинмонофосфата (ЦМФ) и уридинмонофосфата (УМФ) обычно назначают пациентам с нейромышечными нарушениями, такими как невралгия, неврит и миалгия. Как следствие, наблюдается восстановление нарушенных неврологических функций, ослабление боли и улучшение двигательных функций после значительного мышечного напряжения, мышечных судорог или бега. Однако до сих пор не опубликованы работы, в которых эти данные были бы освещены с биохимической точки зрения. Клинический опыт свидетельствует о вовлечении в эти процессы нервной системы, однако метаболиты мышц и крови также могут иметь определенное значение. Было бы хорошо, если бы введенные извне нуклеотиды ЦМФ и УМФ защищали от повреждения или восстанавливали повреждения, вызванные повышенной продукцией молочной кислоты во время физической нагрузки, устраняя боль и улучшая двигательную функцию, или если бы ЦМФ и УМФ оказывали влияние на метаболизм, увеличивая поступление энергии к мышцам. Нуклеотид УМФ является предшественником молекулы уридинтрифосфата (УТФ) и является скорость-лимитирующим фактором при синтезе гликогена. УТФ + глюкозо-1-фосфат ® образование УДФ-глюкозы, которая является донором молекулы глюкозы при синтезе гликогена (УДФ-глюкоза + гликогенn ® гликогенn + 1 + УДФ). Следовательно, весьма вероятно, что введение УДФ стимулирует синтез гликогена и увеличивает запасы глюкозы у крыс. С другой стороны, нуклеотид ЦМФ стимулирует регенерацию нервных и мышечных волокон за счет стимуляции образования ЦДФ-холина и, как следствие, усиления биосинтеза фосфатидилхолинов [31, 36].
С целью выявления положительных эффектов от введения ЦМФ и УМФ у животных, выполняющих физическую нагрузку, мы оценивали время, за которое у них развивалась усталость во время бега по тредмилу. Мы также определили концентрацию различных метаболитов в мышцах и крови, например продукцию молочной кислоты, истощение запасов глюкозы и гликогена, каталитическую концентрацию креатинкиназы (КК, номер в соответствии с интегрированной базой данных ферментов (IntEnz) EC 2.7.3.2) и гликолитических ферментов, таких как лактатдегидрогеназа (ЛДГ, EC 1.1.1.27) аспартатаминотрансфераза (АСТ, EC 2.6.1.1).
Материалы и методы
Животные и экспериментальные группы. В настоящем исследовании использовали крыс линии Sprague Dawley (Harlan Iberica S.L., Испания) весом 275 ± 25 г. Крыс содержали при комнатной температуре 20 ± 2 °С и относительной влажности 50 ± 10 %. Длительность режима «день/ночь» составила 12 ч/12 ч. Крысам давали специальные пищевые гранулы (BK, Испания) и воду ad libitum (лат.: неограниченно, по желанию, сколько угодно. — Прим. перев.). Крыс случайным образом разделили на две экспериментальные группы: тех, которые получали нуклеотиды (леченые крысы, ЛК; n = 23), и тех, которые их не получали (нелеченые крысы, НК; n = 23). Все манипуляции и лечение были выполнены в полном соответствии с положениями об уходе за животными и использовании их в экспериментальных целях, принятыми в Европейском Союзе.
Подготовка препарата и его введение. Препарат нуклео ЦМФ форте вводили животным внутримышечно в дозе 5,5 мг/кг массы тела (3,0 мг/кг УМФ; 2,5 мг/кг ЦМФ). В соответствии с результатами экспериментов по подбору доз, выполненных фармацевтической компанией Grupo Ferrer (Испания), эта доза соответствовала максимальной из тех, введение которых не приводит к развитию токсических эффектов. Препарат растворяли в 2 мл 0,9% раствора NaCl и вводили крысам ежедневно в течение 10 дней подряд. Другой группе крыс внутримышечно вводили эквивалентный объем 0,9% раствора NaCl (без препарата).
Физическая нагрузка, предъявляемая крысам. В течение одной недели до начала эксперимента крысам назначали короткие режимы тренировок (10 мин/день) для того, чтобы они привыкли к тредмилу. Затем все крысы (ЛК и НК) выполняли два различных протокола физической нагрузки. Первый протокол был предназначен для определения времени, в течение которого у крыс развивалась мышечная слабость. Каждый день в течение 10 дней через 30 мин и 1 ч после приема препарата все крысы выполняли физическую нагрузку в полностью закрытом тредмиле LE 8700 (Letica Scientific Instruments, Испания). Каждую крысу заставляли бежать на тредмиле (20,4 м/мин, наклон 7,5 %) до развития состояния истощения, после чего регистрировали соответствующее время. Истощение крыс определяли как неспособность бежать в темпе, задаваемом тредмилом, либо переворачиваться при помещении на спину, либо стоять на четырех лапах при помещении на живот. В последний день эксперимента крыс умерщвляли и забирали образцы крови, мышц задних конечностей и печени для последующего анализа.
Второй протокол был выполнен для того, чтобы оценить эффекты препарата у крыс (ЛК: n = 10, НК: n = 10) в течение первых пяти минут физической нагрузки. В течение 10 дней до выполнения этого протокола крысы ежедневно получали тестируемый препарат. На 10-й день были выполнены условия второго протокола: 5 ЛК и 5 НК были умерщвлены до начала бега, и для последующего анализа у них были взяты образцы мышц задних конечностей и печени; остальные 5 ЛК и 5 НК были умерщвлены спустя 5 мин бега на тредмиле (20,4 м/мин, наклон 7,5 %), и у них для последующего анализа были взяты такие же образцы.
Образцы крови и тканей. Животных вводили в состояние наркоза, размещая ватный тампон, смоченный в галотане, на область носа, после чего пунктировали сердце и забирали образцы крови. Собранную кровь сразу же центрифугировали при 6000 об/мин и 4 °С в течение 20 мин (Eppendorf instruments, Германия), затем отбирали плазму и замораживали при температуре –80 °С для последующего биохимического анализа. Для приготовления образцов тканей забирали приблизительно 1 г мышц задних конечностей и 2 г печени и гомогенизировали их в 3% (масса (г)/объем (мл) х 100 %) холодном 20 мМ трис-HCl буфере, рН 7,5, содержащем 1 мМ ЭДТА, 1 мМ b-меркаптоэтанола и ингибиторы протеаз (фенилметилсульфонил фторид 1 : 100, пепстатин 1 : 1000, бестатин 1 : 1000 и лептин 1 : 1000). При этом для гомогенизации образцов мышечной ткани использовали гомогенизатор Polytron (Kinematica Ltd., Швейцария; позиция 5, в течение 20 с), а для гомогенизации образцов печени — ручной гомогенизатор. Клеточный дебрис удаляли путем центрифугирования при температуре 4 °С в течение 13 мин при 12 500 g, после чего супернатант отбирали и сохраняли при температуре –80 °С для последующего биохимического анализа. Мышечную ткань забирали достаточно быстро, чтобы предотвратить накопление в ней молочной кислоты после смерти животного.
Биохимический анализ. Каталитическую концентрацию лактатдегидрогеназы, креатинкиназы и аспартатаминотрансферазы определяли с помощью коммерческих наборов Roche Diagnostics (Mannheim, Германия). Концентрацию гликогена в тканях определяли по методу, описанному в работе [1]. После гидролиза гликогена с помощью перхлорной кислоты концентрацию глюкозы определяли флюорометрически [25]. Концентрацию молочной кислоты определяли с помощью ферментного колориметрического метода, предложенного Linear Chemicals (Badalona, Испания). Концентрацию белка оценивали по методу, предложенному в работе [7], с использованием бычьего сывороточного альбумина в качестве стандарта.
Статистический анализ. В настоящей работе данные представлены в виде средних значений ± стандартная ошибка. Статистический анализ был выполнен с использованием однофакторного дисперсионного анализа (ANOVA) при уровне значимости p ≤ 0,05. При выявлении общего достоверного эффекта для оценки значимых различий между отдельными группами использовали апостериорный критерий Ньюмана — Кеулса. Весь статистический анализ был выполнен с помощью программы GraphPad Prism 3.02 (GraphPad Software, США).
Результаты
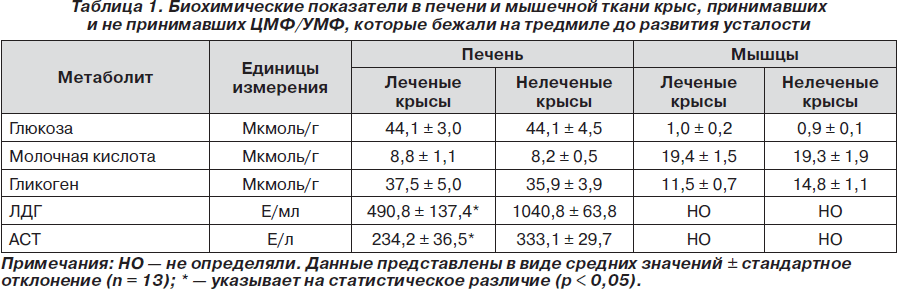
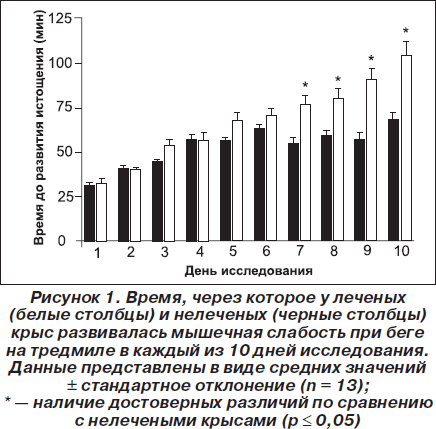
Среднее время, через которое у леченых и нелеченых крыс развивалась усталость при беге по тредмилу в каждый из 10 дней, представлено на рис. 1. В течение первых шести дней эксперимента время, затрачиваемое на достижение мышечной слабости, увеличивалось одинаково в обеих группах животных. Однако, начиная с седьмого дня, леченые животные бежали больший интервал времени по сравнению с нелечеными животными (p ≤ 0,05). На 10-й день после завершения бега крыс умерщвляли, у них забирали образцы крови, печени и мышечной ткани так, как описано выше (см. раздел, посвященный материалу и методам исследования). В плазме крови леченых и нелеченых крыс не было обнаружено достоверных различий при сравнении средних значений глюкозы (соответственно 10,6 ± 0,9 мМ и 11,0 ± 0,9 мМ), молочной кислоты (1,7 ± 0,3 мМ и 1,8 ± 0,1 мМ), ЛДГ (278 ± 60 Е/мл и 242 ± 37 Е/мл), КК (208 ± 44 Е/л и 207 ± 23 Е/л) и АСТ (95,9 ± 5,1 Е/л и 82,1 ± 8,0 Е/л). В табл. 1 представлены средние значения глюкозы, гликогена, лактата, ЛДГ и АСТ в образцах печени леченых и нелеченых крыс. Каталитическая концентрация ЛДГ была достоверно ниже у леченых крыс по сравнению с нелечеными (на 53 %, p ≤ 0,05). Менее выраженные, но также достоверные различия наблюдались в отношении каталитической концентрации АСТ, которая была снижена в группе леченых крыс по сравнению с нелечеными (на 30 %, р ≤ 0,05). Средние значения глюкозы, лактата и гликогена в образцах мышечной ткани (табл. 1) достоверно не различались между группами леченых и нелеченых крыс. Это свидетельствует о том, что развитие усталости у нелеченых крыс не было связано с большим истощением запасов гликогена по сравнению с лечеными крысами.
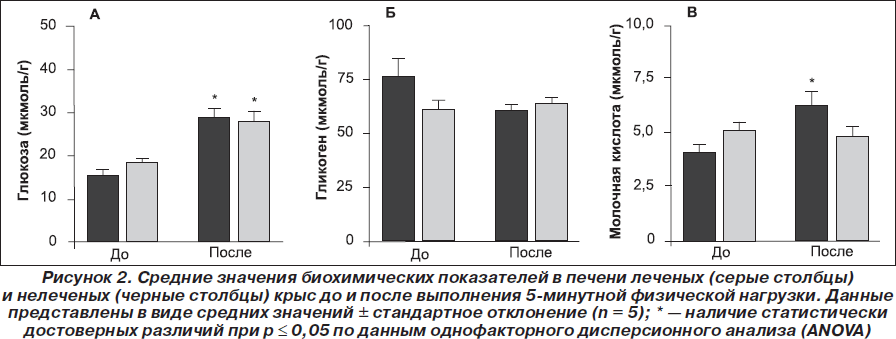
Для того чтобы оценить эффекты препарата в первые 5 мин физической нагрузки, мы определили концентрацию глюкозы, гликогена и лактата в образцах печени (рис. 2) и мышечной ткани (рис. 3) леченых и нелеченых крыс до физической нагрузки и спустя 5 мин после ее начала. Результаты, представленные на рис. 2А, свидетельствуют о том, что концентрация глюкозы в печени после выполнения нагрузки достоверно увеличивалась в обеих группах (p ≤ 0,05), однако увеличение было более низким в группе леченых крыс по сравнению с нелечеными (33,3 и 46,3 % соответственно). Содержание гликогена в печени достоверно не различалось у леченых и нелеченых крыс до и после выполнения нагрузки (рис. 2Б). Как следует из рис. 2В, концентрация молочной кислоты в печени достоверно увеличивалась спустя 5 мин физической нагрузки только в группе нелеченых крыс (6,2 ± 1,4 мкмоль/г по сравнению с 3,9 ± 1,0 мкмоль/г, p ≤ 0,05). Это свидетельствует о том, что в течение первых 5 мин физической нагрузки у леченых крыс не образуется так много лактата, как у нелеченых крыс.
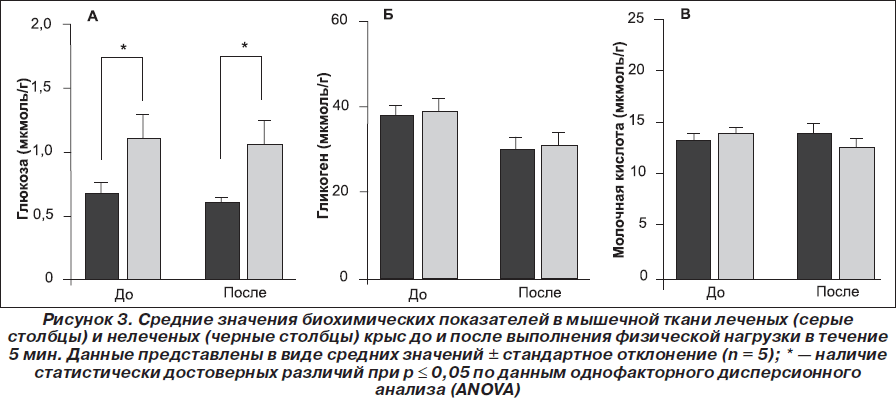
Концентрация глюкозы в мышцах была достоверно выше у леченых крыс по сравнению с нелечеными до и после физической нагрузки (рис. 3А), причем достоверное снижение содержания глюкозы в обеих группах крыс после нагрузки отсутствовало. Содержание гликогена в мышцах до физической нагрузки (рис. 3Б) было одинаковым у леченых и нелеченых крыс (38,2 ± 9,0 мкмоль/г и 37,5 ± 6,0 мкмоль/г соответственно), а спустя 5 мин после физической нагрузки оно немного (недостоверно) снижалось (30,3 ± 7,0 мкмоль/г и 29,0 ± 7,0 мкмоль/г). Содержание молочной кислоты в мышцах было одинаковым у леченых и нелеченых крыс до и после выполнения 5-минутной физической нагрузки (рис. 3В).
Обсуждение
Результаты настоящего исследования свидетельствуют о том, что крысы, получавшие в течение 10 дней ЦМФ/УМФ, были способны бежать на тредмиле более долгое время до развития физического истощения. Этот эффект был виден начиная с 7-го дня приема препарата, что свидетельствует о способности ЦМФ/УМФ во время физической нагрузки менять протекание аэробных механизмов в большей степени, нежели анаэробных. Мы определили концентрацию метаболических субстратов и ферментов, активирующихся во время физической нагрузки, чтобы ответить на вопрос, могут ли подобные метаболические изменения объяснить большую выносливость к нагрузке у леченых крыс.
Для индукции усталости у крыс был выбран бег на тредмиле, а не плавание, поскольку последний метод вызывает и другие формы стресса, например респираторный стресс, что ведет к высокой вариабельности аэробного ответа. Бег на тредмиле является стандартной формой аэробной физической нагрузки, используемой в экспериментах на животных и при исследованиях человека [5, 6, 9, 24].
В соответствии с первым протоколом эксперимента крыс заставляли бежать до достижения усталости или истощения. В этих условиях все биохимические показатели, оцененные в плазме леченых и нелеченых крыс, были одинаковыми. Эти результаты аналогичны тем, которые приводились и в более ранних исследованиях [13, 19, 33]. Ряд авторов сообщали об отсутствии изменений среди ферментов плазмы крови до и после бега на тредмиле у людей [5] и об отсутствии взаимосвязи между повышением каталитической концентрации КК в плазме крови и мышечным напряжением и слабостью [27]. Наши наблюдения подтверждают тот факт, что метаболические изменения, определяемые в тканях после физической нагрузки, если они присутствуют, не всегда выявляются в плазме крови. Возможно, это связано с тем, что физическая нагрузка не вызывает значительного повреждения тканей. У леченых крыс, которые бежали на тредмиле до развития истощения, каталитическая концентрация ЛДГ и АСТ в печени была значительно снижена, а концентрация глюкозы в мышечной ткани была немного повышена. Это свидетельствует о том, что у крыс, получавших ЦМФ/УМФ, наблюдалась чуть более высокая концентрация свободной глюкозы в мышцах, и о том, что они были способны лучше использовать эту глюкозу. Возможно, что ЦМФ и УМФ активируют окислительные ферменты и, при возрастании энергетических потребностей, глюкоза метаболизируется до АТФ в цикле Кребса, а не за счет образования молочной кислоты, вследствие чего каталитическая концентрация ферментов, ответственных за продукцию молочной кислоты, снижается, о чем свидетельствуют результаты нашего исследования. Низкая каталитическая концентрация ЛДГ может быть связана со снижением синтеза данного фермента, что может являться результатом угнетения соответствующих генов.
Наши результаты свидетельствуют о том, что концентрация гликогена в печени и мышцах была одинаковой у леченых и нелеченых крыс. Это говорит о том, что за более длительный период времени, в течение которого леченые крысы достигали состояния усталости, не происходило более выраженное истощение запасов гликогена. Полученные результаты могут быть объяснены исходя из предположения, что к тому моменту, когда животные достигают состояния усталости, весь доступный гликоген и глюкоза используются, вследствие чего в обеих группах животных наблюдаются одинаковые значения данных показателей. Поэтому мы разработали второй протокол физической нагрузки, где крысы бежали 5 мин, а биохимические показатели измеряли до и после выполнения этой нагрузки. В ходе этой части исследования до выполнения физической нагрузки было обнаружено, что у крыс, получавших ЦМФ и УМФ, была значительно повышена концентрация глюкозы в мышцах по сравнению с нелечеными животными. Возможное объяснение этого факта сводится к тому, что у крыс, получавших ЦМФ/УМФ, развивается особое адаптационное состояние, которое позволяет им накопить большее количество глюкозы в мышцах и, следовательно, переносить большие физические нагрузки [21, 28]. Одним из путей, усиливающих поступление глюкозы в клетки, является повышение содержания глюкозных транспортеров, присутствующих в клеточных мембранах, например семейства GLUT [22]. Нам также удалось обнаружить, что после выполнения 5-минутной физической нагрузки концентрация глюкозы в печени повышалась в обеих группах. Это указывает на то, что во время нагрузки наблюдается деградация гликогена в печени, с повышением содержания свободной глюкозы в этом органе, что было видно в группе нелеченых крыс. Кроме того, полученные результаты дают повод думать о том, что во время физической нагрузки нуклеотиды ЦМФ/УМФ поддерживают концентрацию гликогена в печени на постоянном уровне либо за счет того, что крысы способны быстро синтезировать гликоген при избытке УДФ-глюкозы, либо за счет снижения скорости деградации гликогена вследствие избытка глюкозы в мышечной ткани.
Во время выполнения физической нагрузки весьма ожидаемым является увеличение продукции и накопления молочной кислоты, поскольку возникает необходимость в быстрой деградации глюкозы с целью получения энергии, требуемой мышцам [11, 12, 26, 35]. В нашем исследовании этот феномен наблюдался в ткани печени нелеченых крыс, но не в мышцах. Отсутствие повышения содержания молочной кислоты в мышцах и печени леченых крыс спустя 5 мин физической нагрузки может объяснить отсутствие мышечной боли и слабости у леченых животных при беге на тредмиле (до развития утомления). Механизм этого феномена точно не известен, однако предполагалось, что нуклеотиды урацила могут присутствовать в синаптических пузырьках и высвобождаться при стимуляции нервов [4]. Растет количество данных о том, что выделяемые нуклеотиды урацила активируют свои рецепторы, вовлеченные в сигнальные механизмы в клетках, что может иметь значение для развития их фармакологического эффекта.
В заключение необходимо отметить, что введение нуклео ЦМФ форте может способствовать предотвращению развития усталости и мышечных судорог у крыс. Однако необходимо проводить дальнейшие исследования для того, чтобы подтвердить эти данные и прояснить механизм действия экзогенно вводимых УМФ и ЦМФ у людей.
Оригинал статьи опубликован в Journal of Physiology and Biochemistry. — 2008. — Vol. 64, № 1. — 9-17
1. Adamo K.B., Graham Т.Е. Comparison of traditional measurements with macroglycogen and proglycogen analysis of muscle glycogen // J. Appl. Physiol. — 1998. — 84. — 908-913.
2. Allen D.G. Skeletal muscle function: role of ionic changes in fatigue, damage and disease // Clin. Exp. Pharmacol. Physiol. — 2004. — 31. — 485-493.
3. Alessio H.M. Exercise-induced oxidative stress // Med. Sci. Sports Exerc. — 1993. — 25. — 218-224.
4. Anderson C.M., Parkinson F.E. Potential signalling roles for UTP and UDP: sources, regulation and release of uracil nucleotides // TiPS. — 1997. — 18. — 387-392.
5. Ashmaig M.E., Starkey B.J., Ziada A.M., Amro A.A., Sobki S.H., Ferns G.A. Changes in serum concentrations of markers of myocardial injury following treadmill exercise testing in patients with suspected isсhaemic heart disease // Med. Sci. Monk. — 2001. — 7. — 54-57.
6. Bracy D.P., Zinker B.A., Jacobs J.C., Lacy D.B., Wasserman D.H. Carbohydrate metabolism during exercise: influence of circulating fat availability // J. Appl. Physiol. — 1995. — 79. — 506-513.
7. Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. — 1976. — 72. — 248-254.
8. Brooks G.A. Mammalian fuel utilization during sustained exercise // Comp. Biochem. Physiol. B. — 1998. — 120. — 89-107.
9. Chen H.C., Bandyopadhyay G., Sajan M.P., Kanoh Y., Standaert M., Farese R.V., Darese R.V. Activation of the ERK pathway and atypical protein kinase С isoforms in exercise-and aminoimidazole-4-carboxamide-1-beta-D-riboside (AICAR)-stimulated glucose transport // J. Biol. Chem. — 2002. — 277. — 23554-23562.
10. Coyle E.F. Fluid and fuel intake during exercise // J. Sports Sci. — 2004. — 22. — 39-55.
11. Durkot M.J., De Garavilla L., Caretti D., Francesconi R. The effects of dichloroacetate on lactate accumulation and endurance in an exercising rat model // Int. J. Sports Med. — 1995. — 16. — 167-171.
12. Fitts R.H. Cellular mechanisms of muscle fatigue // Physiol. Rev. — 1994. — 74. — 49-94.
13. Fushimi Т., Sato Y. Effect of acetic acid feeding on the circadian changes in glycogen and metabolites of glucose and lipid in liver and skeletal muscle of rats // Br. J. Nutr. — 2005. — 94. — 714-719.
14. Giannesini В., Cozzone P.J., Bendahan D. Non-invasive investigations of muscular fatigue: metabolic and electromyographic components // Biochimie. — 2003. — 85. — 873-883.
15. Green H.J. Mechanisms of muscle fatigue in intense exercise // J. Sports Sci. — 1997. — 15. — 247-256.
16. Green H.J. Mechanisms and management of fatigue in health and disease: symposium introduction // Can. J. Appl. Physiol. — 2004. — 29. — 264-273.
17. Halson S.L., Lancaster G.I., Achten J., Gleeson M., Jeukendrup A.E. Effects of carbohydrate supplementation on performance and carbohydrate oxidation after intensified cycling training // J. Appl. Physiol. — 2004. — 97. — 1245-1253.
18. Hargreaves M. Interactions between muscle glycogen and blood glucose during exercise // J. Exerc. Sport Sci. Rev. — 1997. — 25. — 21-39.
19. Huang M.T., Veech R.L. Role of the direct and indirect pathways for glycogen synthesis in rat liver in the postprandial state // J. Clin. Invest. — 1988. — 1. — 872-878.
20. Ji L.L. Antioxidants and oxidative stress in exercise // Proc. Soc. Exp. Biol. Med. — 1999. — 222. — 283-292.
21. Karelis A.D., Peronnet F., Gardiner P.F. Glucose infusion attenuates muscle fatigue in rat plantaris muscle during prolonged indirect stimulation in situ // Exp. Physiol. — 2002. — 87. — 585-592.
22. Leturque A., Brot-Laroche E., Le Gall M., Stolarczyk E., Tobin V. The role of GLUT2 in dietary sugar handling // J. Physiol. Biochem. — 2005. — 61. — 529-538.
23. Lindinger M.I., McKelvie R.S., Heigenhauser G.J. K+ and Lac- distribution in humans during and after high-intensity exercise: role in muscle fatigue attenuation? // J. Appl. Physiol. — 1995. — 78. — 765-777.
24. Liu J., Yeo H.C., Overvik-Douki E., Hagen Т., Doniger S.J., Chu D.W., Brooks G.A., Ames B.N. Chronically and acutely exercised rats: biomarkers of oxidative stress and endogenous antioxidants // J. App. Physiol. — 2000. — 89. — 21-28.
25. Lowry O.H., Passonneau J.V. A flexible system of enzimatic analysis. — New York: Academic Press, 1972.
26. Lushchak V.I., Bagnyukova T.V., Storey J.M., Storey К.B. Influence of exercise on the activity and the distribution between free and bound forms of glycolytic and associated enzymes in tissues of horse mackerel // Braz. J. Med. Biol. Res. — 2001. — 34. — 1055-1064.
27. Malcom S.A., Anstee A., Halloran M. Time course changes in plasma creatine kinase over four days of repetitive manual work // Ergonomics. — 1995. — 38. — 1019-1024.
28. Marcil M., Karelis A.D., Peronnet F., Gardiner P.F. Glucose infusion attenuates fatigue without sparing glycogen in rat soleus muscle during prolonged electrical stimulation in situ // Eur. J. Appl. Physiol. — 2005. — 93. — 569-574.
29. McLester J.R. Muscle contraction and fatigue. The role of adenosine 5’-diphosphate and inorganic phosphate // Sports Med. — 1997. — 23. — 287-305.
30. Millet G.Y., Lepers R. Alterations of neuromuscular function after prolonged running, cycling and skiing exercises // Sports Med. — 2004. — 34. — 105-116.
31. Rao A.M., Hatcher J.F., Dempsey R.J. CDP-choline: neuroprotection in transient forebrain ischemia of gerbils // J. Neurosci. Res. — 1999. — 58. — 697-705.
32. Sahlin K., Tonkonogi M., Soderlund K. Energy supply and muscle fatigue in humans // Acta Physiol. Scand. — 1998. — 162. — 261-266.
33. Sener G., Kabasakal L., Yuksel M., Gedik N., Ali- can Y. Hepatic fibrosis in biliary-obstructed rats is prevented by Ginkgo biloba treatment // World J. Gastroenterol. — 2005. — 11. — 5444-5449.
34. Stackhouse S.K., Reisman D.S., Binder-Macleod S.A. Challenging the role of pH in skeletal muscle fatigue // Phys. Ther. — 2001. — 81. — 1897-1903.
35. Wasserman K. Coupling of external to cellular respiration during exercise: the wisdom of the body revisited // Am. J. Physiol. — 1994. — 266. — E519-39.
36. Wattig В., Schalow G., Madauss M., Heydenreich F., Warzok R., Cervos-Navarro J. Acceleration of nerve and muscle regeneration by administration of nucleotides — electroneurophysiological and morphometrical investigations // Acta Histochem. Suppl. — 1992. — 42. — 333-339.
37. Westerblad H., Allen D.G., Lannergren J. Muscle fatigue: lactic acid or inorganic phosphate the major cause? // News Physiol. Sci. — 2002. — 17. — 17-21.