Международный эндокринологический журнал 2 (34) 2011
Вернуться к номеру
Новий підхід до реабілітації хворих із поєднанням цукрового діабету 2-го типу й хронічного пієлонефриту
Авторы: Маніщенкова Ю.О., ДЗ «Луганський державний медичний університет»
Рубрики: Эндокринология
Версия для печати
Викладені сучасні дані щодо реабілітації хворих на хронічний пієлонефрит, поєднаний з цукровим діабетом 2-го типу. Вивчено ефективність реабілітаційних заходів при спостереженні за хворими протягом одного року після стаціонарного лікування.
Хронічний пієлонефрит, цукровий діабет 2-го типу, медична реабілітація.
Вступ
У численних дослідженнях вітчизняних та іноземних науковців останнім часом приділяється увага коморбідній патології, особливо поєднанню цукрового діабету (ЦД) і хронічного пієлонефриту (ПН). Наявність ЦД спричиняє в організмі низку метаболічних порушень, що веде до дисбалансу імунної системи та формує основу для розвитку неспецифічних запальних процесів, зокрема ПН. На сьогодні запропоновано велику кількість методів окремого лікування загострень хронічного ПН та декомпенсації ЦД 2-го типу. Застосування антибактеріальної терапії у хворих на хронічний ПН дозволяє добитися ліквідації клінічної симптоматики хронічного ПН, але в цих пацієнтів залишаються порушення в системі імунної реактивності й гемореології, що створює умови для переходу в затяжний перебіг патологічного процесу і ускладнює супутній ЦД [2–4]. Ураховуючи взаємозалежність дисметаболічних розладів при наявності супутньої патології раціонально оптимізувати коррекцію цих порушень. До того ж активний інтерес у лікарів викликають питання медичної реабілітації та диспансеризації хворих із коморбідною патологією.
Проте, на жаль, відсутні роботи з оцінкою ефектів лікування та медичної реабілітації хворих із коморбідною патологією, присвячені одночасному використанню посиленої антибактеріальної терапії та метаболічної терапії, що полягає в основі наших досліджень.
Мета дослідження — вивчення впливу запропонованого методу медичної реабілітації хворих із поєднанням ЦД 2-го типу та хронічного ПН.
Матеріал і методи дослідження
Під спостереженням знаходилось 137 пацієнтів із поєднаною патологією — ЦД 2-го типу та хронічним ПН — віком 45–80 років. Пацієнті були розподілені на 2 групи: 69 хворих першої та 68 — другої групи. Реабілітація здійснювалась у два етапи: ліквідація загострень хронічного ПН (стаціонарний етап) та пролонгація клініко-лабораторної ремісії захворювання (амбулаторний етап). Динамічне спостереження хворих тривало впродовж одного року після закінчення стаціонарного лікування.
На першому етапі медичної реабілітації хворі першої групи із загостренням хронічного ПН, поєднаного з ЦД 2-го типу, отримували базисне лікування, яке складалося з цукрознижувальної (таблетований цукрознижувальний препарат глюренорм у дозі 45–60 мг на добу в три прийоми під час їжі або інсулінотерапія за традиційною схемою) та антибактеріального терапії ломефлоксацином (ломадей, 1 таблетка 0,4 г) 1 раз на добу впродовж 10 діб або цефтріаксон (лораксон або емцеф) 1,0 внутрішньом’язово двічі на добу впродовж 10 діб поспіль. Пацієнти другої групи отримували цукрознижувальну терапію, антибактеріальний засіб із додатковим застосуванням препаратів канефрон Н по 50 крапель або по 2 драже тричі на добу всередину незалежно від прийому їжі та тіотриазолін 2,5% розчин по 2,0 мл внутрішньом’язово 1 раз на добу, щоденно впродовж двох тижнів поспіль.
Другий етап медичної реабілітації полягав у дотриманні хворими загального режиму за віком з обмеженням тривалого ортостатичного навантаження, фізичних та психічних перевантажень, переохолоджень, перегрівань; хворі дотримувались дієти № 9 за Певзнером на тлі раціональної цукрознижувальної терапії (глюренорм або інсулінотерапія за традиційною схемою); було проведено санацію хронічних вогнищ інфекції. Хворі першої групи не вживали ніяких фітопрепаратів, а другої — продовжували прийом канефрону Н по 2 драже 3 рази на добу незалежно від прийому їжі після виписки зі стаціонару протягом одного місяця.
Аналіз ефективності медичної реабілітації проводився шляхом оцінки клінічних проявів перебігу коморбідної патології та додатковим вивченням стану маркерів запалення (фактору некрозу пухлини (ФНП-a), інтерлейкіну-1b (ІЛ-1b), оксиду азоту (NO)) та циркулюючих імунних комплексів (ЦІК). Кількісне визначення ФНП-a та ІЛ-1b проводили імуноферментним методом з використанням тест-систем «Альфа-ФНО-ИФА-БЕСТ» та «ИЛ-1бета-ИФА-БЕСТ» виробництва ЗАТ «ВЕКТОР-БЕСТ» (Росія). Про рівень оксиду азоту в організмі хворих судили за сумарним умістом нітратів та нітритів у сироватці крові, що визначався класичним методом Гріса в модифікації О.А. Орлової та співавторів. Кількість ЦІК вивчали за фракціями за методом преципітації з 3,5% розчином поліетиленгліколю [1].
Контрольну групу склали донори станції переливання крові без ЦД та ознак запальних захворювань сечостатевої системи.
Математичний аналіз отриманих даних проводили на персональному комп’ютері з використанням пакетів ліцензійних програм Microsoft Office 2003, Microsoft Excel та Statistica, розрахованих на статистичну обробку медичної інформації методом варіаційної статистики з підрахунком коефіцієнта Стьюдента (t), Манна — Уїтні (U), Фішера (φ) та Спірмена (r).
Результати дослідження і їх обговорення
При госпіталізації 33 (24,1 %) хворі першої групи відчували практично постійний неінтенсивний біль у поперековій ділянці, 16 (11,7 %) хворих відзначали відчуття дискомфорту в ділянці попереку, а 24 (17,5 %) хворі скарг не мали. Синдром інтоксикації був виявлений у 63 (46 %) хворих. Підвищення температури тіла до 38,5 °С спостерігалося у 14 (10,2 %) випадках, до 37,9 °С — у 27 (19,7 %) випадках, у 28 (20,4 %) пацієнтів температура тіла залишалася у межах нормальних показників. Дизуричні явища відзначали 48 (35 %) хворих. На біль при сечовипусканні скаржились 20 (41,7 %) хворих, 34 (70,8 %) — на почастішання сечовипускання, 21 (43,75 %) пацієнтів турбувала ніктурія. Відчуття неспорожненого сечового міхура, утруднення сечовипускання спостерігалися у 10 (20,8 %) обстежуваних. У 17 (12,4 %) хворих виявлена пастозність обличчя, а симптом Пастернацького був позитивний у 22 (16,1 %) хворих.
Хворі другої підгрупи при госпіталізації мали скарги на незначний ниючий біль у поперековій ділянці (31; 22,6 %), 6 (4,38 %) хворих відзначали як еквівалент болю відчуття тяжкості та дискомфорту в ділянці попереку, а 27 (19,7 %) хворих не мали ніяких неприємних відчуттів. Синдром інтоксикації, переважно з проявами погіршення загального стану хворих, був присутній у 66 (48,2 %) хворих. Підвищення температури тіла до фебрильних значень спостерігалося у 15 (10,9 %) випадках, до субфебрильних — у 21 (15,3 %) випадку, у 32 (23,4 %) пацієнтів температура тіла була не вищою ніж 36,6 °С. На дизуричні явища скаржились 49 (35,8 %) хворих, у тому числі на біль при сечовипусканні — 23 (46,9 %) хворі, на часте сечовипускання малими порціями — 28 (57,1 %), на ніктурію — 27 (55,1 %) хворих. Синдром залишкової сечі спостерігався у 14 (28,6 %) хворих. Набряковий синдром реєструвався у вигляді пастозності або набряків на обличчі у 19 (13,9 %) хворих та пастозності гомілок — у 31 (22,6 %). Симптом Пастернацького визначався позитивним у 23 (16,8 %) хворих.
Прояви декомпенсації ЦД 2-го типу встановлено у всіх обстежуваних обох груп. Хворі скаржились на сухість у роті, спрагу, поліурію та деякі хворі — на полідипсію.
Усі пацієнти проходили лабораторне обстеження. За отриманими результатами клінічного аналізу крові виявлено такі зміни: у хворих першої групи незначний лейкоцитоз та зсув лейкоцитарної формули вліво спостерігався тільки в 15 (10,9 %) випадках, анемічний синдром — у 24 (17,5 %) хворих, ШОЕ перевищувала норму у 18 (13,3 %) хворих; у хворих другої групи незначний лейкоцитоз та зсув лейкоцитарної формули вліво встановлені в 17 (12,4 %) випадках, анемічний синдром у вигляді анемії І ступеня тяжкості — у 22 (16,1 %) хворих, ШОЕ перевищувала норму в 21 (15,3 %) хворого. Вуглеводний обмін на початку лікувального процесу був у стані декомпенсації практично у всіх хворих обох груп. Спостерігалось перевищення рівня глікемії натще (у середньому 9,4 ± 2,1 ммоль/л), постпрандіальної (16,8 ± 3,6 ммоль/л), НbА1с (7,8 ± 0,32 %).
У загальному аналізі сечі гіпостенурія виявлялася у 8 (5,8 %) хворих першої групи та у 9 (6,6 %) пацієнтів другої групи. У всіх хворих були наявні лейкоцити в сечі у кількості від 15–20 у полі зору до всього поля зору, еритроцитурія виявлялася у 2 (1,5 %) хворих першої групи та в одного (0,7 %) пацієнта другої групи. У більшості випадків добова протеїнурія була до 1 г/л, а саме у 30 (21,9 %) хворих першої групи та у 34 (24,8 %) хворих другої групи, а протеїнурія понад 1 г/л спостерігалася лише у 5 (3,6 %) хворих першої групи та 4 (2,9 %) пацієнтів другої групи. Цукор у сечі виявлений у 61 (44,5 %) хворого першої групи та у 62 (45,3 %) хворих другої групи, показники перебували в межах від 5 до 45 г/л, а у 13 (9,5 %) пацієнтів першої групи та 8 (5,8 %) пацієнтів другої групи у сечі був виявлений ацетон (+), (++) і (+++). За аналізом за Нечипоренком у 60 (43,8 %) хворих першої групи та 58 (42,3 %) пацієнтів другої групи показники лейкоцитурії становили від 4000 до 8000 в 1 мл сечі. Для уточнення ступеня бактеріурії проводили бактеріологічний посів сечі. Бактеріологічне дослідження сечі до початку базового лікування хворих першої групи виявило присутність E.сoli у 56 (81,2 %), Proteus spp. — у 13 (18,8 %), Enterococcus spp. — у 2 (2,9 %), Candida alb. — у 19 (27,5 %), S.еpidermalis — у 11 (15,9 %), відсутність росту — у 6 (8,7 %) хворих. У хворих другої групи розподіл збудників був таким: E.сoli — у 45 (66,2 %), Proteus spp. — у 16 (23,5 %), Enterococcus spp. — у 4 (5,9 %), Candida alb. — у 25 (36,8 %), S.еpidermalis — у 8 (13,8 %) у кількості більше ніж 106 КУО в 1 мл сечі, відсутність росту — у 5 (7,35 %) хворих.
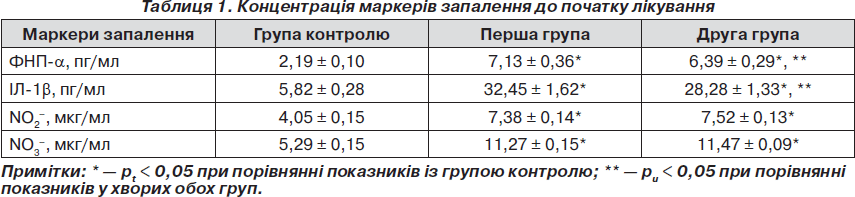
Імунологічні дослідження рівня прозапальних цитокінів у хворих як першої, так і другої групи, а саме ФНП-a та ІЛ-1b, до початку лікування виявили підвищення зазначених показників порівняно з групою контролю (табл. 1). Так, у хворих першої групи початковий рівень ФНП-a становив у середньому 7,13 ± 0,36 пг/мл, що вище за показники контролю в 3,25 раза. Уміст ІЛ-1b також перевищував показники контролю (у 5,6 раза) та дорівнював у середньому 32,45 ± 1,62 пг/мл. Початковий рівень ФНП-a у хворих другої групи становив у середньому 6,39 ± 0,29 пг/мл, що вище за показники контролю в 2,9 раза, а показники ІЛ-1b перевищували норму в 4,9 раза та дорівнювали в середньому 28,28 ± 1,33 пг/мл.
Вивчення концентрації метаболітів NO у сироватці крові хворих першої групи показало, що у період загострення хронічного ПН вона значно перебільшує концентрацію, ніж у групі контролю (табл. 1). Так, концентрація NO2– становила в середньому 7,38 ± 0,14 мкг/мл, NO3– — 11,27 ± 0,15 мкг/мл, що вірогідно перевищує показники контрольної групи у 1,82 та 2,13 раза відповідно. Концентрація метаболітів NO у хворих другої групи становила: NO2– — у середньому 7,52 ± 0,13 мкг/мл, NO3– — у середньому 11,47 ± 0,09 мкг/мл, що вірогідно перевищує показники контрольної групи у 1,86 та 2,17 раза відповідно.
При аналізі взаємозалежності вивчених показників, що характеризують запальний процес у нирках, встановлено пряму кореляційну залежность помірного ступеня між NO та ІЛ-1b у крові (r = +0,352 у першій групі хворих та r = +0,362 у другій групі хворих на ЦД 2-го типу із загостренням хронічного ПН).
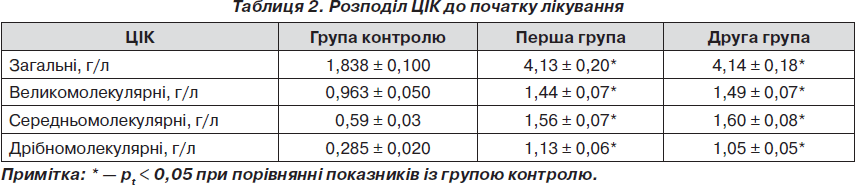
Аналіз стану гуморальної ланки імунітету встановив, що на початку лікування показники у пацієнтів обох груп були значно збільшені порівняно з групою контролю. У першій групі кратність збільшення загальних ЦІК була 2,24 раза, у другій групі — 2,26 раза. Великомолекулярних ЦІК у першій групі — 1,5 раза, у другій групі — 1,55 раза, середньомолекулярних ЦІК у першій групі — 2,64 раза, у другій групі — 2,71 раза, дрібномолекулярних ЦІК у першій групі — 3,96 раза, в другій групі — 3,68 раза (табл. 2).
Після проведеного лікування відбулася практично повна ліквідація больового синдрому, а саме в першій групі кількість хворих із больовим синдромом зменшилася з 24,1 до 0,7 % (рt < 0,05), у другій групі — з 22,6 до 0 % (рt < 0,05). Тобто більш виражений ефект мав місце у хворих другої групи — вірогідність різниці кінцевих параметрів рt > 0,05. Щодо інтоксикаційного синдрому, спостерігалась позитивна динаміка як у першій, так і в другій групі: на фоні базисного лікування в першій групі 27 % хворих скаржилися на загальну слабкість (рt < 0,05) на відміну від другої групи, де аналогічні скарги були присутні у 16,8 % хворих (рt < 0,05); вираженість змін між двома підгрупами (рt < 0,05). Дизуричні явища спостерігались на початку лікування в першій групі у 35 % хворих, а після застосованого лікування у 5,8 % хворих (рt < 0,05), у той час як при застосуванні комплексної терапії у другій групі кількість пацієнтів з дизуричними явищами зменшилась з 35,8 до 3,6 % (рt < 0,05; вірогідність змін рt < 0,05), що свідчить про більшу ефективність лікування в другій групі. Також отримано позитивну динаміку стосовно набрякового синдрому. Так, у першій групі кількість хворих зменшилась з 12,4 до 3,6 % (рt < 0,05), а у другій групі — з 13,9 до 2,2 % (рt < 0,05), але отримані дані невірогідні (рф > 0,05).
Отримано позитивну динаміку лабораторних показників в обох групах хворих. За даними клінічного аналізу крові зареєстровано покращення показників як у першій, так і в другій групі хворих. Так, частота анемічного синдрому легкого ступеня в обох групах вірогідно знизилась у 2,2 раза (з 17,5 до 8 %; рt < 0,05) у першій групі та з 16,1 до 7,3 % у другій групі (рt < 0,05), тобто різниця впливу терапії відсутня (рф > 0,05).
В обох групах проведено аналіз динаміки сечового синдрому, у тому числі патологічної лейкоцитурії. В обох підгрупах визначалась позитивна динаміка. Так, за даними загального аналізу сечі на початку лікування в першій та другій групах була наявна 100% патологічна лейкоцитурія; після базового лікування патологічна лейкоцитурія була наявна у 39,2 % хворих (рt < 0,05) першої групи та у 22 % хворих (рt < 0,05) другої групи. Щодо динаміки кількості хворих з протеїнурією, то у хворих обох груп отримані позитивні зміни. Так, були зареєстровані такі зміни показника протеїнурії до 1 г/л: кількість хворих першої групи зменшилась у 4,29 раза (рt < 0,05) і визначалася до лікування у 21,9 % хворих, після лікування — у 5,1 % хворих, кількість хворих другої групи з аналогічним показником протеїнурії зменшилась у 4,28 раза (рt < 0,05) і після лікування становила 5,8 % на відміну від 24,8 % до лікування. Зіставний аналіз кінцевих даних обох груп є невірогідним (рф > 0,05). Динаміка кількості хворих з добовою протеїнурією понад 1 г/л також була позитивною в обох групах. У першій групі кількість хворих знизилась в 1,64 раза (рt < 0,05), у другій групі — у 4,2 раза (рt < 0,05). Кінцеві дані в обох групах (2,2 та 0,7 % хворих) невірогідні (рф > 0,05). На цьому фоні реєструвалось усунення декомпенсації ЦД, а саме: знизився рівень глікемії, ліквідовано глюкозурію та кетонурію.
Аналіз визначених параметрів анемічного та сечового синдромів вказує на виражений позитивний вплив запропонованого способу лікування з додатковим до антибактеріальної і цукрознижувальної терапії використанням комбінації препаратів канефрон Н та тіотриазолін.
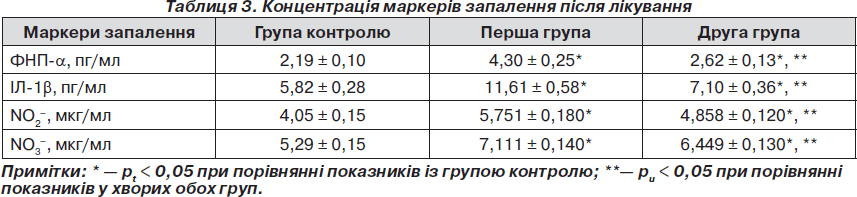
Отримані дані показали, що в обох групах наявна позитивна динаміка показників прозапальних цитокінів. Концентрація ФНП-a знизилась в 1,65 раза (рt < 0,05) у першій групі та в 2,43 раза (рt < 0,05) у другій групі. При аналізі кінцевих параметрів ФНП-a у двох підгрупах отримані вірогідні результати (рu < 0,05) (табл. 3).
Показники кількості ІЛ-1b у першій групі знизились у 2,79 раза (рt < 0,05) та в 3,98 раза (рt < 0,05) у другій групі, тобто більш істотні зміни зареєстровано при використанні розробленого способу лікування хворих. Порівняння кінцевих параметрів ІЛ-1b в обох групах після проведення терапії (у першій — у середньому 11,61 ± 0,58 пг/мл, у другій — у середньому 7,1 ± 0,36 пг/мл) вказує на вірогідність змін (рu < 0,05).
Концентрація метаболітів NO після проведеного лікування у хворих з коморбідною патологією в обох групах мала позитивну динаміку. А саме в першій групі вміст NO2– – зменшився в 1,28 раза (рt < 0,05), NO3– — в 1,59 разів (рt < 0,05), а в другій групі, де була застосована запропонована терапія, кількість NO2– знизилась в 1,55 раза (рt < 0,05), а NO3– — в 1,78 раза (рt < 0,05). Отримані дані наведені в табл. 3.
Отже, використання у хворих із загостренням хронічного ПН, поєднаного з ЦД 2-го типу, додатково до базової терапії комбінації фітопрепарату канефрон Н та метаболічного препарату тіотриазолін сприяє нормалізації рівня метаболітів NO. Аналіз кінцевих параметрів умісту метаболітів NO виявляє вірогідний характер змін NO2– (рu < 0,05) та NO3– (рu < 0,05), що вказує на більшу ефективність запропонованого методу лікування.
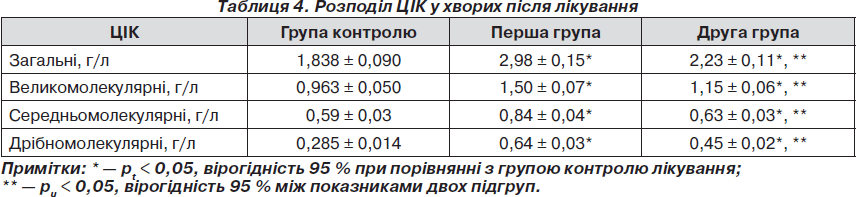
У результаті проведеного лікування зареєстровано перерозподіл показників ЦІК, як у першій, так і в другій групі, а саме в бік збільшення кількості великомолекулярних та зменшення дрібномолекулярних, що відображає зниження активності автоімунних процесів. Так, у першій групі, концентрація загальних ЦІК знизилась в 1,38 раза (рt < 0,05). Зниження ЦІК за фракціями можна розподілити таким чином: великомолекулярних ЦІК — у 0,96 раза (рt < 0,05), середньомолекулярних ЦІК — в 1,85 раза (рt < 0,05), дрібномолекулярних ЦІК — в 1,76 раза (рt < 0,05). У другій групі виявлені такі зміни показників: концентрація загальних ЦІК знизилась в 1,86 раза (рt < 0,05). Зареєстровано таке зниження ЦІК за фракціями: великомолекулярних ЦІК — в 1,29 раза (р < 0,05); середньомолекулярних ЦІК — у 2,54 раза (рt < 0,05); дрібномолекулярних ЦІК — у 2,33 раза (рt < 0,05). Таким чином, порівняльний аналіз кінцевих параметрів ЦІК відображає більш суттєвий вплив додаткової комбінації препаратів на автоімунний процес. Порівняння кінцевих значень концентрації ЦІК має вірогідний характер (рu < 0,05), в тому числі загальних (рu < 0,05), великомолекулярних (рu < 0,05), середньомолекулярних (рu < 0,05), дрiбномолекулярних ЦІК (рu < 0,05). Отримані результаті наведені в табл. 4.
Таким чином, проведена порівняльна оцінка отриманих кінцевих оцінних параметрів свідчить, за даними нашого дослідження, про позитивну динаміку впровадженого способу лікування у хворих другої групи, де на першому етапі медичної реабілітації хворих з коморбідною патологією застосовувалась додатково до базисного лікування комбінація препаратів канефрон Н та тіотриазолін, дані вірогідні щодо прозапальних цитокінів, метаболітів NO та ЦІК.
Після закінчення стаціонарного лікування всім хворим проводились заходи другого етапу медичної реабілітації. За даними анамнезу, за минулий рік загострення хронічного ПН в першій групі були один раз на рік у 33 (53,1 %) пацієнтів та два рази на рік у 21 (33,9 %) хворого; у другій групі: один раз на рік — у 31 (53,5 %) пацієнта та двічі на рік — у 20 (34,5 %) хворих. Таким чином, у хворих першої групи середня частота загострень становила 0,87 ± 0,03 випадку на рік, а у хворих другої групи — 0,88 ± 0,04 випадку на рік.
Динамічне спостереження хворих впродовж одного року за результатами проведених реабілітаційних заходів показало, що відбулося зменшення частоти загострень хронічного ПН у хворих обох груп. При цьому в першій групі загострення хронічного ПН відбулися у 29 (46,8 %) пацієнтів, а в другій групі — у 17 (29,3 %) по одному разу, тобто середня частота загострень становила відповідно 0,47 ± 0,06 випадку на рік та 0,29 ± 0,06 випадку на рік. Двох загострень на рік не реєструвалося в жодній групі хворих.
Як показав аналіз частоти загострень хронічного ПН за минулий рік, кількість випадків загострення практично не відрізнялась в обох групах пацієнтів (рф > 0,05). Після запропонованого лікування частота загострень у першій групі зменшилась у 1,9 раза, а в другій групі втричі (рф < 0,05). Порівняння кінцевих результатів частоти загострень хронічного ПН свідчить про вірогідність отриманого ефекту заходів медичної реабілітації при посиленні їх додатковим використанням канефрону Н на фоні адекватної цукрознижувальної терапії.
Додатково здійснено аналіз специфічних показників запалення. За результатами проведення реабілітаційної терапії, як у першій, так і в другій групі відбулося зменшення прозапальних цитокінів. Так, у хворих першої групи рівень ФНП-a знизився з 4,30 ± ± 0,16 пг/мл до 3,59 ± 0,11 пг/мл, але перевищував показники норми в 1,6 раза (рt < 0,05), а у хворих другої групи — з 2,62 ± 0,07 пг/мл до 2,33 ± 0,08 пг/мл, тобто кінцевий показник майже не відрізнявся від норми (2,2 ± 0,1 пг/мл) (рt < 0,05); рівень ІЛ-1b у хворих першої групи знизився з 11,65 ± 0,17 пг/мл до 6,85 ± ± 0,13 пг/мл і в 1,2 раза перевищував норму (рt < 0,05), а в другій групі — з 7,10 ± 0,19 пг/мл до 5,93 ± 0,09 пг/мл, практично знизившись до норми (5,82 ± 0,28 пг/мл) (рt < 0,05). Отже, в другій групі хворих показники прозапальних цитокінів майже наблизились до норми, на відміну від показників першої групи хворих, що доведено за двостороннім критерієм Фішера (рф > 0,05). Таким чином, показники другої групи мали більш істотну позитивну динаміку, що підтверджує ефективність запропонованого способу реабілітації.
Висновки
1. Проведення комплексного лікування хворих із загостренням хронічного ПН, поєднаного з ЦД 2-го типу, із застосуванням канефрону Н в комбінації з тіотриазоліном має патогенетичну спрямованість, а саме посилює ефективність антибактеріальної терапії, а також сприяє синергізму протизапального ефекту завдяки властивостям канефрону Н та позитивно впливає на метаболічні та автоімунні процеси, що супроводжуються усуненням декомпенсації ЦД і вторинно сприяє нівелюванню запального процесу в нирках завдяки дії тіотриазоліну.
2. Проведення комплексу реабілітаційних заходів у хворих на хронічний пієлонефрит, поєднаний з цукровим діабетом 2-го типу, із застосуванням фітопрепарату з антибактеріальною дією канефрон Н і раціональної цукрознижувальної терапії є ефективним та доцільним, тому що сприяє зменшенню кількості загострень хронічного ПН, пролонгації клініко-лабораторної ремісії, що підтверджено нормалізацією маркерів запалення.
1. Меньшиков В.В. Лабораторные методы исследования в клинике: Справочник. — М: Медицина, 1987. — С. 292.
2. Мартинюк Л.П., Мильнікова Т.О. Ефективність комплексного застосування рослинних препаратів у лікуванні хронічного пієлонефриту у фазі загострення // Український медичний альманах. — 2008. — Т. 11, № 4. — С. 98-100.
3. Рафальский В.В., Страчунский Л.С., Кречикова О.И. Резистентность внебольничных возбудителей инфекций мочевыводящих путей на основании многоцентровых микробиологических исследований UTIAP-I и UTIAP-II // Урология. — 2004. — № 2. — С. 13-17.
3. Иванов Д.Д., Назаренко В.И., Кушниренко С.В. та ін. Терапевтические возможности препарата Канефрон Н в лечении инфекций мочевых путей у пациентов с сахарным диабетом 2 типа и метаболическим синдромом: особенности течения и лечения // Здоров’я України. — 2006. — № 3 (14). — С. 99-102.