Журнал «Болезни и антибиотики» 1 (04) 2011
Вернуться к номеру
Ступенчатая терапия при лечении бактериальных инфекций: вопросы и ответы
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Введение
В общем виде идеальный путь введения медикамента можно охарактеризовать как такой, при котором достигаются плазменные концентрации препарата, достаточные для получения желаемого эффекта и при которых не развиваются нежелательные лекарственные явления (НЛЯ). В прошлом для продолжения лечения больных переводили на прием медикаментов внутрь после завершения адекватного курса парентеральной (обычно внутривенной) терапии. В настоящее время перевод на прием препарата внутрь нередко становится частью начального курса лечения. Многие из доступных на современном фармацевтическом рынке лекарств для приема внутрь стало легче применять, они безопаснее, отличаются высокой биодоступностью, в связи с чем пероральный путь введения превратился в идеальный (или приблизился к таковому).
Что такое ступенчатая терапия?
«Ступенчатая терапия — двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента» [1].
Какие существуют варианты ступенчатой терапии?
Собственно ступенчатая терапия (sequential therapy) — перевод с парентерального на пероральное введение одного и того же медикамента.
Пример: перевод пациента с парентерального введения 500 мг левофлоксацина 1 раз в сутки на прием внутрь этого же антибиотика в той же самой дозе и с такой же кратностью введения. Обе лекарственные формы левофлоксацина терапевтически эквивалентны.
Последовательная терапия (switch therapy) — это перевод с парентерального введения медикамента на прием другого препарата внутрь, который относится к тому же классу лекарственных средств и оказывает сопоставимое терапевтическое действие.
Примеры: перевод с парентерального введения пенициллина на прием внутрь феноксиметилпенициллина или перевод с парентерального введения ванкомицина на прием внутрь тейкопланина.
Нисходящая терапия (step-down therapy) — перевод с парентерального введения медикамента на пероральный прием препарата, принадлежащего к другому классу лекарственных средств либо относящегося к ранее использованному классу, но с иной частотой применения, дозой или спектром активности (в случае антибиотиков).
Примеры: перевод больного с парентерального введения ампициллина/сульбактама по 1,5 г каждые 6 ч на прием внутрь амоксициллина/клавуланата по 875 мг каждые 12 ч либо перевод с парентерального введения цефтриаксона на пероральный цефалоспорин III поколения (цефподоксим проксетил и др.).
Комментарий. В медицинской литературе эти терминологические различия нередко игнорируются и обыкновенно под термином «ступенчатая терапия» понимают и последовательную, и нисходящую. Взаимозаменяемость терминов обусловлена тем, что они базируются на едином принципе: антибиотики, которые вводятся парентерально и применяются внутрь, должны иметь сходный или идентичный спектр активности [2].
Эквивалентно ли введение антибиотиков внутрь их парентеральному применению?
Одной из наиболее важных характеристик медикамента является его биодоступность. В общем виде этот показатель характеризует долю принятого внутрь лекарства, которая попадает в системный кровоток больного. При внутривенном введении препарата в системное кровообращение попадает 100 % дозы. У медикаментов, которые принимаются внутрь, биодоступность нередко ниже, что связано с различиями в скорости и степени растворения препарата в пищеварительном тракте и в количестве лекарства, которое достигает системного кровотока после всасывания (табл. 1). Хотя многие лекарства, которые вводятся внутривенно (в/в), отличаются лучшей биодоступностью, плазменные концентрации целого ряда медикаментов при приеме внутрь сопоставимы с таковыми при использовании парентеральных форм. Например, биодоступность лекарственных форм для приема внутрь некоторых современных антибиотиков составляет почти 100 % (офлоксацин) или равна 100 % (левофлоксацин) [3].
Таким образом, с точки зрения фармакологии лекарственные формы антибиотиков для парентерального введения и для приема внутрь в большинстве случаев неэквивалентны, хотя в отношении некоторых препаратов это утверждение не соответствует действительности.
Означает ли неэквивалентность лекарственных форм антибиотиков для перорального и парентерального применения, что они различаются по клинической эффективности?
При тяжелых инфекциях, по крайней мере на первом этапе лечения, антибиотики следует вводить парентерально (как правило, в/в), в то время как при инфекциях легкой степени тяжести основной путь введения антибиотиков — непарентеральный (не в силу клинического превосходства, а потому что удобнее для пациента и дешевле). При среднетяжелых инфекциях (по крайней мере некоторых локализаций) эффективность парентерального пути введения антибиотиков и приема их внутрь сопоставима. В качестве примера можно привести внебольничную пневмонию (ВП).
Традиционно госпитализация пациента рассматривается как показание к парентеральному введению антибиотиков. В действующем в Украине протоколе по оказанию помощи госпитализированным больным с ВП антибиотики рекомендуется назначать парентерально. Только для пациентов с нетяжелой ВП, госпитализированных в терапевтические отделения, допускается назначение макролидов внутрь — в отсутствие нарушений всасывания в кишечнике. При этом b-лактамные антибиотики, которые назначаются данной категории пациентов в комбинации с макролидами, предлагается вводить парентерально [4].
В действительности продемонстрировать превосходство парентерального введения антибиотиков над пероральным у госпитализированных больных с нетяжелой ВП не удалось. В метаанализе 7 сравнительных исследований у пациентов с обычным уровнем иммунитета назначение антибиотиков внутрь не сопровождалось ни снижением клинической эффективности, ни увеличением смертности больных (рис. 1) [5].
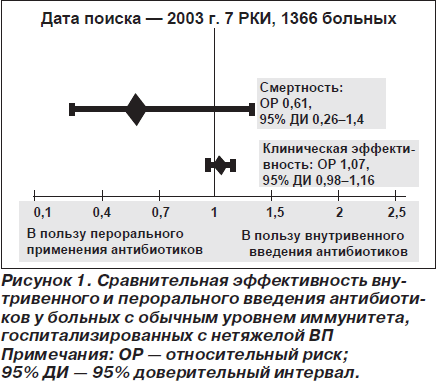
Какие антибиотики могут использоваться для ступенчатой терапии?
Если говорить о собственно ступенчатой терапии, то для приема внутрь используется тот же самый антибиотик, что применялся парентерально. Однако пероральная форма лекарства должна в идеале характеризоваться высокой биодоступностью (желательно 100%) и хорошей переносимостью при приеме внутрь, что бывает далеко не всегда.
Есть и любопытные исключения. Например, ванкомицин уникален в своем роде, поскольку его лекарственные формы для парентерального введения и для приема внутрь применяются по разным показаниям. Парентеральная форма используется для лечения инфекций, вызванных резистентными грамположительными бактериями. Лекарственная же форма для приема внутрь (в Украине не зарегистрирована) плохо всасывается и применяется почти исключительно для лечения диарей, вызванных Clostridiumdifficile. Поэтому ванкомицин не используется для ступенчатой терапии.
В целом ступенчатую терапию одним антибиотиком следует рассматривать как субоптимальную, если биодоступность лекарственной формы для приема внутрь < 60 % [3].
Для ступенчатой терапии могут использоваться и препараты, принадлежащие к одному классу и/или поколению антибиотиков. Однако в ряде случаев невозможно выбрать антибиотик для приема внутрь из того же класса препаратов, который применялся для парентерального введения. Например, карбапенемы (имипенем, дорипенем и др.) и ингибиторозащищенные карбокси- и уреидопенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) существуют только в лекарственных формах для парентерального введения. Поэтому при переводе больных, получающих перечисленные антибиотики, на долечивание препаратами для приема внутрь используются антибиотики других классов. То же самое справедливо и в случае применения цефтазидима — самого активного из цефалоспоринов III поколения в отношении Pseudomonasaeruginosa.
Поэтому оптимальными медикаментами для использования при ступенчатой терапии являются препараты, отличающиеся высокой биодоступностью (> 80 %) и хорошей переносимостью при приеме внутрь, эффективность которых подтверждена в качественных клинических исследованиях, включая рандомизированные (РКИ). Применительно к антибиотикам следует уточнить, что препарат для приема внутрь должен обладать спектром действия, сопоставимым с ранее использовавшимся парентеральным медикаментом, либо проявлять активность в отношении выделенного возбудителя. Способствуют повышению комплайентности и потому весьма желательны такие характеристики препарата, как наличие многих лекарственных форм для приема внутрь (например, таблеток и сиропов) и кратность применения, соответствующая (или меньше) таковой при использовании парентеральной формы препарата.
В табл. 2 перечислены наиболее употребительные антибактериальные средства, нашедшие применение в программах по переводу больных с парентерального введения медикаментов на прием их внутрь [6].
Каковы критерии исключения пациентов из числа кандидатов на перевод на пероральный прием антибиотиков?
Перевод больных на пероральный прием антибиотиков могут ограничивать 1) тяжесть заболевания (до улучшения клинического состояния после начальной парентеральной терапии); 2) локализация инфекционного процесса (инфекционный эндокардит, менингит, абсцесс мозга, орбитальный целлюлит, другие инфекции центральной нервной системы и эндофтальмит — заболевания, при которых антибиотики следует вводить парентерально); 3) залогом успеха ступенчатой терапии является адекватное всасывание медикамента в желудочно-кишечном тракте (ЖКТ), поэтому состояния, при которых нарушается всасывание, являются противопоказаниями к использованию этой технологии:
— наличие назогастрального зонда и отсасывание через него содержимого желудка;
— тяжелая/стойкая тошнота и рвота;
— синдром мальабсорбции, перенесенные резекция желудка или гастрэктомия, синдром короткого кишечника и другие состояния, при которых ускоряется время прохождения медикаментов через пищеварительный тракт и/или снижается всасывание;
— (продолжающееся) желудочно-кишечное кровотечение;
— введение высоких доз вазопрессоров (особенно в условиях шока);
— затруднения при глотании или нарушения сознания при отсутствии непосредственного доступа в желудок (например, через назогастральный зонд);
— документированная кишечная непроходимость;
— продолжающееся энтеральное питание, которое нельзя прекратить, а больной нуждается в приеме медикаментов, нарушающих всасывание.
Комментарий. При наличии назогастрального зонда и отсасывании через него содержимого желудка вся или часть дозы медикамента будет вскоре удалена, если только на какое-то время не приостановить процесс отсасывания. Больные, испытывающие затруднения при глотании, или с нарушениями сознания относятся к группе риска аспирации содержимого желудка. Пациенты, находящиеся в состоянии шока, не рассматриваются в качестве кандидатов для ступенчатой терапии из-за нарушения кровоснабжения пищеварительного тракта — вторичного по отношению к собственно шоку или вследствие введения вазопрессоров. В результате всосавшееся лекарство не будет должным образом поступать в системный кровоток.
При продолжающемся желудочно-кишечном кровотечении перевод больного на прием медикаментов внутрь возможен только после документированной его остановки.
Всасывание некоторых антибиотиков, в частности фторхинолонов, нарушается в условиях питания через энтеральный зонд.
Является ли энтеральное питание противопоказанием для проведения ступенчатой терапии?
Само по себе энтеральное питание не является абсолютным противопоказанием к проведению ступенчатой терапии — если только его невозможно прервать. Существуют определенные правила, облегчающие перевод больного с парентерального на непарентеральный путь введения медикаментов при наличии постоянного энтерального зонда [7, 8]:
1. Для введения через назогастральный зонд следует выбрать наиболее пригодную лекарственную форму препарата для приема внутрь. Растворы и суспензии предпочтительнее таблеток. Если такая возможность отсутствует, таблетку следует размельчить (при условии, что эта таблетка не относится к числу форм с постепенным высвобождением препарата или с кишечнорастворимым покрытием). Далее таблетку растворяют в небольшом количестве жидкости для приготовления суспензии и с помощью большого шприца вводят через зонд. После завершения процедуры все оборудование, использовавшееся для приготовления и введения препарата, ополаскивают и полученные смывы снова вводят через зонд.
2. Перед введением и после завершения введения медикамента зонд, через который осуществляется введение, промывают водой во избежание закупорки.
3. Ни в коем случае медикаменты не добавляются непосредственно к питательным смесям, вводимым через зонд.
4. При введении пероральных фторхинолонов следует прекратить энтеральное питание за 2 ч до введения и возобновить его не ранее чем через 2 ч после окончания процедуры.
Каковы критерии отбора больных для проведения ступенчатой терапии?
Успех ступенчатой терапии во многом будет зависеть от правильной идентификации больных, диагноза заболевания, выбора медикамента и учета противопоказаний для перевода пациента на пероральный прием лекарств. Критерии отбора больных для проведения ступенчатой терапии могут различаться, но в обязательном порядке включают в себя:
— интактный и функционирующий ЖКТ;
— улучшение клинического состояния после начальной парентеральной терапии.
Каковы критерии улучшения клинического состояния после начальной парентеральной терапии?
У больных с инфекциями под улучшением клинического состояния после начальной парентеральной терапии обыкновенно понимают нормализацию или снижение температуры тела, уменьшение лейкоцитоза и стабилизацию клинического состояния пациента. Снижение числа лейкоцитов указывает на затухание воспалительного процесса, связанного с инфекцией. Некоторые медикаменты, которые больной получает вместе с антибиотиками, могут повышать число лейкоцитов в периферической крови. Например, пациент с бактериальной инфекцией одновременно страдает неким диффузным заболеванием соединительной ткани, по поводу которого принимает глюкокортикостероиды. На фоне парентеральной антибиотикотерапии его состояние улучшается, а число лейкоцитов в периферической крови остается выше нормы. В этом случае безопасный перевод больного на прием антибиотиков внутрь вполне возможен. Наоборот, больные с нейтропенией (которая обычно определяется как содержание нейтрофилов менее 500 клеток в 1 мкл крови), как правило, не рассматриваются в числе кандидатов на перевод с парентерального введения лекарств на пероральный.
На решение врача о переводе больного с парентерального на непарентеральный путь введения антибиотика влияют многие факторы, значимость которых можно проиллюстрировать на примере больных с ВП. Согласно исследованию [9], эти факторы (в порядке убывания значимости) выглядят следующим образом:
— отсутствие гнойных осложнений (93 %);
— способность принимать медикаменты внутрь (79 %);
— исходная частота сердечных сокращений (ЧСС) (64 %);
— отрицательные результаты посевов крови (63 %);
— нормальная температура тела (62 %);
— исходная оксигенация крови (55 %);
— исходный психический статус (50 %).
Согласно тому же исследованию, 58 % опрошенных врачей полагают, что перед переводом больного на прием антибиотиков внутрь температура тела должна быть нормальной в течение 24 ч, а 19 % считают, что пациент должен получать стандартный курс в/в введения антибиотиков. Некая медиана параметров, при наличии которых больного можно переводить на прием антибиотиков внутрь, по мнению опрошенных выглядит так:
— температура тела Ј 37,8 °С;
— частота дыхательных движений (ЧДД) Ј 20 в 1 мин;
— ЧСС Ј 100 уд/мин;
— систолическое артериальное давление (АД) і 100 мм рт.ст.
— насыщение крови кислородом при дыхании комнатным воздухом (SaO2) і 90 %.
По мнению другой группы авторов [10], для безопасного перевода больных на ступенчатую терапию необходимо наличие 4 критериев:
— улучшение кашля и респираторного дистресса;
— отсутствие лихорадки в течение не менее 8 ч;
— число лейкоцитов находится в пределах нормы;
— больной способен принимать лекарства внутрь.
В нашей стране критериями перевода больных с ВП на пероральный прием антибиотиков признаны следующие:
— нормальная температура тела во время двух последних измерений с интервалом 8 ч;
— уменьшение выраженности одышки;
— отсутствие нарушений сознания;
— позитивная динамика других симптомов заболевания;
— отсутствие нарушений всасывания в пищеварительном тракте;
— согласие (настроенность) больного на прием препаратов внутрь [4].
По мнению экспертов IDSA/ATS (Американского общества инфекционных болезней и Американского торакального общества), критериями стабилизации клинического состояния пациента являются:
— температура тела Ј 37,8 °С;
— ЧСС Ј 100 ударов в 1 мин;
— ЧДД Ј 24 в 1 мин;
— систолическое АД і 90 мм рт.ст.;
— SaO2 і 90 % или напряжение кислорода в артериальной крови (PaO2) > 60 мм рт.ст. при дыхании комнатным воздухом;
— способность принимать препараты внутрь;
— отсутствие нарушений сознания [11].
При этом 2 последних критерия имеют значение для решения вопроса о выписке больного или переводе его на прием антибиотиков внутрь, но не являются необходимыми для суждения об отсутствии эффекта от антибактериальной терапии (АБТ) [11].
Как влияют на эффективность ступенчатой терапии сопутствующая медикаментозная терапия и прием пищи?
Успех ступенчатой терапии во многом будет зависеть от того, насколько удастся избежать риска межлекарственных взаимодействий и отрицательного влияния питания пациента на эффективность антибиотиков. Например, фторхинолоны ципрофлоксацин, левофлоксацин и моксифлоксацин великолепно подходят для ступенчатой терапии благодаря высокой биодоступности, быстрому всасыванию и хорошему проникновению в органы и ткани. Однако всасывание фторхинолонов снижается при одновременном использовании соединений, содержащих двух- и трехвалентные катионы, антацидов, сукральфата. Так, левофлоксацин следует применять не позднее чем за 2 ч и не раньше чем через 2 ч после использования вышеперечисленных препаратов. Для ципрофлоксацина соответствующие показатели составляют 2 и 6 ч, для моксифлоксацина — 4 и 8 ч. Из-за своих физических характеристик суспензия ципрофлоксацина не вводится через назогастральный зонд. Перечисленные фторхинолоны могут приниматься внутрь вне зависимости от приема пищи [6].
Линезолид является слабым неселективным обратимым ингибитором моноаминоксидазы (МАО). Больным, принимающим этот антибиотик, следует избегать продуктов и напитков, содержащих большие количества тирамина, из-за опасности реакций типа серотонинового синдрома и тяжелых гипертензивных реакций [12].
Прием пищи оказывает разное влияние на всасывание других антибиотиков. Перед переводом больного на прием антибиотиков внутрь следует ознакомиться с инструкцией по их применению.
Биодоступность при приеме внутрь триазоловых противогрибковых средств флуконазола, итраконазола и вориконазола остается приемлемой (в случае адекватного использования). У большинства больных флуконазол хорошо всасывается, причем прием пищи и изменения pH желудочного сока не влияют на всасывание. В одном из исследований у хирургических больных с нарушенным всасыванием в пищеварительном тракте и получавших энтеральное питание биодоступность флуконазола составила 100 % [13]. В отличие от других триазолов для всасывания итраконазола необходима кислая среда в желудке. Антациды, блокаторы H2-гистаминовых рецепторов, ингибиторы протонной помпы, сукральфат существенно снижают биодоступность этого препарата. По рекомендации производителя, больным, получающим блокаторы H2-гистаминовых рецепторов, итраконазол следует запивать колой. Жидкие лекарственные формы итраконазола лучше всасываются натощак, капсулы следует принимать вместе с приемом пищи. Напротив, вориконазол лучше всасывается, если принимается за 1 ч до еды или спустя 1 ч после приема пищи. Лекарственные формы итраконазола и вориконазола для внутривенного введения противопоказаны больным с дисфункцией почек из-за опасности накопления и проявления токсичности циклодекстрана, который содержится в растворах обоих препаратов.
Насколько выгодно внедрение ступенчатой терапии для стационаров?
Системы здравоохранения, сложившиеся в разных странах, весьма различаются, поэтому данные, полученные в одной из стран, не всегда применимы к другой. Но попробовать проследить некоторые тенденции стоит. Пример прежний — больные с ВП.
В США в 2007 г. 31 % всех затрат на здравоохранение приходился на долю пребывания и питания больных в стационаре [14], в то время как стоимость антибиотиков составляет 2–5 % от всех расходов на лечение госпитализированных больных [15–20].
Приблизительно 10 % госпитализаций в США связаны с заболеваниями дыхательной системы, 35 % из них обусловлены пневмонией (средняя длительность пребывания в стационаре 5,1 сут.) [21]. В 2005 г. грипп/пневмония были 8-й ведущей причиной смерти в США, на их долю приходилось 2,6 % всех смертей госпитализированных больных [22].
Сокращение длительности пребывания больных в стационаре должно быть одной из основных целей в перечне мер по сокращению расходов на здравоохранение, связанных с антимикробной терапией [19]. Этот тезис можно подтвердить, например, такими данными: стоимость стационарного лечения больных с пневмониями примерно в 25 раз выше, чем амбулаторного [11, 23].
Согласно базе данных US Medicare Pneumonia Project, у клинически стабильных пациентов нет необходимости придерживаться рутинной практики — продолжения наблюдения за больным с ВП в условиях стационара после перевода его с в/в на пероральный прием антибиотиков [24].
В одном из ранних исследований ступенчатой терапии у больных с ВП сообщалось о сокращении длительности пребывания в стационаре на 3,4 сут. [25], причем 44 % госпитализированных пациентов с ВП могут эффективно лечиться с использованием ступенчатой терапии и ранней выписки из стационара. Ступенчатая терапия не ухудшает исходы ВП, но позволяет сократить длительность нахождения больных в стационаре и ассоциируется с высоким уровнем удовлетворенности данной стратегией лечения (более 95 % пациентов). Эта же группа авторов в более поздней работе подтвердила, что внедрение ступенчатой терапии позволяет сократить длительность пребывания больных в стационаре более чем на 2 сут. [11]. Сопоставимые данные (безопасность раннего перевода пациентов с тяжелой ВП на пероральный прием антибиотиков, сокращение длительности пребывания в стационаре в среднем на 2 дня) были получены и в более поздних исследованиях [26], и, наконец, в метаанализах (рис. 2, 3) [27, 28].
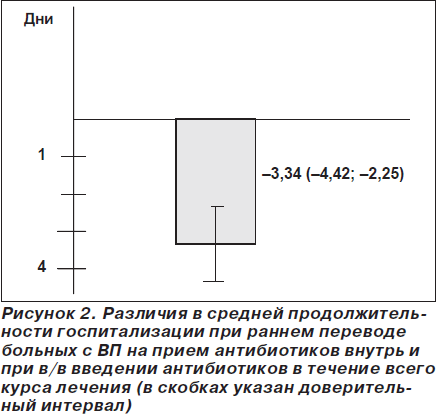
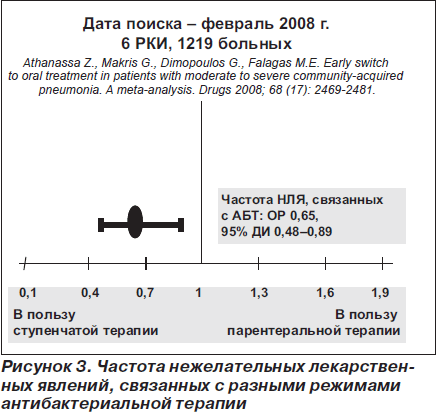
Своевременный перевод с в/в на пероральный прием антибиотиков больных с ВП позволяет снизить стоимость лечения не только вследствие ранней выписки из стационара, но и за счет различных цен на парентеральные и таблетированные препараты, уменьшения расхода шприцев, капельниц, стерильных растворов и др. [1, 29, 30].
Вообще, анализ стоимости лечения не может ограничиваться учетом расходов на приобретение медикаментов и сроками госпитализации. Он должен также включать:
— расходы на медицинский и фармацевтический персонал, заказывающий, готовящий и применяющий антибиотики;
— стоимость расходных материалов и их утилизации;
— стоимость терапевтического лекарственного мониторинга;
— возможную дополнительную стоимость комбинированной АБТ;
— стоимость сопутствующей терапии;
— расходы на устранение НЛЯ;
— стоимость преодоления распространяющейся антибиотикорезистентности;
— расходы, связанные с клиническими неудачами, включая увеличение длительности пребывания в стационаре и повторные госпитализации [1, 31, 32].
Стоимость рабочего времени персонала больницы, затраченного на лечение больного, стоимость расходных материалов и другие сопутствующие расходы составляют от 11 до 53 % ежедневной стоимости АБТ [32]. При в/в введении антибиотиков дополнительные расходы на хранение, маркировку, разведение и введение составляют примерно 10 долларов США на 1 дозу препарата. Медикаменты с коротким периодом полувыведения вводятся чаще, что увеличивает расходы на персонал за счет времени, необходимого для приготовления и введения этих препаратов. Стоимость мониторирования введения некоторых медикаментов превосходит стоимость самих лекарств [31].
Расходы на лечение инфекций, вызванных антибиотикорезистентными патогенами, на 6000–30 000 долларов США превышают расходы на лечение инфекций, вызванных антибиотикочувствительными микроорганизмами [33].
Не столь очевидная польза от ступенчатой терапии заключается в уменьшении частоты внутрисосудистых катетерных инфекций [34]. Ступенчатая терапия может также использоваться как составная часть программы по снижению селективного давления антибиотиков, в особенности цефалоспоринов, на эндемичных госпитальных возбудителей, например Clostridiumdifficile и грамотрицательных продуцентов b-лактамаз расширенного спектра действия (БЛРС).
Безусловно, не все из вышесказанного свидетельствует в пользу ступенчатой терапии. Например, НЛЯ, возникшие у больных, получающих антибиотики амбулаторно, нередко обусловливают дополнительные визиты к врачам и/или госпитализацию, что следует учитывать при оценке стоимости АБТ. Однако экономическая выгода для стационаров от внедрения ступенчатой терапии несомненна.
Какую выгоду могут извлечь пациенты от внедрения ступенчатой терапии?
Среди преимуществ ступенчатой терапии для пациента можно выделить следующие:
— уменьшение количества инъекций и, следовательно, более комфортное лечение;
— уменьшение риска постъинъекционных осложнений (абсцессов, флебитов, катетер-ассоциированных инфекций);
— ранняя выписка и продолжение лечения в более привычных и удобных домашних условиях в сочетании со снижением риска нозокомиальных инфекций [1].
С другой стороны, существуют и аргументы против ступенчатой терапии. Во-первых, у части общества сформировалось представление, что «настоящее» лечение — это когда антибиотики (и не только они) вводятся парентерально. Пациенты, настроенные подобным образом, негативно отнесутся к переводу на «таблетки».
Во-вторых, ранняя выписка из стационара означает, что больному придется приобретать антибиотики самостоятельно. (Как будто в стационарах в сложившихся условиях они предоставляются бесплатно!) В-третьих, уход за больным в домашних условиях нередко ложится на родственников, да и сами эти условия могут быть хуже, чем в больнице. В-четвертых, неприятные органолептические свойства выписанного антибиотика (большие размеры таблеток, отталкивающие вкус или запах), неудобная схема дозирования (необходимость приема более 2 раз в сутки) могут негативно сказаться на комплайентности (соблюдении предписанного режима дозирования) и, соответственно, привести к рецидивам и повторным госпитализациям.
Что касается комплайентности, то, вопреки распространенным заблуждениям, низкая приверженность к терапии не связана ни с возрастом, ни с полом больного, ни с его семейным или социальным положением, уровнем образования, доходами, ни даже со стоимостью препарата или отсутствием необходимости платить за лекарство [35]. Приверженность к приему лекарств — будь она высокой или низкой — является одной из черт личности человека.
Среди перспективных подходов к улучшению приверженности к терапии можно выделить следующие:
— уменьшение кратности приема антибиотиков;
— сокращение продолжительности терапии;
— выбор приемлемой для пациента или его родителей лекарственной формы либо упаковки препарата;
— выведение на рынок медикаментов с улучшенной переносимостью;
— выдача пациенту (либо его родственникам и/или опекунам) письменных инструкций по приему антибиотиков;
— обучение больного;
— использование разных форм напоминания о времени приема очередной дозы [36].
Некоторые из этих подходов вполне могут быть реализованы в ходе ступенчатой терапии. В частности, выше уже отмечалось, что повышению комплайентности способствуют и потому желательны такие характеристики препарата, как наличие многих лекарственных форм для приема внутрь и кратность применения, не превышающая таковую при использовании парентеральной формы антибиотика.
Какие вопросы использования ступенчатой терапии и сегодня остаются предметом дискуссии?
Нет единства мнений по таким вопросам, как минимальная длительность пребывания больного в стационаре до перевода на прием лекарств внутрь, минимальное количество парентеральных введений препаратов перед переводом и др.
Какая доля больных и в какие сроки может быть переведена на ступенчатую терапию?
На конкретные цифры будут влиять нозологическая форма инфекционного заболевания, его тяжесть, сопутствующая патология, принятые в лечебном учреждении критерии стабилизации клинического состояния и другие факторы. Например, по оценкам экспертов IDSA/ATS, две трети больных с ВП, госпитализированных в стационар, могут быть переведены с в/в введения антибиотиков на прием их внутрь спустя 3 сут от начала заболевания, а большинство пациентов, не нуждающихся в госпитализации в отделения реанимации и интенсивной терапии (ОРИТ), — к 7-му дню госпитализации [11].
Можно ли рассматривать проведение полного курса пероральной антибактериальной терапии или перевод больных на прием антибиотиков внутрь после однократного парентерального введения в качестве альтернатив ступенчатой терапии?
Действительно, существуют режимы, альтернативные раннему переводу больных с в/в на пероральный прием антибиотиков:
— лечение больных от начала до конца пероральными антибиотиками;
— введение одной дозы антибиотика в/в перед переводом пациента на прием препарата внутрь.
Например, лечение больных с ВП антибиотиками исключительно для приема внутрь (обычно фторхинолонами) может быть полезной стратегией по снижению расходов на лечение по сравнению со стартовой парентеральной АБТ. В сравнительном исследовании 129 больных с тяжелой ВП, госпитализированных в общетерапевтические отделения («не-ОРИТ»), пациенты были рандомизированы в группы пероральной терапии левофлоксацином по 500 мг 2 раза в сутки (n = 77) и последовательной терапии цефтриаксоном 2,0 г/сут (с добавлением (n = 20) или без добавления кларитромицина (n = 17) в/в или внутрь) с последующим переводом на прием антибиотиков внутрь [37]. Клиническая эффективность обоих сравниваемых режимов была одинаковой (92 %), длительность терапии — тоже (12,1 ± 8,7 дня в группе левофлоксацина, 13,5 ± 3,6 дня — в группе последовательной терапии). Однако лечение левофлоксацином оказалось экономически более выгодным, в том числе и за счет сокращения времени, которое тратил средний медицинский персонал на введение медикаментов [37].
Сопоставимые клиническая эффективность, продолжительность лечения и длительность пребывания больных с ВП в стационаре установлены и в другом сравнительном исследовании пероральной терапии фторхинолонами и последовательной терапии цефтриаксоном и цефуроксим аксетилом (в комбинации с макролидом или без него) [38].
Таким образом, лечение больных с ВП от начала до конца антибиотиками для приема внутрь в ряде случаев может быть альтернативой ступенчатой терапии. Однако у больных с тяжелыми заболеваниями (например пациентов с ВП, госпитализированных в ОРИТ) лечение следует начинать с парентерального введения антибиотиков. Оптимальная длительность парентеральной терапии точно не установлена. Чаще всего перевод больных на прием антибиотиков внутрь рекомендуется начинать после достижения клинической стабилизации состояния пациента. Исходя из этого, введения одной дозы антибиотика в/в перед переводом больного на прием препарата внутрь может оказаться недостаточно. Данная альтернатива ступенчатой терапии возможна (по крайней мере, у части пациентов), но как минимум нуждается в дальнейшем изучении.
В какие сроки следует переводить больных с парентерального пути введения антибиотиков на пероральный?
Существует 2 подхода к определению сроков перевода больных с парентерального введения антибиотиков на прием их внутрь. Первый из них заключается в достижении стабилизации клинического состояния пациента, второй — в волевом переводе спустя определенный срок парентеральной АБТ (обычно — 2 сут. и более), вне зависимости от достигнутого эффекта [39].
Каковы достоинства и недостатки раннего перевода больных с парентерального введения антибиотиков на прием их внутрь?
Достоинствами раннего перевода на пероральный прием являются снижение стоимости лечения и возможность ранней выписки из стационара для долечивания в амбулаторных условиях. К предполагаемым недостаткам следует отнести возрастание риска клинических неудач, повторных госпитализаций и смертности, а также увеличение нагрузки на членов семьи и работников системы здравоохранения, оказывающих помощь больному в амбулаторных условиях [40].
Отсутствие качественных данных, касающихся пути введения антибиотиков у тяжелых госпитализированных больных с ВП, длительности терапии, методов оценки клинической стабильности влечет за собой консервативный подход к лечению (длительная парентеральная АБТ) и удлинение сроков пребывания в стационаре [41].
Возможность раннего перевода больных с тяжелой ВП с в/в введения антибиотиков на прием их внутрь тестировался в нескольких исследованиях. В недавнем метаанализе ранней ступенчатой терапии у госпитализированных больных со среднетяжелой и тяжелой ВП проанализированы результаты 6 РКИ у 1219 пациентов [28]. Под ранним переводом больных на прием антибиотиков внутрь понимали перевод спустя 2–4 сут. от начала антибиотикотерапии. В 4 РКИ тестировались разные лекарственные формы одного и того же антибиотика, в 2 РКИ — последовательная терапия.
В 5 РКИ эффективность ранней ступенчатой и постоянной в/в терапии оказалась сопоставимой [26, 42–45], в то время как в 1 РКИ она была ниже [46]. В целом у 86,2 % больных в группе ранней ступенчатой терапии и у 86,5 % пациентов из группы постоянной в/в терапии лечение оказалось эффективным. Длительность пребывания в стационаре в анализируемых РКИ существенно различалась как в группе ранней ступенчатой терапии (4,1–11 сут.), так и у пациентов из группы постоянной в/в терапии (8,2–13 сут.). В 5 РКИ длительность пребывания в стационаре в группе ранней ступенчатой терапии была меньше, чем в группе постоянной в/в терапии, еще в 1 РКИ различия по величине этого показателя отсутствовали.
Согласно результатам метаанализа, ступенчатая терапия не уступала постоянной в/в терапии ни по клинической эффективности, ни по влиянию на смертность или частоту рецидивов (рис. 4). О лучшей переносимости ступенчатой терапии и позитивном влиянии на длительность пребывания в стационаре говорилось выше (см. рис. 2 и 3).

Таким образом, большинство больных со среднетяжелой и тяжелой ВП можно переводить на пероральный прием антибиотиков уже в ранние сроки после начала парентеральной АБТ (спустя 2–4 сут.). Точное время перевода определяется исходя из сроков достижения клинической стабилизации состояния пациента.
Чем ступенчатая терапия отличается от деэскалационной?
Как указывалось выше, под ступенчатой терапией понимают двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента [1]. Деэскалационная же терапия предполагает первоначальное назначение антибиотика (или комбинации антибиотиков), спектр действия которого (которых) охватывает практически всех возможных возбудителей заболевания, с последующим переходом (после получения результатов микробиологического исследования) на целенаправленную АБТ препаратом (препаратами) более узкого спектра действия. При этом подчеркивается необходимость сокращения сроков АБТ до разумной достаточности [47].
В общем виде основные принципы деэскалации можно представить так:
— уменьшение количества и/или сужение спектра антибиотиков;
— незамедлительная отмена антибиотика (-ов) у больных с подтвержденной неинфекционной этиологией заболевания.
К сожалению, при инфекциях, вызванных неферментирующими грамотрицательными палочками, использовать деэскалацию удается нечасто, а в случаях, когда идентифицировать возбудителя заболевания не удалось, применить эту технологию невозможно.
По существу деэскалация является одним из компонентов современной стратегии лечения больных с тяжелыми инфекциями («лечи сразу правильно»), которая включает в себя:
— раннее применение антибиотиков широкого спектра действия;
— использование оптимальной дозы и пути введения препарата;
— выбор антибиотиков на основании локального профиля резистентности ключевых возбудителей;
— раннюю коррекцию или прекращение антибактериальной терапии в зависимости от результатов микробиологического исследования (деэскалация);
— адекватную длительность антибактериальной терапии [48].
Появление стратегии «лечи сразу правильно» продиктовано следующими обстоятельствами. На протяжении десятилетий доминирующей схемой применения антибиотиков у тяжелых больных была так называемая восходящая: если не «работали» препараты первого ряда, назначали антибиотики более «мощные» (второго ряда). В условиях низкого уровня резистентности к антибиотикам такой подход к назначению лечения был клинически и экономически оправданным. Однако во второй половине восьмидесятых — девяностых годах прошлого столетия человечество столкнулось с проблемой повсеместного роста резистентности (устойчивости) клинически значимых микроорганизмов к наиболее употребительным антибиотикам. До достижения определенного порога (для каждой нозологической единицы — разного) резистентность не трансформировалась в клинические неудачи. Однако после преодоления данного порога случаи неуспеха АБТ лавинообразно нарастали.
В изменившихся условиях принципиальное значение приобретает своевременное и адекватное (по спектру действия, разовой и суточной дозе, своевременности назначения, длительности применения, способности противостоять факторам защиты бактерий и недопускать возникновения новых защитных механизмов) применение антибиотиков. Неадекватная стартовая эмпирическая АБТ по сравнению с адекватной сопровождается статистически значимым увеличением смертности (как общей, так и атрибутивной, то есть обусловленной собственно инфекционным заболеванием), длительности пребывания больного в стационаре, расходов на лечение. Эти данные, полученные, главным образом, в ходе исследований у больных с тяжелыми инфекциями нижних дыхательных путей и кровотока [49–55], легли в основу стратегии «лечи сразу правильно». Внедрение принципов данной стратегии в клиническую практику, как полагают, позволит повысить эффективность терапии при одновременном сокращении расходов на лечение (не столько путем снижения расходов на приобретение и введение антибиотиков, сколько за счет уменьшения длительности пребывания больного в стационаре) и минимизации риска появления резистентности в процессе лечения.
Таким образом, ступенчатая и деэскалационная терапия суть разные технологии разумного использования антибиотиков.
Выводы
1. Ступенчатая терапия — это двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента.
2. Антибиотики, которые при ступенчатой терапии вводятся парентерально и применяются внутрь, должны иметь сходный или идентичный спектр активности. Антибиотик для приема внутрь может быть тем же, который использовался для парентерального введения, принадлежать к тому же классу и, в ряде случаев, — к другому классу антибиотиков.
3. При лечении больных с тяжелыми бактериальными инфекциями антибиотики сначала следует вводить парентерально. Большинство пациентов в разные сроки могут быть с успехом переведены на пероральный прием антибиотиков. При некоторых инфекциях (инфекционный эндокардит, менингит, абсцесс мозга, орбитальный целлюлит, другие инфекции центральной нервной системы и эндофтальмит) больных на прием антибиотиков внутрь не переводят — в силу тяжести собственно инфекции и/или локализации инфекционного процесса.
4. Внедрение ступенчатой терапии — при сохранении высокой клинической эффективности парентерального введения антибиотиков на протяжении всего курса лечения — обеспечивает немалую экономическую выгоду для стационаров.
5. Наряду с преимуществами для стационаров ступенчатая терапия предоставляет выгоду и для пациентов — за счет уменьшения количества инъекций и, следовательно, более комфортного лечения; уменьшения риска постъинъекционных осложнений (абсцессов, флебитов, катетер-ассоциированных инфекций); ранней выписки и продолжения лечения в более привычных и удобных домашних условиях в сочетании со снижением риска нозокомиальных инфекций.
6. Несмотря на наличие критериев исключения, ступенчатая терапия пригодна для большинства пациентов.
7. Проведение полного курса пероральной антибактериальной терапии и перевод больных на прием антибиотиков внутрь после однократного парентерального введения антибиотика или парентеральной антибиотикотерапии на протяжении одних суток могут быть альтернативами ступенчатой терапии. Однако у больных с тяжелыми заболеваниями лечение следует начинать с парентерального введения антибиотиков. Оптимальная длительность парентеральной терапии точно не установлена и нуждается в дальнейшем изучении.
8. При внебольничных пневмониях и других инфекциях больных можно переводить на пероральный прием антибиотиков уже в ранние сроки после начала парентеральной антибиотикотерапии (спустя 2–4 сут.). Точное время перевода определяется исходя из сроков достижения клинической стабилизации состояния пациента.
9. Ступенчатая и деэскалационная терапия — суть разные технологии разумного использования антибиотиков.
1. Страчунский Л.С., Розенсон О.Л. Ступенчатая терапия: новый подход к применению антибактериальных препаратов // Клин. фармакол. тер. — 1997. — 6(4).
2. Lelekis M., Gould I.M. Sequential antibiotic therapy for cost containment in the hospital setting: why not? // J. Hosp. Infect. — 2001. — 48. — 249-257.
3. Shah P.M. Sequential or switch treatment — which criteria should be fulfilled? // Int. J. Antimicrob. Agents. — 2000. — 16. — 301-302.
4. Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19.03.2007 р. № 128.
5. Marras T.K., Nopmaneejumruslers C., Chan C.K. Efficacy of exclusively oral antibiotic therapy in patients hospitalized with non-severe community-acquired pneumonia: a retrospective study and meta-analysis // Am. J. Med. — 2004. — 116. — 385-93.
6. Lacy C.F., Armstrong L.L., Goldman M.P. et al. Drug Information Handbook. — 15th ed. — Hudson, OH: Lexi-Comp, 2007.
7. Lourenco R. Enteral feeding: Drug/nutrient interaction // Clin. Nutr. — 2001. — 20(2). — 187- 193.
8. Gilbar P.J. A guide to enteral drug administration in palliative care // J. Pain Symptom Manage. — 1999. — 17. — 197-207.
9. Halm E.A., Switzer G.E., Mittman B.S. et al. What factors influence physicians, decisions to switch from intravenous to oral antibiotics for community-acquired pneumonia? // J. Gen. Intern. Med. — 2001. —16 (9). — 599-605.
10. Ramirez J.A. Managing antiinfective therapy of community-acquired pneumonia in the hospital setting: focus on switch therapy // Pharmacotherapy. — 2001. — 21(7 Pt 2). — 79S-82S.
11. Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2007. — 44(suppl.). — S27-S72.
12. Huang V., Gortney J.S. Risk of serotonin syndrome with concomitant administration of linezolid and serotonin agonists // Pharmacotherapy. — 2006. — 26. — 1784-1793.
13. Pelz R.K., Lipsett P.A., Swoboda P.A. et al. Enteral fluconazole is well absorbed in critically ill surgical patients // Surgery. — 2002. — 131. — 534-540.
14. Centers for Medicare & Medicaid Services, Office of the Actuary, National Health Statistics Group. The nation’s health dollar, calendar year 2007: where it went (pie chart). (CMS Website.) Available at: http://www.cms.hhs.gov/NationalHealthExpendData/downloads/PieChartSourcesExpenditures2007.pdf.
15. Niederman M.S., McCombs J.S., Unger A.N., Kumar A., Popovian R. The cost of treating community-acquired pneumonia // Clin. Ther. — 1998. — 20. — 820-837.
16. Nicolau D.P. The challenge of prescribing treatment for respiratory tract infections // Am. J. Manag. Care. — 2000. — 69(suppl.). — S419-S426.
17. Dresser L.D., Niederman M.S., Paladino J.A. Cost-effectiveness of gatifloxacin vs ceftriaxone with a macrolide for the treatment of community-acquired pneumonia // Chest. — 2001. — 119. — 1439-1448.
18. Orrick J.J., Segal R., Johns T.E., Russell W., Wang F., Yin D.D. Resource use and cost of care for patients hospitalised with community acquired pneumonia: impact of adherence to Infectious Diseases Society of America guidelines // Pharmacoeconomics. — 2004. — 22. — 751-757.
19. Frei C.R., Burgess D.S. Cost-effectiveness of 4 empiric antimicrobial regimens in patients with community-acquired pneumonia // Formulary. — 2005. — 40. — 298-303.
20. Sun H.K., Nicolau D.P., Kuti J.L. Resource utilization of adults admitted to a large urban hospital with community-acquired pneumonia caused by Streptococcus pneumoniae // Chest. — 2006. — 130. — 807-814.
21. DeFrances C.J., Lucas C.A., Buie V.C., Golosinskiy A. 2006 national hospital discharge survey // Natl. Health Stat. Rep. — 2008. —1-20.
22. Kung H.C., Hoyert D.L., Xu J., Murphy S.L. Deaths: final data for 2005 // Natl. Vital Stat. Rep. — 2008. — 56. — 1-120.
23. Restrepo M.I., Frei C.R. Health economics of use fluoroquinolones to treat patients with community-acquired pneumonia // Am. J. Med. — 2010. — 123. — S39- S46.
24. Nathan R.V., Rhew D.C., Murray C., Bratzler D.W., Houck P.M., Weingarten S.R. In-hospital observation after antibiotic switch in pneumonia: a national evaluation // Am. J. Med. — 2006. — 119(6). — 512.e1-7.
25. Ramirez J.A., Vargas S., Ritter G.W. et al. Early switch from intravenous to oral antibiotics and early hospital discharge: a prospective observational study of 200 consecutive patients with community-acquired pneumonia // Arch. Intern. Med. — 1999. — 159(20). — 2449-2454.
26. Oosterheert J.J., Bonten M.J., Schneider M.M., Buskens E., Lammers J.W., Hustinx W.M. Effectiveness of early switch from intravenous to oral antibiotics in severe community acquired pneumonia: multicentre randomised trial // BMJ. — 2006. — 333(7580). — 1193.
27. Rhew D.C., Tu G.S., Ofman J. et al. Early switch and early discharge strategies in patients with community-acquired pneumonia: a meta-analysis // Arch. Intern. Med. — 2001. — 161(5). — 722-727.
28. Athanassa Z., Makris G., Dimopoulos G., Falagas M.E. Early switch to oral treatment in patients with moderate to severe community-acquired pneumonia: a meta-analysis // Drugs. — 2008. — 68. — 2469-2481.
29. Hoнuков B.E., Макарова О.В., Маликов В.Е. Внебольничная пневмония: ступенчатая терапия левофлоксацином // Пульмонология. — 2003. — 13(2). — 97-100.
30. Wawruch M., Bozekova L., Krcmery S. et al. Cost-effectiveness analysis of switching from intravenous to oral administration of antibiotics in elderly patients // Bratisl. Lek. Listy. — 2004. — 105(10-11). — 374-378.
31. Cunha B.A. Principles of antibiotic formulary selection for P&T committees. Part 5: the cost of antimicrobial therapy // Pharm. Ther. — 2003. — 28. — 662-665.
32. Van Zanten A.R., Engelfriet P.M., van Dillen K., van Veen M., Nuijten M.J., Polderman K.H. Importance of nondrug costs of intravenous antibiotic therapy // Crit. Care. — 2003. — 7. — R184-R190.
33. Cosgrove S.E. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs // Clin. Infect. Dis. — 2006. — 42(suppl. 2). — S82-S89.
34. Wilcox M.H. Implementation of sequential therapy programs — a microbiologist's view // J. Infect. — 1998. — 37(suppl. 1). — 51-54.
35. Kardas P. Patient compliance with antibiotic treatment for respiratory tract infections // J. Antimicrob. Chemother. — 2002. — 49. — 897-903.
36. Березняков И.Г. Пути повышения приверженности к приему антибиотиков // Фармация Казахстана. — 2010. — 2. — 13-16.
37. Wasserfallen J.B., Erard V., Cometta A., Calandra T., Lamy O. Cost-effectiveness of full-course oral levofloxacin in severe community-acquired pneumonia // Eur. Respir. J. — 2004. — 24. — 644-648.
38. Lode H., File T.M. Jr, Mandell L., Ball P., Pypstra R., Thomas M., for the 185 Gemifloxacin Study Group. Oral gemifloxacin versus sequential therapy with intravenous ceftriaxone/oral cefuroxime with or without a macrolide in the treatment of patients hospitalized with community-acquired pneumonia: a randomized, open-label, multicenter study of clinical efficacy and tolerability // Clin. Ther. — 2002. — 24. — 1915-1936.
39. Castro-Guardiola A., Viejo-Rodriguez A.L., Soler-Simon S. et al. Efficacy and safety of oral and early-switch therapy for community-acquired pneumonia: a randomized controlled trial // Am. J. Med. — 2001. — 111. — 367-74.
40. Березняков И.Г. Внебольничные пневмонии. — Донецк: издатель Заславский А.Ю., 2009.
41. Mills G.D., Laing R. Severe community acquired pneumonia // BMJ. — 2006. — 333. — 1181-2.
42. Siegel R.E., Halpern N.A., Almenoff P.L., Lee A., Cashin R., Greene J.G. A prospective randomized study of inpatient IV antibiotics for community-acquired pneumonia: the optimal duration of therapy // Chest. — 1996. — 110. — 965-971.
43. Omidvari K., de Boisblanc B.P., Karam G., Nelson S., Haponik E., Summer W. Early transition to oral antibiotic therapy for community-acquired pneumonia: duration of therapy, clinical outcomes, and cost analysis // Respir. Med. — 1998. — 92. — 1032-1039.
44. Norrby S.R., Petermann W., Willcox P.A., Vetter N., Salewski E. A comparative study of levofloxacin and ceftriaxone in the treatment of hospitalized patients with pneumonia // Scand. J. Infect. Dis. — 1998. — 30. — 397-404.
45. Yaqub A., Khan Z. Comparison of early intravenous to oral switch amoxicillin/clavulanate with parenteral ceftriaxone in treatment of hospitalized patients with community acquired pneumonia // Pak. J. Med. Sci. — 2005. — 21. — 259-266.
46. Castro-Guardiola A., Viejo-Rodriguez A.L., Soler-Simon S. et al. Efficacy and safety of oral and early-switch therapy for community-acquired pneumonia: a randomized controlled trial // Am. J. Med. — 2001. — 111. — 367-374.
47. Kollef M. Appropriate empirical antibacterial therapy for nosocomial infections: getting it right the first time // Drugs. — 2000. — 63(20). — 2157-68.
48. Masterton R.G. // Int. J. Antimicrob. Agents. — 2009. — 33. — 105.e1- 105.e8.
49. Alvarez-Lerma F. Modification of empiric antibiotic treatment in patients with pneumonia acquired in the intensive care unit. ICU-Acquired Pneumonia Study Group // Intensive Care Med. — 1996. — 22. — 387-94.
50. Luna C.M., Vujacich P., Niederman M.S. et al. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia // Chest. — 1997. — 111. — 676-85.
51. Rello J., Gallego M., Mariscal D., Sonora R., Valles J. The value of routine microbial investigation in ventilator-associated pneumonia // Am. J. Respir. Crit. Care Med. — 1997. — 156. — 196-200.
52. Kollef M.H., Ward S. The influence of mini-BAL cultures on patient outcomes: implications for the antibiotic management of ventilator-associated pneumonia // Chest. — 1998. — 113. — 412-20.
53. Leibovici L., Shraga I., Drucker M., Konigsberger H., Samra Z., Petlik S.D. The benefit of appropriate empirical antibiotic treatment in patients with bloodstream infection // J. Intern. Med. — 1998. — 244. — 379-86.
54. Kollef M.H., Sherman G., Ward S., Frazer V.J. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients // Chest. — 1999. — 115. — 462-74.
55. Ibrahim E.H., Sherman G., Ward S., Frazer V.J., Kollef M.H. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting // Chest. — 2000. — 118. — 146-55.


