Международный эндокринологический журнал 5 (37) 2011
Вернуться к номеру
Влияние селена на течение легких форм офтальмопатии Грейвса
Авторы: Claudio Marcocci, M.D., George J. Kahaly, M.D., Gerasimos E. Krassas, M.D., Luigi Bartalena, M.D., Mark Prummel, M.D., Matthias Stahl, M.D., Maria Antonietta Altea, M.D., Marco Nardi, M.D., Susanne Pitz, M.D., Kostas Boboridis, M.D., Paolo Sivelli, M.D., George von Arx, M.D., Maarten P. Mourits, M.D., Lelio Baldeschi, M.D., Walter Bencivelli, Ph.D., Wilmar Wiersinga, M.D., от имени Европейской группы по изучению офтальмопатии Грейвса (EUGOGO)
Рубрики: Эндокринология
Версия для печати
Предпосылки исследования. Свободные радикалы кислорода и цитокины имеют патогенетическое значение в развитии офтальмопатии Грейвса.
Методы. Мы выполнили рандомизированное двойное слепое плацебо-контролируемое клиническое исследование с целью оценить эффективность селена (антиоксидант) и пентоксифиллина у 159 пациентов с легкими формами офтальмопатии Грейвса. Пациентам назначали пероральный прием селена (100 мкг 2 раза в день), пентоксифиллина (600 мг 2 раза в день) или плацебо (2 раза в день) в течение 6 месяцев, после чего прием препаратов прекращался, и за больными наблюдали еще в течение 6 месяцев. Две первичные конечные точки исследования оценивали спустя 6 месяцев (момент прекращения терапии): 1) общая офтальмологическая оценка (композит нескольких пунктов) на основании заключения офтальмологов, которые не были осведомлены о виде получаемой терапии; 2) значение заполняемого пациентами опросника, специфически оценивающего качество жизни при офтальмопатии Грейвса. Вторичные конечные точки исследования оценивали с помощью шкалы клинической активности и шкалы диплопии Гормана.
Результаты. Спустя 6 месяцев лечение селеном, но не пентоксифиллином приводило к улучшению качества жизни (p < 0,001), уменьшению поражения глаз (р = 0,01) и замедлению прогрессирования офтальмопатии Грейвса (р = 0,01) по сравнению с плацебо. Значение по шкале клинической активности уменьшалось во всех трех группах, но изменения были достоверно большими в группе пациентов, получавших селен. Аналогичное оценивание, выполненное спустя 12 месяцев исследования, подтвердило результаты, которые были получены через 6 месяцев. Двум пациентам из плацебо-группы и одному пациенту из группы с пентоксифиллином потребовалось назначение иммуносупрессивной терапии в связи со значительным ухудшением их состояния. В группе пациентов, получавших селен, не было обнаружено побочных эффектов, в то время как в группе с пентоксифиллином часто наблюдались диспептические расстройства.
Выводы. Назначение селена достоверно улучшало качество жизни, уменьшало поражение глаз и замедляло прогрессирование заболевания у пациентов с легкими формами офтальмопатии Грейвса. (Исследование поддержано Пизанским университетом и Министерством высшего и среднего образования и научных исследований Италии; регистрационный номер клинического исследования NTR524 (EUGOGO, Нидерланды).)
Приблизительно у половины пациентов с болезнью Грейвса (син. Базедова болезнь, диффузный токсический зоб. — Прим. перев.) в патологический процесс вовлекаются глаза (офтальмопатия Грейвса) [1]. Умеренно тяжелые и активные формы офтальмопатии Грейвса могут быть эффективно пролечены с помощью глюкокортикоидов, облучения глаз или обоих методов [1, 2], в то время как более легкие формы могут проходить сами по себе и требуют только местной терапии, направленной на борьбу с симптомами (например, искусственные слезы, мази и призмы).
Стратегию наблюдения, при которой пациентов мониторируют до тех пор, пока симптомы не начнут ухудшаться, можно оспорить. Во-первых, у многих пациентов даже с легкими формами офтальмопатии Грейвса наблюдается существенное снижение качества жизни. Об этом свидетельствуют данные опросников, оценивающих качество жизни исходя из общего состояния здоровья [3], а также опросника, специфически оценивающего качество жизни при офтальмопатии Грейвса (Graves’ orbitopathy-specific quality-of-life questionnaire (GO-QOL)) [4]. Во-вторых, при наблюдении за естественным течением легких форм офтальмопатии Грейвса было выяснено, что спонтанное улучшение наблюдалось примерно у 20 % пациентов, в то время как у 65 % пациентов заболевание оставалось статичным, а у 15 % — прогрессировало [5]. Следовательно, учитывая все перечисленное, применение терапии при легких формах офтальмопатии Грейвса кажется оправданным. Лечение должно быть недорогим, хорошо переносимым и легкодоступным. По состоянию на сегодняшний день существуют два лекарственных средства, которые потенциально могут ингибировать механизмы патогенеза и, как полагают, быть эффективными при офтальмопатии Грейвса, — селен и пентоксифиллин.
Селен относится к микроэлементам и имеет эссенциальное значение для синтеза селеноцистеина [6]. Селеноцистеин встраивается в ряд селенобелков, в основном ферментов, в которых селен играет роль окислительно-восстановительного центра и действует как антиоксидант. В то же время большое количество исследований in vitro свидетельствует о том, что усиление образования свободных радикалов кислорода имеет патогенетическое значение в развитии офтальмопатии Грейвса [7–9]. Селен, кроме того, оказывает важное влияние на иммунную систему [6, 10] и потому может быть полезен у пациентов с тиреоидитом Хашимото [11, 12] или болезнью Грейвса [13].
Пентоксифиллин является неспецифическим ингибитором фосфодиэстеразы, используемым для лечения перемежающейся хромоты [14]. Он обладает также противовоспалительными и иммуномодуляторными свойствами [15–17], а in vitro оказывает ингибиторное действие на экспрессию HLA-DR и секрецию гликозаминогликанов фибробластами глаза [18, 19]. Все эти факторы принимают участие в патогенезе офтальмопатии Грейвса [20, 21]. В одном небольшом пилотном исследовании было показано, что пентоксифиллин может быть эффективен у пациентов с офтальмопатией Грейвса [22].
От имени Европейской группы по изучению офтальмопатии Грейвса (European Group on Graves’ Orbitopathy (EUGOGO)) мы публикуем результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования, целью которого было выяснить, будут ли селен и пентоксифиллин оказывать лечебное действие при офтальмопатии Грейвса.
Методы
Пациенты и протокол исследования
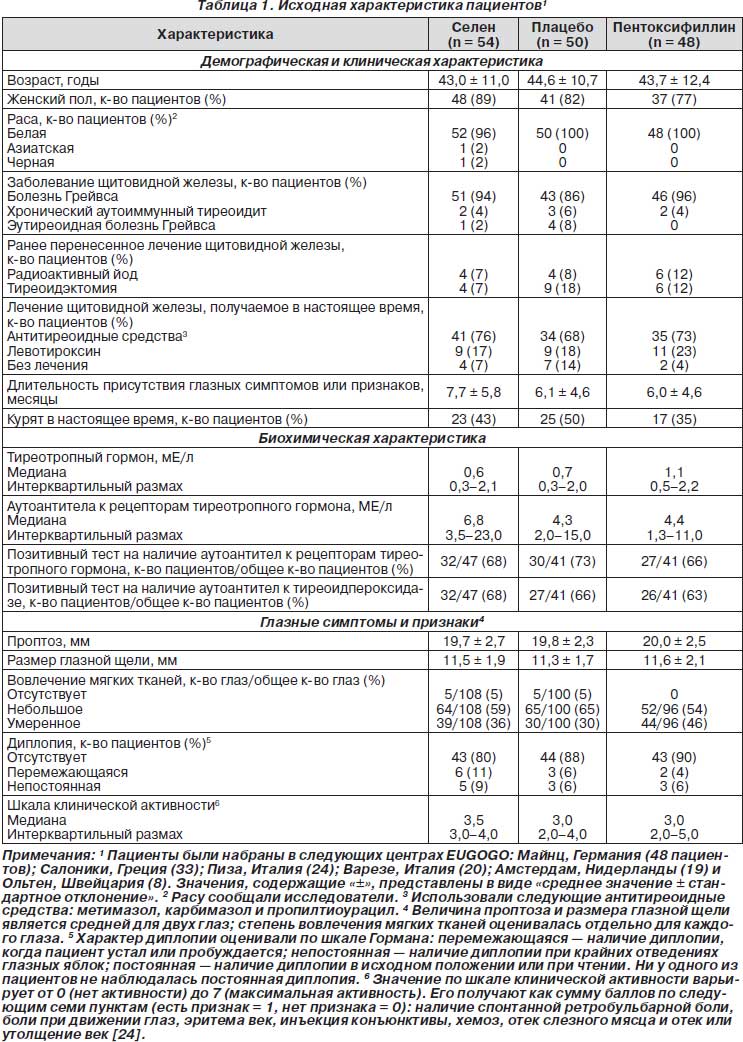
С января 2005 г. по январь 2009 г. всех пациентов, госпитализированных в шесть центров EUGOGO (Амстердам, Нидерланды; Майнц, Германия; Ольтен, Швейцария; Пиза, Италия; Салоники, Греция; Варезе, Италия), у которых наблюдались легкие признаки или симптомы офтальмопатии Грейвса, заболевание длилось менее 18 месяцев и которые соответствовали критериям включения, приглашали принять участие в нашем исследовании. (Перечень критериев включения и исключения приведен в табл. 1 приложения, доступного с полной версией данной статьи на NEJM.org)
Цель настоящего исследования заключалась в том, чтобы выяснить, будут ли селен и пентоксифиллин влиять на течение офтальмопатии Грейвса (улучшение состояния или предупреждение ухудшения) и улучшать качество жизни пациентов по сравнению с плацебо. Исследование длилось 1 год и состояло из двух периодов: 6 месяцев — получение терапии и 6 месяцев — наблюдение.
Оба лекарственных средства и плацебо принимали перорально. Селен назначали в виде селена селенита в дозе 100 мкг 2 раза в день, пентоксифиллин (трентал, Sanofi Aventis) назначали в дозе 600 мг 2 раза в день, плацебо давали 2 раза в день. Таблетки селена и плацебо были приготовлены Gelfipharma и были идентичны таблеткам пентоксифиллина. Рандомизацию выполняли центральным путем в Амстердаме, со стратификацией по центрам в блоках по 6. Каждые два из шести запечатанных конвертов с тестируемыми средствами были обозначены как лот 1, лот 2 или лот 3. Таблетки доставлялись в идентичных боксах (обозначенных как лот 1, 2 или 3) и давались пациентам местным эндокринологом, который был не осведомлен о содержании лотов.
Исследование было одобрено комиссиями по биоэтике каждого из участвующих центров и комиссией по биоэтике Академического медицинского центра при Амстердамском университете. До включения в исследование все пациенты дали письменное информированное согласие на участие в нем. Исследование было проведено в соответствии с протоколом, приведенным на NEJM.org.
Структура исследования была разработана EUGOGO группой. Все авторы участвовали в сборе данных и несут ответственность за их точность. Статистический анализ выполнил один из авторов. Первый автор написал черновой вариант рукописи, а все авторы участвовали в ее проверке и принятии решения о ее публикации. Все тестируемые препараты были приобретены у производителей.
Оцениваемые показатели и конечные точки исследования
Пациентов оценивали в исходных условиях, а также на 3, 6 и 12-м месяце исследования. Обследование глаза выполнял офтальмолог, который не был осведомлен о получаемом лечении, с использованием модифицированной формы медицинской карты больного от EUGOGO. Во всех контрольных точках в каждом из центров пациентов обследовал один и тот же офтальмолог, который фиксировал размер глазной щели (в миллиметрах), степень вовлечения мягких тканей (в соответствии с цветным атласом на www.eugogo.eu) [23], выраженность экзофтальма (в миллиметрах; в каждом из центров использовался один и тот же экзофтальмометр Гертеля), степень вовлечения глазных мышц (величину дукции измеряли в градусах) и остроту зрения (измеряли в долях единицы с помощью таблицы Снеллена).
Шкала клинической активности (Clinical Activity Score) состояла из 7 пунктов: спонтанная ретробульбарная боль, боль при попытке выполнить глазные движения (вверх, из стороны в сторону или вниз), покраснение конъюнктивы, покраснение век, хемоз, отек слезного мясца и отек век. Общий балл получали как сумму всех присутствующих пунктов [24]. Шкала диплопии Гормана включала 4 категории: нет диплопии (отсутствует), диплопия, когда пациент устал или пробуждается (перемежающаяся), диплопия при крайних отведениях глазных яблок (непостоянная) и непрерывная диплопия в исходном положении или при чтении (постоянная) [25]. Качество жизни оценивали с помощью ранее апробированного опросника GO-QOL [4, 26], который доступен на нескольких языках. Образцы крови забирали во время каждого визита для того, чтобы оценить функцию щитовидной железы (определяли содержание в плазме свободного тироксина, общего и свободного трийодтиронина, тиреотропного гормона) и выявить наличие аутоантител к тиреоидпероксидазе и к рецепторам тиреотропного гормона. Во время каждого визита регистрировали все побочные эффекты, связанные с проводимым лечением.
В ходе нашего исследования были оценены два основных исхода: глазные изменения, оцененные офтальмологами, которые не были осведомлены о получаемой терапии, и значение по опроснику GO-QOL, заполненному пациентами. В качестве первичных конечных точек служило сравнение частоты исходов (улучшение, без изменения, ухудшение) в общей офтальмологической оценке и по опроснику GO-QOL (табл. 1) к 6-му месяцу исследования между пациентами, принимавшими какой-либо из двух препаратов, и пациентами, получавшими плацебо. Общая офтальмологическая оценка являлась композитом многих пунктов; использование подобного подхода позволяло учесть ситуацию, когда улучшение в одном пункте сопровождалось одновременным ухудшением в другом пункте. В качестве вторичных конечных точек оценивали изменение характера диплопии и значения по семипунктовой шкале клинической активности к 6-му месяцу исследования.
Статистический анализ
Исследование было спланировано таким образом, чтобы сравнить эффективность селена и плацебо, а также пентоксифиллина и плацебо. Размер групп был рассчитан исходя из результатов предыдущего наблюдательного исследования пациентов с офтальмопатией Грейвса, в ходе которого было показано, что в отсутствие специфической терапии улучшение наблюдается у 20 % пациентов, отсутствие изменений — у 65 % пациентов и ухудшение — у 15 % пациентов [5]. Мы решили проверить гипотезу о том, что лечение селеном или пентоксифиллином в течение 6 месяцев приведет к увеличению на 25 % (с 20 до 45 %) количества пациентов, у которых наблюдается улучшение. Чтобы выявить такие различия с 80% мощностью и уровнем значимости 0,05, каждая исследуемая группа должна была включать по 52 пациента.
Пациентов, которые преждевременно выбывали из исследования вследствие развития побочных эффектов, несоблюдения режима исследования или прогрессирования заболевания, требующего специфического лечения, включали в окончательный анализ при условии, что у них были оценены необходимые показатели во время визита, осуществлявшегося на 3-м месяце исследования. Результаты этого их последнего оценивания «переносили вперед» и рассматривали в качестве последнего визита. Пациенты, которые выбывали до визита, осуществлявшегося на 3-м месяце исследования, были исключены из анализа.
Категориальные переменные сравнивали с помощью критерия хи-квадрат или точного критерия Фишера. Двусторонний t-критерий Стьюдента и критерий Манна — Уитни были использованы для того, чтобы оценить различия в изменении значений по опроснику GO-QOL и значений по шкале клинической активности к 6-му и 12-му месяцу относительно исходного уровня между каждой из групп, получавших активную терапию, и плацебо-группой. Уровни тиреоидных аутоантител в конце терапии (6 месяцев) сравнили с исходными уровнями с помощью парного знакового теста для аутоантител к тиреоидпероксидазе (так как в различных центрах были использованы различные методы для их определения) и знакового рангового критерия Вилкоксона для аутоантител к рецепторам тиреотропного гормона. Эффективность терапии в отношении предупреждения прогрессирования офтальмопатии Грейвса оценивали путем сравнения количества пациентов, у которых поражение глаз ухудшалось, с количеством пациентов, у которых поражение глаз уменьшалось или оставалось неизменным.
Различия считали статистически достоверными при р-значении менее 0,05. Мы планировали применить поправку Бенджамини — Хокберга для множественных сравнений при оценке межгрупповых различий по первичным конечным точкам [27]. Р-значения для вторичных конечных точек и для конечных точек на 12-м месяце исследования были рассчитаны в разведочных целях (т.е. целях разведочного анализа. — Прим. перев.).
Результаты
Пациенты
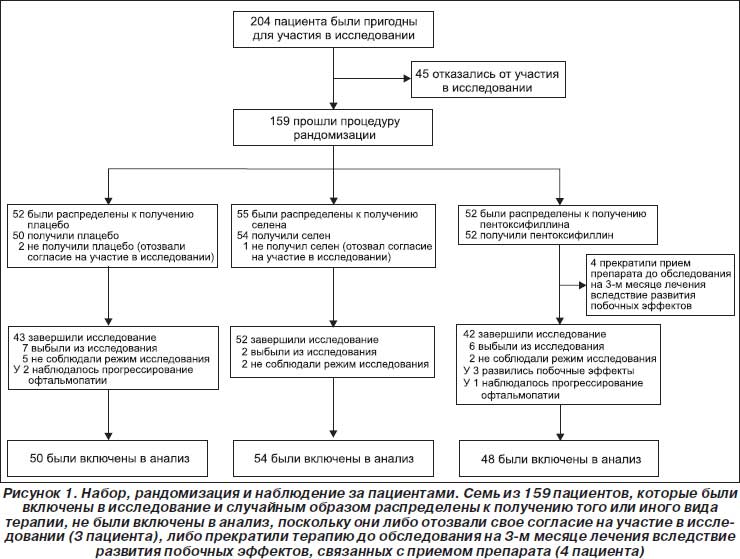
С января 2005 г. по январь 2009 г. в общей сложности 204 пригодным пациентам было предложено принять участие в исследовании (рис. 1). Из этих 204 пациентов 45 отклонили предложение, а 159 были случайным образом распределены к приему селена (55 пациентов), пентоксифиллина (52) или плацебо (52). Клиническая характеристика пациентов, которые отказались от участия в исследовании, не отличалась от тех, которые были распределены к тому или иному виду терапии. Семь пациентов выбыли из исследования в течение первого месяца либо вследствие того, что отозвали свое согласие (1 в группе с селеном и 2 в плацебо-группе), либо вследствие развития побочных эффектов, связанных с приемом препарата (4 в группе с пентоксифиллином). Эти пациенты не были включены в окончательный анализ. Остальные 152 пациента (54 в группе с селеном, 48 в группе с пентоксифиллином и 50 в плацебо-группе) принимали участие в исследовании по крайней мере до первого оценивания спустя 3 месяца терапии и были включены в окончательный анализ.
Исходная характеристика исследуемых пациентов и количество пациентов в расчете на один центр представлены в табл. 1. Из 152 пациентов 137 (90 %) полностью завершили исследование (52 (96 %) в группе с селеном, 42 (87 %) в группе с пентоксифиллином и 43 (86 %) в плацебо-группе); 15 выбыли преждевременно вследствие несоблюдения режима исследования (2, 2 и 5 пациентов в трех группах соответственно), развития побочных эффектов (0, 3 и 0 пациентов соответственно) или прогрессирования офтальмопатии Грейвса, что требовало внутривенного введения глюкокортикоидов, облучения глаз или применения обоих методов (0, 1 и 2 пациента соответственно).
Тесты на функцию щитовидной железы подтвердили эутиреоидизм у всех пациентов; нескольким пациентам потребовалась незначительная коррекция в дозе антитиреоидного препарата или левотироксина. Уровни аутоантител к тиреоидпероксидазе снижались как в группе с селеном (р = 0,001), так и в группе с пентоксифиллином (р = 0,02), но не в плацебо-группе (р = 0,4). Уровни аутоантител к рецепторам тиреотропного гормона снижались во всех трех группах (р = 0,002; р = 0,002 и р = 0,004 соответственно) (табл. 2 приложения на NEJM.org).
Первичные и вторичные конечные точки исследования
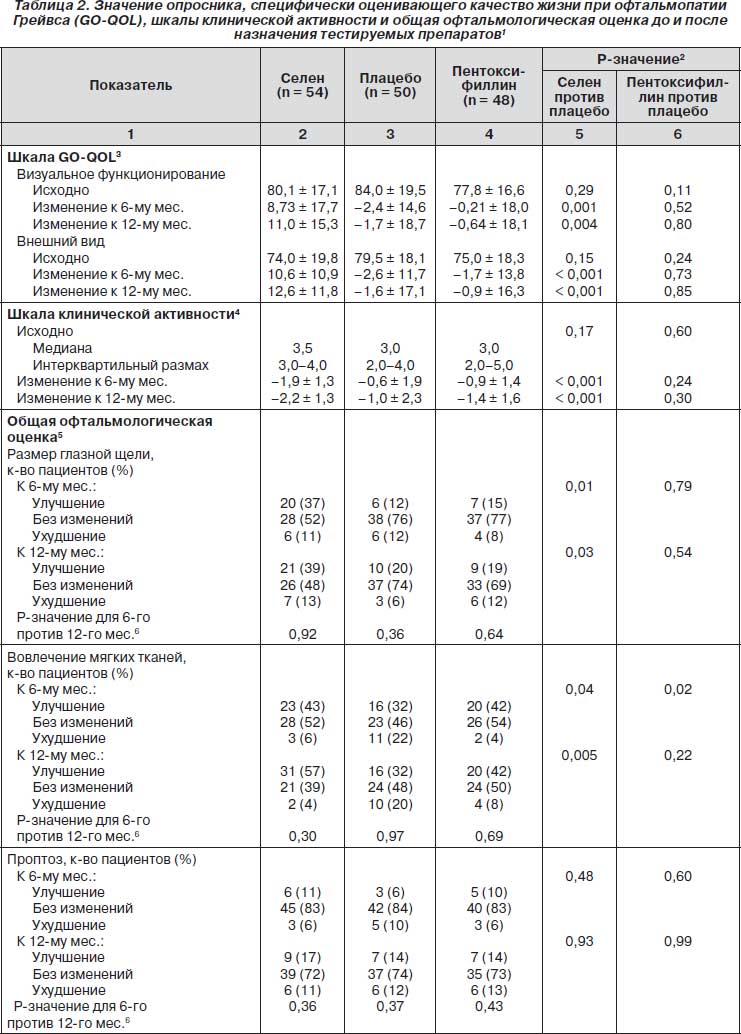
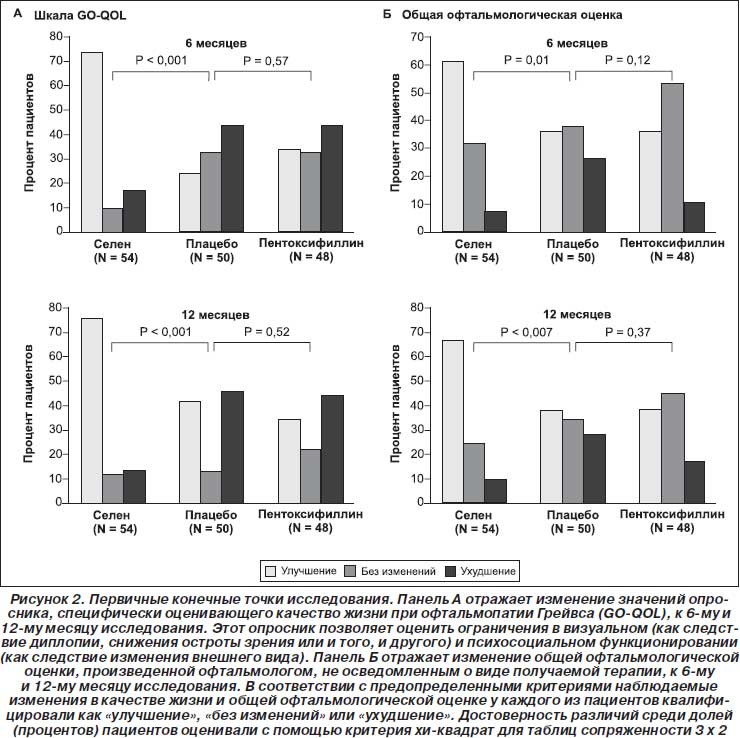
Средние значения по опроснику GO-QOL в исходных условиях и после проведения курса терапии представлены в табл. 2. В соответствии с этим опросником каждому из восьми вопросов в каждой из подшкал присваивается 1, 2 или 3 балла в зависимости от того, было ли ограничение заметным, легким или отсутствовало соответственно. Затем все эти баллы суммировались, чтобы получить «сырой балл». Окончательное значение рассчитывали следующим образом: («сырой балл» – 8) ч 16 х 100. Получаемое значение могло варьировать от 0 (полное ограничение) до 100 (нет ограничений). Увеличение балла свидетельствовало об улучшении, а снижение — об ухудшении. Изменение в 6 баллов считали минимальной клинически значимой разницей.
Значения по опроснику GO-QOL, зарегистрированные в исходных условиях, выявили легкие и умеренные нарушения качества жизни, без достоверных различий среди трех групп по баллам, характеризующим визуальное функционирование и внешний вид. Спустя 6 месяцев значение по опроснику GO-QOL среди 53 пациентов, получавших селен, увеличилось по сравнению с исходным уровнем на 6 и более баллов для визуального функционирования у 33 пациентов (62 %) и для внешнего вида у 40 пациентов (75 %). Как показано на рис. 2А, у достоверно большего количества пациентов из группы с селеном наблюдалось улучшение качества жизни спустя 6 месяцев по сравнению с теми, которые получали плацебо. Более того, у пациентов, принимавших селен, наблюдалась существенно более низкая частота ухудшения качества жизни (9 из 53 пациентов) по сравнению с теми, которые получали плацебо (20 из 46 пациентов) (17 % против 43 %; р = 0,004).
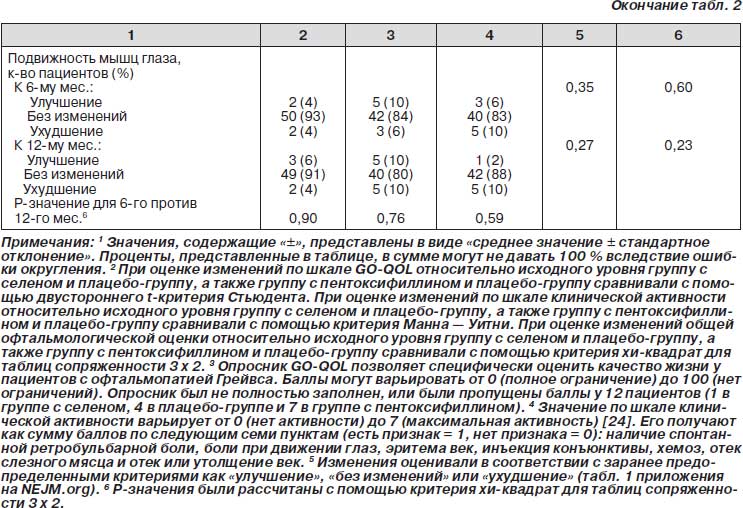
Общая офтальмологическая оценка к 6-му месяцу была достоверно лучше в группе с селеном по сравнению с плацебо-группой (р = 0,01), в то время как между группой с пентоксифиллином и плацебо-группой достоверных различий не было (р = 0,12) (рис. 2Б). Выраженность офтальмопатии Грейвса уменьшалась у 33 из 54 пациентов (61 %) в группе с селеном, у 17 из 48 пациентов (35 %) в группе с пентоксифиллином и у 18 из 50 пациентов (36 %) в плацебо-группе; течение болезни ухудшалось у 4 из 54 пациентов (7 %) в группе с селеном, 5 из 48 пациентов (10 %) в группе с пентоксифиллином и 13 из 50 пациентов (26 %) в плацебо-группе. Частота ухудшения офтальмопатии Грейвса была достоверно ниже в группе с селеном по сравнению с плацебо-группой (р = 0,01). Поскольку каждая из оцениваемых первичных конечных точек к 6-му месяцу достоверно менялась, то в использовании поправки Бенджамини — Хокберга не было необходимости. Изменения каждого из отдельных пунктов, входящих в общую офтальмологическую оценку, представлены в табл. 2. В группе пациентов, получавших селен, улучшение общей офтальмологической оценки было связано в большей степени с уменьшением размера глазной щели и степени вовлечения мягких тканей, нежели с изменением проптоза и подвижности глаз. Медиана уменьшения размера глазной щели составила 2 мм (интерквартильный размах от 2 до 3) к 6-му месяцу и 3 мм (интерквартильный размах от 2 до 4) к 12-му месяцу. К 6-му месяцу у большей части из 32 пациентов, которые получали селен и у которых было выявлено уменьшение размера глазной щели и степени вовлечения мягких тканей, наблюдалось также улучшение на 6 или более баллов по подшкале внешнего вида (84 %; 95% доверительный интервал (ДИ) от 67 до 95), по подшкале визуального функционирования (72 %; 95% ДИ от 53 до 86) и по общему баллу опросника GO-QOL (81 %; 95% ДИ от 63 до 93).
Положительное влияние селена на качество жизни и общую офтальмологическую оценку удерживалось в течение 6 месяцев после прекращения терапии, и наблюдаемые исходы оставались лучше в группе с селеном по сравнению с плацебо-группой (p < 0,001 для качества жизни и р = 0,007 для общей офтальмологической оценки) (табл. 3 приложения на NEJM.org).
Острота зрения была нормальной у всех пациентов в исходных условиях и не менялась в течение 12 месяцев исследования. Употребление/неупотребление сигарет не оказывало видимого влияния на эффекты проводимой терапии в отношении первичных конечных точек исследования как в общей популяции пациентов, так и в каждой из групп в отдельности. Дисфункция экстраокулярных мышц не претерпевала достоверных изменений в ходе исследования ни в одной из групп (данные не представлены). Средний балл по шкале клинической активности снижался во всех группах (табл. 2), и снижение к 6-му и 12-му месяцу в группе с селеном было достоверно большим по сравнению с плацебо-группой; между группой с пентоксифиллином и плацебо-группой достоверных различий получено не было.
Побочные эффекты
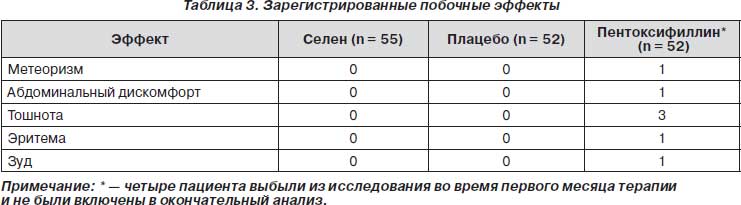
Побочные эффекты, связанные с приемом препарата (кожные реакции и диспептические расстройства), наблюдались у 7 пациентов, получавших пентоксифиллин (4 из них выбыли из исследования в течение первого месяца терапии). Побочные эффекты, связанные с приемом препарата, не наблюдались у пациентов, получавших селен или плацебо (табл. 3).
Обсуждение
В настоящем исследовании было показано, что назначение селена по сравнению с плацебо приводило к достоверному улучшению качества жизни у пациентов с офтальмопатией Грейвса, оцененного с помощью опросника GO-QOL [4]. Улучшение касалось как баллов, связанных с внешним видом, так и баллов, касающихся визуального функционирования, и было, по-видимому, связано с уменьшением степени вовлечения мягких тканей и размера глазной щели, что наблюдалось у большинства пациентов с улучшением по опроснику GO-QOL. Ни пентоксифиллин, ни плацебо не вызывали достоверных изменений качества жизни.
Положительные эффекты селена на качество жизни были подтверждены тем, что к 6-му месяцу терапии данным препаратом наблюдался достоверно лучший офтальмологический исход по сравнению с плацебо. Общая офтальмологическая оценка улучшилась у 33 из 54 пациентов, главным образом за счет уменьшения степени вовлечения мягких тканей и размера глазной щели. У 4 пациентов, которые принимали селен, наблюдалось небольшое прогрессирование заболевания, которое требовало применения лишь местных средств. В плацебо-группе офтальмопатия Грейвса уменьшалась у 18 из 50 пациентов, а прогрессировала у 13 пациентов, 2 из которых требовалось проведение серьезных вмешательств. Таким образом, по сравнению с плацебо назначение селена было связано с увеличением частоты улучшений и снижением частоты ухудшений. За исключением временного положительного эффекта в отношении степени вовлечения мягких тканей к 6-му месяцу, первичные конечные точки при назначении пентоксифиллина не отличались от таковых при назначении плацебо.
К 6-му месяцу значение по шкале клинической активности в группе с селеном было достоверно ниже, чем в плацебо-группе. Однако это значение снижалось во всех трех группах, отражая, по-видимому, естественную динамику легких форм офтальмопатии Грейвса, которые в большинстве случаев становятся менее активными или вовсе не активными. Оценка показателей, выполненная на 12-м месяце исследования, подтвердила результаты, полученные на 6-м месяце.
Болезнь Грейвса характеризуется развитием оксидативного стресса [28, 29], и увеличение образования свободных радикалов кислорода может играть роль в патогенезе офтальмопатии Грейвса [7–9]. Плазменный уровень селенопротеина Р, являющийся показателем оксидативного стресса, ниже у пациентов с офтальмопатией Грейвса по сравнению с контролем и характеризуется наличием слабой обратной корреляции с активностью болезни [30]. В противоположность этим данным в одном из последних исследований было показано отсутствие достоверных различий по уровню селена у пациентов с легкими формами офтальмопатии Грейвса и контролем [31]. Учитывая имеющиеся данные, мы предположили, что интервенция, направленная на улучшение антиоксидантного баланса, может быть эффективной и при гипертиреоидизме, и при офтальмопатии Грейвса. Терапия антитиреоидными средствами у пациентов с болезнью Грейвса снижает образование активных форм кислорода [28], и состояние эутиреоидизма достигается более быстро, если к метимазолу добавляют антиоксиданты (включая селен) [13]. В одном из исследований было показано, что у пациентов с болезнью Грейвса и ремиссией гипертиреоидизма после лечения антитиреоидными средствами наблюдается более высокая концентрация селена, чем у пациентов с рецидивом заболевания, и что уровни антител к рецепторам тиреотропного гормона отрицательно коррелировали с концентрацией селена в плазме крови [32]. В нерандомизированном исследовании, включавшем пациентов с умеренными и тяжелыми формами офтальмопатии Грейвса, было показано, что антиоксидантная терапия аллопуринолом и никотинамидом была более эффективна по сравнению с плацебо [33].
В нашем исследовании было два ограничения. Во-первых, у нас нет данных об изменении концентрации селена в плазме крови после введения селена селенита. Во-вторых, хотя мы не измеряли содержание селена в образцах плазмы, полученных до и после назначения селена селенита, большая часть пациентов была из тех областей, в которых уровни селена в общей популяции маргинально снижены [6, 34, 35]. Как сообщается в других исследованиях, маргинальный дефицит селена может способствовать развитию положительных эффектов от назначения селена [6].
Таким образом, наши данные свидетельствуют о том, что назначение селена в течение 6 месяцев приводило к уменьшению выраженности офтальмопатии Грейвса и связанного с этим заболеванием нарушения качества жизни.
Исследование выполнено при поддержке грантами от Пизанского университета (Fondi d’Ateneo per la Ricerca, to Dr. Marcocci) и Министерства высшего и среднего образования и научных исследований Италии (PRIN 20074X8RKK, to Dr. Bartalena).
Заявление авторов об отсутствии конфликта интересов доступно на NEJM.org.
Мы благодарны профессору Jan Tyssen за его помощь при подготовке окончательной версии статьи.
Перевод к.м.н. А.В. Савустьяненко
Оригинал статьи опубликован в N. Engl. J. Med. — 2011. — 364. — 1920-31.
1. Bartalena L., Pinchera A., Marcocci C. Management of Graves’ ophthalmopathy: reality and perspectives // Endocr. Rev. — 2000. — 21. — 168-99.
2. Bartalena L., Baldeschi L., Dickinson A. et al. Consensus statement of the European Group on Graves’ Orbitopathy (EUGOGO) on management of GO // Eur. J. Endocrinol. — 2008. — 158. — 273-85.
3. Gerding M.N., Terwee C.B., Dekker F.W., Koornneef L., Prummel M.F., Wiersinga W.M. Quality of life in patients with Graves’ ophthalmopathy is markedly decreased: measurement by the Medical Outcomes Study instrument // Thyroid. — 1997. — 7. — 885-9.
4. Terwee CB, Gerding MN, Dekker FW, Prummel M.F., Wiersinga W.M. Development of a disease specific quality of life questionnaire for patients with Graves’ ophthalmopathy: the GO-QOL // Br. J. Ophthalmol. — 1998. — 82. — 773-9.
5. Perros P., Crombie A.L., Kendall-Taylor P. Natural history of thyroid associated ophthalmopathy // Clin. Endocrinol. (Oxf.). — 1995. — 42. — 45-50.
6. Rayman M.P. The importance of selenium to human health // Lancet. — 2000. — 356. — 233-41.
7. Burch H.B., Lahiri S., Bahn R.S., Barnes S. Superoxide radical production stimulates retroocular fibroblast proliferation in Graves’ ophthalmopathy // Exp. Eye Res. — 1997. — 65. — 311-6.
8. Heufelder A.E., Wenzel B.E., Bahn R.S. Methimazole and propylthiouracil inhibit the oxygen free radical-induced expression of a 72 kilodalton heat shock protein in Graves’ retroocular fibroblasts // J. Clin. Endocrinol. Metab. — 1992. — 74. — 737-42.
9. Lu R., Wang P., Wartofsky L. et al. Oxygen free radicals in interleukin-1betainduced glycosaminoglycan production by retro-ocular fibroblasts from normal subjects and Graves’ ophthalmopathy patients // Thyroid. — 1999. — 9. — 297-303.
10. Hoffmann P.R., Berry M.J. The influence of selenium on immune responses // Mol. Nutr. Food. Res. — 2008. — 52. — 1273-80.
11. Negro R. Selenium and thyroid autoimmunity // Biologics. — 2008. — 2. — 265-73.
12. Nacamulli D., Mian C., Petricca D. et al. Influence of physiological dietary selenium supplementation on the natural course of autoimmune thyroiditis // Clin. Endocrinol. (Oxf.). — 2010. — 73. — 535-9.
13. Vrca V.B., Skreb F., Cepelak I., Romic Z., Mayer L. Supplementation with antioxidants in the treatment of Graves’ disease: the effect on glutathione peroxidase activity and concentration of selenium // Clin. Chim. Acta. — 2004. — 341. — 55-63.
14. Girolami B., Bernardi E., Prins M.H. et al. Treatment of intermittent claudication with physical training, smoking cessation, pentoxifylline, or nafronyl: a meta-analysis // Arch. Intern. Med. — 1999. — 159. — 337-45.
15. Anaya J.M., Espinoza L.R. Phosphodiesterase inhibitor pentoxifylline: an antiinflammatory/immunomodulatory drug potentially useful in some rheumatic diseases // J. Rheumatol. — 1995. — 22. — 595-9.
16. Dezube B.J., Sherman M.L., Friedovich-Keil J.L., Allen-Ryan J., Pardee A.B. Downregulation of tumor necrosis factor expression by pentoxifylline in cancer patients: a pilot study // Cancer Immunol. Immunother. — 1993. — 36. — 57-60.
17. Okunieff P., Augustine E., Hicks J.E. et al. Pentoxifylline in the treatment of radiation-induced fibrosis // J. Clin. Oncol. — 2004. — 22. — 2207-13.
18. Chang C.C., Chang T.C., Kao S.C., Kuo Y.F., Chien L.F. Pentoxifylline inhibits the proliferation and glycosaminoglycan synthesis of cultured fibroblasts derived from patients with Graves’ ophthalmopathy and pretibial myxoedema // Acta Endocrinol. (Copenh.). — 1993. — 129. — 322-7.
19. Balazs C., Kiss H., Farid N.R. Inhibitory effect of pentoxifylline on HLA-DR expression and glycosaminoglycan synthesis by retrobulbar fibroblasts // Horm. Metab. Res. — 1998. — 30. — 496-9.
20. Prabhakar B.S., Bahn R.S., Smith T.J. Current perspective on the pathogenesis of Graves’ disease and ophthalmopathy // Endocr. Rev. — 2003. — 24. — 802-35.
21. Bahn R.S. Graves’ ophthalmopathy // N. Engl. J. Med. — 2010. — 362. — 726-38.
22. Balazs C., Kiss E., Vamos A., Molnar I., Farid N.R. Beneficial effect of pentoxifylline on thyroid associated ophthalmopathy (TAO): a pilot study // J. Clin. Endocrinol. Metab. — 1997. — 82. — 1999-2002. [Erratum, J. Clin. Endocrinol. Metab. — 1997. — 82. — 3077.]
23. Dickinson A.J., Perros P. Controversies in the clinical evaluation of active thyroid-associated orbitopathy: use of a detailed protocol with comparative photographs for objective assessment // Clin. Endocrinol. (Oxf.). — 2001. — 55. — 283-303.
24. Mourits M.P., Prummel M.F., Wiersinga W.M., Koornneef L. Clinical activity score as a guide in the management of patients with Graves’ ophthalmopathy // Clin. Endocrinol. (Oxf.). — 1997. — 47. — 9-14. [Erratum, Clin. Endocrinol. (Oxf.). — 1997. — 47. — 632.]
25. Bahn R.S., Gorman C.A. Choice of therapy and criteria for assessing treatment outcome in thyroid-associated ophthalmopathy // Endocrinol. Metab. Clin. North Am. — 1987. —16. — 391-407.
26. Terwee C.B., Dekker F.W., Mourits M.P. et al. Interpretation and validity of changes in scores on the Graves’ Ophthalmopathy Quality of Life Questionnaire (GO-QOL) after different treatments // Clin. Endocrinol. (Oxf.). — 2001. — 54. — 391-8.
27. Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. R. Stat. Soc. B. — 1995. —57. —289-300.
28. Abalovich M., Llesuy S., Gutierrez S., Repetto M. Peripheral parameters of oxidative stress in Graves’ disease: the effects of methimazole and 131 iodine treatments // Clin. Endocrinol. (Oxf.). — 2003. —59. — 321-7.
29. Ademoğlu E., Ozbey N., Erbil Y. et al. Determination of oxidative stress in thyroid tissue and plasma of patients with Graves’ disease // Eur. J. Intern. Med. — 2006. — 17. — 545-50.
30. Dehina N.E., Minich W., Behrends T., Morgenthaler N.G., Kohrle J., Schomburg L. Circulating selenoprotein P concentrations are decreased in patients with Graves’ disease and correlate inversely to severity of orbitopathy // Acta Med. Port. — 2009. — 22. — 1.
31. Krassas G., Karras S., Boboridis K., Spanos E. Selenium serum levels in patients with mild Graves’ orbitopathy: results of a controlled study. Presented at the 12th European Congress of Endocrinology, Prague, Czech Republic, April 24–28, 2010. abstract.
32. Wertenbruch T., Willenberg H.S., Sagert C. et al. Serum selenium levels in patients with remission and relapse of Graves’ disease // Med. Chem. — 2007. — 3. — 281-4.
33. Bouzas E.A., Karadimas P., Mastorakos G., Koutras D.A. Antioxidant agents in the treatment of Graves’ ophthalmopathy // Am. J. Ophthalmol. — 2000. — 129. — 618-22.
34. Rayman M.P. Food-chain selenium and human health: emphasis on intake // Br. J. Nutr. — 2008. — 100. — 254-68.
35. Burney P., Potts J., Makowska J. et al. A case-control study of the relation between plasma selenium and asthma in European populations: a GAL2EN project // Allergy. — 2008. — 63. — 865-71. [Erratum, Allergy. — 2008. — 63. — 1647.]