Международный эндокринологический журнал 5 (37) 2011
Вернуться к номеру
Глимепирид (Aмарил®) в терапии больных сахарным диабетом 2-го типа (патофизиологическое обоснование и клиническая реализация)
Авторы: Полторак В.В.1, Кравчун Н.А.1, Горшунская М.Ю.2, 1ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», г. Харьков, 2Харьковская медицинская академия последипломного образования
Рубрики: Эндокринология
Версия для печати
Число больных сахарным диабетом (СД) 2-го типа во всем мире увеличивается очень быстро, и возрастающая его частота связана с факторами образа жизни, то есть с повышенным приемом калорий и пониженной физической активностью. СД 2-го типа является главным образом результатом недостаточной секреции инсулина и инсулинорезистентности. Производные сульфонилмочевины (СМ), которые стимулируют секрецию инсулина панкреатическими b-клетками, широко используются в терапии диабета. Главными осложнениями, ассоциированными с производными СМ, являются гипогликемия, прирост массы тела и истощение b-клеток в результате гиперинсулинемического эффекта СМ (Briscoe V.J., Griffith M.L., Davis S.N., 2010).
Доминантная роль инсулинорезистентности/гиперинсулинемии в генезе макрососудистой патологии при СД 2-го типа, являющейся основной причиной смертности этой категории пациентов, в ассоциации с определяющим значением глюко- и липотоксичности в развитии диабетических микроангиопатий сформировали современные требования к антидиабетической фармакологической коррекции, которая должна быть направлена на реабилитацию/уменьшение двух дефектов, детерминирующих развитие, манифестацию и спонтанную эволюцию данной формы диабета, а именно — инсулинорезистентности и дисфункции b-клеток поджелудочной железы. Более того, полученные в последние годы данные акцентируют внимание на необходимости обеспечения нормального алгоритма секреции инсулина, сопряженного с уровнем глюкозы в крови, чтобы избежать/уменьшить гипогликемии и нефизиологическую гиперинсулинемию в связи с атерогенными эффектами последней. В частности, у больных СД 2-го типа доказана «селективная» (метаболическая) инсулинорезистентность при сохранении чувствительности к ростовому сигналингу гормона, что при фармакологическом моделировании перманентной гиперинсулинемии может стимулировать атерогенез (Cusi K. et al., 2000; DeFronzo R.A., 2010).
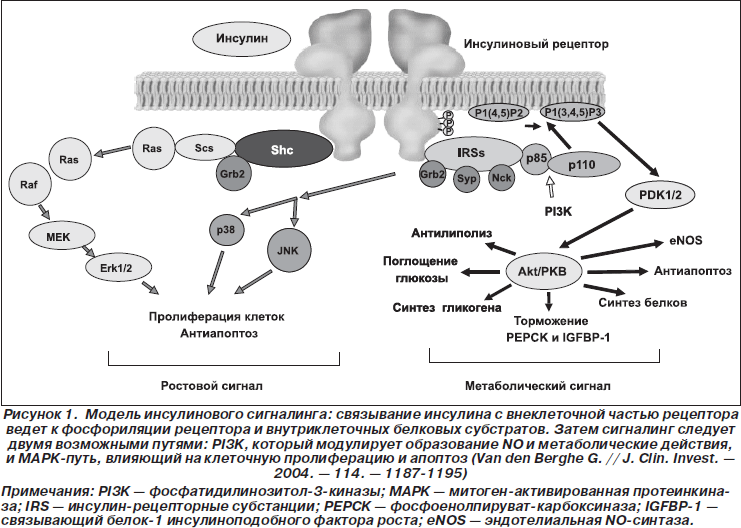
Концепция «селективной» (метаболической) резистентности к инсулину разработана исходя из физиологических путей сигналинга инсулина (рис. 1) и результатов исследования биоптатов мышц больных СД 2-го типа, тучных без диабета и контрольных лиц с нормальным весом, полученных до и после эугликемического гиперинсулинемического «зажима». Показано, что метаболический сигналинг инсулина (фосфатидилинозитол-3-киназный путь) резко снижен у тучных лиц и практически отсутствует у больных диабетом, ростовой сигналинг инсулина (митоген-активированный протеинкиназный путь) остается сравнительно неизменным (Cusi K. et al., 2000).
Следует подчеркнуть обоснованность концепции терапевтической стратегии, утверждающей, что коррекция гипергликемии без уменьшения резистентности к инсулину может не быть ни кардиопротекторной, ни антиатерогенной, как может и не определять улучшение сигналинга инсулина по фосфатидилинозитол-3-(РI3)-киназному пути (Marquezine С.F., Wajchenberg B.J., 2007).
Современные рекомендации относительно ведения больных СД 2-го типа направлены больше на ослабление инсулинорезистентности, чем на стимуляцию инсулиновой секреции (Nathan D.M. et al., 2009).
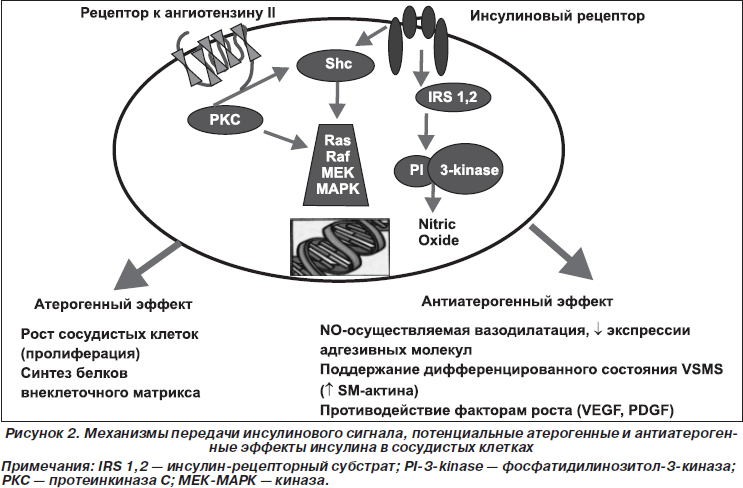
В связи с этим целесообразно еще раз акцентировать внимание на атерогенных эффектах гиперинсулинемии и патогенетической обоснованности антидиабетической фармакотерапии, обеспечивающей достижение хорошего метаболического контро-ля при «щадящей» стимуляции секреции инсулина (рис. 2). Гиперинсулинемия приводит к гиперстимуляции митоген-активированного протеин-(МАР)-киназного пути с сохраненной чувствительностью к инсулину, что вызывает пролиферацию сосудистых гладкомышечных клеток, увеличенное образование коллагена и избыточную продукцию факторов роста/воспалительных цитокинов. С другой стороны, нарушение метаболического сигналинга инсулина приводит к снижению продукции оксида азота (NO), что, в свою очередь, делает эндотелиальные клетки и сосудистые гладкомышечные клетки беззащитными перед неблагоприятным воздействием эндотелиального фактора роста, тромбоцитарного фактора роста и других воспалительных пептидов. Эти проатерогенные эффекты усиливаются при угнетении РI3-киназного пути (концепция «двойного инсулинового сигналинга») (Wang L., Goalstone M.L., Draznin B., 2004; Draznin B., 2006). Более того, гиперинсулинемия удваивает способность ангиотензина II трансактивировать нуклеарный фактор каппа В (NF-kВ), который, в свою очередь, активирует множественные воспалительные пути, включенные в атерогенез, и угнетает метаболический инсулиновый сигналинг, вызывая фосфориляцию серина в инсулин-рецепторной субстанции-1 (ИРС-1). Кроме того, ангиотензин II фосфорилирует серин в ИРС-1 в гладкомышечных клетках аорты и в скелетных миоцитах (DeFronzo K.A., 2010).
Следует подчеркнуть, что обычные СМ-препараты стимулируют секрецию инсулина панкреатическими b-клетками, но не могут воспроизводить пиковый характер секреции инсулина, вызываемый приемом пищи. Как результат, задержанная гиперинсулинемия вызывает накопление висцерального жира. Это наводит на мысль, что обычные СМ-препараты ухудшают инсулинорезистентность и индуцируют атеросклероз (Purnell J.Q., Weyer C., 2003). Существенно, что глимепирид, СМ-препарат 3-й генерации, обладающий эквивалентным гипогликемическим эффектом с другими СМ-препаратами, оказывает менее выраженное стимулирующее действие на секрецию инсулина (Muller G., Satoh Y., Geisen K., 1995; Draeger K.E. et al., 1996; Полторак В.В., Горбенко Н.И., 2001; Полторак В.В., Горшунская М.Ю., 2010), улучшая при этом первую и вторую фазы секреторного ответа b-клеток у больных СД 2-го типа (Korytkowski M. et al., 2002).
Как и традиционные СМ-препараты, глимепирид (Амарил®) стимулирует секрецию инсулина путем закрытия КАТФ-зависимых каналов панкреатических b-клеток. Однако уже на этом, самом существенном этапе действия имеется отличие препарата Амарил® от других препаратов СМ. В то время как другие СМ-препараты связываются на клеточной мембране b-клетки с рецептором, молекулярная масса которого составляет 140 кДа, глимепирид связывается с субъединицей этого рецептора массой 65 кДа. Благодаря этому глимепирид в 2,5–3,0 раза быстрее связывается со своим рецептором по сравнению с другими препаратами СМ. Таким образом, глимепирид обладает быстрым началом действия. Кроме того, препарат способен высвобождаться и диссоциировать с рецепторным аппаратом b-клетки в 8–9 раз быстрее, чем другие препараты СМ, что обусловливает менее выраженное повышение уровня инсулина и, как следствие, более редкое развитие нежелательных эффектов препарата и гипогликемических реакций по сравнению с другими «похожими» сахароснижающими препаратами (Muller G., 1994; Muller G. et al., 1994).
Клиническая эффективность
У больных СД 2-го типа глимепирид (Амарил®) оказывает существенный благоприятный эффект на гликемический контроль, оцененный по показателям «глюкозной триады» (HbA1c, глюкоза крови натощак — ГКН и постпрандиальная глюкоза крови — ППГ) как в рандомизированных плацебо-контролируемых исследованиях (Goldberg R.B. et al., 1996; Rosenstock J. et al., 1996; Schade D.S., Jovanovic L., Schneider J., 1998), так и в реальной жизни (Кравчун Н.А. и соавт., 2007).
В многоцентровом двойном слепом исследовании больные СД 2-го типа, до этого получавшие СМ-препараты, были рандомизированы в группу контроля (плацебо) или глимепирида в четырех дозах (4 и 8 мг дважды в день, 8 и 16 мг 1 раз в день) в течение 14 недель (для всех пациентов был определен 3-недельный период вхождения в исследование, когда все пациенты получали плацебо) (Rosenstock J. et al., 1996). У пациентов, получавших плацебо, отмечено увеличение глюкозы плазмы натощак с 234 мг% в исходном состоянии до 261 мг% по сравнению с выраженным снижением в группе больных, получавших глимепирид в разных дозах, на 74–104 мг%. Определено также существенное снижение уровней ППГ на 101–109 мг%. При этом увеличение уровней инсулина и С-пептида в циркуляции совпадало с гликемическими пиками, вызываемыми приемом пищи (2-часовой постпрандиальный уровень глюкозы), и не наблюдалось натощак. В группе, получавшей плацебо, значимо увеличивались уровни HbA1c — с 7,7 % в исходном состоянии до 9,7 % в конечной точке, в то время как у больных, леченных глимепиридом, они снижались с 8,0 до 7,5 % (р < 0,001).
В связи с прогрессирующим характером естественного течения СД 2-го типа рекомендуется использование комбинации инсулина с пероральными препаратами или комбинирование ряда пероральных препаратов с различными механизмами действия для того, чтобы исключить отсутствие гликемического контроля в условиях монотерапии (Nathan D.M. et al., 2009). В частности, показана эффективность комбинации метформина и глимепирида (Charpentier G. et al., 2001; Кравчун Н.О. и соавт., 2004). Так, у 372 плохо контролируемых монотерапией метформином больных СД 2-го типа дополнительное назначение глимепирида оказалось более эффективным по сравнению с пациентами, продолжавшими принимать только метформин или переведенными только на глимепирид: по сравнению с начальным периодом в конечной точке терапии изменение уровней ГКН составило в группе метформина 0,8 ± 0,4 мМ/л; в группе глимепирида — 0,7 ± 0,3 мМ/л; в группе «метформин + глимепирид» — 2,6 ± 0,3 мМ/л; соответственно, динамика HbA1c (от базального) такова: 0,07 ± 0,14; 0,27 ± 0,09 и –0,74 ± 0,08 %, то есть наблюдалось значимое снижение уровней по сравнению с базальными в группе пациентов на комбинированной терапии (Charpentier G. et al., 2001).
Глимепирид является единственным препаратом СМ, рекомендуемым FDA (США) для комбинированной терапии с инсулином. Проведено несколько исследований по оценке эффективности такой комбинации (Garber A.J., 2003). В многоцентровом исследовании показано, что у тучных пациентов с СД 2-го типа (возраст от 45 до 70 лет), плохо контролированного монотерапией СМ, перевод на комбинированное лечение глимепиридом в сочетании с одной инъекцией 70/30 инсулина (70 % нейтрального протамина Хагедорна — НПХ, 30 % регулярного) был таким же эффективным в достижении гликемического контроля, как и более сложные режимы множественных инъекций инсулина без пероральных препаратов (Riddle M.C., 1996). В другом многоцентровом двойном слепом исследовании больные СД 2-го типа (n = 208), у которых монотерапия только СМ не обеспечивала хороших показателей гликемического контроля в базальном состоянии, были переведены на режим однократной инъекции 70/30 инсулина без глимепирида. Целевой уровень ГКН был достигнут в обеих группах, однако гликемический контроль улучшался значительно быстрее на фоне режима «комбинированный инсулин + глимепирид» (р < 0,001 через 2 недели) (Kabadi M.U., Kabadi U.M., 2003). Также требовалась меньшая доза инсулина при сочетании его с глимепиридом (49 vs 78 Ед/день, р < 0,001). Глимепирид понижал общую суточную дозу инсулина и таким образом — потребность в экзогенном инсулине в исследованной популяции больных СД 2-го типа. Исследователи делают вывод, что глимепирид по сравнению с другими производными СМ имеет более выраженные инсулинсберегающие свойства (более экономная стимуляция) (Kabadi M.U., Kabadi U.M., 2003). В рандомизированном контролируемом исследовании Fritsche A., Schweitzer M.A. и Haling H.U. (2003) изучили эффективность и безопасность 24-недельного приема глимепирида (3 мг) в сочетании с утренним или вечерним (перед сном) введением гларгина или вечерним введением НПХ-инсулина у больных СД 2-го типа, до этого плохо контролированного пероральными антигипергликемическими препаратами. Доза инсулина титровалась до достижения уровней ГКН ≤ 100 мг%. Установлено, что показатели HbA1c снижались на 1,24 % на фоне утренней инъекции гларгина и на 0,84 % на фоне вечерней инъекции НПХ. Улучшение показателей HbA1c было более выраженным при утренней инъекции гларгина, чем при введении НПХ-инсулина (р = 0,001) или вечерней инъекции гларгина (р = 0,008). Подобное улучшение уровней ГКН в конечной точке исследования по сравнению с базальной наблюдалось во всех трех группах пациентов. Ночные гипогликемии были менее частыми при утреннем и вечернем введении гларгина по сравнению с НПХ-инсулином (соответственно 17, 23 vs 38 %, р < 0,001). Авторы сделали вывод о том, что риск ночных гипогликемий у больных СД 2-го типа был ниже при сочетанных режимах использования глимепирида с утренней или вечерней инъекцией гларгина по сравнению с режимом «глимепирид + вечерняя инъекция НПХ-инсулина».
Влияние глимепирида (Амарила®) на резистентность к инсулину
Ряд исследований был посвящен изучению экстрапанкреатических эффектов глимепирида. Полученные результаты свидетельствовали о потенцировании глимепиридом ответа периферических тканей на инсулин (Muller G., Satoh Y., Geisen K., 1995; Muller G., 2000; Overkamp D. et al., 2002).
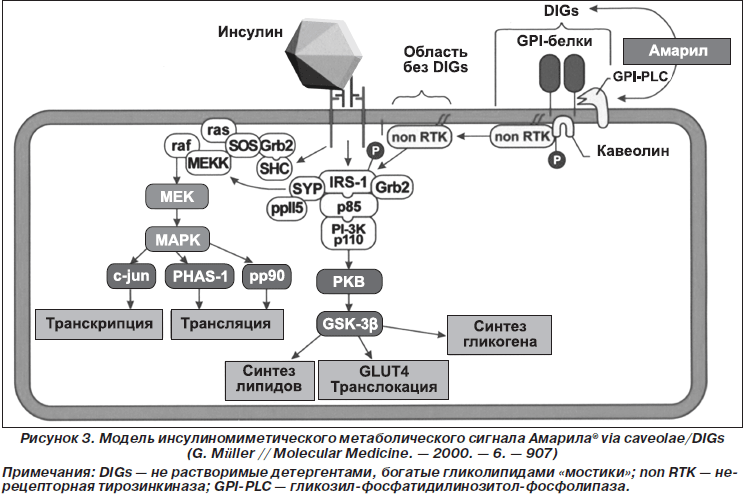
Относительно снижения инсулинорезистентности при применении глимепирида (препарат Амарил®) особого внимания заслуживает реализация последнего за пределами дефектного у больных СД 2-го типа взаимодействия «инсулин — рецептор», а именно: глимепирид, активируя нерецепторную тирозинкиназу, стимулирует метаболический инсулиновый сигналинг посредством прямой активации ИРС-1 с результирующим повышением утилизации глюкозы и липогенеза в органах/тканях-мишенях, торможением апоптоза, антиатерогенными эффектами, в частности с повышением выделения NO, снижением индукторов воспалительного процесса и др. (Muller G., 2000) (рис. 3).
Путем определения соотношения «среднее увеличение инсулина в плазме/среднее уменьшение глюкозы крови» можно изучить относительную степень экстрапанкреатической активности препарата. В исследовании, в котором оценивался ряд СМ-препаратов, глимепириду было присуще самое низкое соотношение увеличенного инсулина к уменьшенному уровню глюкозы, что наводит на мысль о существенной экстрапанкреатической активности этого препарата (Muller G., Satoh Y., Geisen K., 1995) (рис. 4). Overkamp D. и соавт. (2002) у небольшой группы инсулинрезистентных нормогликемических детей (потомков больных сахарным диабетом) изучили эффекты глимепирида в сравнении с физиологическим раствором на чувствительность к инсулину при использовании техники гиперинсулинемического эугликемического «зажима». При условии корректной блокады эндогенной секреции инсулина октреотидом в глимепиридной группе наблюдалось увеличение элиминации глюкозы из кровотока.

По сравнению с больными СД 2-го типа на терапии глибенкламидом или инсулином у пациентов, леченных глимепиридом, отмечены достоверно более низкие уровни ГКН, НbA1c, а НОМА-индексы, оценивающие выраженность резистентности к инсулину, были ниже у больных, получавших глимепирид, относительно показателей в группе, леченной глибенкламидом (Koshiba K. et al., 2006).
Снижение инсулинорезистентности, верифицированное в ряде клинических исследований на фоне терапии глимепиридом больных СД 2-го типа (Tsunekawa T. et al., 2003; Inukai K. et al., 2005a; Koshiba K. et al., 2006), основывается на усилении поглощения глюкозы в печени и периферической ткани и подавлении выделения глюкозы печенью (Muller G., Satoh Y., Geisen K., 1995). Сообщено, что глимепирид повышает продукцию в печени фруктозы-2, 6-бифосфата, активирует гликолитический путь, ингибирует глюконеогенез, выделение глюкозы и кетогенез в исследовании in vitro (Hatao K. et al., 1985). Глимепирид также усиливает поглощение глюкозы в скелетных мышцах (Takada Y. et al., 1996) и жировой ткани (Muller G., Geisen K., 1996).
Исследования in vitro с использованием культуры скелетных мышечных клеток обосновывают мнение об инсулин-сенсибилизирующем эффекте глимепирида (Haupt A. et al., 2002). Возможный механизм инсулин-сенситайзерной активности глимепирида включает активацию транспорта переносчиков глюкозы GLUT4 и/или перемещение в адипоцитах и миоцитах (Campbell R.K., 1998; Muller G., Satoh Y., Geisen K., 1995; Muller G., 2000). В более поздних исследованиях показано, что глимепирид тормозит липолиз и вызывает накопление триацилглицерола в адипоцитах крыс, действуя на фосфодиэстеразу и 5’-нуклеотидазу. Эти ферменты перемещались из специфических областей плазматической мембраны в клеточные жировые капли и гидролизовали цАМФ в ответ на экспозицию к глимепириду (Muller G. et al., 2008).
Недавно получены доказательства in vivo, что глимепирид действует как инсулин-сенситайзер, увеличивая ответы печени и мышц на инсулин (Mori R.C.T. et al., 2008). Так, 4-недельное введение глимепирида тучным инсулинрезистентным крысам увеличивало экспрессию GLUT4-протеина и утилизацию глюкозы в мышцах с повышенной интенсивностью окислительных процессов, а также чувствительность к инсулину и накопление гликогена в печени. Необходимо отметить, что у обработанных in vivo глимепиридом крыс увеличивалось содержание GLUT4-протеина, несмотря на их высокие инсулинемические уровни. Принимая во внимание тот факт, что хроническая гиперинсулинемия способна вызывать инсулинорезистентность с уменьшенной экспрессией GLUT4 в m.soleus, инсулин-сенситайзерные свойства глимепирида привлекают особое внимание. Получены доказательства, что in vivo глимепирид на модели экспериментальной инсулинорезистентности, индуцированной подкожной инъекцией мононатрия глутамата, действует на гликогенный путь, стимулируя и/или сохраняя содержание гликогена в печени (Mori R.C.T. et al., 2008).
Относительно возможных механизмов действия глимепирида следует отметить, что глимепирид как липофильная молекула способен интеркалировать в липидный бислой клеток и модулировать этапы инсулин-сигналингового каскада (Muller G., 2000). Кроме того, глимепирид может уменьшать активность NF-kВ (Schiekofer S. et al., 2003), экспрессия которого, как показано, отрицательно коррелирует с экспрессией GLUT4 в m.soleus (Silva J.L.T. et al., 2005). Эти механизмы могут включаться в тканево-специфичный путь улучшения чувствительности к инсулину глимепиридом.
Необходимо особо акцентировать внимание на существенном повышении адипонектина в крови при терапии глимепиридом пациентов с СД 2-го типа (Tsunekawa T. et al., 2003; Koshiba K. et al., 2006). Адипонектин является гликопротеином, синтезируемым исключительно жировой тканью, с плейотропными свойствами (инсулин-сенситайзерными, антивоспалительными, антиатерогенными и антионкогенными). Так, адипонектин усиливает активность тирозинкиназы без прямой связи с инсулиновыми рецепторами, вызывает повышение фосфориляции тирозина ИРС-1 и ИРС-2, активирует синтез гликогена через различные внутриклеточные сигналы. В добавление к этому сообщено, что адипонектин увеличивает фосфориляцию и активность 5’-АМФ-активированной протеинкиназы и это одновременно увеличивает поглощение глюкозы в миоцитах и печени и таким образом прямо регулирует обмен глюкозы и чувствительность к инсулину (Yamauchi T. et al., 2002). Напротив, фактор некроза опухоли альфа (ФНО-a) снижает активность тирозинкиназы инсулиновых рецепторов (Ozes O.N. et al., 2001), уменьшает транспорт глюкозы и вызывает инсулинорезистентность (Jain R. et al., 1999). Адипонектин и ФНО-a ингибируют и конкурируют друг с другом во время биосинтетической фазы в жировой ткани и в специфических тканях (Ouchi N. et al., 1999).
Механизм увеличения уровня адипонектина после введения глимепирида остается неясным. Имеются два биосинтетических пути для продукции адипонектина: 1) прямая продукция адипонектина через гамма-рецептор, активированный пролифератором пероксисом (PPAR-g), — внутриядерный рецептор адипоцитов и 2) относительное увеличение содержания адипонектина, вызванное уменьшением концентрации ФНО-a, который ингибирует продукцию адипонектина.
Mori и соавт. (2004) сообщили, что экспрессия мРНК ФНО-a в ретроперитонеальной жировой ткани значимо уменьшалась в группе крыс после введения глимепирида по сравнению с крысами, обработанными глибенкламидом. Имеются клинические сообщения о снижении циркуляторных уровней ФНО-a, ассоциированном с одновременным повышением адипонектинемии, у больных СД 2-го типа, леченных глимепиридом (Tsunekawa J. et al., 2003; Koshiba K. et al., 2006). Вместе с тем требуются дальнейшие исследования механизма увеличения уровня адипонектина и уменьшения ФНО-a после введения глимепирида.
Недавно показано, что глимепирид оказывает прямое действие на PPAR-g (Fukuen S. et al., 2005). При этом максимальная PPAR-g-активность в отношении глимепирида составляла 20 % от 1 мкмоля пиоглитазона. Этот PPAR-g-стимулирующий эффект глимепирида не наблюдался при использовании глибенкламида (Inukai K. et al., 2005). Это может быть причиной достоверного увеличения уровня адипонектина после введения глимепирида. Вышеприведенные результаты обеспечивают доказательства для нового аспекта действия глимепирида как агониста PPAR-g.
Влияние глимепирида на вес тела и ИМТ
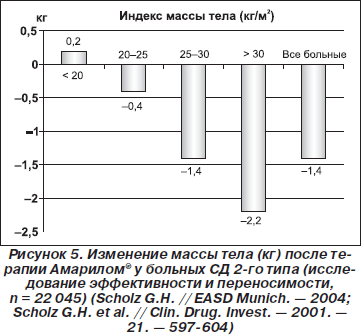
Контроль веса часто является проблемой при терапии больных СД 2-го типа. Глимепирид обеспечивает эффективный контроль уровней глюкозы крови без прироста веса (Davis S.N., 2004). Прирост веса является важным побочным эффектом при ряде режимов терапии больных СД 2-го типа, включая введение инсулина, тиазолидиндионов и других секретагогов. Это имеет клиническое значение, поскольку многие больные СД 2-го типа характеризуются наличием избыточного веса или ожирения до начала терапии. Отсутствие достоверного увеличения веса показано в группе больных СД 2-го типа, находившихся на терапии глимепиридом более 12 месяцев (Bugos С. et al., 2000). Реальное уменьшение веса (1–2 кг) наблюдалось через 8 недель терапии глимепиридом и было наиболее выражено у тучных пациентов (Scholz G. et al., 2001) (рис. 5). Вышеприведенное формирует заключение о более нейтральном относительно веса действии глимепирида по сравнению с другими препаратами СМ. При сравнении эффектов глимепирида и глибурида на вес тела у 520 амбулаторных больных СД 2-го типа на протяжении более 12 месяцев показано, что средняя потеря веса и уменьшение индекса массы тела в конечной точке относительно базального состояния были бульшими при терапии глимепиридом: соответственно –2,0 ± 4,0 кг/ –0,7 ± 1,4 кг/м2 vs –0,58 ± 3,70 кг/–0,2 ± 1,3 кг/м2, р < 0,001 (Martin S. et al., 2003). С другой стороны, имеется сообщение об увеличении веса при терапии глимепиридом (1,7 ± 0,4 кг) длительностью более 26 недель, которое было подобно наблюдавшемуся после терапии пиоглитазоном (Umpierrez G., Issa M., Vlajnic A., 2006).
Несколько клинических исследований также подтвердили, что как вес, так и индекс массы тела не увеличивается после введения глимепирида (Weitgasser R. et al., 2003; Koshiba K. et al., 2006).
Антиатерогенный эффект глимепирида
На начальных стадиях атеросклероза поврежденные эндотелиальные васкулярные клетки экспрессируют межклеточные адгезивные молекулы, такие как адгезивные молекулы васкулярных клеток (VCAM-1), внутриклеточные адгезивные молекулы ICAM-1 и Е-селектин, что приводит к прикреплению моноцитов к сосудистой стенке. Моноциты внедряются в сосудистый эндотелий, секретируют цитокины, такие как ФНО-a, аккумулируют эфиры холестерина и трансформируются в пенистые клетки. Более того, ФНО-a вызывает дальнейшую адгезию моноцитов. В поврежденном эндотелии адипонектин подавляет экспрессию этих межклеточных адгезивных молекул, уровни которых увеличены ФНО-a-зависимым путем (Ouchi N. et al., 2000), а также экспрессию и секрецию ФНО-a (Yokota N. et al., 2000), экспрессию скавенджер-рецепторов класса А и угнетает превращение макрофагов в пенистые клетки (Ouchi N. et al., 2001). Эти механизмы ингибируют как начало (инициирование), так и прогрессирование атеросклероза.
Глимепирид способствует улучшению обмена липидов (Derosa G. et al., 2004), улучшает функцию эндотелия, связанную с биосинтезом монооксида азота (Ueba H. et al., 2005), и обладает антиатеросклеротическими эффектами (Ueba H. et al., 2005; Yang B. et al., 2005). Так, глимепирид увеличивал продукцию NO эндотелиальными клетками коронарной артерии человека (HCAECs) in vitro (Ueba H. et al., 2005). Необходимо подчеркнуть важность NO-повышающего эффекта глимепирида, поскольку для инсулинорезистентных больных СД 2-го типа с ухудшением/отсутствием инсулинового сигналинга по метаболическому (РI3-киназному) пути характерно снижение продукции NO (NO-синтаза активируется через тот же РI3-киназный путь), что приводит к эндотелиальной дисфункции и ускоренному атеросклерозу (DeFronzo R.A., 2010).
Глимепирид вызывал значимое повышение эндотелий-зависимой вазодилатации у больных СД 2-го типа in vivo, исследованной с помощью позитрон-эмиссионной томографии, при комбинированной терапии с метформином (один метформин не оказывал эффекта на данный показатель) (Alexanderson A. et al., 2007).
В связи с этим заслуживает внимания сообщение, что 28-недельное применение глимепирида у больных СД 2-го типа, находившихся до этого на терапии глибенкламидом, повышало чувствительность к инсулину и уменьшало атеросклеротические нарушения: снижался показатель НОМА-ИР, достоверно увеличивались уровни плазменного адипонектина, уменьшались циркуляторные уровни ФНО-a, интерлейкина-6 и высокочувствительного СРП (вч-СРП), замедлялась скорость брахиально-лодыжечной пульсовой волны и снижались показатели индекса увеличения (Koshiba K. et al., 2006). Следует отметить, что в группе больных СД 2-го типа, продолжавших получать глибенкламид, а также в группе пациентов на инсулинотерапии данные показатели по сравнению с исходным периодом не изменялись. Эти уникальные свойства глимепирида могут быть полезными у пациентов с метаболическим синдромом.
Рекомендации АНА/АСС 2003 года сообщают о полезности определения вч-СРП для первичной профилактики кардиоваскулярных болезней (Pearson T.A. et al., 2003). Достоверное снижение вч-СРП у больных СД 2-го типа после лечения глимепиридом (Tsunekawa J. et al., 2003; Koshiba K. et al., 2006) свидетельствует об участии препарата в предупреждении коронарной болезни сердца (ИБС). Более того, глимепирид также оказывает ингибиторный эффект на начало и развитие атеросклероза. Так, Yunukai K. и соавт. (2005) показали, что у пациентов, ранее леченных только СМ, или леченных СМ короткое время (менее чем 5 лет) с ожирением (ИМТ ≥ 25), или имевших высокую инсулинорезистентность (НОМА-ИР ≥ 3), переход с терапии глибенкламидом на терапию глимепиридом приводил к уменьшению инсулинорезистентности. В добавление необходимо подчеркнуть еще раз антиатерогенные свойства глимепирида, реализуемые через повышение уровней циркулирующего адипонектина (Tsunekawa J. et al., 2003; Koshiba K. et al., 2006), обладающего инсулин-сенсибилизирующими и антиатерогенными эффектами, опосредуемыми в пределах и за пределами повышения чувствительности организма к инсулину (Fernandez-Real J.-M. et al., 2004). Существенно то, что клинические результаты свидетельствуют о снижении инсулинорезистентности и атеросклеротических нарушений глимепиридом без прироста массы тела.
Следует отметить также клинические и экспериментальные данные, демонстрирующие наиболее выраженные по сравнению с другими СМ-препаратами антитромботические свойства глимепирида (Шустов С.Б., Ромашевский Б.В., Лысенко А.Г., 2001; Siluk D. et al., 2002) и замедляющий эффект относительно роста атеросклеротической бляшки (Shakuto S. et al., 2002), как и снижение частоты желудочковых экстрасистол у больных СД 2-го типа с сердечной недостаточностью, леченных гликлазидом (Pogatsa G. et al., 2001) (рис. 6).

Безопасность
Безопасность и переносимость глимепирида оценена более чем у 5000 пациентов, и результаты свидетельствуют об отсутствии нарушений лабораторных показателей. Побочными событиями, обнаруженными у менее чем 2 % больных пациентов, получавших глимепирид, были проявления гипогликемии, головокружение, астения, головная боль, сыпь и тошнота (Sanofi-Aventis Canada, 2009). Гастроинтестинальные побочные реакции (рвота, гастроинтестинальная боль, диарея) наблюдались менее чем у 1 % пациентов в плацебо-контролируемых исследованиях (Sanofi-Aventis Canada, 2009). Анализ объединенных результатов свидетельствует о том, что частота всех побочных эффектов глимепирида подобна или меньше по сравнению с таковой других СМ-препаратов (Briscoe V.J., Grifith M.L., Davis S.N., 2010).
Наиболее существенным клиническим побочным эффектом глимепирида, как и других производных СМ, является гипогликемия. Согласно данным проспективного анализа частоты тяжелых гипогликемий (необходимость внутривенного введения глюкозы или глюкагона) при лечении глимепиридом vs глибурид (глибенкламид) большой группы пациентов, частота гипогликемий была существенно ниже при терапии глимепиридом (0,86 эпизода/1000 пациенто-лет vs 5,6 эпизода/1000 пациенто-лет) (Holstein A., Plaschke A., Egbers E.H., 2001). Несомненным преимуществом глимепирида является уменьшенние частоты гипогликемий во время физических упражнений. Так, показано статистически значимое снижение уровней С-пептида и инсулина в крови во время острой физической нагрузки у больных СД 2-го типа, леченных глимепиридом, по сравнению с леченными глибуридом (Massi-Benedetti M., Herz M., Preiffer C., 1996). Это может объяснять меньшую частоту гипогликемий во время и после физических упражнений.
Реализация данного эффекта связана с отсутствием у глимепирида по сравнению в другими СМ-препаратами, в частности глибенкламидом, блокирующего действия на КАТФ-зависимые каналы панкреатических a-клеток, синтезирующих и секретирующих глюкагон (Diedenhofen A., Rosenkranz B. et al., 2000), а также с зависимостью инсулин-сенсибилизирующего действия глимепирида от уровня глюкозы (Muller G., 2004). Безопасность глимепирида определяется также отсутствием его повреждающего влияния на защитный феномен ишемического прекондиционирования (Klepzing H. et al., 1999; Александров А.А. и соавт., 2002; Caulfield M. et al., 2002; Lee T.M. et al., 2003; Полторак В.В., Горбенко Н.И., Горшунская М.Ю., 2002).
И хотя клиническое значение ишемического прекондиционирования у человека до конца не выяснено, имеющиеся к настоящему времени доказательства позволяют говорить о полезности этого адаптивного феномена и правомерности его определения как золотого стандарта кардиопротекции (Ferdinand P. et al., 2007). Глимепирид, обладающий уникальным сочетанием инсулин-секретогенных («щадящая» стимуляция) и инсулин-сенситайзерных свойств, при нейтральном эффекте на вес и низком риске гипогликемий может быть лучшим выбором у больных СД 2-го типа при наличии кардиоваскулярного риска по сравнению с другими СМ-препаратами в связи с отсутствием повреждающего эффекта в отношении этого защитного феномена.
Не исключено, что сохранение феномена ишемического прекондиционирования, а именно митохондриальных его механизмов, глимепиридом, оставляющим открытыми КАТФ-каналы мембран миокардиальных митохондрий, которые доминируют в генезе метаболической адаптации к ишемии (Tann M. et al., 2001), и объясняет наименьшую смертность при комбинированной терапии во Флорентийском исследовании больных СД 2-го типа (Mannuci E. et al., 2004). У пациентов, получавших репаглинид или гликлазид в сочетании с метформином, годовая смертность была выше, чем у больных на комбинированной терапии «метформин + глимепирид» (соответственно р = 0,024 и 0,035).
Клинические преимущества препарата Амарил® определяются его длительным антидиабетическим действием (24 часа), реализуемым за счет:
1) щадящей дозозависимой стимуляции секреции инсулина, ассоциированной с концентрацией глюкозы и отсутствием стимулирующего эффекта на продукцию контринсулинового гормона глюкагона b-клетками поджелудочной железы, что существенно снижает риск гипогликемий и уменьшает прирост массы тела/не влияет на нее;
2) внепанкреатических эффектов:
— прямого инсулин-имитирующего действия + инсулин-сенсибилизирующих эффектов (через повышение уровня адипонектина и снижение фактора некроза опухоли a, вч-СРП);
— повышения продукции NO сосудистыми клетками.
Вышеперечисленные эффекты препарата Амарил® реализуются в оптимизации гликемического контроля, индуцирующей снижение глюко- и липотоксичности и обусловленных ими прежде всего диабетических микроангиопатий, а также в благоприятном (протективном) действии на связанные с инсулинорезистентным состоянием классические и неклассические факторы риска макрососудистой патологии, в первую очередь — кардиоваскулярной.
Таким образом, глимепирид (Амарил®), являясь единственным препаратом СМ 3-й генерации, способным воздействовать на оба патогенетических звена СД 2-го типа — инсулинорезистентность и нарушенную функцию b-клеток, обеспечивает эффективный гликемический контроль, равный таковому других секретагогов при «щадящей» секреции инсулина в ассоциации с уникальными антиатерогенными свойствами, обладает сниженным потенциалом к гипогликемии, отсутствием повреждающего влияния на вес (иллюстративный материал представлен в лекции Полторак В.В., Горшунской М.Ю., 2010). Более того, в фармакоэкономическом исследовании, в котором были учтены оригинальные эффекты глимепирида, а также стоимость этого препарата, сделано заключение, что монотерапия глимепиридом или комбинация его с другими сахароснижающими препаратами (метформин, инсулин) являются наиболее эффективными еще и с экономической точки зрения (Kabadi U.M., 2004).
В настоящее время глимепирид широко используется более чем в 60 странах мира для терапии больных СД 2-го типа (Briscoe V.J., Grifith M.L., Davis S.N., 2010).
В заключение необходимо сделать ремарку относительно того, что представленные в обзоре результаты клинических исследований биологических эффектов глимепирида (специфическое действие, параметры безопасности) получены при использовании брендового препарата. Реализация всего спектра специфической фармакологической активности и обеспечение сопоставимых показателей безопасности в случае использования генериков гарантируется при условии доказанной для последних фармацевтической, фармакокинетической и терапевтической эквивалентности с брендовыми препаратами (Meredith P., 2003; Рудык Ю.С., 2007; Полторак В.В., Липсон В.В., Никишина Л.Е., 2008; Jazairi A.S. et al., 2008).
И хотя определение фармакокинетического паттерна (биоэквивалентности) лекарственных средств считается основным критерием медико-биологического контроля качества генерического препарата в странах ЕС, США, Российской Федерации, накопленный в последние годы фактический материал свидетельствует о возможности клинической неэквивалентности брендовых и генерических препаратов определенных классов при доказанной их био- эквивалентности (Meredith P., 2003; Рудык Ю.С., 2007; Полторак В.В., Липсон В.В., Никишина Л.Е., 2008). Относительно пероральных антидиабетических препаратов: к факторам, определяющим возможные несовпадения, могут быть отнесены различия в функционировании ряда биологических систем у добровольцев, включаемых для исследования биодоступности, и больных СД, которым показана длительная антидиабетическая терапия (соответственно, у добровольцев более молодой возраст, использование одной минимальной дозы препарата vs широкий диапазон терапевтических доз препарата при многолетнем применении у больных, как и наличие у последних метаболического дисбаланса и различных хронических осложнений, которые могут влиять на фармакокинетику препарата). Вышеотмеченное обосновывает значимость исследования клинической эффективности генерика для идентификации терапевтической его эквивалентности брендовому препарату.
Следует подчеркнуть немногочисленность публикаций относительно биоэквивалентности инновационного глимепирида (референтный препарат Amaryl®, Amarel®, Solosa®, Sanofi-Aventis, Paris, France) и его генерических копий, верифицированной независимыми исследовательскими группами (Jovanovic D. et al., 2006). Особенно настораживает доказанная итальянскими исследователями фармацевтическая неэквивалентность 74 % маркетированных генерических форм глимепирида (17 из 23 воспроизведенных препаратов таблеток глимепирида) оригинальному препарату (2 мг глимепирида, Amaryl®, Sanofi-Aventis) (Atorrese G., Massi-Benedetti M., 2007). Больше всего образцов (15 из 23) имели существенные различия в профилях растворения по сравнению с оригинальным лекарственным средством (ЛС). Содержание АФИ во всех образцах находилось в пределах 90–102 % от бренда, вместе с тем у отдельных генериков наблюдалось увеличение продуктов деградации АФИ на модели «ускоренного старения» ЛС (хранение лекарственной формы без упаковки при температуре 60 °С). Следует подчеркнуть, что тесты на содержание АФИ, сопутствующих примесей и остаточных растворителей являются фармакопейными требованиями и характеризуют частоту препаратов, а тест «Растворение» позволяет выявить фальсификации и является первым этапом в оценке биоэквивалентности. Следовательно, если в ходе исследования in vitro доказано, что воспроизведенные ЛС неадекватны по качеству оригинальному препарату, то нет смысла в проведении их испытаний in vivo.
В целом исследование итальянских авторов показало, что значительный процент генерических копий глимепирида (Амарил®) характеризуется ухудшенным качеством (несоответствием бренду), определенным по содержанию активного компонента, уровню примесей, остаткам растворителя и профилю диссоциации. Такие отклонения от стандартов могут приводить к продукции глимепирида с уменьшенной эффективностью.
Несомненно, широкое использование генерических препаратов в клинической практике должно основываться на доступных практикующим врачам ясных указаниях относительно фармацевтической, фармакокинетической и, в первую очередь, терапевтической эквивалентности генерика оригинальному препарату. Более того, поиск фармакоэкономических преимуществ генерика по сравнению с брендовым (оригинальным) препаратом обоснован лишь при наличии полной информации о соблюдении требований GМР при производстве генерика, фармакокинетической и терапевтической его эквивалентности при сравнении с оригинальным препаратом (Meredith P., 2003; Рудык Ю.С., 2007).
В Украине в связи с преобладанием на рынке воспроизведенных ЛС (генериков) проблема их идентичности брендам чрезвычайно актуальна, и, хотя ее научные аспекты достаточно широко обсуждаются многими специалистами, экспериментальная оценка основных биофармацевтических показателей копий пока не получила должного распространения.
1. Briscoe V.J. The role of glimepiride in the treatment of type 2 diabetes mellitus [Text] / V.J. Briscoe, M.L. Griffith, S.N. Davis // Expert Opin. Drug Metab. Toxicol. — 2010. — Vol. 6. — P. 225-235.
2. Insulin resistance differentially affects the PI 3-kinase and map kinase-mediated signaling in human muscle [Text] / K. Cusi, K. Maezono, A. Osman [et al.] // J. Clin. Invest. — 2000. — Vol. 105. — P. 311-320.
3. DeFronzo R.A. Insulin resistance, lipotoxity, type 2 diabetes and atherosclerosis: the missing links. The Claude Bernard Lecture 2009 [Text] / R.A. DeFronzo // Diabetologia. — 2010. — Vol. 53. — P. 1270-1287.
4. Marquezine C.F., Wajchenberg B.J. // The Endocrinologist. — 2007. — Vol. 17. — P. 351-356.
5. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes [Text] / D.M. Nathan, J.B. Buse, M.B. Davidson et al. // Diabetes Care. — 2009. — Vol. 32. — P. 193-203.
6. Wang L. Molecular mechanisms of insulin resistance that impact cardiovascular biology [Text] / L. Wang, M.L. Goalstone, B. Draznin // Diabetes. — 2004. — Vol. 53. — P. 2735-2740.
7. Draznin B. Molecular mechanisms of insulin resistance: serine phosporylation of insulin receptor substrate-1 and increased expression of p85alfa: the two sides of a coin [Text] / B. Draznin // Diabetes. — 2006. — Vol. 55. — P. 2392-2397.
8. Purnell J.Q. Weight effect of current and experimental drugs for diabetes mellitus: from promotion to alleviation of obesity [Text] / J.Q. Purnell, C. Weyer // Treat Endocrinol. — 2003. — Vol. 2. — P. 33-47.
9. Muller G. Extrapancreatic effects of sulfonylureas — a comparison between glimeperide and conventional sulfonylureas [Text] / G. Muller, Y. Satoh, K. Geisen // Diabetes Res. Clin. Pract. — 1995. — Vol. 28. — P. 115-137.
10. Long-term treatment of type 2 diabetic patients with the new oral antidiabetic agent glimepiride (amaryl): a double-blind comparison with glibenclamide [Text] / K.E. Draeger, K. Wernicke-Panten, H.J. Lomp et al. // Horm. Metab. Res. — 1996. — Vol. 28, № 9. — P. 419-425.
11. Полторак В.В. Амарил — сульфаниламидный препарат третьей генерации: роль в лечении сахарного диабета 2-го типа [Текст] / В.В. Полторак, Н.И. Горбенко // Український терапевтичний журнал. — 2001. — Т. 3, № 2. — С. 27-32.
12. Полторак В.В. Сахарный диабет 2-го типа: два патогенетических дефекта, две мишени для терапевтического воздействия [Текст] / В.В. Полторак, М.Ю. Горшунская // Ліки України. — 2010. — № 6(142). — С. 82-85.
13. Glimepiride improves both first and second phases of insulin secretion in type 2 diabetes [Text] / M. Korytkowski, A. Thomas, L. Reid et al. // Diabetes Care. — 2002. — Vol. 25. — Р. 1607-1611.
14. Muller G. Differential interaction of glimepiride and glibenclamide with the beta-cell sulfonylurea receptor. I. Binding characteristics [Text] / G. Muller // Biochim. Biophys. Acta. — 1994. — Vol. 1191. — P. 267-277.
15. Differential interaction of glimepiride and glibenclamide with the b-cell sulfonylurea receptor. II. Photoaffinity labeling of a 65 kDa protein by [3H] glimepiride [Text] / G. Muller, D. Hartz, J. Punter et al. // Biochim. Biophys. Acta. — 1994. — Vol. 1191. — P. 267-277.
16. Goldberg R.B. A dose-response study of glimepiride in patients with NIDDM who have previously received sulfonylurea agents. The Glimepiride Protocol № 201 Study Group [Text] / R.B. Goldberg, S.M. Holvey, J. Schneider // Diabetes Care. — 1996. — Vol. 19. — P. 849-856.
17. Glimepiride, a new once-daily sulfonylurea. A double-blind placebo-controlled study of NIDDM patients. Glimepiride Study Group [Text] / J. Rosenstock, E. Samols, D.B. Muchmore et al. // Diabetes Care. — 1996. — Vol. 19. — P. 1194-1199.
18. Schade D.S. A placebo-controlled, randomized study of glimepiride in patients with type 2 diabetes mellitus for whom diet therapy is unsuccessful [Text] / D.S. Schade, L. Jovanovic, J. Schneider // J. Clin. Pharmacol. — 1998. — Vol. 38. — P. 636-641.
19. Сучасна пероральна антидіабетична терапія [Текст]: метод. рекомендації / Міністерство охорони здоров’я України, Національна Академія медичних наук України / Н.О. Кравчун, Ю.І. Караченцев, В.В. Полторак, М.Ю. Горшунська, О.В. Козаков, Т.П. Левченко. — Х., 2007. — 20 с.
20. Improved glycaemic control by addition of glimepiride to metformin monotherapy in type 2 diabetic patients [Text] / G. Charpentier, F. Fleury, M. Kabir et al. // Diabet. Med. — 2001. — Vol. 18. — P. 828-834.
21. Применение амарила в комплексной терапии сахарного диабета типа 2 с метаболическим синдромом [Текст]: метод. рекомендации / Министерство здравоохранения Украины, Академия медицинских наук Украины, Украинский центр научной медицинской информации и патентно лицензионной работы / Н.А. Кравчун, Т.П. Левченко, В.В. Полторак, О.В. Козаков. — Х., 2004. — 20 с.
22. Garber A.J. Benefits of combination therapy of insulin and oral hypoglycemic agents [Text] / A.J. Garber // Arch. Intern. Med. — 2003. — Vol. 163. — P. 1781-1782.
23. Riddle M.C. Combined therapy with a sulfonylurea plus evening insulin: safe, reliable, and becoming routine [Text] / M.C. Riddle // Horm. Metab. Res. — 1996. — Vol. 28. — P. 430-433.
24. Kabadi M.U. Efficacy of sulfonylureas with insulin in type 2 diabetes meilitus [Text] / M.U. Kabadi, U.M. Kabadi // Ann. Pharmacother. — 2003. — Vol. 37. — P. 1572-1576.
25. Fritsche A. Glimepiride combined with morning insulin glargine, bedtime neutral protamine hagedorn insulin, or bedtime insulin glargine in patients with type 2 diabetes. A randomized, controlled trial [Text] / A. Fritsche, M.A. Schweitzer, H.U. Haling // Ann. Intern. Med. — 2003. — Vol. 38. — P. 952-959.
26. Muller G. The molecular mechanism of the insulin-mimetic/sensitizing activity of the antidiabetic sulfonylurea drug amaryl [Text] / G. Muller // Mol. Med. — 2000. — Vol. 6. — P. 907-933.
27. Acute effect of glimepiride on insulin-stimulated glucose metabolism in glucose-tolerant insulin-resistant offspring of patients with type 2 diabetes [Text] / D. Overkamp, A. Volk, E. Maerker et al. // Diabetes Care. — 2002. — Vol. 25. — P. 2065-2073.
28. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis [Text] / K. Koshiba, M. Nomuro, Y. Nakaya et al. // Journ. Med. Invest. — 2006. — Vol. 53. — P. 87-94.
29. Plasma adiponectin plays an important role in improving insulin resistance with glimepiride in elderly type 2 diabetic subjects [Text] / T. Tsunekawa, T. Hayashi, Y. Suzuki et al. // Diabetes Care. — 2003. — Vol. 26. — P. 285-289.
30. Efficacy of glimepiride in Japanese type 2 diabetic subjects [Text] / K. Inukai, M. Watanabe, Y. Nakashima et al. // Diabetes Res. Clin. Pract. — 2005a. — Vol. 68. — P. 250-257.
31. Sulfonylurea stimulates liver fructose-2, 6-biphospate formation in proportion to its hypoglycemic action [Text] / K. Hatao, K. Kaku, M. Matsuda et al. // Diabetes Res. Clin. Pract. — 1985. — Vol. 1. — P. 49-53.
32. Effect of glimepiride (HOE 490) on insulin receptors of sceletal muscles from genetically diabetic KK-Ay mouse [Text] / Y. Takada, Y. Takata, M. Iwanishi et al. // Eur. J. Pharmacol. — 1996. — Vol. 308. — P. 205-210.
33. Muller G. Characterization of the molecular mode of action of the sulfonylurea, glimeperide, at adipocytes [Text] / G. Muller, K. Geisen // Horm. Metab. Res. — 1996. — Vol. 28. — P. 469-487.
34. Effect of glimepiride on insulin-stimulated glycogen synthesis in cultured human skeletal muscle cells: a comparison to glibenclamide [Text] / A. Haupt, C. Kausch, D. Dahl et al. // Diabetes Care. — 2002. — Vol. 25. — P. 2129-2132.
35. Campbell R.K. Glimepiride: role of a new sulfonylurea in the treatment of type 2 diabetes mellitus [Text] / R.K. Campbell // Ann. Pharmacother. — 1998. — Vol. 32. — P. 1044-1052.
36. Coordinated regulation of esterification and lipolysis by palmitate, H2O2 and the anti-diabetic sulfonylurea drug, glimepiride, in rat adipocytes [Text] / G. Muller, S. Wied, J. Straub et al. // Eur. J. Pharmacol. — 2008. — Vol. 597. — P. 6-18.
37. Glimepiride as insulin sensitizer: increased liver and muscle responses to insulin [Text] / R.C.T. Mori, S.M. Hirabara, A.E. Hirata et al. // Diabetes, Obesity and Metabolism. — 2008. — Vol. 1111. — P. 1463-1326.
38. Glimepiride reduces mononuclear activation of the redox-sensitive transcription nuclear factor-kappaB [Text] / S. Schiekofer, G. Rudofsky Jr., M. Andrassy et al. // Diabetes Obes. Metab. — 2003. — Vol. 5. — P. 251-261.
39. NF-kB, MEF-2A, MEF-2D and HIF1a involvement on insulin and contraction-induced regulation of GLUT4 gene expression in soleus muscle [Text] / J.L.T. Silva, G. Giannocco, D.T. Furuya et al. // Moll. Cell. Endocrynol. — 2005. — Vol. 240. — P. 82-93.
40. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase [Text] / T. Yamauchi, J. Kamon, Y. Monokoshi et al. // Nat. Med. — 2002. — Vol. 8. — P. 1288-1295.
41. A phosphatidylinositol 3-kinase/Akt/mTOR pathway mediates and PTEN antagonizes tumor necrosis factor inhibition of insulin signaling through insulin receptor substrate-1 [Text] / O.N. Ozes, H. Akca, L.D. Mayo et al. // Proc. Natl. Acad. Sci. — 2001. — Vol. 98. — P. 4660-4645.
42. Tumour necrosis factor-alpha regulates expression of CCAAT-enhancer-binding proteins (C/EBPs) alpha and beta and determines the occupation of the C/EBP site in the promoter of the insulin-responsive glucose-transporter gene in 3T3-L1 adipocytes [Text] / R. Jain, S. Police, K. Phelps et al. // Biochem. J. — 1999. — Vol. 338. — P. 737-743.
43. Novel modulator for endothelial adhesion molecules: adipocyte-derived receptor gamma agonistic activity [Text] / N. Ouchi, S. Kihara, Y. Arita et al. // Biochem. J. — 1999. — Vol. 100. — P. 2473-2476.
44. Comparison of the effects of glimepiride and glibenclamide on adipose tissue tumour necrosis factor-alpha mRNA expression and cellularity [Text] / Y. Mori, H. Komiya, N. Kurokawa et al. // Diabetes Obes. Metab. — 2004. — Vol. 6. — P. 28-34.
45. Sulfonylurea agents exhibit peroxisome proliferators-activated receptor gamma agonistic activity [Text] / S. Fukuen, M. Iwaki, A. Yasui et al. // J. Biol. Chem. — 2005. — Vol. 280. — P. 23653-23659.
46. Glimepiride enhances intrinsic peroxisome proliferator-activated receptor-gamma activity in 3T3-L1 adipocytes [Text] / K. Inukai, M. Watanabe, Y. Nakashima et al. // Biochem. Byophys. Res. Commun. — 2005b. — Vol. 328. — P. 484-490.
47. Davis S.N. The role of glimepiride in the effective management of type 2 diabetes [Text] / S.N. Davis // J. Diabetes Complications. — 2004. — Vol. 18. — P. 367-376.
48. Long-term treatment of type 2 diabetes mellitus with glimepiride is weight neutral: a meta-analysis [Text] / C. Bugos, M. Austin, T. Atherton et al. // Diabetes Res. Clin. Pract. — 2000. — Vol. 50, Suppl. 1. — S. 47.
49. Efficacy and tolerability of glimepiride in daily practice: a non-interventional observational cohort study [Text] / G. Scholz, K. Schneider, W. Knirsch et al. // Diabetes Res. Clin. Pract. — 2001. — Vol. 21. — P. 597-604.
50. Change in patients’ body weight after 12 months of treatment with glimepiride or glibenclamide in type 2 diabetes: a multicentre retrospective cohort study [Text] / S. Martin, H. Kolb, J. Beuth et al. // Diabetologia. — 2003. — Vol. 46. — P. 1611-1617.
51. Umpierrez G. Glimepiride versus pioglitazone combination therapy in subjects with type 2 diabetes inadequately controlled on metformin monotherapy: results of a randomized clinical trial [Text] / G. Umpierrez, M. Issa, A. Vlajnic // Curr. Med. Res. Opin. — 2006. — Vol. 22. — P. 751-759.
52. Effects of glimepiride on HbA(1c) and body weight in type 2 diabetes: results of a 1.5-year follow-up study [Text] / R. Weitgasser, M. Lechleitner, A. Luger et al. // Diabetes Res. Clin. Pract. — 2003. — Vol. 61. — P. 13-19.
53. Adiponectin, an adipocyte-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway [Text] / N. Ouchi, S. Kihara, Y. Arita et al. // Circulation. — 2000. — Vol. 102. — P. 1296-1301.
54. Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages [Text] / N. Yokota, K. Oritani, I. Takahashi et al. // Blood. — 2000. — Vol. 96. — P. 1723-1732.
55. Adipocyte-derived plasma protein, adiponectin, suppresses lipid accumulation and class A scavenger receptor expression in human monocyte-derived macrophages [Text] / N. Ouchi, S. Kihara, Y. Arita et al. // Circulation. — 2001. — Vol. 103. — P. 1057-1063.
56. Metabolic variations with oral antidiabetic drugs in patients with type 2 diabetes: comparison between glimepiride and metformin [Text] / G. Deroza, I. Franzetti, G. Gadaleta et al. // Diabetes Nutr. Metab. — 2004. — Vol. 17. — P. 143-150.
57. Glimepiride induces nitric oxide production in human coronary artery endothelial cells via a PI3-kinase-Act dependent pathway [Text] / H. Ueba, M. Kuroki, S. Hashimoto et al. // Atherosclerosis. — 2005. — Vol. 183. — P. 35-39.
58. The change of atherogenic index of plasma (AIP) level in type 2 diabetic pedigrees and the response of AIP to Acarbose or Glimepiride in therapy of type 2 diabetes mellitus [Text] / B. Yang, H. Tian, Y. Ren et al. // Sheng Wu Yi Xue Gong Cheng Xue Za Zhi 22 (English Abstract). — 2005. — P. 560-564.
59. Treatment of endothelial dysfunction with glimepiride + metformin in patients with type 2 diabetes mellitus: evaluation with position emission tomography [Text] / A. Alexanderson, G. Alexanderson, C. Sierra et al. // Diabetologia (Abstracts of the 43rd EASD Annual Meeting, Netherlands). — 2007. — Vol. 50. — Abstract. 1177. — S. 483.
60. Centers for Disease Control and Prevention; American Heart Association: Markers of inflammation and cardiovascular disease: application to clinical and public health practice. A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association [Text] / T.A. Pearson, G.A. Mensah, R.W. Alexanderson et al. // Circulation. — 2003. — Vol. 107. — P. 499-511.
61. Glimeperide enhaces intrinsic peroxisome proliferator-activated receptor-gamma activity in 3T3-L1 adipocytes [Text] / K. Yunukai, M. Watanabe, Y. Nakashima et al. // Biochem. Byophys. Res. Commun. — 2005. — Vol. 328. — P. 484-490.
62. Adiponectin is associated with vascular function independent of insulin sensitivity [Text] / J.M. Fernandez-Real, A. Castro, G. Vasques et al. // Diabetes Care. — 2004. — Vol. 27, № 3. — P. 739-745.
63. Шустов С.Б. Влияние Амарила® на углеводный, липидный обмен и гемодинамику у больных сахарным диабетом 2-го типа [Текст] / С.Б. Шустов, Б.В. Ромашевский, А.Г. Лысенко // Сахарный диабет. — 2001. — № 4. — С. 42-45.
64. Antiagregattory activity of hypoglycaemic sulphonylureas [Text] / D. Siluk, R. Kaliszan, P. Haber et al. // Diabetologia. — 2002. — Vol. 45, P. 1034-1037.
65. Prophylactic effect of the sulphonylurea, glimepiride, on athe-rosclerosis [Text] / S. Shakuto, Y. Sato, K. Oshima et al. // Diabetologia (Abstracts of the 38th Annual Meeting of the EASD, Hungary). — 2002. — Vol. 45, suppl. 2. — Abstract 853. — P. A275.
66. Pogatsa G. et al. // Diabetes. — 2001. — Vol. 50. — Suppl. 1: A128. — Abstract 513P.
67. Sanofi-Aventis Canada, Inc. Product Monograph (Amaryl, glimepiride). — 2009.
68. Holstein A. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide [Text] / A. Holstein, A. Plaschke, E.H. Egberts et al. // Diabetes Metab. Res. Rev. — 2001. — Vol. 17. — P. 467-473.
69. The effects of acute exercise on metabolic control in type 2 diabetic patients treated with glimepiride or glibenclamide [Text] / M. Massi-Benedetti, M. Herz, C. Pfeiffer et al. // Horm. Metab. Res. — 1996. — Vol. 28. — P. 451-455.
70. Scientific monograph Amaryl® 3rd revised edition [Text] / A. Diedenhofen, B. Rosenkranz, R. Robkamp et al. // Aventis Pharma. — 2000. — P. 1-114.
71. Sulfonylureas and ischemic preconditioning; a double- blind, placebo-controlled evaluation of glimeperide and glibenclamide [Text] / H. Klepzing, G. Kober, C. Matter et al. // Eur. Heart J. — 1999. — Vol. 20. — P. 439.
72. Александров А.А. Сахароснижающая терапия и сердце: бремя доказательств [Текст] / А.А. Александров // Consilium Medicum. — 2002. — Т. 4, № 10. — С. 551-554.
73. Caulfield M. Cardiovascular safety of oral antidiabetic agents: the insulin secretagogues [Text] / M. Caulfield, K. O’Brien et al. // Clin. Diabetes. — 2002. — Vol. 20. — P. 81-84.
74. Lee T.M. Impairment of myocardial protection in type 2 diabetic patients [Text] / T.M. Lee, T.F. Chou et al. // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — P. 531-537.
75. Полторак В.В. Блокада К-АТФ-каналів препаратами сульфонілсечовини та кардіоваскулярна безпека у хворих на цукровий діабет 2 типу [Текст] / В.В. Полторак, Н.І. Горбенко, М.Ю. Горшунська // Український медичний часопис. — 2002. — № 6(32). — С. 65-78.
76. Ferdinand P. Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury, preconditioning, and postconditioning [Text] / P. Ferdinand, R. Schulz, G.F. Baxter et al. // Pharmacol. Rev. — 2007. — Vol. 59. — P. 418-458.
77. Contribution of both sarcolemmal K-ATP and mitochondrial K-ATP channels to infarct size limitation by K-ATP channels openers: differences from preconditioning in the role of sarcolemmal K-ATP channels [Text] / M. Tann et al. // Naunyn-Schmiedeberg’s Arch. Pharmacol. — 2001. — Vol. 364. — P. 226-232.
78. All-cause mortality in diabetic patients treated with combination of sulfonylureas and biguanides [Text] / E. Mannucci, M. Monami, G. Masotti et al. // Diabetes Metab. Res. Rev. — 2004. — Vol. 20. — P. 44-47.
79. Kabadi U.M. Cost-effective management of hyperglycemia in patient with type 2 diabetes using oral agents [Text] / U.M. Kabadi // Managed Care. — 2004. — Vol. 6. — Р. 48-59.
80. Meredith P. Bioequivalence and other unresolved issues in generic drug substitution [Text] / P. Meredith // Clinical Therapeutic. — 2003. — Vol. 25, № 11. — P. 2875-2890.
81. Bioequivalence assessment of the two brands of glimeperide tablets [Text] / D. Jovanovic, D. Stojsic, M. Zlatkovic et al. // Vojnosanit Pregl. — 2006. — Vol. 63, № 12. — P. 1015-1020.
82. Attorrese G. Quality and behavior of glimeperide generics versus amaryl under stressed conditions [Text] / G. Attorrese, M. Massi-Benedetti // Diabetes technology & Therapeutics. — 2007. — Vol. 9, № 3. — P. 287-296.
83. Рудык Ю.С. Терапевтическая эквивалентность лекарственных средств и возможные источники ошибок [Текст] / Ю.С. Рудык // Здоров’я Украіни. — 2007. — № 12(1). — С. 71-73.
84. Brand and generic medications: are they interchangeable? [Text] / A.S. Al-Jazairi, S. Bihareth, I.S. Eqtefan et al. // Ann. Saudi Med. — 2008. — Vol. 28, № 1. — P. 33-41.
85. Полторак В.В. Критерии замены оригинальных лекарственных средств генериками [Текст] / В.В. Полторак, В.В. Липсон, Л.Е. Никишина // Проблеми ендокринної патології. — 2008. — № 3. — С. 83-96.