Журнал «Медицина неотложных состояний» 5 (36) 2011
Вернуться к номеру
Влияние комплекса нейропротекторов и антиоксидантов на состояние сознания при делириозном синдроме на фоне эндогенной интоксикации
Авторы: Лизогуб Н.В., Добростомат У.Н., Курсов С.В., Белашко С.А., Пащенко О.Н. Харьковский национальный медицинский университет Харьковская городская клиническая больница скорой и неотложной медицинской помощи
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
У 32 больных с делириозным синдромом, развившимся после операции на фоне острого панкреатита, прослежена динамика регрессии энцефалопатии под влиянием 2 схем лечения. Первая схема коррекции включала введение «больших» и «малых» транквилизаторов. При второй схеме лечения помимо транквилизаторов применялись магния сульфат, пиридоксин и натрия тиосульфат. Оценка функции сознания проведена при помощи шкалы тяжести продуктивных расстройств сознания. Применение магния сульфата, пиридоксина и натрия тиосульфата достоверно ускоряло восстановление ясного сознания.
Делириозный синдром, транквилизаторы, магния сульфат, пиридоксин, натрия тиосульфат.
Введение
Осложнение течения основного заболевания делирием всегда связано с увеличением летальности, повышением стоимости лечения и более длительным пребыванием пациентов в стационаре. У пациентов с делирием на 25– 30 % увеличивается продолжительность лечения в отделении интенсивной терапии и на 30–40 % — в госпитале [1]. Формированию делирия способствует тяжелый стресс (в том числе травма, операция), лихорадка, эндогенная интоксикация, прекращение приема этанола [2–4]. Достаточно часто делирий развивается у пациентов мужского пола на фоне острой хирургической патологии органов брюшной полости. Панкреатит, перитонит, кишечная непроходимость, при которых имеет место увеличение активности протеолитических ферментов в крови, ассоциированы с повышением проницаемости гематоэнцефалического барьера для токсических веществ. Одновременно увеличивается проницаемость гематоэнцефалического барьера для ионов натрия, которые в норме проходят через него плохо. Вслед за натрием в ткань мозга поступает вода. Нарушение метаболизма глюкозы в мозге, которое приводит к накоплению в клетках лактата и пирувата, увеличивает внутриклеточную осмолярность, и вода перемещается далее, в клетки. Таким образом, формируется отек-набухание головного мозга, при котором начинает страдать мозговой кровоток и в ЦНС активируются процессы свободнорадикального окисления. Биохимический механизм формирования делирия включает избыточное высвобождение из нейронов возбуждающих медиаторов (глутамата, аспартата, дофамина) и угнетение высвобождения гамма-аминомасляной кислоты. Когнитивные функции при этом процессе грубо нарушаются, возникает длительное, стойкое возбуждение, продуктивная симптоматика. Традиционно и повсеместно для купирования делириозного синдрома применяются «малые» и «большие» транквилизаторы, однако время восстановления ясного сознания у пациентов может быть весьма продолжительным. Первое введение нейролептиков порой обостряет делирий. Поэтому наряду с психотропными препаратами широко распространены методы лечения делирия, включающие введение витаминов, антигипоксантов, коррекцию водно-электролитного обмена и кислотно-основного состояния.
Мы выбрали для комплексной терапии делириозного синдрома применение сульфата магния, пиридоксина и натрия тиосульфата. Магния сульфат рассматривается как один из наиболее перспективных компонентов защиты мозга. Протективный эффект магнезии связывают со способностью блокировать NMDA-рецепторы возбуждающих аминокислот, благодаря чему ограничивается поступление ионов кальция внутрь нейронов и уменьшается интенсивность процессов перекисного окисления липидов клеточных мембран. Терапия магния сульфатом способствует снижению внутричерепного давления. Магнезию широко используют у больных с черепно-мозговой травмой, субарахноидальными кровоизлияниями, ишемическими инсультами, преэклампсией и эклампсией, гипоксическими поражениями ЦНС, церебральным параличом [9, 10]. Биодоступность магния увеличивается при его использовании в комплексе с пиридоксином [11]. Пиридоксин в организме превращается в пиридоксальфосфат, который участвует в синтезе нейромедиаторов: норадреналина, дофамина, глицина, ГАМК и серотонина. При этом он изменяет баланс указанных медиаторов в сторону преобладания тормозных медиаторов — ГАМК, глицина, а также серотонина. Таким образом, пиридоксин принимает участие в регуляции возбудимости ЦНС, а также активирует антиноцицептивную систему и усиливает действие анальгезирующих средств. По своей химической структуре он приближается к производным 3-оксипиридина, обладающим противогипоксическим и антиоксидантным эффектом [12, 13]. Тиосульфат натрия является детоксикационным и антиоксидантным средством, обладающим свойствами сильного восстановителя, улучшающим функции клеток за счет увеличения содержания в них восстановленного глутатиона. Обладает противовоспалительным действием. Тиосульфат натрия с успехом используется при лечении токсических гепатитов, осложнений химиотерапии, применяется в качестве противовоспалительного средства при острых заболеваниях органов брюшной полости и забрюшинного пространства, препятствует образованию кальцинатов [14, 15].
Цель исследования. Оценить эффект комбинированной терапии делириозного синдрома при острой хирургической абдоминальной патологии на основании динамики функции сознания пациентов под влиянием терапии только транквилизаторами и транквилизаторами с комплексом магнезии, пиридоксина и тиосульфата натрия.
Материалы и методы
Исследование проведено у 32 больных с острой хирургической патологией. Все пациенты — мужчины, зависимые от этанола. Делирий развился в раннем послеоперационном периоде на фоне синдрома повышенного катаболизма и эндогенной интоксикации. Почва для развития делирия — острый панкреатит и прекращение приема этанола. Для купирования делирия 12 больных (контрольная группа) получали 3 раза в сутки инъекции сибазона по 2–4 мл 0,5% раствора и аминазин по 2 мл 2,5% раствора 2–3 раза в сутки. Еще у 20 пациентов (основная группа) помимо транквилизаторов применялись внутривенные инфузии 20 мл 25% раствора магния сульфата в составе глюкозо-калиево-инсулиновой смеси. На ней же вводили пиридоксин по 4 мл 5% раствора 1 раз в сутки. Кроме этого, больным 2 раза в сутки внутривенно медленно вводился натрия тиосульфат в дозе 20 мл 30% раствора. Для оценки тяжести продуктивных расстройств сознания использована шкала, предложенная В.В. Зверевым и А.П. Черемским (2008).
Шкала учитывает:
1) характер дезориентированности: во времени, в пространстве, в собственной личности;
2) характер нарушений восприятия: иллюзии, галлюцинации зрительные, галлюцинации слуховые, галлюцинации тактильные;
3) характер психомоторного возбуждения: ажитация, умеренное, выраженное или хаотичное;
4) наличие оглушения: умеренного.
Наличие каждого признака оценивается в 1 балл. Только для характеристики характера психомоторного возбуждения введена оценка от 1 до 4 баллов. В зависимости от суммы баллов диагностируют: пределирий (1–2 балла), делирий средней тяжести (3–5 баллов), тяжелый делирий (6–8 баллов), очень тяжелый делирий (9–12 баллов) [16].
Результаты исследования и их обсуждение
В 1-е сутки появления симптомов делирия средняя оценка тяжести продуктивного расстройства сознания составила у больных контрольной группы 4,33 ± 1,30 балла, у пациентов основной группы — 4,40 ± 1,14 балла (р = 0,88). Несмотря на применение седативных психотропных средств, на 2-е сутки обнаружено усиление симптоматики делирия в обеих группах наблюдения. Балльная оценка больных контрольной группы возросла до 6,17 ± 0,09. У пациентов основной группы нарастание симптоматики оказалось не таким выраженным. Оценка составила 5,45 ± 1,15 балла. Однако достоверной разницы обнаружено не было (р = 0,086). Динамика расстройств сознания отражена на рис. 1.
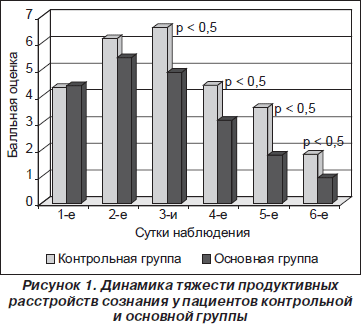
Существенная разница в состоянии больных появилась на 3-и сутки лечения делирия. Если у пациентов контрольной группы тяжесть продуктивной симптоматики продолжала нарастать и балльная оценка составила 6,58 ± 1,38, то у больных основной группы оценка снизилась до 4,90 ± 0,91 балла. При сравнении показателей р = 0,00024. Достоверные отличия в дальнейшем сохранялись до конца исследования. То есть пациенты основной группы имели достоверно меньшую тяжесть продуктивной симптоматики. На 6-е сутки лечения делирия полное отсутствие симптомов энцефалопатии обнаружено только у 2 больных контрольной группы — 16,67 %. В противовес этому, среди больных основной группы ясное сознание имелось у 8 пациентов — 40 %. Таким образом, выявлены существенные преимущества схемы лечения делириозного синдрома, включающей комплекс магнезии, пиридоксина и тиосульфата натрия.
Учитывая, что развитию делирия всегда сопутствует гиперактивация симпатоадреналовой системы, мы решили проследить за динамикой наиболее частого проявления нарушенных вегетативных функций при указанном синдроме — тахикардии [17]. Частоту сокращений сердца (ЧСС) у всех пациентов регистрировали в одно и то же время. При этом больным не назначались атропин и бета-адреноблокаторы. Динамика изменений ЧСС в процессе лечения отражена на рис. 2.
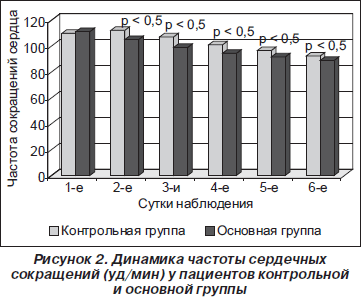
Тахикардия имела место у всех пациентов без исключения. В начале развития делирия отмечено повышение ЧСС у больных контрольной группы до 109,92 ± ± 7,34 уд/мин. У пациентов основной группы ЧСС составила 112,20 ± 6,34 уд/мин. При сравнении этих показателей достоверных различий не выявлено (р = 0,605). Но уже на 2-е сутки отличия стали достоверными. У больных контрольной группы тахикардия продолжала нарастать, ЧСС у них составила 112,17 ± 4,76 уд/мин, тогда как в основной группе тахикардия регрессировала. Показатель ЧСС колебался в пределах 105,05 ± 6,60 уд/мин, р = 0,0028. На 3-и сутки различия стали еще более выраженными. ЧСС в контрольной группе равнялась 107,08 ± 5,38 уд/мин, а в основной — 98,95 ± 5,37 уд/мин (р = 0,0003). Наличие достоверной статистической разницы в дальнейшем сохранилось до конца исследования. Следовательно, терапия комплексом препаратов, включающих магнезию, пиридоксин и тиосульфат натрия, в условиях острой хирургической патологии с эндогенной интоксикацией способствовала более скорой нормализации функций вегетативной нервной системы.
Вывод
Применение комплекса нейропротекторов и антиоксидантов, включающего магния сульфат, пиридоксин и тиосульфат натрия, при терапии делириозного синдрома, возникшего на фоне эндогенной интоксикации, способствует ускорению восстановления ясного сознания и нормализации функций вегетативной нервной системы.
1. Intensive care unit delirium is an independent predictor of longer hospital stay: a prospective analysis of 261 non-ventilated patients / J.W.W. Thomason, A. Shintani, J.F. Peterson et al. // Critical Care. — 2005. — № 9. — P. 375-381.
2. Is peri-operative cortisol secretion related to post-operative cognitive dysfunction? / L.S. Rasmussen, J.T. O’Brien, J.H. Silverstein et al. // Acta Anaesthesiologica Scandinavica. — 2005. — Vol. 49, № 9. — Р. 1225-1231.
3. Treatment of feverin neurosurgical patients / M. Cormio, G. Citerio, G. Portella et al. // Minerva Anestesiologica. — 2003. — Vol. 69, № 4. — P. 214-222.
4. Сытинский И.А. Биохимические основы действия этанола на центральную нервную систему. — М.: Медицина, 1980. — 192 с.
5. Marotta F. Failure of blood-brain barrier competence in the course of experimental acute pancreatitis / F. Marotta, D.H. Chui, Y. M.Liu, G. Barbi // European Journal of Clinical Investigation. — 1997. — Vol. 27, Suppl. 1. — Р. 9.
6. Yim A. Delirium Tremens in Emergency Medicine Treatment & Management [электронный ресурс] / A. Yim, B.E. Brenner // Medscape Reference. Drugs, Conditions & Procedures. — Режим доступа: http://emedicine.medscape.com/article/791802-treatment.
7. Spies C.S. Alcohol Withdrawal in the Surgical Patient: Prevention and Treatment / C.S. Spies, H. Rommelspacher // Anesthesia & Analgesia. — 1999. — Vol. 88, № 4. — Р. 946-954.
8. Heymann A. Alcohol Withdrawal in the Surgical Patient: Prevention and Treatment / A. Heymann A.I. Nachtigall, A. Goldmann, C. Spies // Surgical Intensive Care Medicine. — 2010. — Issue 11. — P. 659-666.
9. Sen A.P. Use of Magnesium in Traumatic Brain Injury/ A.P. Sen, A. Gulati // Neurotherapeutics. — 2010. — Vol. 7, № 1. — Р. 91-99.
10. Bendure V. Magnesium Sulfate May Offer Protection From Cerebral Palsy // Health. — 2011, Feb 11.
11. Торшин И.Ю. Механизмы антистрессорного и антидепрессивного действия магния и пиридоксина / И.Ю. Торшин, О.А. Громова, Е.И. Гусев // Журнал неврологии и психиатрии. — 2009. — № 11. — С. 107-110.
12. Коваль И.В. Современные подходы к фармакологической коррекции гипоксических состояний / И.В. Коваль, Н.В. Вдовенко, В.А. Козловский, В.П. Кутняк // Спортивная медицина. — 2008. — № 1. — С. 36-41.
13. Карнаух А.И. Применение антиоксидантов в комплексной терапии травматических внутричерепных кровоизлияний // Поленовские чтения. — Санкт-Петербург, 2005. — C. 51.
14. Cardioprotective Role of Sodium Thiosulfate on Chronic Heart Failure by Modulating Endogenous H2S Generation / U. Sen, T.P. Vacek, W.M. Hughes et al. // Pharmacology. — 2008. — Vol. 82. — P. 201-213.
15. Канаян А.С. Влияние тиосульфата натрия на жизнеспособные отделы поджелудочной железы при экспериментальном панкреатите / А.С. Канаян, Н.А. Габриелян, Г.А. Геворкян // Бюллетень экспериментальной биологии и медицины. — 1983. — № 10. — С. 68-70.
16. Звєрєв В.В. Клінічна оцінка тяжкості продуктивних розладів свідомості на прикладі алкогольного делірійного синдрому / В.В. Звєрєв, А.П. Черемський // Біль, знеболювання і інтенсивна терапія. — 2008. — № 2(Д). — С. 123-124.
17. Циммерман М., Ениг В., Вутке В. и др. Физиология человека: В 3 т. / Под ред. Р. Шмидта, Г. Тевса; Пер. с англ. Н.Н. Алипова. — М.: Мир, 1996. — Т. 2. — C. 343-383.
