Журнал «Медицина неотложных состояний» 5 (36) 2011
Вернуться к номеру
Респираторный дистресс-синдром у новорожденных
I. Особенности патогенеза
Респираторный дистресс-синдром (РДС) является наиболее встречающимся патологическим состоянием у новорожденных в раннем неонатальном периоде. Встречаемость его тем выше, чем меньше гестационный возраст и чем чаще возникают патологические состояния, связанные с патологией систем дыхания, кровообращения и ЦНС. Заболевание полиэтиологично.
В основе патогенеза респираторного дистресс-синдрома новорожденных (РДСН) лежит дефицит или незрелость сурфактанта, что приводит к диффузному ателектазированию. Это, в свою очередь, способствует снижению легочного комплайенса, увеличению работы дыхания, усилению легочной гипертензии, вследствие чего возникает гипоксия, усиливающая легочную гипертензию, в результате снижается синтез сурфактанта, т.е. возникает порочный круг.
Дефицит и незрелость сурфактанта имеются у плода в гестационном сроке менее 35 недель. Хроническая внутриутробная гипоксия усиливает и удлиняет этот процесс. У недоношенных детей (особенно глубоко недоношенных) имеет место первый вариант течения РДСН. Даже если процесс родов прошел без отклонений, у них может развиться развернутая клиника РДС в последующем, потому что их пневмоциты II типа синтезируют незрелый сурфактант и очень чувствительны к любой гипоксии.
Другой, гораздо чаще встречающийся вариант РДС, характерный для новорожденных, отличается снижением возможности пневмоцитов лавинообразно синтезировать сурфактант сразу после рождения. Этиотропными здесь являются факторы, нарушающие физиологическое течение родов. При нормальных родах через естественные родовые пути возникает дозированная стимуляция симпатоадреналовой системы. Расправление легких при эффективном первом вдохе способствует снижению давления в малом круге кровообращения, улучшению перфузии пневмоцитов и усилению их синтетических функций. Любое отклонение от нормального течения родов, даже плановое оперативное родоразрешение, может вызвать процесс недостаточного синтеза сурфактанта с последующим развитием РДС.
Наиболее частой причиной развития этого варианта РДС является острая асфиксия новорожденных. РДС сопутствует этой патологии, вероятно, во всех случаях. РДС также возникает при аспирационных синдромах, тяжелой родовой травме, диафрагмальной грыже, часто при родоразрешении путем кесарева сечения.
Третьим вариантом развития РДС, характерного для новорожденных, является сочетание предшествующих видов РДС, которое встречается довольно часто у недоношенных.
Об остром респираторном дистресс-синдроме (АRDS) можно думать в тех случаях, когда ребенок перенес процесс родов без отклонений, а в последующем у него развернулась картина какого-либо заболевания, которое способствовало развитию гипоксии любого генеза, централизации кровообращения, эндотоксикоза.
Следует учитывать еще, что период острой адаптации у новорожденных, родившихся недоношенными или больными, увеличивается. Считают, что период максимального риска проявлений нарушений дыхания у таких детей, родившихся от здоровых матерей, составляет 24 часа, а у родившихся от больных он длится в среднем до конца 2-х суток. При сохраняющейся высокой легочной гипертензии у новорожденных долго сохраняются фатальные шунты, способствующие развитию острой сердечной недостаточности и легочной гипертензии, которые являются важным компонентом в формировании РДС у новорожденных.
Таким образом, при первом варианте развития РДСН пусковым моментом является дефицит и незрелость сурфактанта, при втором — сохраняющаяся высокая легочная гипертензия и обусловленный ею нереализованный процесс синтеза сурфактанта. При третьем варианте (смешанном) эти два момента сочетаются. Вариант формирования ARDS обусловлен развитием «шокового» легкого.
Все эти варианты РДС отягощаются в раннем неонатальном периоде ограниченными возможностями гемодинамики новорожденного.
Это способствует существованию такого термина, как «кардиореспираторный дистресс-синдром» (КРДС).
Для более эффективной и рациональной терапии критических состояний у новорожденных следует разграничивать варианты формирования РДС.
В настоящее время основным методом интенсивной терапии РДСН является респираторная поддержка. Чаще всего при этой патологии приходится начинать с «жестких» параметров искусственной вентиляции легких (ИВЛ), при которых, помимо опасности баротравмы, еще существенно угнетается и гемодинамика. Чтобы избежать «жестких» параметров ИВЛ с высоким средним давлением в дыхательных путях, следует начинать ИВЛ превентивно, не дожидаясь развития интерстициального отека легких и тяжелой гипоксии, т.е. тех состояний, когда развивается ARDS.
В случае предполагаемого развития РДС сразу после рождения следует или смоделировать эффективный «первый вдох», или пролонгировать эффективное дыхание (у недоношенных детей) с проведением заместительной терапии сурфактантом. В этих случаях ИВЛ не будет столь «жесткой» и длительной. У ряда детей появится возможность после кратковременной ИВЛ проводить СДППДВ через биназальные канюли до того времени, пока пневмоциты не смогут нарабатывать достаточное количество зрелого сурфактанта.
Превентивное начало ИВЛ с ликвидацией гипоксии без использования «жесткой» ИВЛ позволит более эффективно применять препараты, снижающие давление в малом круге кровообращения.
При таком варианте начала ИВЛ создаются условия для более раннего закрытия фетальных шунтов, что будет способствовать улучшению центральной и внутрилегочной гемодинамики.
II. Диагностика
А. Клинические признаки:
1. Симптомы дыхательной недостаточности, тахипноэ, вздутие грудной клетки, раздувание крыльев носа, затруднения при выдохе и цианоз.
2. Другие симптомы, например гипотензия, олигурия, мышечная гипотония, нестабильность температуры, парез кишечника, периферические отеки.
3. Недоношенность при оценке гестационного возраста.
В течение первых часов жизни ребенку каждый час проводится клиническая оценка по модифицированной шкале Downes, на основании которой делается вывод о наличии и динамике течения РДС и необходимом объеме респираторной помощи (табл. 1).
Б. Рентгенограмма грудной клетки. Характерные узловые или круглые затемнения и воздушная бронхограмма свидетельствуют о диффузных ателектазах.
В. Лабораторные признаки:
1. Соотношение лецитин/сфингомиелин (Л/С) в амниотической жидкости менее 2,0 и отрицательные результаты пробы со встряхиванием при исследовании амниотической жидкости и желудочного аспирата. У новорожденных от матерей с сахарным диабетом РДС может развиться при Л/С более 2,0.
2. Отсутствие фосфатилдиглицерола в амниотической жидкости.
Кроме того, при появлении первых признаков РДС следует исследовать Hb/Ht, содержание глюкозы и лейкоцитов, по возможности — кислотно-основное состояние (КОС) и газы крови.
III. Течение заболевания
А. Дыхательная недостаточность, нарастающая в течение 24–48 часов, а затем стабилизирующаяся.
Б. Разрешению часто предшествует увеличение темпа диуреза между 60-м и 90-м часом жизни.
IV. Профилактика
При преждевременных родах в сроке 28–34 недели следует предпринять попытку торможения родовой деятельности путем применения бета-миметиков, спазмолитиков либо сернокислой магнезии, после чего провести терапию глюкокортикоидами по одной из следующих схем:
— бетаметазон по 12 мг в/м через 12 часов дважды;
— дексаметазон по 5 мг в/м каждые 12 часов, 4 введения;
— гидрокортизон по 500 мг в/м каждые 6 часов, 4 введения. Эффект наступает через 24 часа и длится в течение 7 дней.
При пролонгированной беременности следует еженедельно вводить бета- или дексаметазон по 12 мг внутримышечно. Противопоказанием для применения глюкокортикоидов является наличие у беременной вирусной или бактериальной инфекции, а также язвенной болезни.
При использовании глюкокортикоидов следует проводить мониторинг сахара крови.
При предполагаемом родоразрешении путем кесарева сечения при наличии условий родоразрешение следует начинать с амниотомии, проводимой за 5–6 часов до операции, с целью стимуляции симпатоадреналовой системы плода, которая стимулирует его сурфактантную систему. При критическом состоянии матери и плода амниотомия не проводится!
Профилактике способствует бережное извлечение головки плода при кесаревом сечении, а у глубоко недоношенных детей — извлечение головки плода в плодном пузыре.
V. Лечение
Цель терапии РДС — поддержать новорожденного, пока не наступит разрешение заболевания. Потребление кислорода и продукцию углекислоты можно уменьшить, поддерживая оптимальный температурный режим. Поскольку функция почек в этот период может быть нарушена, а перспирационные потери увеличиваются, очень важно тщательно поддерживать водно-электролитный баланс.
А. Поддержание проходимости дыхательных путей:
1. Положите новорожденного, слегка разогнув голову. Поворачивайте ребенка. Это улучшает дренаж трахеобронхиального дерева.
2. Отсасывание из трахеи требуется для санации трахеобронхиального дерева от густой мокроты, появляющейся в экссудативную фазу, которая начинается приблизительно с 48 часов жизни.
Б. Кислородотерапия:
1. Согретая, увлажненная и обогащенная кислородом смесь подается новорожденному в палатку или через эндотрахеальную трубку.
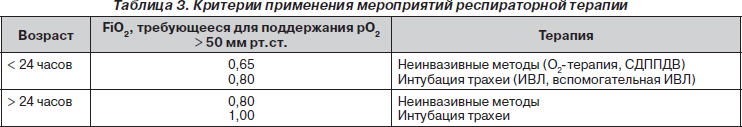
2. Следует поддерживать оксигенацию между 50 и 80 мм рт.ст., а сатурацию — в промежутке 85–95 %.
В. Сосудистый доступ: венозный пупочный катетер, конец которого находится выше диафрагмы, может быть полезен для обеспечения венозного доступа и измерения центрального венозного давления.
Г. Коррекция гиповолемии и анемии:
1. Контролируйте центральный гематокрит и артериальное давление начиная с момента рождения ребенка.
2. В течение острой фазы поддерживайте гематокрит в пределах 45–50 % с помощью трансфузий. В фазе разрешения достаточно поддерживать гематокрит больше 35 %.
Д. Ацидоз:
1. Метаболический ацидоз (ВЕ < –6 мЭкв/л) требует выявления возможной причины.
2. Дефицит оснований менее –8 мЭкв/л обычно требует коррекции для поддержания рН более 7,25.
3. Если рН падает ниже 7,25 за счет дыхательного ацидоза, то показана искусственная или вспомогательная вентиляция легких.
Е. Вскармливание:
1. Если гемодинамика новорожденного стабильна и вам удается купировать дыхательную недостаточность, то кормление следует начать на 48–72-м часу жизни.
2. Избегайте кормления из соски, если одышка превышает 70 дыхательных движений в минуту, так как высок риск аспирации.
3. Если нет возможности начать энтеральное кормление, подумайте о парентеральном питании.
4. Прием витамина А парентерально по 2000 Ед через день, пока не начато энтеральное кормление, снижает частоту хронических заболеваний легких.
Ж. Рентгенологическое исследование грудной клетки:
1. Для постановки диагноза и оценки течения заболевания.
2. Для подтверждения места стояния эндотрахеальной трубки, плеврального дренажа и пупочного катетера.
3. Для диагностики таких осложнений, как пневмоторакс, пневмоперикардиум и некротический энтероколит.
З. Возбуждение:
1. Отклонения РаО2 и РаСО2 могут вызывать возбуждение и вызываться им. Следует обращаться с такими детьми очень аккуратно и прикасаться к ним только по показаниям.
2. Если новорожденный не синхронен с респиратором, для синхронизации с аппаратом и профилактики осложнений может потребоваться седация или миорелаксация.
И. Инфекция:
1. У большинства новорожденных с дыхательной недостаточностью следует исключать сепсис и пневмонию, поэтому целесообразно назначать эмпирическую антибактериальную терапию бактерицидными антибиотиками широкого спектра действия до получения результатов посевов.
2. Инфекция, вызванная гемолитическим стрептококком группы В, может клинически и рентгенологически напоминать РДС.
К. Терапия острой дыхательной недостаточности:
1. Решение о применении методик дыхательной поддержки должно обосновываться в истории болезни.
2. У новорожденных с массой тела менее 1500 г применение методик СРАР может привести к неоправданным затратам энергии.
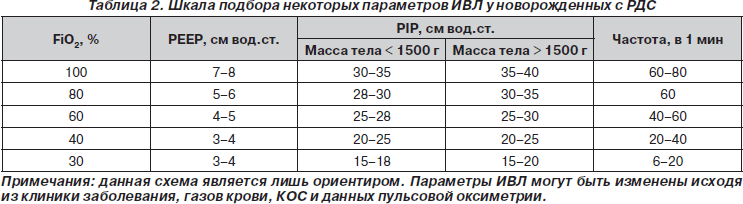
3. Надо изначально пытаться настроить параметры вентиляции так, чтобы снизить FiO2 до 0,6–0,8. Обычно для этого требуется поддерживать среднее давление в пределах 12–14 см вод.ст:
а) когда РаО2 превысит 100 мм рт.ст. или не будет признаков гипоксии, следует постепенно снижать FiO2 не более чем на 5 % до 60–65 %;
б) эффект от снижения параметров вентиляции оценивается через 15–20 минут по анализу газов крови или пульсоксиметром;
в) при низких концентрациях кислорода (менее 40 %) оказывается достаточным снижение FiO2 на 2–3 %.
4. Далее снижается давление на вдохе, что позволяет предупредить баротравму:
а) если FiO2 более 0,6, снижайте FiO2;
б) если FiO2 в пределах 0,4–0,6, снижайте тот параметр, который вам кажется наиболее опасным для пациента;
в) если FiO2 удается снизить до 0,4, следует предпринять попытки снижения частоты и параметров давления;
г) экстубацию обычно производят, когда FiO2 находится в пределах 0,3–0,4.
5. В острую фазу РДС может наблюдаться задержка углекислого газа:
а) поддерживайте уровень рСО2 меньше 60 мм рт.ст., изменяя частоту вентиляции или пиковое давление;
б) если ваши попытки купировать гиперкапнию приводят к нарушению оксигенации, проконсультируйтесь с более опытными коллегами.
Л. Причины ухудшения состояния больного:
1. Разрыв альвеол и развитие интерстициальной эмфиземы легких, пневмоторакса или пневмоперикардиума.
2. Нарушение герметичности дыхательного контура:
а) проверьте места подсоединения аппаратуры к источнику кислорода и сжатого воздуха;
б) исключите обструкцию эндотрахеальной трубки, экстубацию или продвижение трубки в правый главный бронх;
в) если выявлена обструкция эндотрахеальной трубки или самоэкстубация, уберите старую эндотрахеальную трубку и раздышите ребенка мешком и маской. Переинтубацию лучше производить после стабилизации состояния больного.
3. При очень тяжелом РДС может происходить шунтирование крови справа налево через артериальный проток.
4. Когда функция внешнего дыхания улучшается, сопротивление сосудов малого круга может резко снижаться, обусловливая шунтирование через артериальный проток слева направо.
5. Гораздо реже ухудшение состояния новорожденных обусловлено внутричерепным кровоизлиянием, септическим шоком, гипогликемией, ядерной желтухой, транзиторной гипераммониемией или врожденными дефектами метаболизма.
М. Терапия сурфактантом:
1. В настоящее время проходят испытания человеческий, синтетический и сурфактант животных. В России для клинического применения разрешен сурфактант экзосурф неонатал фирмы Glaxo Wellcome.
2. Назначается профилактически в родовом зале или позже, в сроки от 2 до 24 часов. Профилактическое применение сурфактанта показано: недоношенным новорожденным с массой тела при рождении менее 1350 г и с высоким риском развития РДС; новорожденным с массой тела более 1350 г и с подтвержденной объективными методами незрелостью легких. С лечебной целью сурфактант применяется новорожденным с клинически и рентгенологически подтвержденным диагнозом РДС, находящимся на ИВЛ через эндотрахеальную трубку.
3. Вводится в дыхательные пути в виде суспензии на физрастворе. С профилактической целью экзосурф вводится от 1 до 3 раз, с лечебной — 2 раза. Однократная доза экзосурфа во всех случаях составляет 5 мл/кг и вводится болюсно двумя полудозами за период времени от 5 до 30 минут в зависимости от реакции ребенка. Безопаснее вводить раствор микроструйно со скоростью 15–16 мл/ч. Повторная доза экзосурфа вводится через 12 часов после введения первоначальной.
4. Уменьшает тяжесть РДС, но потребность в ИВЛ сохраняется и частота хронических заболеваний легких не уменьшается.
VI. Тактические мероприятия
Возглавляет бригаду специалистов по лечению РДС неонатолог, подготовленный по реанимации и интенсивной терапии, или квалифицированный реаниматолог.
Из лечебного учреждения с уровнем реанимационной неонатологической помощи 1–3 обязательно обращение в реанимационно-консультативный центр для новорожденных и необходима очная консультация в 1-е сутки. Госпитализация в специализированный центр по реанимации и интенсивной терапии новорожденных после стабилизации состояния больного через 24–48 часов силами реанимационно-консультативной бригады для новорожденных.