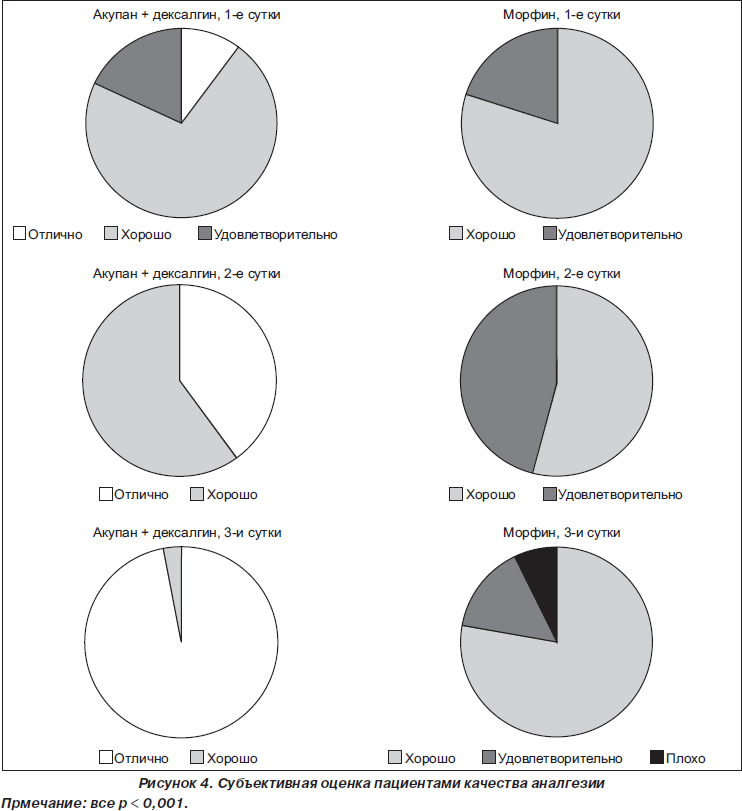Журнал «Медицина неотложных состояний» 6 (37) 2011
Вернуться к номеру
Применение мультимодальной аналгезии с использованием Акупана, дексалгина и налбуфина в периоперационном периоде
Авторы: Черний В.И., Ермилов Г.И., Колганова Е.А., Егоров А.А. Донецкий национальный медицинский университет им. М. Горького Донецкое областное клиническое территориальное медицинское объединение
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
В статье исследуется эффективность применения Акупана, дексалгина и налбуфина в составе полимодальной аналгезии в периоперационном периоде. Доказано, что совместное применение Акупана и дексалгина у онкохирургических больных позволяет достичь более качественного обезболивания в послеоперационном периоде по сравнению с традиционной аналгезией опиатами при лучшей переносимости. Показано, что аналгезия Акупаном после эпидуральной анестезии бупивакаином или ропивакаином, а также аналгезия Акупаном и налбуфином после общей анестезии не менее эффективны, чем аналгезия морфином после урологических операций средней травматичности.
Акупан, дексалгин, налбуфин, полимодальная аналгезия, морфин, послеоперационное обезболивание.
Актуальность
В настоящее время проблема лечения острой послеоперационной боли не утрачивает своей актуальности. Несмотря на уровень достижений современной медицины и многообразие аналгетических препаратов, далеко не все пациенты палат интенсивной терапии адекватно обезболены после плановых онкологических операций [6]. Это приводит как к значительному ухудшению ближайших результатов хирургического лечения, так и к неблагоприятным отдаленным последствиям [7]. Исследования, проведенные в области изучения механизмов боли, позволили лучше понять природу возникновения острой и хронической боли [11]. Установлено, что в раннем послеоперационном периоде травма, воспаление тканей и связанная с этим генерация ноцицептивных импульсов приводят к сенситизации путей проведения на центральном и периферическом уровнях. Вследствие этого происходит увеличение возбудимости спинальных нейронов и облегчение процессов проведения болевых импульсов по ноцицептивным трактам, что приводит к формированию гипералгезии — аномально высокой чувствительности к болевым раздражителям [2]. Недостаточная аналгезия у данного контингента больных, по данным литературы, в 11–65 % случаев приводит к развитию хронического болевого синдрома, значительному ограничению трудоспособности, инвалидности и снижению качества жизни [10]. В раннем послеоперационном периоде несвоевременная либо неполная аналгезия неизбежно приводит к активации симпатоадреналовой системы. Результатом этого является гипоперфузия органов спланхнической зоны, сердца и головного мозга, респираторные расстройства, гемостатические и метаболические нарушения, иммуносупрессия и развитие локальных и системных инфекционных осложнений [8]. В современной анестезиологии методы лечения болевого синдрома, связанного с оперативным вмешательством, развиваются параллельно с усовершенствованием разнообразных техник и разработкой новых терапевтических подходов к лечению боли. Фармакологические методы включают выбор одного или нескольких препаратов, пути их введения, дозировки и частоты применения [1, 4]. Классическая схема мультимодальной аналгезии предусматривает три основных компонента — опиоидные аналгетики, неопиоидные аналгетики (нестероидные противовоспалительные средства (НПВС) + парацетамол) и методы регионарной аналгезии [9]. Однако применение опиатов сопрождается достаточно высокой частотой серьезных побочных эффектов, а применение НПВС — сомнительностью полноценного аналгетического эффекта, особенно в онкохирургии [5].
В связи с этим представляет интерес разработка новых схем послеоперационной аналгезии с использованием ненаркотического аналгетика центрального действия Акупана (нефопам) в сочетании с НПВС дексалгином (декскетопрофен) и агонист-антагонистами опиоидных рецепторов (налбуфин).
Акупан (нефопам) — ненаркотический аналгетик, структурно не похожий на другие аналгетики. Препарат является представителем нового класса препаратов центрального миорелаксантного действия. Акупан (нефопам) — ингибитор обратного захвата серотонина, норадреналина и дофамина в синапсах центральной нервной системы. Обладает слабыми антихолинергическими, антигистаминными и симпатомиметическими свойствами. К уникальным свойствам препарата следует отнести его способность купировать боль без угнетения дыхания и отсутствие эффекта привыкания к препарату при длительном использовании.
Цель исследования. Изучить эффективность мультимодальной аналгезии — сочетанного применения препарата Акупан (А) (нефопам) с регионарными методами обезболивания (эпидуральная анестезия — ЭА), НПВС (дексалгином — Д) и агонист-антагонистами опиоидных рецепторов (налбуфин — Н) — по сравнению с аналгезией опиоидами (морфин — М).
Материалы и методы
Исследование проводилось на двух клинических базах: в Донецком областном клиническом территориальном медицинском объединении (ДОКТМО) и Донецком областном противоопухолевом центре (ДОПЦ).
В клиническое исследование вошли 220 пациентов в возрасте от 18 до 74 лет I–III функционального класса по ASA со злокачественными новообразованиями желудка, толстого кишечника, женских внутренних половых органов, по поводу которых выполнялись оперативные вмешательства в объеме гастрэктомии, резекций желудка и кишечника, экстирпации матки с придатками в ДОПЦ. А также пациенты с различной урологической патологией, которым проводилось оперативное лечение в отделении урологии ДОКТМО (трансуретральная резекция простаты и мочевого пузыря, открытая аденомэктомия, нефролитотомия, коррекция аномалий развития мочевыделительной системы).
Больные были разделены на группы, сопоставимые по полу, возрасту, сопутствующей соматической патологии.
Методы проведения общей анестезии и послеоперационного обезболивания в онкологии
1-я группа (Монк), 50 пациентов
Сбалансированная общая внутривенная анестезия. На операционном столе, непосредственно перед началом оперативного вмешательства, производится премедикация. Объем премедикации — М-холинолитик (атропин 0,01 мг/кг внутривенно) и транквилизатор (сибазон 0,2 мг/кг внутривенно), блокатор NMDA-рецепторов (кетамин 0,5 мг/кг), наркотический аналгетик (морфин 0,15 мг/кг).
Индукция анестезии осуществляется введением 40 мг 1% раствора пропофола каждые 10 с до наступления клинической стадии наркоза (1,5–2,5 мг/кг) или тиопенталом натрия (3–5 мг/кг).
Миорелаксация обеспечивается ардуаном 0,06–0,08 мг/кг.
После интубации трахеи больные переводятся на искусственную вентиляцию легких (ИВЛ). Минутный объем дыхания (МОД) определялся по формуле Т.М. Дарбиняна:
МОД (л/мин) = масса тела (кг)/10 + 1,
дыхательный объем (ДО) — 7–8 мл/кг.
Для поддержания анестезии дипрофол вводится внутривенно капельно либо инфузоматом из расчета 1,5–2,5 мг/кг/час, кетамин — внутривенно болюсно 0,5–1,5 мг/кг/час, ардуан — 0,01–0,03 мкг/кг/час.
Аналгезия обеспечивается внутривенным фракционным введением фентанила. Индукционная доза составляет 5 мкг/кг, в течение операции доза фентанила определяется из расчета 3–4,5 мкг/кг/час. Введение фентанила прекращается за 30 минут до окончания оперативного вмешательства. Потенцирование аналгезии возможно закисью азота в соотношении 2 : 1.
После перевода пациента в палату из операционной назначались наркотические аналгетики (морфин 30–40 мг/сут в/м, каждые 6 часов по 10 мг). Послеоперационная аналгезия продолжалась в течение 3 суток.
2-я группа (А + Д), 50 пациентов
Сбалансированная общая внутривенная анестезия. На операционном столе, непосредственно перед началом оперативного вмешательства, производится премедикация. Объем премедикации — М-холинолитик (атропин 0,01 мг/кг внутривенно), транквилизатор (сибазон 0,2 мг/кг внутривенно), блокатор NMDA-рецепторов (кетамин 0,5 мг/кг), наркотический аналгетик (морфин 0,15 мг/кг).
Индукция анестезии: 40 мг 1% раствора пропофола каждые 10 с до наступления клинической стадии наркоза (1,5–2,5 мг/кг) или тиопенталом натрия (3–5 мг/кг).
Миорелаксация обеспечивается ардуаном 0,06–0,08 мг/кг.
После интубации трахеи больные переводятся на искусственную вентиляцию легких. Минутный объем дыхания определялся по формуле Т.М. Дарбиняна:
МОД (л/мин) = масса тела (кг)/10 + 1,
дыхательный объем (ДО) — 7–8 мл/кг.
Для поддержания анестезии дипрофол вводится внутривенно капельно либо инфузоматом из расчета 1,5–2,5 мг/кг/час, кетамин — внутривенно болюсно 0,5–1,5 мг/кг/час, ардуан — 0,01–0,03 мкг/кг/час.
Аналгезия обеспечивается внутривенным фракционным введением фентанила. Индукционная доза составляет 5 мкг/кг, в течение операции доза фентанила определяется из расчета 3–4,5 мкг/кг/час. Введение фентанила прекращается за 30 минут до окончания оперативного вмешательства. Потенцирование аналгезии возможно закисью азота в соотношении 2 : 1. За 30–40 минут до окончания операции внутримышечно вводили дексалгин 50 мг и Акупан 20 мг.
После перевода пациента в палату из операционной назначались ненаркотические аналгетики (дексалгин до 150 мг/сут в/м, через 8 часов по 50 мг, и Акупан до 120 мг/сут, каждые 3–4 часа по 20 мг в/м). Послеоперационная аналгезия продолжалась в течение 3 суток.
Методы проведения общей анестезии и послеоперационного обезболивания в урологии
Методика проведения общей анестезии
Премедикация (в/в): дексаметазон 4–8 мг, атропин 0,5–1 мг (с учетом частоты сердечных сокращений).Индукция (в/в): сибазон 0,5 мг/кг или мидазолам 0,2–0,4 мг/кг; 0,5–1% раствор тиопентала натрия 2–5 мг/кг; ардуан 4 мг (прекураризация); дитилин 2 мг/кг; фентанил 1–1,4 мкг/кг; интубация трахеи, ИВЛ. Поддержание анестезии: ИВЛ кислородно-воздушной смесью; пропофол 1–2 мг/кг/ч; фентанил 2–3 мкг/кг на начало операции и далее по 0,07 мкг/кг/мин; ардуан 0,02–0,03 мг/кг.
Методика проведения эпидуральной анестезии
Премедикация — Акупан в/м за 30 мин до операции; дексаметазон 4–8 мг, атропин 0,5–1 мг в/в. Пункция эпидурального пространства на уровне L2-L3, 0,5% р-р маркаина (бупивакаина) 15–20 мл или 1% р-р наропина (ропивакаина) 12–15 мл (в зависимости от роста и возраста пациентов). Интраоперационная седация: пропофол 1–2 мг/кг/ч.
Распределение пациентов по группам было следующим.
3-я группа (А + Н), 30 пациентов
Общая анестезия, для полимодальной аналгезии использовались фентанил (во время операции), Акупан (20 мг в/м за 20–30 мин до операции, в послеоперационном периоде по 20 мг в/м 3 раза в сутки) и налбуфин (10–20 мг в/м 2–3 раза в сутки по требованию больного).
4-я группа (А + ЭА), 30 пациентов
Для полимодального обезболивания использовались эпидуральная анестезия и Акупан (20 мг в/м за 20–30 мин до операции, в послеоперационном периоде по 20 мг в/м 3 раза в сутки).
5-я группа (Мур), 30 пациентов
Оперативное лечение проводилось с использованием общей анестезии. Послеоперационное обезболивание осуществлялось в/м введением 10 мг морфина 4–6 раз в сутки (по требованию больного).
6-я группа (М + ЭА), 30 пациентов
Эпидуральная анестезия, послеоперационная аналгезия морфином (10 мг морфина в/м 2–3 раза в сутки по требованию больного).
Для клинической оценки интенсивности послеоперационной боли использовали визуально-аналоговою шкалу (ВАШ). ВАШ — это наиболее простая субъективная методика оценки боли. Оценка проводится в баллах или в процентах, при этом 0 баллов или 0 мм обозначает полное отсутствие болевых ощущений, а 10 баллов или 100 мм — очень сильную боль на грани терпимости. Пациенту предлагается сделать на линейке отметку, которая отвечает интенсивности болевых ощущений у него на данный момент. Расстояние между концами линейки «нет боли» и «максимально возможная боль» измеряется в миллиметрах.
Проводилась регистрация частоты развития побочных эффектов послеоперационного обезболивания (гипотония, седация, галлюцинации, общая центральная депрессия, тошнота или рвота, запор, задержка мочи, кожный зуд, аллергические реакции) и исследовалась общая оценка пациентами предлагаемого метода обезболивания: «плохо», «удовлетворительно», «хорошо», «отлично».
Статистическая обработка данных проводилась следующим образом. Соответствие нормальному закону распределения данных проверялось при помощи критерия Шапиро — Уилка. Для сравнения центральных тенденций исследуемых групп применялись критерии Вилкоксона и Стьюдента. Для сравнения распределения частот признака использовался критерий хи-квадрат, при сравнении долей — критерий Фишера с поправкой Йейтса. Расчеты проводились при помощи лицензионного пакета статпрограмм MedStat [3].
Результаты исследования
Онкология
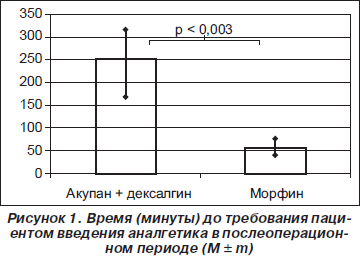
Время до первого введения аналгетиков в послеоперационном периоде составило в исследуемой группе 250 ± 35 минут, а в контрольной — 54 ± 8 минут (р = 0,003) (рис. 1). Время от момента введения до наступления обезболивающего эффекта существенно не различалось в обеих группах и составило 17 ± 2 минуты в исследуемой и 12 ± 2 минуты — в контрольной группе.
Продолжительность аналгезии существенно различалась в обеих группах, причем если в исследуемой группе она возрастала на протяжении послеоперационного периода, то в контрольной (с использованием наркотических аналгетиков) практически не изменилась. Так, в исследуемой группе в первые сутки продолжительность аналгезии составила 8 ± 1 час, во вторые — 10,0 ± 1,4 часа, в третьи — 12,0 ± 1,7 часа, а в контрольной она не превышала 6,0 ± 0,8 часа на протяжении всего периода исследования.
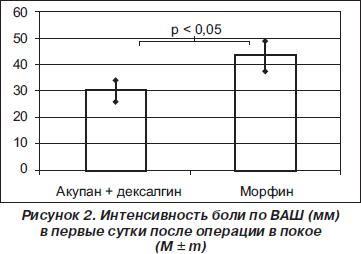
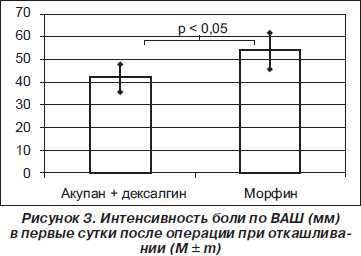
Качество послеоперационной аналгезии, оцениваемое по ВАШ, также отличалась в обеих группах. В исследуемой группе интенсивность послеоперационной боли в первые сутки составила в покое 30 ± ± 4 мм и 42 ± 6 мм при таких активных движениях, как, например, откашливание. В контрольной группе в первые сутки были отмечены следующие значения соответствующих показателей: 43 ± 6 мм и 54 ± 8 мм (р < 0,05 в сравнении с исследуемой группой) (рис. 2, 3). Во вторые сутки интенсивность боли была оценена пациентами исследуемой и контрольной групп в 34 ± ± 5 мм и 41 ± 6 мм соответственно (р = 0,075), а в третьи — в 23 ± 3 мм и 22 ± 3 мм (р > 0,05).
При исследовании общей субъективной оценки качества послеоперационной аналгезии отмечено следующее: в первые сутки в исследуемой группе 10 % пациентов оценили ее на «отлично», 72 % — «хорошо», 18 % — «удовлетворительно», а в контрольной группе 58 % — «хорошо», 42 % — «удовлетворительно» (р < 0,001). На вторые сутки в исследуемой группе 40 % — «отлично» и 60 % — «хорошо», в контрольной группе 54 % — «хорошо», 46 % — «удовлетворительно» (р < 0,001). На третьи сутки качество аналгезии 97 % пациентов оценили в исследуемой группе как «отличное», 3 % — «хорошее», в контрольной группе 78 % — «хорошо», 15 % — «удовлетворительно» и 7 % — «плохо» (р < 0,001) (рис. 4). Причем появление оценки «плохо» больные объясняли не низким качеством аналгезии, а нарастанием побочных эффектов: тошноты, рвоты, сонливости, выраженной общей слабости и пр.
Степень выраженности и частота побочных эффектов аналгетиков также существенно различались. В первые сутки в исследуемой группе их наличие отмечали 20 % больных, в контрольной группе — 64 % (р < 0,001), во вторые сутки — в исследуемой группе 12 %, в контрольной — 21 % (р = 0,128), в третьи сутки — в исследуемой группе 5 %, в контрольной — 4 % (р < 0,001).
Урология
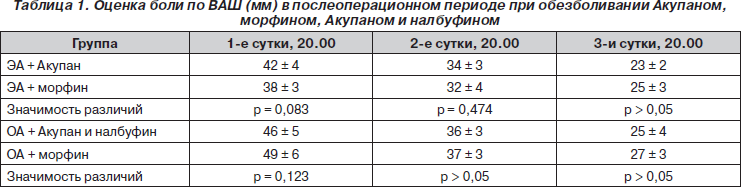
В результате проведенных исследований не было выявлено статистически значимой разницы в оценке пациентами боли по ВАШ между группой 4 (Акупан + ЭА) и группой 6 (морфин + ЭА) (табл. 1). Также не было выявлено достоверных различий между группами 3 (ОА + Акупан и налбуфин) и 5 (ОА + морфин). Таким образом, интраоперационное использование Акупана обеспечивает адекватный уровень аналгезии у урологических пациентов, прооперированных под эпидуральной анестезией, и не требует дополнительного применения наркотических аналгетиков в послеоперационном периоде, что способствует более ранней активизации пациентов. Также аналгезия Акупаном и налбуфином после проведения общей анестезии в оперативной урологии не уступает по эффективности аналгезии морфином.
Следует отметить, что предоперационное применение Акупана на фоне проведения эпидуральной аналгезии пролонгирует время послеоперационного комфортного состояния больного до первого требования обезболивания (ЭА + Акупан — 480 ± 42 мин, ЭА + морфин — 152 ± 19 мин, р = 0,013).
Интраоперационное в/в использование Акупана при проведении тотальной в/в анестезии с ИВЛ позволяет снижать суммарную дозу фентанила или кратность его введения, а также отсрочить послеоперационное введение опиоидов на 60–90 минут, а иногда и более.
Осложнений и побочных эффектов при введении Акупана мы не наблюдали. Дрожь после использования Акупана (нефопама) в послеоперационном периоде не наблюдалась ни в одной из групп.
Выводы
1. Сочетанное применение Акупана и дексалгина в послеоперационном периоде у онкохирургических больных позволяет достичь более качественного обезболивания по сравнению с традиционной аналгезией опиатами при гораздо лучшей переносимости и существенно меньшей частоте побочных эффектов.
2. Проведение упреждающей аналгезии Акупаном при эпидуральной анестезии бупивакаином и ропивакаином позволяет отказаться от введения опиоидов после урологических операций средней травматичности.
3. Аналгезия Акупаном и налбуфином после урологических операций, проведенных под общей анестезией, не уступает по эффективности аналгезии морфином.
4. Применение Акупана в комплексе периоперационной полимодальной аналгезии представляется целесообразным, поскольку препарат проявляет высокую аналгетическую активность, не обладает седативным эффектом и не угнетает дыхание.
Впервые опубликовано: Український журнал екстремальної медицини ім. Г.О. Можаєва, 2011, июль
1. Бобров О.Е., Брындиков Л.Н. и др. Лечение болевого синдрома в онкологии. — Ровно: Каллиграф, 2003. — 196 с.
2. Кобеляцкий Ю.Ю. Современные аспекты периоперационного обезболивания в травматологии и ортопедии // Здоров’я України. — 2008. — № 8. — С. 29-30.
3. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStat. — Донецк: Издатель Папакица Е.К., 2006.
4. Овечкин А.М. Профилактика послеоперационного болевого синдрома: патогенетические основы и клиническое применение // Автореф. дис… д-ра мед. наук. — М., 2000. — 42 с.
5. Осипова Н.А., Новиков Г.А., Прохоров Б.М. Хронический болевой синдром в онкологии. — М.: Медицина, 1998.
6. Apfelbaum J., Chen C., Mehta S. Postoperative pain experience: results from a national survey suggest postoperative pain continues to be undermanaged // Anesth. Analg. — 2003. — V. 97. — P. 534-540.
7. Ferrante F.M., VadeBoncouer T.R. Postoperative Pain Management / Послеоперационная боль. — М.: Медицина, 1998. — 640 c.
8. Hopf Н., Weitz J. Postoperative pain management // Arch. Surg. — 1994. — V. 129(2). — P. 128-132.
9. Kehlet H. Labat Lecture 2005. Surgical stress and postoperative outcome — from here to where? // Reg. Anesth. Pain Med. — 2006. — 31. — 47-52.
10. Rawal N. Analgesia technique and post-operative morbidity // Eur. J. Anaesthesiol. Suppl. — 1995 May. — 10. — 47-52.
11. Warfield C., Kahn C. Acute pain management. Programs in U.S. hospitals and experiences and attitudes among U.S. adults // Anesthesiology. — 1995. — V. 83. — P. 1090-1094.