Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Гипогонадотропный гипогонадизм у женщин: патогенез, диагностика, клиническая характеристика
Авторы: Зекцер В.Ю., Эндокринологический научный центр, г. Москва, Россия
Рубрики: Эндокринология
Версия для печати
Введение
Биологическое значение половых стероидов в организме женщины очень разностороннее. Половые стероиды контролируют не только репродуктивную функцию и состояние органов урогенитального тракта, но и влияют на регуляцию деятельности сердечно-сосудистой, центральной и вегетативной нервной, костной и других систем организма [1]. Проведено большое количество исследований, посвященных негативным изменениям в организме женщины на фоне снижения содержания эстрогенов. Подавляющее большинство научных работ касается пациенток перименопаузального возраста, но снижение содержания половых стероидов может обнаруживаться и у женщин репродуктивного возраста [2]. Одной из причин стойкой гипоэстрогенемии является нарушение гонадотропной функции гипофиза (так называемый гипогонадотропный гипогонадизм). Причины гипогонадотропного гипогонадизма могут быть врожденными (например, синдром Каллманна) или при- обретенными (например, последствия оперативного/лучевого лечения аденом гипофиза) [3].
Есть единичные сообщения о том, что у женщин с гипогонадотропным гипогонадизмом могут быть нарушения липидного и костного обмена [4], однако не проводилось комплексной оценки клинических, биохимических и гормональных изменений у женщин с данным заболеванием, а также сравнительной оценки изолированного гипогонадотропного гипогонадизма и гипогонадизма в сочетании с другими видами гипофизарной недостаточности (гипопитуитаризм). Не проводилось исследований качества жизни пациенток с данным заболеванием. Кроме того, недостаточно изучены механизмы нарушения функции гипоталамо-гипофизарно-овариальной системы, приводящие к формированию центрального гипогонадизма у женщин.
Поэтому комплексная оценка клинических симптомов, гормональных и метаболических расстройств у женщин с врожденным и приобретенным гипогонадотропным гипогонадизмом, изучение причин репродуктивной дисфункции, а также разработка диагностических и дифференциально-диагностических подходов к данной группе больных является актуальной проблемой.
Цель исследования — выявление патогенетических, клинических, метаболических и гормональных особенностей гипогонадотропного гипогонадизма у женщин репродуктивного возраста, а также разработка диагностических критериев гипогонадотропного гипогонадизма.
Материалы и методы исследования
В исследование вошли 54 пациентки: с идиопатическим гипогонадотропным гипогонадизмом (n = 25), с гипопитуитаризмом после хирургического вмешательства на хиазмально-селлярной области (n = 25), а также с синдромом первичного «пустого» турецкого седла (n = 4). В группе женщин с гипопитуитаризмом у 14 было сочетание гипогонадизма и вторичного гипотиреоза, а у 12 — сочетание гипогонадизма, вторичного гипотиреоза и вторичной надпочечниковой недостаточности. На момент исследования гипотиреоз и гипокортицизм были компенсированы: содержание свободного тироксина (св.Т4) составило 14,9 ± 5,8 пмоль/л, клинических признаков надпочечниковой недостаточности у больных не отмечалось.
Критерии включения:
— возраст от 18 до 50 лет;
— отсутствие менструаций в течение 12 мес.;
— низкий или нормальный уровень гонадотропинов;
— компенсация других видов гипофизарной недостаточности (если они есть);
— отсутствие приема эстроген-гестагенных препаратов в течение предшествующих 12 мес.
Критерии исключения:
— наличие гормонально-активной опухоли в момент обследования;
— наличие гипергонадотропной аменореи;
— наличие гиперпролактинемического гипогонадизма (табл. 1);
— наличие врожденной множественной недостаточности гормонов аденогипофиза;
— наличие тяжелых соматических заболеваний с поражением печени и почек;
— наличие поликистозных изменений яичников.
В контрольную группу вошли 25 практически здоровых женщин, не принимающих в течение 12 месяцев оральные контрацептивы, с регулярным двухфазным менструальным циклом.
Ультразвуковое исследование органов малого таза проводилось всем пациенткам с помощью прибора Ultrasоund Scanner Type 2002 ADI The Panther фирмы B&K Medical (Англия), работающего в реальном масштабе времени с использованием трансабдоминального датчика 3,5 мГц и трансвагинального датчика от 5 до 7,5 мГц. Определялось положение матки, ее размеры, оценивалась структура миометрия; толщина, эхогенность и структура эндометрия; размер и структура яичников, объем яичников подсчитывался по формуле:
V = [длина (см) • ширина (см) • высота (см)] • 0,479,
где 0,479 — коэффициент поправки на эллипсоидность.
Биохимические исследования проводились при помощи анализатора Hitachi 912 по стандартной методике. Определение концентрации холестерина, липопротеидов высокой плотности (ЛПВП), липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности, тиреоидных гормонов, щелочной фосфатазы, ионизированного Са, Р, гамма-глютамилтранспептидазы, аланинаминотрансферазы, аспартатаминотрансферазы, лактатдегидрогеназы в сыворотке периферической крови проходило при использовании стандартных наборов фирмы Roche (Швейцария). Пробы для определения этих показателей забирались в утренние часы (8–11 ч) натощак при венепункции локтевой вены.
Определение концентрации эстрадиола, тестостерона, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), св.Т4 и тиреотропного гормона (ТТГ), пролактина проводилось при помощи автоматизированной системы Vitrus фирмы Johnson and Johnson company методом усиленной люминесценции. Для определения пиковой секреции ЛГ и ФСГ забор крови проводился через каждые 10 минут в течение 4 часов в периферической крови после установки внутривенного катетера. Определение концентрации глобулина, связывающего половые гормоны (ГСПГ), проходило при помощи автоматизированной системы Auto-Delfia фирмы Wallac (Финляндия), дегидроэпиандростерон-сульфата (ДГЭА-С) — иммуноферментным методом фирмы «Алкор-био» (Россия).
Подсчет концентрации свободного тестостерона (сТ) осуществлялся по формуле:
сТ = ([T] – N[cT]) / Kt{ГСПГ – [T] + N[cT]}.
Определение концентрации ЛГ, ФСГ и половых стероидов у пациенток контрольной группы проводилось на 5–7-й день менструального цикла.
Магнитно-резонансная томография (МРТ) головного мозга проводилась на томографе фирмы Siemens (Erlangen, Германия) с напряженностью магнитного поля 1 Тесла. Для получения сагиттальных, фронтальных и аксиальных изображений применялись параметры TR/TE/FA = 330/12/70 (импульсные последовательности «турбо-спин-эхо», взвешенные по Т1) и 5000.119.186 (импульсные последовательности «турбо-спин-эхо», взвешенные по Т2). Толщина среза составляла 3 мм для сагиттальных и фронтальных изображений и 4 мм — для аксиальных изображений. Исследование осуществлялось без предварительной подготовки в положении лежа на спине.
Выделение геномной ДНК из цельной венозной крови проводили, используя набор реактивов DNA Prep100 (DIAtom™) по методике, рекомендованной изготовителем. Полимеразная цепная реакция (ПЦР): подбор олигонуклеотидных праймеров осуществляли из данных нуклеотидной последовательности генов, приведенной в базе данных NCBI. Амплификацию всех исследуемых фрагментов генов проводили методом ПЦР. Олигонуклеотидные праймеры были синтезированы метоксифосфоамитидным методом в НПФ «Литех» и Институте био-органической химии им. Шемякина. Анализ полученных ПЦР-фрагментов осуществляли методом электрофореза в 2,5% агарозном и/или 8% полиакриламидном гелях (ПААГ) с последующей визуализацией в УФ-свете после окрашивания бромистым этидием. Метод SSCP-анализа: поиск мутаций в кодирующей последовательности и областях экзон-интронных соединений гена FGFR1 осуществляли методом анализа конформационного полиморфизма однонитевой ДНК (SSCP-анализа) (М. Orita et al., 1989). Определение нуклеотидной последовательности ДНК: определение нуклеотидной последовательности ПЦР-фрагментов с выявленной при SSCP-анализе измененной электрофоретической подвижностью методом прямого секвенирования ДНК с использованием прямого или обратного праймеров. Автоматическое секвенирование проходило согласно протоколу фирмы-производителя на приборе ABI Prism 3100 (Applied Biosystems) в НПФ «Литех». Анализ полиморфизма длин рестрикционных фрагментов (ПДРФ-анализ): для анализа известных точковых мутаций в генах проводился ПЦР-ПДРФ-анализ с использованием эндонуклеаз рестрикции производства фирмы ООО «Сибэнзим». Электрофорез в ПААГ: для оценки результатов рестрикции использовали 8% гель с соотношением акриламида и бисакриламида 29 : 1 (Т. Маниатис с соавт., 1984). Электрофорез проводили при 15–18 В/см в течение 1–2 часов. В качестве маркера молекулярного веса использовали ДНК фага l, рестрицированную MspI. После разделения фрагментов гель окрашивали в растворе бромистого этидия (0,1 мкг/мл в 1хТВЕ) в течение 5 минут.
Определение аутоантител к гипофизу проводилась при помощи твердофазного анализа с использованием в качестве антигена мембранной фракции из гипофиза человека.
Оценка качества жизни производилась с помощью «Анкеты общего состояния здоровья» (General Health Questionnaire — GHQ-12), которая направлена на выявление минимальных психоэмоциональных расстройств и определяет связанное со здоровьем качество жизни.
Вопросы были распределены по группам:
1. Положительные характеристики качества жизни (баллы от 1 до 4, максимальный балл указывает на наилучшее качество жизни): положительные эмоциональные реакции, социальная и физическая активность, повседневная активность, качество сна.
2. Негативные характеристики качества жизни (баллы от –1 до –4, минимальный балл — наихудшее состояние пациентки): депрессия и нервозность.
3. Когнитивные функции (баллы от 1 до 4, максимальный балл указывает на наилучшие функции).
Производилось суммирование баллов по каждой группе вопросов.
Статистическая обработка полученных результатов проводилась с использованием статистической программы Statistica 6.0 для Windows XP с применением методов вариационной статистики. Вид распределения оценивался по методу Шапиро — Уилка. Результаты представлены в виде средних значений и их стандартной ошибки (M ± m) в случаях с параметрическими данными, а также в виде медианы (Me) (интерквартильный размах — Q25-Q75) в случаях с непараметрическими данными. Для проведения корреляционного анализа использовался метод Спирмена. Для определения достоверности различий в случае параметрических данных использовался Т-тест, а в случае с непараметрическими — U-тест Манна — Уитни. Для статистической обработки данных, полученных при определении пиковой секреции ЛГ и ФСГ, применялись элементы дисперсионного анализа, в частности для определения отличий между осцилляциями ЛГ и ФСГ использовалась диаграмма рассеяния. Диаграмма рассеяния визуализирует зависимость между двумя переменными X и Y. Данные изображаются точками в двумерном пространстве, где оси соответствуют переменным (X — горизонтальной, а Y — вертикальной оси).
Результаты исследования и их обсуждение
Все пациентки были распределены на 2 группы: в группу 1 вошли 28 женщин с изолированным гипогонадизмом, в группу 2 — 26 женщин с гипогонадизмом в сочетании с другими видами недостаточности гормонов аденогипофиза (гипопитуитаризмом). Группы обследованных пациенток и здоровых женщин не отличались по возрасту и времени наступления менархе.
Основными жалобами у женщин в 1-й группе были скудное половое оволосение и недостаточное развитие молочных желез, другие жалобы встречались статистически значимо реже по сравнению с группой 2. В группе 2 статистически значимо чаще встречались жалобы на слабость, усталость и быструю утомляемость, а также на урогенитальные расстройства, приливы и боли в костях, в то время как жалобы на скудное половое оволосение и недоразвитие молочных желез были не характерны.
При осмотре у 22 (80 %) женщин 1-й группы развитие молочных желез соответствовало 3–5-й ст. полового развития по Таннеру (1968), у 6 (20 %) было отмечено отсутствие спонтанного развития молочных желез. При гинекологическом осмотре у пациенток 1-й группы статистически значимо чаще наблюдались скудное половое оволосение, соответствующее 1–2-й ст. по Таннеру (1968), и пальпаторные признаки гипоплазии внутренних половых органов, в то время как другие признаки гипоэстрогении встречались в обеих группах с одинаковой частотой.
У 20 (72 %) женщин 1-й группы и 22 (82 %) женщин 2-й группы результаты цитологического исследования мазков свидетельствовали о различной степени гипоэстрогении. Частота выявления изменений клеточного состава не отличалась в группе 1 и 2.
По данным ультразвукового исследования органов малого таза у женщин в 1-й и 2-й группах была отмечена выраженная гипоплазия внутренних гениталий, достоверная по сравнению с контрольной группой. Срединное маточное эхо визуализировалось в виде линейной структуры толщиной не более 0,1 см, что свидетельствовало о крайне низкой функциональной активности эндометрия. Ни у одной пациентки не выявлено миом матки, эндометриоза, кист яичников.
В обеих группах не было отмечено влияния на объем яичников такого фактора, как длительность аменореи. Были выявлены положительные корреляции средней степени между концентрацией эстрадиола (r = 0,7, р = 0,000001), ФСГ (r = 0,6, p = 0,000002), ЛГ (r = 0,55, р = 0,0001) в сыворотке крови и объемом яичников в группах у обследованных женщин.
При осмотре у женщин обеих групп молочные железы были безболезненные, выделений из сосков при надавливании не было. По заключению рентгенологического/ультразвукового исследования молочных желез гипоплазия ткани молочной железы и фиброзно-кистозная гипоплазия встречались с одинаковой частотой.
У пациенток в группе с изолированным гипогонадотропным гипогонадизмом отмечалось статистически значимое снижение концентрации ЛГ, в то время как концентрация ФСГ статистически значимо не отличалась от контрольной группы.
В группе с гипопитуитаризмом снижение концентраций как ЛГ, так и ФСГ было статистически значимым по сравнению с контрольной группой.
У пациенток с нормогонадотропной аменореей (n = 11) статистически значимых отличий от контрольной группы выявлено не было: концентрации ЛГ и ФСГ составили 3,6 (3,14; 5,3) Е/л и 4,9 (3,9; 5,7) Е/л соответственно. В то время как у женщин с изолированным гипогонадизмом (n = 17) статистически значимо снижены базальные концентрации по сравнению с контрольной группой: ЛГ 0,1 (0,1; 0,7) Е/л, ФСГ 1,5 (0,4; 2,1) Е/л (р = 0,00004, р = 0,0001 соответственно).
При исследовании пиковой секреции ЛГ и ФСГ было выявлено достоверное снижение концентраций ЛГ у пациенток с нормогонадотропной аменореей (n = 6) по сравнению со здоровыми женщинами (3,2 (2,1; 4,1) vs 8,29 (6,35; 9,1) соответственно; р = 0,016), при этом значимых различий базальной концентрации ФСГ отмечено не было (5,1 (3,4; 6,4) vs 6,55 (5,8; 8,2) соответственно; р = 0,87).
При построении диаграмм рассеяния было выявлено достоверное снижение осцилляций как ЛГ (р = 0,00004), так и ФСГ (р = 0,00004) между пациентками с нормогонадотропной аменореей и здоровыми женщинами.
В группе 1 выброс ЛГ после введения аналогов гонадотропин-рилизинг-гормона (ГнРГ) был статистически значимо ниже по сравнению с контрольной группой (16,05 (6,4; 42,1) Е/л vs 43,4 (35,8; 61,0) Е/л соответственно; р = 0,019). Различий в выбросе ФСГ выявлено не было (15,4 (8,2; 20,1) Е/л vs 19,4 (14; 26,2) Е/л соответственно; р = 0,94).
В группе 2 в ответ на введение аналога гонадолиберина выброс ЛГ и ФСГ был статистически значимо снижен по сравнению с контрольной группой (р = 0,0001 и р = 0,0001 соответственно).
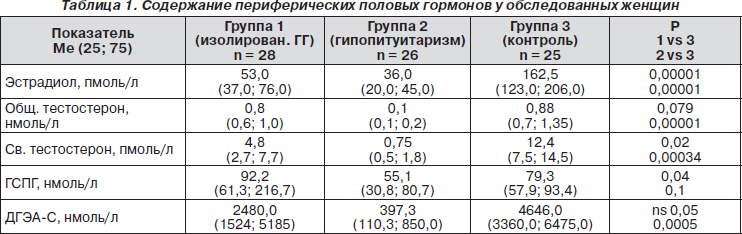
У всех пациенток с гипогонадизмом как в 1-й, так и во 2-й группе наблюдалось выраженное, статистически достоверное снижение концентраций эстрадиола (табл. 1). Согласно Консенсусу по диагностике андрогенной недостаточности у женщин (G. Bachmann et al., Fertil Steril, 2002), показанием к диагностике андрогенной недостаточности и определению содержания свободного тестостерона является концентрация общего тестостерона в пределах нижней четверти референтных значений или ниже (т.е. менее 0,825 нмоль/л). У 15 (53,6 %) пациенток 1-й группы и всех пациенток (100 %) 2-й группы были основания для дальнейшего исследования андрогенов. Тем не менее медиана концентраций общего тестостерона была статистически снижена только у пациенток 2-й группы, в то время как в группе 1 и 3 эти показатели статистически значимо не отличались. Так как в нашем исследовании применялись иммуноферментные методы определения гормонов, определение концентраций свободного тестостерона рассчитывалось по формуле, требующей определения концентраций ГСПГ. В группе 1 зафиксировано повышенное содержание ГСПГ, статистически значимо отличающееся от показателей групп 2 и 3. Расчет содержания свободного тестостерона показал, что у пациенток обеих групп имеется значительное снижение концентрации этого гормона, статистически значимое по сравнению с контрольной группой (табл. 1).
Несмотря на то что концентрация ДГЭА-С у пациенток в группе 1 статистически значимо не отличалась от контрольной группы, у 21 (75 %) женщины его содержание находилось в пределах нижней четверти и даже ниже нижней границы референтных значений. Такие показатели встречались в группе 1 статистически значимо чаще по сравнению с контрольной группой (n = 12, 48 %, 1 vs 3 р = 0,0002). Уменьшение концентрации ДГЭА-С может объясняться снижением содержания ЛГ у этой когорты женщин. В исследовании была выявлена прямая статистически значимая корреляционная зависимость между концентрацией ДГЭА-С и ЛГ (r = 0,54; p = 0,0005).
У всех пациенток 2-й группы концентрация ДГЭА-С была ниже референтных значений, причем это не коррелировало с наличием и степенью выраженности надпочечниковой недостаточности. Медиана концентрации ДГЭА-С была статистически значимо ниже, чем в группе 1 и в контрольной группе.
При исследовании GnRHR, FGFR1, FSHb мутаций выявлено не было. В двух образцах гена рецептора к ГнРГ обнаружен полиморфизм Ser151Ser (AGC-AGT), не приводящий к замене аминокислоты и описанный в литературе. Функционального значения этот полиморфизм не имеет.
Ни в одном из исследуемых образцов крови не обнаружена мутация в гене FSHB. В одном образце обнаружена замена Т-С в гетерозиготном состоянии. Данная замена является одним из описанных полиморфизмов, не приводящих к замене аминокислот Y76Y.
У 5 из 15 пациенток (33,3 %) 1-й группы, у 4 из 11 (36,3 %) 2-й группы и у 1 из 19 здоровых женщин (5,2 %) было выявлено присутствие антигипофизарных аутоантител (АГАТ). Частота выявляемости АГАТ была достоверно выше в 1-й и 2-й группе по сравнению с контрольной группой и не отличалась при сравнении между исследуемыми группами. У всех пациенток 2-й группы причиной возникновения гипогонадизма была операция на хиазмально-селлярной области, поэтому у них нельзя исключить формирование вторичных АГАТ, однако ни у одной из пациенток 1-й группы в анамнезе не было вмешательств на хиазмально-селлярной области. Из 5 пациенток 1-й группы, имеющих АГАТ, у 2 женщин никаких изменений хиазмально-селлярной области (по данным МРТ) отмечено не было, у 3 визуализировалось первичное «пустое» турецкое седло. Полученные результаты указывают на то, что нарушения гуморального аутоиммунитета могут быть одной из причин формирования гипогонадотропного гипогонадизма.
Частота выявления снижения минеральной плотности костной ткани (МПКТ) в обеих группах существенно не различалась, однако в 1-й группе статистически значимо чаще отмечалось поражение шейки бедра (44 % vs 36 %, p = 0,016), а также двух отделов одновременно (р = 0,04). В то время как в группе 2 статистически значимо чаще встречались изменения в позвоночнике (р = 0,004) по сравнению с группой 1.
У пациенток 1-й группы статистически значимо чаще по сравнению с группой 2 наблюдалась остеопения поясничных позвонков (р = 0,000001); остеопения и остеопороз бедренной кости (р = 0,019 и р = 0,0018 соответственно). Остеопороз в поясничном отделе позвоночника был выявлен в группе 2 статистически значимо чаще по сравнению с групой 1 (р = 0,000001).
В группе 2 была выявлена прямая зависимость МПКТ (в г/см2) от концентрации общего тестостерона (r = 0,62, p < 0,05). При этом достоверной зависимости между МПКТ и концентрацией эстрогенов получено не было.
У 13 (46,8 %) пациенток 1-й группы содержание общего холестерина превышало референтные значения, у 5 (17,8 %) содержание ЛПНП превышало референтные значения, однако в целом достоверных отличий от контрольной группы по этим показателям выявлено не было. Также не было отмечено достоверного изменения содержания ЛПВП и триглицеридов.
В группе 2 у 17 (64 %) пациенток показатели общего холестерина, у 6 (24 %) — триглицеридов и у 9 (40 %) — ЛПНП превышали референтные значения. Все эти показатели достоверно превышали значения в контрольной группе. Кроме того, в группе с гипопитуитаризмом было выявлено снижение ЛПВП.
В обеих группах была выявлена отрицательная статистически значимая зависимость между концентрациями периферических половых стероидов и содержанием липидов:
1. Эстрадиол:
а) триглицериды: r = –0,44; p = 0,009.
2. Общий тестостерон:
а) ЛПВП: r = 0,34; p = 0,02;
b) холестерин: r = –0,4; p = 0,03;
c) триглицериды: r = –0,4; p = 0,005.
3. Свободный тестостерон:
a) ЛПВП: r = 0,33; p = 0,04;
b) холестерин: r = –0,4; p = 0,04;
c) триглицериды: r = –0,34; p = 0,03.
В результате проведенного исследования было выявлено статистически значимое снижение положительных характеристик качества жизни в группах 1 и 2 по сравнению с контрольной группой (р = 0,026 и р = 0,00005 соответственно). При этом снижения когнитивных функций в обеих группах отмечено не было.
Некоторые характеристики качества жизни прямо зависели от концентраций периферических половых гормонов в крови:
1. Эстрадиол:
а) уровень социальной и физической активности: r = 0,45; p = 0,0035;
b) качество сна: r = 0,33; p = 0,04;
2. Общий тестостерон:
а) уровень социальной и физической активности: r = 0,54; p = 0,000003;
b) качеством сна: r = 0,47; p = 0,02.
3. Свободный тестостерон:
а) уровень социальной и физической активности: r = 0,6; p = 0,00004;
b) качество сна: r = 0,46; p = 0,003;
с) уровень положительных эмоциональных реакций: r = 0,33; p = 0,04.
4. ДГЭА-С:
а) уровень социальной и физической активности: r = 0,5; p = 0,0009;
b) качество сна: r = 0,45; p = 0,00;
с) уровень положительных эмоциональных реакций: r = 0,46; p = 0,003;
d) уровень повседневной активности: r = 0,56, p = 0,0002.
При анализе негативных показателей качества жизни было отмечено их повышение в группах 1 и 2 по сравнению с контрольной группой. В группе 1 повышение негативных характеристик качества жизни было менее выраженным по сравнению с группой 2 и статистически недостоверным по сравнению с контрольной группой. В группе 2 повышение нервозности, дискомфорта и депрессии статистически значимо отличалось от показателей контрольной группы (р = 0,0007). При проведении корреляционного анализа были выявлены достоверные обратные корреляционные зависимости между концентрациями эстрадиола, общего и свободного тестостерона и ДГЭА-С в крови и уровнем депрессивности, чувством дискомфорта и нервозности у обследованных женщин:
1. Эстрадиол:
a) депрессивность: r = –0,33; p = 0,04;
b) нервозность: r = –0,44; p = 0,005.
2. Общий тестостерон:
a) депрессивность: r = –0,67; p = 0,000003;
b) нервозность: r = –0,57; p = 0,0001.
3. Свободный тестостерон:
a) депрессивность: r = –0,7; p = 0,000002;
b) нервозность: r = –0,6; p = 0,00004.
4. ДГЭА-С:
a) депрессивность: r = –0,55; p = 0,0002;
b) нервозность: r = –0,45; p = 0,004.
Выводы
1. У пациенток с гипогонадотропным гипогонадизмом состояние органов малого таза (по данным УЗИ и цитологической картине мазков) и молочных желез указывает на выраженную гипоэстрогению. При изолированном гипогонадизме статистически значимо чаще встречаются жалобы на недоразвитие вторичных половых признаков, в то время как при гипопитуитаризме на первый план выходят общие неспецифические жалобы. При гипогонадотропном гипогонадизме отмечается снижение концентрации не только эстрадиола, но и андрогенов: при изолированном гипогонадизме статистически значимо снижены медианы концентраций свободного тестостерона, при гипопитуитаризме — общего и свободного тестостерона, ДГЭА-С.
2. При гипогонадотропном гипогонадизме отмечается снижение МПКТ менее –1 SD в поясничном отделе позвоночника у 63 % пациенток. В группе с изолированным гипогонадотропным гипогонадизмом статистически значимо чаще выявлялись изменения МПКТ в бедренной кости, остеопороз встречался статистически значимо чаще при гипопитуитаризме. При гипогонадотропном гипогонадизме статистически значимо чаще отмечается повышение содержания холестерина по сравнению со здоровыми женщинами. При гипопитуитаризме имеются более выраженные изменения липидного спектра: статистически значимое повышение медиан концентраций всех атерогенных липидных фракций, снижение медианы концентрации ЛПВП. Концентрация триглицеридов, холестерина и ЛПВП прямо статистически значимо зависит от содержания эстрадиола, общего и свободного тестостерона.
3. У пациенток с изолированным идиопатическим при генетическом анализе генов рецептора к гонадотропинрилизинг гормону, гена b-субъединицы ФСГ, гена FGRF выявлены случаи полиморфизма: ГнРГ (AGC-AGT) Ser151Ser; b-cyбъединицы ФСГ (TAT-TAC) Y76Y, которые, однако, не могут считаться причиной заболевания. Частота выявления аутоантител к гипофизу при гипогонадотропном гипогонадизме статистически значимо выше по сравнению с контрольной группой, что свидетельствует о нарушениях гуморального аутоиммунитета у части женщин.
4. У женщин с гипогонадотропным гипогонадизмом отмечается снижение качества жизни, наиболее выраженное при гипопитуитаризме. Снижение положительных и увеличение отрицательных характеристик качества жизни прямо зависит от концентраций эстрадиола, общего и свободного тестостерона, а также ДГЭА-С.
1. Иловайская И.А., Пищулин А.А., Гончаров Н.П., Марова Е.И. Эффективность заместительной гормональной терапии в лечении женщин с гипогонадотропным гипогонадизмом // Акушерство и гинекология. — 2005. — № 4. — С. 53-56.
2. Андрогенный статус у женщин с гипогонадотропным гипогонадизмом / И.А. Иловайская, Е.Ю. Донина, Н.П. Гончаров, Г.А. Мельниченко // Российский вестник акушера-гинеколога. — 2007. — T. 7, № 4. — C. 26-31.
3. Иловайская И.А., Донина Е.Ю., Ильин А.В. и др. Нарушения липидного спектра и их коррекция у пациенток с гипогонадотропным гипогонадизмом // Ожирение и метаболизм. — 2006. — № 3. — С. 25-29.
4. Иловайская И.А., Михайлова Д.С., Гончаров Н.П. и др. Влияние заместительной гормональной терапии на качество жизни пациенток с гипогонадотропным гипогонадизмом // Вестник репродуктивного здоровья. — 2008. — № 2.