Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Уперше виявлена гіперглікемія у хворих на ішемічну хворобу серця з точки зору кардіолога
Авторы: Королюк О.Я., Радченко О.М., Львівський національний медичний університет імені Данила Галицького, кафедра внутрішньої медицини № 2
Рубрики: Эндокринология
Версия для печати
При ішемічній хворобі серця гіперглікемія може бути зумовлена стресом, переддіабетом і цукровим діабетом. Останні два стани вимагають особливої уваги, оскільки підвищують смертність і збільшують частоту ускладнень. Із метою вивчення особливостей клінічних проявів, чинників ризику та стану інсулінової регуляції у хворих на ІХС з уперше виявленою гіперглікемією обстежені 116 пацієнтів та 20 практично здорових осіб (контроль). Установлено, що переддіабет і діабет виявляються у хворих із метаболічним синдромом, частіше при гострих коронарних синдромах. Порушення з гіперглікемією після навантаження (порушення толерантності до глюкози і діабет) мають спільні патогенетичні риси і більш несприятливий вплив на перебіг ІХС. Єдиним способом їх діагностики є пероральний глюкозотолерант-ний тест, що слід проводити всім пацієнтам. Первинною ланкою в патогенезі порушень вуглеводного обміну й підвищенні серцево-судинного ризику є зниження чутливості тканин до інсуліну, що визначається вже на стадії нормальної регуляції обміну глюкози й вимагає комплексного контролю чинників ризику. Переддіабетичні стани мають різний патогенез: при порушенні глікемії натще переважає гіперсекреторна відповідь інсуліну на глюкозу, при порушенні толерантності до глюкози — варіабельна, з гіпосекрецією у ранній фазі.
Iшемічна хвороба серця, цукровий діабет, переддіабет.
При ішемічній хворобі серця (ІХС) уперше виявлена гіперглікемія завжди вимагає особливої уваги, оскільки може бути наслідком трьох різних станів: дебюту цукрового діабету (ЦД), переддіабету та реакцією на стрес, зумовлений дестабілізацією ІХС. При стрес-гіперглікемії достатньо лише спостереження, оскільки це транзиторний стан, викликаний гіперпродукцією контрінсулярних гормонів. ЦД є відомим чинником ризику, що підвищує смертність і частоту ускладнень. Останнім часом опубліковано все більше даних, що переддіабетичні стани, зокрема порушення глікемії натще (ПГН) і порушення толерантності до глюкози (ПТГ), також негативно впливають на перебіг ІХС [1–6].
Мета — вивчити особливості клінічних проявів, фактори ризику і стан інсулінової регуляції у хворих на ІХС з уперше виявленою гіперглікемією для патогенетичного обґрунтування лікування.
Матеріали і методи
Дослідження проведене на базі інфарктного і кардіо- логічного відділів МКЛ № 8 м. Львова з 2009 по 2011 рр. Критерії включення: верифікована ІХС; глюкоза в плазмі ≥ 5,6 ммоль/л; письмова згода пацієнта. Критерії виключення: раніше встановлений ЦД, супутні ендокринні хвороби; захворювання інших органів і систем у стадії загострення чи зі значним порушенням функції; прийом ліків, що впливають на обмін вуглеводів. В основну групу включені 116 хворих на ІХС віком від 37 до 84 років (середній вік — 62,2 року), серед них 51 жінка та 65 чоловіків. Групу контролю становили 20 практично здорових осіб, 10 жінок і 10 чоловіків, віком від 32 до 68 років (середній вік — 46,3 року). Обстеження включало антропометрію, вимірювання артеріального тиску (АТ), оцінку стану вегетативної нервової системи за питальником С. Пухлика [7]. Натщесерце визначали рівні глікозильованого гемоглобіну (НbA1c), ліпідів, глюкози, інсуліну, С-пептиду, високочутливого С-реактивного протеїну (СРП). Після перорального навантаження глюкозою (75 г у 300 мл кип’яченої води) повторювали визначення глюкози та інсуліну на 30’, 60’ і 120’. Глікемію вимірювали в плазмі глюкозооксидазним методом («Філісіт-Діагностика», Україна), НbA1c — у цільній венозній крові, стабілізованій ЕДТА методом іонообмінної хроматографії (HUMAN, Німеччина). Холестерин (ХС), тригліцериди (ТГ), ХС ліпопротеїдів високої щільності (ХС ЛПВЩ) визначали ензиматичними методами (HUMAN, Німеччина); інсулін, С-пептид (набори DRG Instrumentals GmbH, Німеччина) та СРП (ХЕМА, Росія) — методом ферментного імуносорбційного аналізу в сироватці крові. Уміст ХС ліпопротеїдів низької щільності (ХС ЛПНЩ) розраховували за формулою W. Friedewald, коефіцієнт атерогенності (КА) — за формулою А. Клімова, продукт акумуляції ліпідів (LAP, см/ммоль/л) — за формулами: (ОТ – 58) TГ (для жінок), (ОТ – 65) TГ (для чоловіків), де ОТ — окружність талії [8]. Чутливість/резистентність до інсуліну й секреторну функцію оцінювали за показниками, які обчислювали за значеннями глюкози та інсуліну під час глюкозотолерантного тесту [9]. Статистичну обробку проводили із застосуванням Statistica for Windows 6.0 (Statsoft, США) непараметричними методами, оскільки розподіл більшості показників не відповідав такому за Гаусом (тип розподілу визначали тестом Шапіро — Уїлкса). Відносні величини подані у відсотках, групи порівнювали із застосуванням точного тесту Фішера; кількісні величини — як медіану [25-й; 75-й процентилі], порівняння проводили за U-критерієм Манна — Уїтні. Статистично значущими вважали показник р < 0,05.
Результати та їх обговорення
За значеннями глюкози0' і глюкози120' відповідно до критеріїв ВООЗ/МДФ [10] пацієнтів поділено на такі групи: нормальна регуляція обміну глюкози (НРГ, n = 24), ПГН (n = 23), ПТГ (n = 45) та ЦД (n = 24).
Установлено, що вперше виявлена гіперглікемія у 2,2 раза частіше спостерігалася в пацієнтів із гострим коронарним синдромом (ГКС), ніж у хворих із стабільним перебігом (n = 80/69% та n = 36/31% відповідно). В осіб із стабільним перебігом гіперглікемія практично з однаковою частотою відповідала НРГ (22 %), ПГН (25 %), ПТГ (28 %) і ЦД (25 %), при ГКС — суттєво переважала ПТГ (НРГ — 20 %, ПГН — 18 %, ПТГ — 44 %, ЦД — 18 %), особливо в жінок (частота ПТГ при стабільних формах і ГКС становила 12,5 і 43 % відповідно, p = 0,053). Таким чином, переддіабет і ЦД частіше виявляються при ГКС і, очевидно, призводять до дестабілізації ІХС.
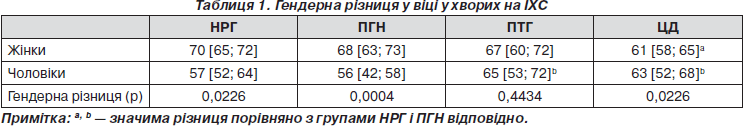
Відомо, що завдяки захисному впливу естрогенів у жінок ІХС розвивається в середньому на 10 років пізніше, ніж у чоловіків [11]. Із прогресуванням порушень вуглеводного обміну гендерна різниця у віці поступово нівелювалася (табл. 1). На відміну від чоловіків у жінок чітко простежувалося зменшення середнього віку в міру поглиблення порушень вуглеводного обміну (табл. 1).
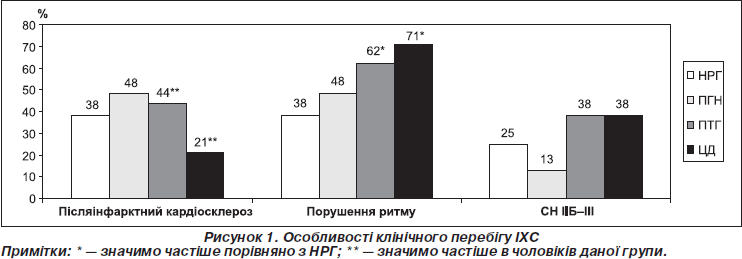
Післяінфарктний кардіосклероз дещо частіше виявляли в осіб із ПД; у групах НРГ і ПГН приблизно з однаковою частотою в чоловіків і жінок, у групах ПТГ і ЦД — значно частіше в чоловіків (рис. 1).
Частота порушень ритму збільшувалася з прогресуванням порушень вуглеводного обміну й була значимо вищою у групах ПТГ і ЦД порівняно з НРГ (рис. 1). Пацієнти з ПТГ і ЦД частіше мали бівентрикулярну серцеву недостатність (СН) (рис. 1).
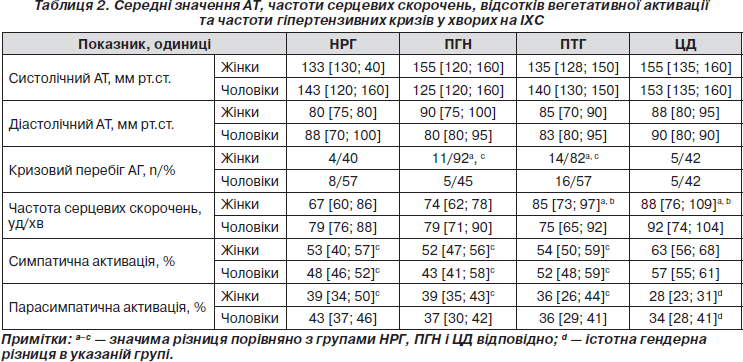
Усі хворі на ІХС мали артеріальну гіпертензію (АГ), переважно 3-го ступеня: НРГ — 67 %, ПГН — 74 %, ПТГ — 64 % і ЦД — 58 %. За середніми значеннями АТ групи суттєво не відрізнялися (табл. 2). У чоловіків не було значимої різниці в частоті гіпертензивних кризів, у жінок кризовий перебіг гіпертензії значно частіше виявляли у групах із переддіабетом (табл. 2).
У жінок середні значення частоти серцевих скорочень (ЧСС) прогресивно збільшувалися, досягаючи максимуму при ПТГ і ЦД з істотними різницями порівняно з групами НРГ і ПГН (табл. 2). У чоловіків значне, але невірогідне збільшення ЧСС спостерігалося лише у групі ЦД (табл. 2). У жінок і чоловіків із ЦД виявлено значно вищі показники симпатичної активації та значно нижчі показники парасимпатичної активації порівняно з іншими групами, причому зниження було більш вираженим у жінок (табл. 2). Зменшення парасимпатичних впливів може бути одним із механізмів пригнічення секреції інсуліну [12]. Гіперактивація симпатичної нервової системи є відомим механізмом АГ і СН [13], що обґрунтовує доцільність застосування метаболічно нейтральних b-блокаторів (ББ). Достатню доказову базу мають метопролол (дослідження MERIT-HF), бісопролол (CIBIS II) і карведилол (COPERNICUS, COMET), тому їх призначення хворим з ІХС і ЦД затверджене як засіб першої лінії для лікування СН (клас І, рівень доказовості С), з метою зниження захворюваності і смертності у хворих із ГКС (клас ІІа, рівень доказовості В) та як засіб комплексної терапії АГ [14]. Небіволол — високоселективний b1-блокатор ІІІ покоління з NO-залежною судинорозширювальною дією і позитивним впливом на вуглеводний обмін [15], ефективно знижує АТ, переноситься краще, ніж лосартан, антагоністи кальцієвих каналів та інші ББ [16], у хворих похилого віку із СН зменшує захворюваність і смертність (дослідження ENECA, SENIORS) [17].
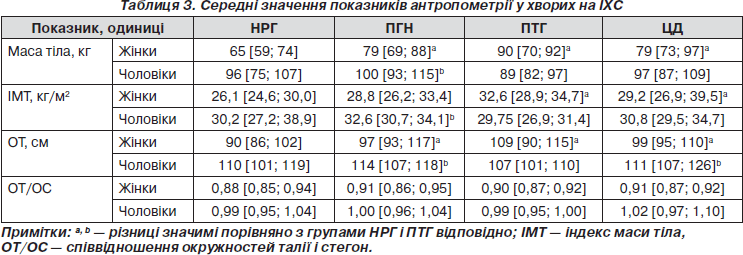
У 63 хворих (54 %) індекс маси тіла (ІМТ) перевищував 30 кг/м2, у тому числі у 23 жінок і 40 чоловіків. Найчастіше ожиріння мали жінки з ПТГ (р > 0,05) і чоловіки з ПГН з істотними різницями порівняно з НРГ і ПТГ. Абдомінальне ожиріння (ОТ ≥ 80 см у жінок і ≥ 94 см у чоловіків) виявлено у 106 осіб із частотою у жінок: НРГ — 90 %, ПГН — 100 %, ПТГ — 94 %, ЦД — 100 %; у чоловіків: НРГ — 86 %, ПГН — 100 %, ПТГ — 82 %, ЦД — 92 %. Середні значення показників антропометрії наведені в табл. 3.
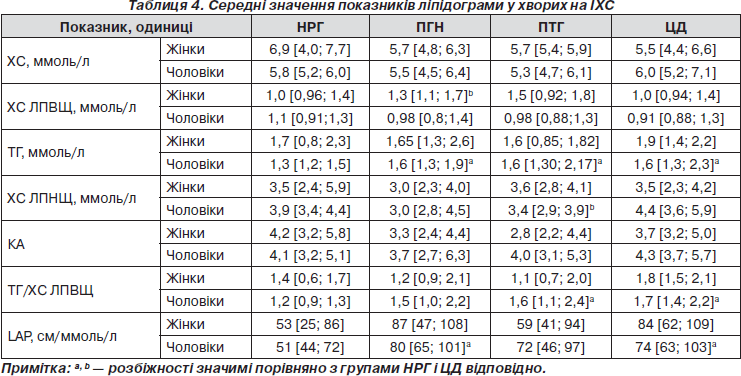
Усі хворі на ІХС мали дисліпідемію, яку діагностували при відхиленні за межі оптимальних значень, рекомендованих Європейським товариством кардіологів (2003), будь-якого показника ліпідограми, середні значення яких подано у табл. 4.
Частота ізольованої гіпертригліцеридемії була практично однаковою: НРГ — 17 %, ПГН — 22 %, ПТГ — 18 %, ЦД — 17 %. Ізольоване зниження ХС ЛПВЩ спостерігалося в 46 % осіб із НРГ та у третини хворих із ПГН, ПТГ і ЦД. Комбіновану діабетогенну дисліпідемію (¯ХС ЛПВЩ + ТГ) найчастіше виявляли у групі ЦД з істотною різницею порівняно з НРГ (38 і 8 % відповідно, р = 0,036); у групах ПГН і ПТГ — із частотою 26 і 22 % відповідно.
Таким чином, у більшості хворих на ІХС з уперше виявленою гіперглікемією спостерігалися ознаки метаболічного синдрому (МС), який діагностовано в 67 % осіб із НРГ і 100 % пацієнтів інших груп (р = 0,004 між групами НРГ і ПГН та НРГ і ЦД, р = 0,0001 між групами НРГ і ПТГ).
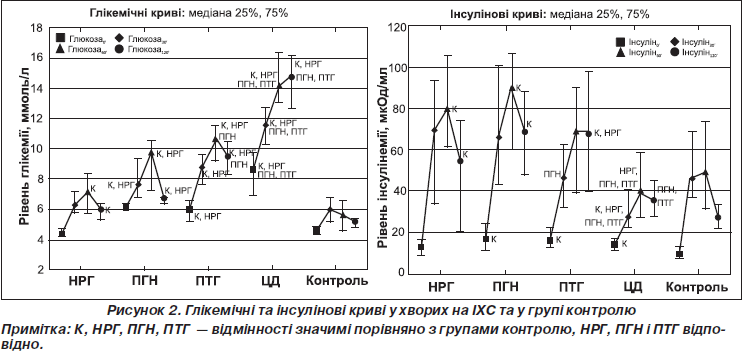
Максимальні та значимо вищі рівні глікемії в усіх точках порівняно з рештою груп виявлено у групі ЦД; в обох переддіабетичних групах значення глюкози0–120' були істотно вищими порівняно з контролем та НРГ; вірогідно вищі значення глюкози60' і глюкози120' виявлено у групі ПТГ порівняно з ПГН та у групі НРГ порівняно з контролем (рис. 2).
Рівні інсуліну0’ в усіх групах хворих на ІХС були істотно вищими, ніж у групі контролю (рис. 2). Концентрації інсуліну після навантаження у групах НРГ, ПГН, ПТГ були істотно вищими, ніж у групі контролю, а в групі ЦД — істотно нижчими порівняно з іншими групами (рис. 2). У групі ПТГ виявлено істотно нижчі значення інсуліну30', ніж у групі ПГН (рис. 2).
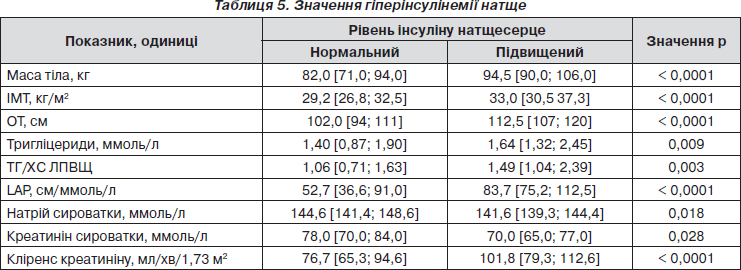
Базальну гіперінсулінемію (інсулін0' > 16 мкОд/мл [18]), що вважається сурогатним маркером інсулінорезистентності (ІР), найчастіше виявляли у групі ПГН зі значною відмінністю порівняно з НРГ (57 і 25 % відповідно, р = 0,04); у групах ПТГ і ЦД її частота становила 49 і 29 % відповідно. Хворі з гіперінсулінемією мали значно вищі показники маси тіла, ІМТ, ОТ, ТГ, ТГ/ХС ЛПВЩ, LAP, ніж особи з нормальним рівнем інсуліну0' (табл. 5). Це узгоджується з теорією, що ожиріння, насамперед вісцеральне, потенціює ІР, посилюючи синтез вільних жирних кислот, які порушують активність фосфатидилінозитол-3-кінази, що викликає гіперглікемію й діабетогенну дисліпідемію. Хворі з гіперінсулінемією мали також значно нижчі концентрації натрію і креатиніну в крові та істотно вищі значення кліренсу креатиніну — ClСr (табл. 5). Інсулін має антинатрій-уретичний ефект через посилення реабсорбції натрію в дистальних канальцях [14], підвищення ClСr при цьому є компенсаторним механізмом [19].
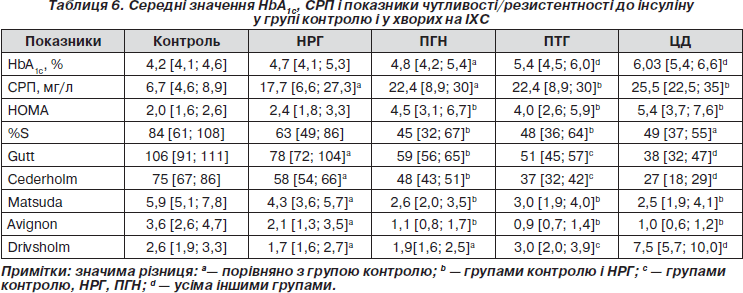
Середні значення HbA1c були істотно вищими у групі ПГН порівняно з контролем та у групах ПТГ і ЦД порівняно з іншими групами; середні значення СРП у всіх групах істотно перевищували показники групи контролю, а у групах ПТГ і ЦД були значно вищими, ніж у групі НРГ (табл. 6).
Показники чутливості/резистентності до інсуліну, що враховують значення глюкози та інсуліну натще і після навантаження, в усіх групах були суттєво нижчими, ніж у контролю (табл. 6). У групах ПГН, ПТГ і ЦД спостерігалося поступове прогресування ІР та істотне зниження усіх показників чутливості до інсуліну (табл. 6).
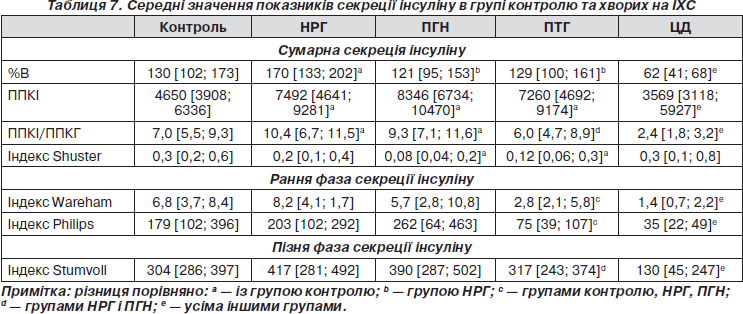
Оцінка показників секреції (табл. 7): при НРГ спостерігалися значимо вищі показники сумарної секреції інсуліну, ніж у групі контролю. З прогресуванням порушень вуглеводного обміну секреторні показники прогресивно знижувалися, досягаючи мінімуму при ЦД. Основною відмінністю між ПГН і ПТГ є істотне зниження ранньої фази секреції при ПТГ.
Отже, якщо розглядати діабетогенез як прогресивний процес (НРГ ® переддіабет ® ЦД), то зниження чутливості тканин до інсуліну спостерігається вже при НРГ, насамперед в осіб із МС. Запобігти розвитку ЦД і зменшити серцево-судинний ризик можна жорстким контролем факторів ризику [14]. Насамперед це зниження маси тіла на 5–10 % від початкового рівня при ІМТ > 25 кг/м2, що можна досягти дієтою (гіпокалорійна з достатньою кількістю свіжих овочів і фруктів та обмеженим умістом вуглеводів і насичених жирів), фізичною активністю (не < 30 хв щодня) або медикаментозними засобами (орлістат, акарбоза). Не менш важливими є: 1) контроль АТ (цільові рівні < 130/80 мм рт.ст., препарати вибору — інгібітори РААС); 2) корекція дисліпідемії (при ЦД цільові рівні ХС ЛПНЩ 1,8–2,0 ммоль/л, пріоритетними є статини, клас І, рівень доказовості В; якщо після цього рівні ТГ > 2 ммоль/л, рекомендовані фібрати, клас ІІb, рівень доказовості В); 3) забезпечення нормоглікемії (HbA1c < 7,0 %; метформін є препаратом вибору при ЦД в осіб із надмірною масою тіла, клас IIb, рівень доказовості C; призначення метформіну чи акарбози особам із ПТГ може запобігти розвитку ЦД, клас І, рівень доказовості А, однак, немає клінічних досліджень, які доводять їх ефективність у зниженні серцево-судинного ризику); 4) відмова від паління й надмірного вживання алкоголю. Слід також уникати метаболічно агресивних засобів: ББ, діуретики (окрім індапаміду), антидепресанти, кортикостероїди [14]. Доцільність призначення хворим із ПТГ стимуляторів секреції інсуліну потребує подальшого вивчення, оскільки більшість препаратів мають небажані побічні ефекти, несприятливий або недостатньо вивчений кардіологічний профіль [20].
Висновки
1. Цукровий діабет і переддіабет діагностують здебільшого у хворих із МС і ГКС.
2. Порушення з гіперглікемією після навантаження (ПТГ і ЦД) мають спільні патогенетичні риси (ІР із секреторним дефектом, активація запалення й симпатичної нервової системи) та більш несприятливий вплив на перебіг ІХС (вища частота аритмій, бівентрикулярної СН, тахікардії; ранній розвиток ІХС у жінок). Єдиним способом їх діагностики є пероральний глюкозотолерантний тест, який слід проводити усім хворим на ІХС, насамперед пацієнтам із МС.
3. Первинною ланкою в патогенезі порушень вуглеводного обміну й підвищенні серцево-судинного ризику є зниження чутливості тканин до інсуліну, що визначається вже на стадії НРГ і вимагає комплексного контролю факторів ризику.
4. Переддіабет не є однорідною групою: при ПГН відповідь інсуліну на глюкозу гіперсекреторна, при ПТГ — варіабельна, з гіпосекрецією у ранній фазі.
1. The DECODE Study Group. Glucose tolerance and cardiovascular mortality: comparison of fasting and 2-hour diagnostic criteria // Arch. Intern. Med. — 2001. — Vol. 161, № 3. — P. 397-405.
2. Newly detected abnormal glucose tolerance important predictor of long term outcome after an acute myocardial infarction / M. Bartnik, K. Malmberg, A. Norhammar [et al.] // Eur. Heart J. — 2004. — Vol. 25. — P. 1990-1997.
3. Is nondiabetic hyperglycemia a risk factor for cardiovascular disease? A meta-analysis of prospective studies / E. Levitan, Y. Song, E. Ford, S. Liu // Arch. Intern. Med. — 2004. — Vol. 164, № 19. — P. 2147-2155.
4. Prognostic value of impaired fasting glucose for outcomes of patients with stable angina pectoris treated with percutaneous coronary interventions / A. Dibra, G. Ndrepepa, J. Mehilli, [et al.] // The American Journal of Cardiology. — 2005. — Vol. 96, № 8. — P. 1113-1115.
5. Porter A. Impaired fasting glucose and outcomes of ST-elevation acute coronary syndrome treated with primary percutaneous intervention among patients without previously known diabetes mellitus / A. Porter // Am. Heart J. — 2008. — Vol. 155, № 2. — P. 284-289.
6. Impact of pre-diabetic state on clinical outcomes in patients with acute coronary syndrome // R. Otten, E. Kline-Rogers, D.J. Meier [et al.] // Heart. — 2005. — Vol. 91. — P. 1466-1468.
7. Пухлик С.М. Принципы диагностики и клинические особенности вегетативных нарушений у больных аллергическим ринитом / С.М. Пухлик // Імунологія і алергологія. — 1998. — № 1–2. — С. 126-131.
8. Kahn H.S. The lipid accumulation product performs better than the body mass index for recognizing cardiovascular risk: a population-based comparison / H.S. Kahn // BMC Cardiovasc. Disord. — 2005. — Vol. 5. — P. 26.
9. Королюк О. Особливості інсулінової регуляції у хворих на ішемічну хворобу серця з порушеннями обміну глюкози / О. Королюк, О. Радченко, В. Коваль [та ін.] // Сімейна медицина. — 2010. — № 4. — С. 61-70.
10. World Health Organization. Definition and diagnosis of diabetes mellitus and intermediate hyperglycemia: report of a WHO/IDF consultation // Geneva: WHO, 2006. — 46 р.
11. Ischemic heart disease in women. A review for primary care physicians / A.V. Kusnoor, A.D. Ferguson, R. Falik // South Med. J. — 2011. — Vol. 104, № 3. — P. 200-204.
12. Gilton P. Cholinergic control of pancreatic b-cell function / P. Gilton, J.-C. Henquin // Endocrine Reviews. — 2001. — Vol. 22, № 5. — P. 565-604.
13. Excessive sympathetic activation in heart failure with obesity and metabolic syndrome: characteristics and mechanisms / G. Grassi, G. Seravalle, F. Quarti-Trevano [et al.] // Hypertension. — 2007. — Vol. 49. — P. 535-541.
14. Guidelines on diabetes, pre-diabetes, and cardiovascular disease: full text / The Task Force on Diabetes and Cardiovascular disease / L. Ryden, E. Standl, M. Bartnik [et al.] // European Heart Journal Supplements. — 2007. — Vol. 9, Supplement C. — P. C3-C74.
15. Van Bortel L.M. Efficacy, tolerability and safety of nebivolol in patients with hypertension and diabetes: a post-marketing surveillance study / L.M. Van Bortel // Eur. Rev. Med. Pharmacol. Sci. — 2010. — Vol. 14, № 9. — P. 749-758.
16. Van Bortel L.M. Efficacy and tolerability of nebivolol compared with other antihypertensive drugs: a meta-analysis / L.M. Van Bortel, F. Fici, F. Mascaqni // Am. J. Cardiovasc Drugs. — 2008. — Vol. 8, № 1. — P. 35-44.
17. Tavazzi L. Nebivolol for heart failure in the elderly / L. Tavazzi // Expert Rev. Cardiovasc. Ther. — 2007. — Vol. 5, № 3. — P. 423-433.
18. Fontbonne A.M. Insulin and cardiovascular disease. Paris Prospective Study / A.M. Fontbonne, E.M. Eschwege // Diabetes Care. — 1991. — Vol. 14. — P. 461-469.
19. Chronic hyperinsulinemia and blood pressure regulation / J.E. Hall, T.G.Coleman, H.L. Mizelle, M.J. Smith Jr // Am. J. Physiol. — 1990 — Vol. 258. — Р. 722-731.
20. Fisman E. A cardiologic approach to non-insulin antidiabetic pharmacotherapy in patients with heart diasease / E.Z. Fisman, A. Tenebaum // Cardiovascular Diabetology. — 2009. — Vol. 8. — P. 38-51. Available from http://www.cardiab.com/content/8/I/38