Международный неврологический журнал 8 (46) 2011
Вернуться к номеру
Состояние нейроиммунной активации у больных, перенесших ишемический инсульт
Авторы: Волошина И.Н., Запорожский государственный медицинский университет, кафедра внутренних болезней № 2
Рубрики: Неврология
Версия для печати
Проведено изучение состояния нейроиммунной активации по плазменному содержанию уровней медиаторов симпатической нервной системы, трансформирующего фактора роста β1 и сывороточных цитокинов у больных с артериальной гипертензией, перенесших ишемический инсульт. Обследовано 90 больных (61 мужчина, 29 женщин) с последствиями перенесенного ишемического инсульта. Всем пациентам было проведено определение плазменного содержания норадреналина, нейропептида Y, сывороточных интерлейкинов-4, 6, 10, гамма-интерферона и трансформирующего фактора роста β1. Установлено, что для больных с артериальной гипертензией, перенесших ишемический инсульт, характерны выраженные процессы нейроиммунной активации, проявляющиеся прогрессирующей гиперсимпатикотонией и дисбалансом иммунных реакций. Иммуновоспалительный ответ наиболее выражен у постинсультных пациентов с тяжелой гипертензией, что проявляется гиперсекрецией гамма-интерферона и интерлейкина-6.
Гипертоническая болезнь, инсульт, нейроиммунная активация.
Число случаев мозгового инсульта в мире постоянно увеличивается, достигая 10 % в структуре общей смертности населения планеты [14]. Основными причинами развития ишемического инсульта (ИИ) являются атеросклероз, артериальная гипертензия (АГ) и их сочетание [1]. Научными исследованиями последних лет было установлено, что гиперактивация симпатического отдела нервной системы и иммунный дисбаланс являются неотъемлемыми звеньями патогенеза инсульта и прогрессирования гипертензии. На фоне значительного повышения артериального давления (АД), в условиях «срыва» мозговой ауторегуляции, гиперсимпатикотония способствует формированию церебрального вазоспазма и ухудшению тканевой перфузии [7]. Экспериментальные данные показали, что стимуляция симпатического отдела нервной системы у животных ассоциируется со снижением суммарного церебрального кровотока на фоне ангиоспазма. В исследовании R. Zhang и соавт. [4] после проведения блокады симпатических ганглиев триметафаном у здоровых добровольцев было отмечено снижение как системного АД, так и линейной скорости мозгового кровотока, по данным транскраниальной допплерографии была зафиксирована дилатация средних мозговых артерий. Несмотря на эти убедительные данные, ряд ученых продолжает вести дискуссию о влиянии автономной нервной системы на показатели церебральной гемодинамики при различных клинических состояниях.
Нарушение симпатического тонуса при различных патологических состояниях сопровождается дисфункцией иммунной системы, т.к. первичные и вторичные лимфоидные органы имеют преимущественно симпатическую/норадренергическую иннервацию. В норме норадреналин и нейропептид Y, высвобождаясь из периваскулярных и паренхимальных нервных окончаний, играют роль иммуномодуляторов. Возникающая после инсульта дисфункция иммунного ответа, которая развивается на фоне гиперсимпатикотонии, является ключевым фактором ослабления иммунитета перед бактериальной инфекцией, присоединение которой значительно ухудшает прогноз заболевания и удлиняет период реабилитации [8].
Принято считать, что иммунный ответ состоит из врожденного, или антиген-неспецифического, и адаптивного, или антиген-специфического, звеньев. Врожденный иммунный ответ осуществляет первую линию защиты, направленную против инвазии патогенов или активизируясь в ответ на тканевое повреждение. Имеются клинические наблюдения, касающиеся наличия тесной корреляции между уровнем системного воспаления и тяжестью инсульта либо объемом инфарктной зоны мозга [11].
В условиях церебральной ишемии значительно возрастает концентрация таких антигенов, как основной белок миелина, нейрон-специфическая энолаза и другие, кроме того, велик риск нарушения проницаемости гематоэнцефалического барьера. Было показано, что вскоре после инсульта антигены центральной нервной системы (ЦНС) можно выявить в ткани шейных лимфоузлов. Встреча лимфоцитов с антигенами ЦНС зачастую приводит к развитию аутоиммунного ответа [5].
Иммунный ответ лимфоцита на присутствие антигена становится возможным при образовании антиген-презентирующих клеток в комплексе с молекулами главного комплекса гистосовместимости ІІ типа, получая при этом дополнительные костимуляторные сигналы. В случае если «наивный» лимфоцит распознает антиген в присутствии гамма-интерферона (гамма-ИФН), развивается тип Th1 иммунного ответа. В присутствии интерлейкина-4 (ИЛ-4) происходит развитие типа Th2 (гуморального) иммунного ответа. Присутствие плейотропного трансформирующего фактора роста b1 (ТФР-b1) и интерлейкина-6 (ИЛ-6) увеличивает Th-хелперный иммунный ответ. Регуляторные Т-лимфоциты формируются преимущественно в присутствии интерлейкина-10 (ИЛ-10) либо при отсутствии ИЛ-6. Лимфоциты, реализующие иммунный ответ по типу Th1, связаны с реакциями клеточного иммунитета и характеризуются секрецией гамма-ИФН и лимфотоксина a. Клетки типа Th2 ассоциированы с гуморальным иммунитетом и секрецией ИЛ-4, ИЛ-5 и ИЛ-13. Лимфоциты, продуцирующие ТФР-b1 и ИЛ-6, являются модуляторами воспалительных реакций с привлечением нейтрофилов. Кроме того, они могут участвовать в развитии аутоиммунных реакций [12]. Существует несколько теорий развития аутоиммунного ответа после мозгового инсульта. Одна из них основана на факте формирования иммунного ответа к антигенам мозговой ткани, возникающего вслед за ишемией мозга. Было показано, что в условиях окклюзии средней мозговой артерии у крыс формирование Th1-иммунного ответа к антигенам ЦНС было ассоциировано с худшим прогнозом для выживания [6]. Повышенное содержание миелин-реактивных Т-лимфоцитов было обнаружено у больных с цереброваскулярными заболеваниями ишемического генеза [10]. Результаты этих исследований указывают на участие клеточного иммунного ответа к антигенам ЦНС, развивающегося после инсульта. Повышение титров антител к мозговым антигенам, включая нейрофиламенты и N-метил-D-аспартат-рецептор в остром периоде инсульта, указывает также на развитие формирования гуморального иммунитета к этим антигенам [3]. Несмотря на активное изучение персистенции антигенов ЦНС после инсульта, остается пока неясным, является ли их наличие косвенным результатом повреждения гематоэнцефалического барьера и какое клиническое значение они имеют для прогноза заболевания. Вышеприведенные данные относительно изучения нервных и иммунных механизмов были получены на моделях острого периода церебральной ишемии. Клинических исследований, посвященных изучению нейроиммунных взаимодействий в отдаленные сроки после инсульта, ранее не проводилось.
Цель исследования: изучить состояние нейроиммунной активации по плазменному содержанию уровней медиаторов симпатической нервной системы, трансформирующего фактора роста b1 и сывороточных цитокинов у больных с эссенциальной артериальной гипертензией, перенесших ишемический инсульт.
Материалы и методы
Обследовано 90 больных (61 мужчина, 29 женщин) с диагнозом «гипертоническая болезнь ІІІ стадии (ГБ), последствия перенесенного ишемического инсульта», перенесших ИИ давностью более 12 месяцев различной локализации: в 34 случаях — в стволе головного мозга, у 29 пациентов — в правом полушарии, в 27 случаях — в левом полушарии. Средний возраст пациентов составил 62,0 ± 3,7 года. Критерии включения больных в исследование: установленный диагноз ГБ ІІІ стадии, наличие перенесенного ишемического инсульта давностью более 1 года, возраст больных старше 18 лет, синусовый ритм сердца, согласие на участие в исследовании. Критерии исключения: наличие симптоматических артериальных гипертензий, тяжелая сердечная недостаточность, сахарный диабет, острый коронарный синдром в анамнезе давностью менее 6 месяцев, фракция выброса левого желудочка < 45 %, тяжелая почечная и печеночная недостаточность, аутоиммунные заболевания, наличие любых воспалительных процессов на момент включения, органическая неврологическая патология, кроме перенесенного ишемического инсульта.
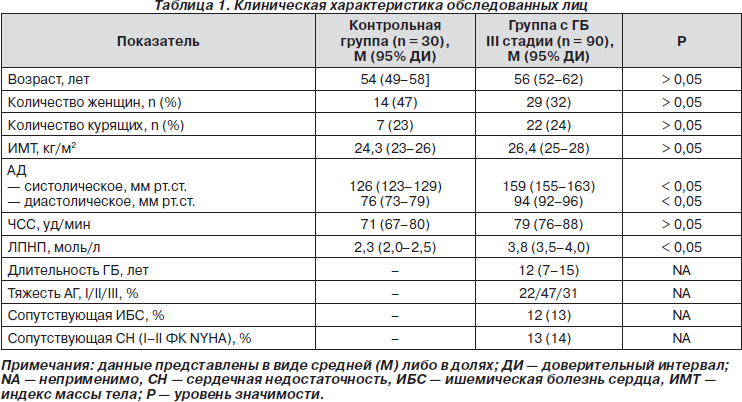
Контрольную группу составили 30 клинически здоровых лиц (16 мужчин, 14 женщин) в возрасте 54,0 ± 3,7 года, не имеющих в анамнезе артериальной гипертензии и цереброваскулярных заболеваний. Всем пациентам и волонтерам было проведено общеклиническое обследование c определением клинического уровня АД, частоты сердечных сокращений (ЧСС), индекса массы тела (ИМТ), уровня липопротеидов низкой плотности (ЛПНП). Клиническая характеристика обследованных лиц представлена в табл. 1, из которой видно, что по полу, возрасту, частоте курения и массе тела группы обследуемых были сопоставимы.
Уровни изучаемых показателей определяли иммуноферментным методом (ИФА) на базе центральной научно-исследовательской лаборатории ЗГМУ (заведующий — д.м.н., проф. А.В. Абрамов) [2]. Уровень норадреналина в плазме крови определяли с помощью наборов IBL (Германия) и Peninsula (Великобритания) — для определения NPY. Концентрацию ТРФ-b1 в плазме крови определяли с помощью наборов DRG (Германия). Содержание ИЛ-4, ИЛ-6, ИЛ-10 и гамма-ИФН в сыворотке крови осуществляли методом ИФА с помощью наборов закрытого акционерного общества «Вектор-Бест» (Россия). Образцы крови для ИФА брали из локтевой вены, контрлатеральной той руке, где измерялось АД, утром натощак, до приема медикаментов, в состоянии покоя. На момент проведения исследования все обследованные лица либо не получали постоянной антигипертензивной терапии, либо она была отменена за 48 часов до включения больных в исследование. Плазму (либо сыворотку) отделяли методом центрифугирования незамедлительно и замораживали при температуре –70 °С до момента проведения анализа. Уровень NPY определяли после экстракции медиатора из плазмы с помощью картриджей SEP-COLUMN, содержащих 200 мг сорбента С18 (Peninsula).
Полученные результаты представляли в виде средней (M) и стандартной ошибки среднего (m), или 95% доверительного интервала (ДИ). Внутри- и межгрупповые различия оценивали с помощью двухвыборочного Т-теста или c2-теста в зависимости от вида данных в рамках программы StatPlus, 2009. Статистически достоверными считали различия между показателями при отклонении нулевой гипотезы и уровне значимости p < 0,05.
Результаты и их обсуждение
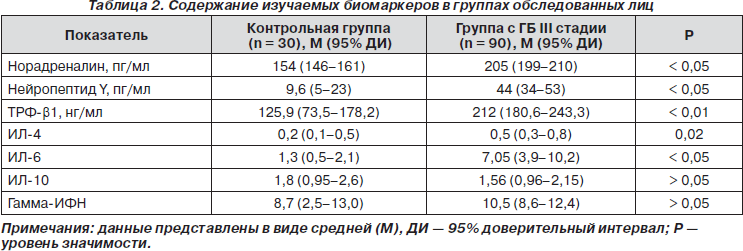
Анализ полученных данных показал, что большинство изучаемых показателей нейроиммунной активации у пациентов, перенесших ИИ, значительно отличались от таковых в контрольной группе (табл. 2). Значительно повышенными в основной группе наблюдения оказались уровни норадреналина, нейропептида Y, ТРФ-b1, ИЛ-4, ИЛ-6. Содержание гамма-ИФН и ИЛ-10 было сопоставимо с аналогичным показателем в контрольной группе.
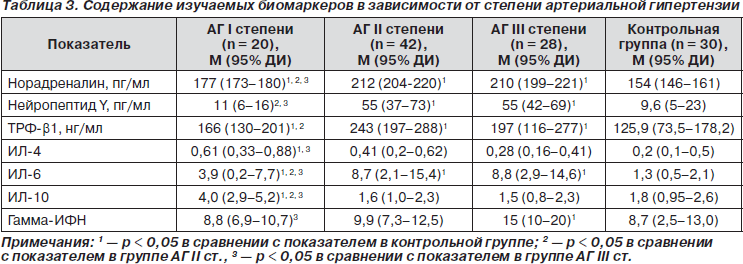
Для изучения влияния основного фактора риска инсульта — АГ — был произведен анализ изучаемых показателей в зависимости от уровня повышения АД (табл. 3).
В результате анализа полученных данных оказалось, что содержание как медиаторов СНС, так и сывороточных цитокинов значительно варьирует в зависимости от степени АГ. У пациентов с уровнем АГ І степени (140–159/90–99 мм рт.ст.) в сравнении с контрольной группой был достоверно выше уровень норадреналина, ТРФ-b1, ИЛ-4, ИЛ-6 и ИЛ-10. В группе больных с уровнем АГ ІІ степени (160–179/100–109 мм рт.ст.) было отмечено статистически достоверное повышение уровней норадреналина, нейропептида Y, ТРФ-b1 и ИЛ-6 в сравнении с аналогичными показателями в контрольной группе.
Пациенты с АГ ІІІ стадии, с уровнем АД свыше 180/110 мм рт.ст. характеризовались достоверным увеличением содержания норадреналина, нейропептида Y, ТРФ-b1, ИЛ-6 и гамма-ИФН.
Среди всех пациентов, перенесших ИИ, наивысшие концентрации норадреналина, нейропептида Y, ТРФ-b1 и ИЛ-6 отмечались у лиц с АГ ІІ и ІІІ степени. Максимальные сывороточные уровни ИЛ-4 и ИЛ-10 были выявлены у больных с АГ І степени. А уровень гамма-ИФН оказался наиболее высоким у пациентов с тяжелой АГ.
Таким образом, полученные в работе данные указывают на несомненную роль нейроиммунной активации в патогенезе артериальной гипертензии у пациентов, перенесших инсульт. Впервые выявленная прогредиентная тенденция к повышению уровней симпатических медиаторов — норадреналина и нейропептида Y, от меньшей степени АГ к большей, отражает механизм прогрессирования гипертонической болезни у постинсультных пациентов с гиперсимпатикотонией, которая у данной категории больных не только вызывает явления системного ангиоспазма, но и является предиктором кардиальных аритмогенных осложнений. Обращает на себя внимание то, что при АГ І степени уровень нейропептида Y, одного из наиболее мощных вазоконстрикторов, был сопоставим с показателем в контрольной группе, в то время как при умеренной и тяжелой АГ было отмечено пятикратное увеличение концентрации пептида. Известно, что уровень АД является важнейшей составляющей при расчете индивидуального кардиоваскулярного риска. Возможно, уровень нейропептида Y, как чувствительный маркер активности СНС, сможет рассматриваться в качестве прогностического критерия прогрессирования АГ.
Неоднозначные данные, выявленные относительно уровней сывороточных цитокинов у пациентов с АГ, перенесших ИИ, отражают гетерогенность и комплексность патогенеза при данном патологическом состоянии. Если рассматривать группу больных в целом (табл. 2), то можно сделать вывод о преобладании Th-2 (антивоспалительного) иммунного ответа с увеличением секреции ИЛ-4 в сочетании с повышением титров ИЛ-6 и ТРФ-b1, что свидетельствует о дисбалансе секреции цитокинов и, возможно, с развитием аутоиммунного процесса.
При распределении группы пациентов по степеням АГ оказалось, что у пациентов с «мягкой» АГ преобладало сочетание Th-2 и Th-рег иммунного ответов. Можно предположить, что такая иммунологическая реактивность является наиболее благоприятной, так как ранее было выявлено нейропротективное влияние антивоспалительных цитокинов, в большей степени ИЛ-10, на клинические исходы инсульта [13]. В то же время повышенное содержание антивоспалительных цитокинов является предвестником ослабления иммунитета перед бактериальной инфекцией [9]. У больных с умеренной АГ доминировало повышение содержания ИЛ-6 и ТРФ-b1, способного увеличиваться при аутоиммунном ответе.
При тяжелой АГ ІІІ степени наблюдалась гиперсекреция цитотоксического гамма-ИФН, являющегося признаком цитотоксического Th1-иммунного ответа, в сочетании с провоспалительным (аутоиммунным?) Th-17-типом иммунного ответа (повышение уровней ИЛ-6 и ТРФ-b1). Очевидно, что данная комбинация иммунологической реактивности является наиболее опасной для развития активных воспалительных процессов и аутоиммунных реакций.
Таким образом, наибольший дисбаланс в содержании нервных и иммунных биомаркеров наблюдается у пациентов, перенесших инсульт, в сочетании с артериальной гипертензией III степени. Поэтому АГ необходимо рассматривать как независимый ведущий фактор риска развития цереброваскулярных катастроф.
Выводы
1. Для больных с артериальной гипертензией, перенесших ишемический инсульт, характерны выраженные процессы нейроиммунной активации, проявляющиеся прогрессирующей гиперсимпатикотонией и дисбалансом иммунных реакций.
2. Иммуновоспалительный ответ наиболее выражен у постинсультных пациентов с тяжелой артериальной гипертензией, что проявляется гиперсекрецией гамма-интерферона и интерлейкина-6.
1. Структура факторів ризику мозкового інсульту в деяких регіонах України за даними регістру інсульту / Т.С. Міщенко, Л.А. Лапшина, І.В. Реміняк [та інші] // Мат-ли III Національного конгресу неврологів, психіатрів та наркологів України. — Харків, 2007. — С. 87.
2. Хаитов Р.М. Иммунология. — M.: Медицина, 2000. — 432 с.
3. Antibodies to brain antigens following stroke / N.M. Bornstein, B. Aronovich, A.D. Korczyn [et al.] // Neurology. — 2001. — Vol. 56. — P. 529-530.
4. Autonomic neural control of dynamic cerebral autoregulation in humans / R. Zhang, J.H. Zuckerman, K. Iwasaki [et al.] // Circulation. — 2002. — Vol. 106. — P. 1814-1820.
5. Brain antigens in functionally distinct antigen-presenting cell populations in cervical lymph nodes in MS and EAE / M. van Zwam, R. Huizinga, M.J. Melief [et al.] // J. Mol. Med. — 2009. — Vol. 87. — P. 273-286.
6. CNS Immune Responses Following Experimental Stroke / D. Zierath, M. Thullbery, J. Hadwin // Neurocritical. Care. — 2011. — Vol. 14. — Р. 274-284.
7. Hamel E. Perivascular nerves and the regulation of cerebrovascular tone // J. Appl. Physiol. — 2006. — Vol. 100. — P. 1059-1064.
8. Infarct volume is a major determiner of post-stroke immune cell function and susceptibility to infection / A. Hug, A. Dalpke, N. Wieczorek [et al.] // Stroke. — 2009. — Vol. 40. — P. 3226-3232.
9. Interleukin 10, monocytes and increased risk of early infection in ischaemic stroke / Б. Chamorro, S. Amaro, M. Vargas [et al.] // J. Neurol. Neurosurg. Psychiatry. — 2006. — Vol. 77. — P. 1279-1281.
10. Myelin antigen reactive t cells in cerebrovascular diseases / W.Z. Wang, T. Olsson, V. Kostulas [et al.] // Clin. Exp. Immunol. — 1992. — Vol. 88. — P. 157-162.
11. Peak plasma interleukin-6 and other peripheral markers of inflammation in the first week of ischaemic stroke correlate with brain infarct volume, stroke severity and long-term outcome / C.J. Smith, H.C. Emsley, C.M. Gavin [et al.] // BMC Neurol. — 2004. — Vol. 4. — P. 223-228.
12. Peck A., Mellins E.D. Precarious balance: Th17 cells in host defense / Peck A. // Infect. Immun. — 2010. — Vol. 78. — P. 32-38.
13. Postischemic gene transfer of IL-10 protects against focal ischemia / H. Ooboshi, S. Ibayashi, T. Kitazono [et al.] // Stroke. — 2002. — Vol. 33. — P. 346.
14. Trends in Incidence, Lifetime Risk, Severity, and 30-Day Mortality of Stroke Over the Past 50 Years / R. Carandang, S. Seshadri, A. Beiser [et al.] // JAMA. — 2006. — Vol. 296 (24). — P. 2939-2946.