Международный неврологический журнал 8 (46) 2011
Вернуться к номеру
Нарушения перекисного окисления липидов и антиоксидантной защиты при поражении центральной нервной системы у больных анкилозирующим спондилитом
Авторы: Антонова Л.Н., Синяченко О.В., Статинова Е.А., Тов И.В., Донецкий национальный медицинский университет имени М. Горького
Рубрики: Неврология
Версия для печати
Преходящие нарушения мозгового кровообращения у больных анкилозирующим спондилитом влияют на интегральное состояние процессов перекисного окисления липидов и антиоксидантной защиты, причем развитие и тяжесть патологии центральной нервной системы сопровождаются уменьшением активности прооксидантной ксантиноксидазы и компенсаторным повышением содержания в волосах антиоксидантного селена. С разными звеньями перекисного окисления липидов и антиоксидантной защиты связаны патогенетические построения при дисциркуляторной энцефалопатии, кортиконуклеарном синдроме, расстройствах мозгового кровообращения, корковой атаксии.
Анкилозирующий спондилит, нервная система, пероксидация.
Введение
Разнообразная симптоматика со стороны центральной нервной системы (ЦНС) является неотъемлемой частью широкого спектра клинических проявлений анкилозирующего спондилита (АС), которая констатируется у каждого четвертого-пятого больного [6, 7]. Необходимо отметить, что патогенез поражения ЦНС при АС изучен недостаточно [16].
Как известно, головной мозг человека очень подвержен процессам пероксидации, которые в первую очередь связывают с угнетением содержания в тканях антиоксиданта глутатиона [4], усилением активности капсазы-3 и увеличением уровня перекиси водорода [5], а также конечного продукта системы оксида азота пероксинитрита [3]. В эксперименте на мышах показано, что супероксиддисмутаза (СОД) и каталаза обладают мощным нейропротекторным действием [17], что также свойственно антиоксидантным гормонам мелатонину, синтесизеду и эдаравону, особенно в отношении гипоксии головного мозга, эндотелиальной дисфункции его сосудов и апоптоза клеток ЦНС [10]. В целом оксидативный стресс относится к главным повреждающим факторам в отношении ЦНС [8].
В свою очередь, АС протекает с усилением процессов перекисного окисления липидов (ПОЛ) [9] и нарушениями системы антиоксидантной защиты (АОЗ) в виде уменьшенного содержания в крови глутатиона, активностей СОД, каталазы и глутатионпероксидазы (ГПО) [13, 15]. АС свойственно повышение сывороточной концентрации ферритина [12], обладающего, кстати, отчетливым нейротоксичным действием [11]. Роль нарушений ПОЛ и АОЗ в патогенетических построениях поражения разных вариантов ЦНС у больных АС не изучена. Это и стало целью данного исследования.
Материал и методы
Под наблюдением находились 98 больных АС в возрасте от 17 до 66 лет (в среднем 38,0 ± 1,1 года), среди которых было 7 % женщин и 93 % мужчин. При постановке диагноза АС мы пользовались Нью-Йоркскими критериями, рекомендованными для клинической практики в 2004 году Украинской ассоциацией ревматологов. Длительность заболевания составила в среднем 12,0 ± 0,8 года. I степень активности патологического процесса констатирована у 27 % от числа обследованных пациентов, ІІ — у 32 %, ІІІ — у 41 %.
У 97 % больных диагностировано поражение позвоночника (остеохондроз, спондилоартроз), причем из них шейного отдела — у 64 %, грудного — у 72 %, поясничного — у 85 %. В 13 % наблюдений имели место энтезопатии, в 18 % — тендовагиниты, в 17 % — поражение глаз в виде увеита, в 61 % — сердца (кардиосклероз, аортит, изменения клапанов и перикарда), в 13 % — легких (интерстициальный фиброз) и плевры, в 40 % — почек (гломерулонефрит, интерстициальный нефрит, амилоидоз), в 34 % — периферической нервной системы (моно- или полинейропатия, радикулопатия, цервикокраниалгия, синдромы метакарпального канала и канала Гуйона, мортоновская метатарзалгия). 73 пациента (3/4 от общего числа) с поражением ЦНС (дисциркуляторная энцефалопатия, астеновегетативный, кортиконуклеарный, псевдобульбарный, пирамидный, эпилептиформный синдромы, мозжечковая и корковая атаксия, преходящее нарушение мозгового кровообращения) включены в основную группу обследованных, а остальные составили контрольную.
Больным выполняли электрокардиографию (аппараты МІДАК-ЕК1Т, Украина, и Fukuda Denshi Cardimax-FX326, Япония), эхокардиографию (Acuson-Aspen-Siemens, Германия), постоянно-волновую допплерографию экстракраниальных сосудов (Aplia-XG-Toshiba, Япония), рентгенографию грудной клетки, периферических суставов, крестцово-подвздошных сочленений и позвоночника (Multix-Compact-Siеmens, Германия), сонографию суставов и внутренних органов (Envisor-Philips, Нидерланды), электроэнцефалографию (EEG-8S-Medicor, Венгрия, и «ДХ-4000», Украина). Части обследованных больных проведена компьютерная (Somazom-Emotion-6 Siemens, Германия) и магнитно-резонансная (Gygoscan-Intera-Philips, Нидерланды) томография головного мозга.
Используя биохимические анализаторы BS-200 (Китай) и Olympus-AU-640 (Япония), в сыворотке крови изучали показатели ферритина и церулоплазмина (ЦП). Параметры диеновых конъюгат (ДК), малонового диальдегида (МД), a-токоферола (ТФ), активностей ксантиноксидазы (КО), СОД и каталазы исследовали спектрофотометрически («СФ-46», Россия), а активность ГПО в гепаринизированной крови — колориметрическим методом с использованием наборов Ransel-Randox (Великобритания). С помощью метода атомно-абсорбционной спектрометрии с электрографитовым атомизатором (аппарат SolAAr Mk2 MOZe, Великобритания) в волосах исследовали содержание антиоксидантного микроэлемента селена (Se). Изучение концентрации Se в волосах выполнено в Донецком центре «Биотическая медицина», биохимические методы исследования — в ЦНИЛ Донецкого национального медицинского университета им. М. Горького и лабораторном отделении Донецкого областного клинического территориального медицинского объединения.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (лицензионные программы Microsoft Excel и Statistica-StatSoft, США). Оценивали средние значения (M), их ошибки (m), коэффициенты корреляции, критерии дисперсии (D), регрессии (R), Стьюдента (t), Уилкоксона — Рао и достоверность статистических показателей (р).
Результаты
По данным однофакторного дисперсионного анализа возраст больных АС оказывает достоверное влияние на содержание в сыворотке крови ферритина (p = 0,037) и каталазы (p = 0,005), а степень активности патологического процесса — на уровень КО (p < 0,001). Согласно увеличению степени активности патологического процесса нарастает в сыворотке активность прооксидантной КО (p < 0,001). По нашему мнению, активность в крови КО > 6 мкмоль/л/мин (> M + 4m больных) указывает на высокую степень активности АС. Как свидетельствует многофакторный дисперсионный анализ, на интегральное состояние ПОЛ и АОЗ у больных АС влияет поражение локтевых (p = 0,049) и голеностопных (p = 0,036) суставов, вовлечение в процесс шейного (p = 0,044) и грудного (p = 0,042) отделов позвоночника, сердца (p = 0,006) и легких (p = 0,009). Тазобедренные суставы определяют уровень ДК (p = 0,007), плечевых — МД (p = 0,044), голеностопных и коленных — активность СОД (соответственно p = 0,042 и p = 0,004), шейного и поясничного отделов позвоночника — активность каталазы (p = 0,038 и p = 0,010), на что указывает ANOVA.
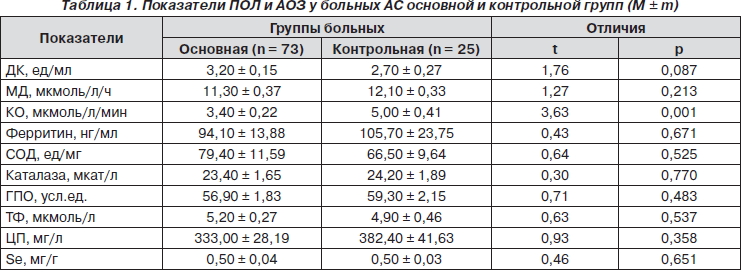
Показатели ПОЛ и АОЗ у больных АС основной и контрольной групп нашли свое отражение в табл. 1. По данным ANOVA/MANOVA, имеет место достоверное влияние на интегральное состояние ПОЛ и АОЗ тяжести поражения ЦНС (p = 0,001), хотя, как свидетельствует однофакторный дисперсионный анализ, в большей степени на это реагирует только активность КО (p = 0,008). В свою очередь, на тяжесть церебральной патологии при АС воздействуют уровни в крови сывороточной КО (p = 0,004) и в волосах Se (p = 0,037).
Как в основной, так и в контрольной группах больных АС установлена обратная корреляционная связь между содержанием ферритина в крови и активностью каталазы (соответственно p = 0,012 и p = 0,020). У пациентов без изменений ЦНС констатируется также отрицательная корреляция показателей ТФ с активностью КО (p = 0,007) и уровнем ферритина (p = 0,022), прямая — между активностью ГПО и параметрами Se в волосах (p = 0,008). У больных с поражением ЦНС показатели ГПО обратно коррелируют с содержанием МД (p = 0,024) и ферритина (p = 0,040), а прямо — с активностью СОД (p = 0,039), ТФ — с уровнями ДК (p = 0,037) и МД (p = 0,007), Se — позитивно с МД (p = 0,001), СОД (p = 0,013) и ТФ (p < 0,001), ДК — с МД (p = 0,036). Наличие кардиопатии у больных АС определяет концентрацию в крови ДК (p = 0,049), пневмопатии — МД (p = 0,012) и активность ГПО (p = 0,002), нефропатии — ферритин (p = 0,003) и КО (p = 0,005), субхондральный суставной склероз — ДК (p = 0,036), эпифизарный остеопороз и артикулярные кальцинаты — активность ГПО (соответственно p = 0,004 и p = 0,002).
Обсуждение результатов
КО участвует в образовании продуктов ПОЛ супер-оксида и пероксинитритов, способных повреждать нуклеиновые кислоты, белковые молекулы клеточных мембран и потенцировать процессы апоптоза [14]. Повышение активности прооксидантной КО сопровождается генерацией супероксидных радикалов. Возникающая повышенная проницаемость мембран у больных АС способствует выходу из клеток протеаз, которые, опять-таки, активируют КО и увеличивают продукцию кислородных радикалов. Образующиеся пероксидазы липидов в головном мозге могут стимулировать синтез простагландинов, калликреиновую систему и высвобождение гистамина из тучных клеток. Нужно подчеркнуть, что контрольная группа больных без изменений ЦНС отличается от основной только более высокой активностью КО. Гиперактивность КО определяют в тканях головного мозга [1], а ее индуктором являются молибдаты. Суточная потребность организма человека в молибдене (стимулятор КО), необходимая для физиологической активности данного фермента, составляет примерно 1–2 мг. Менее значительными активаторами КО считаются антиоксиданты аскорбиновая кислота и глутатион.
Согласно увеличению степени тяжести поражения ЦНС уменьшается активность КО и нарастает содержание Se. Так, при минимальной выраженности церебральной патологии показатели КО и Se соответственно составляют 3,70 ± 0,36 мкмоль/л/мин и 0,40 ± 0,04 мг/г, при умеренной — 3,20 ± 0,26 мкмоль/л/мин и 0,50 ± 0,06 мг/г, при значительной — 2,90 ± 0,12 мкмоль/л/мин и 0,70 ± 0,12 мг/г. Достоверность отличий касается концентрации Se у больных с незначительной и выраженной степенью тяжести поражения ЦНС (p = 0,014). Мы считаем, что параметры активности в сыворотке КО < 3 мкмоль/л/мин (< M – 4m больных с поражением ЦНС) и в волосах Se > 700 мкг/г (> M + 4m) являются прогнознегативными в отношении церебральной патологии у больных АС. Не исключается, что указанная динамика показателей КО и Se является компенсаторной в сложных патогенетических построениях патологии ЦНС при АС.
На интегральный уровень продуктов ПОЛ и АОЗ, по данным многофакторного дисперсионного анализа, оказывает влияние преходящее нарушение мозгового кровообращения (p = 0,011), но не наличие дисциркуляторной энцефалопатии, астеновегетативного, кортиконуклеарного, псевдобульбарного, пирамидного, эпилептиформного синдромов, атаксии мозжечкового генеза и корковой атаксии. ANOVA свидетельствует о влиянии нарушения мозгового кровообращения на активность ГПО (p = 0,038).
Мы проанализировали патогенетическую значимость нарушений процессов ПОЛ и АОЗ при изменениях ЦНС. Оказалось, что активность КО участвует в развитии дисциркуляторной энцефалопатии (p = 0,012) и астеновегетативного синдрома (p = 0,021), ДК — корковой атаксии (p = 0,003), а нарушение мозгового кровообращения определяют ферритин (p = 0,001) и ГПО (p = 0,016).
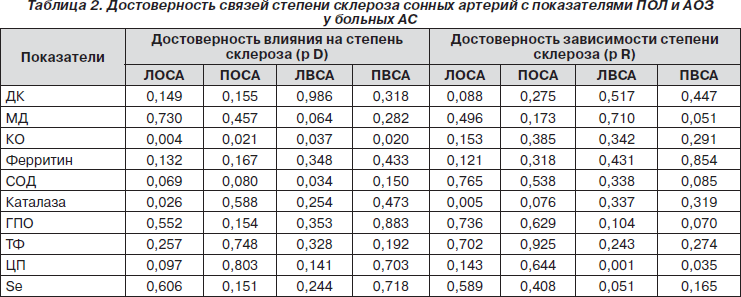
Как видно из табл. 2, активность КО влияет на степень склероза левой общей сонной артерии (ЛОСА), правой общей сонной артерии (ПОСА), левой внутренней сонной артерии (ЛВСА) и правой внутренней сонной артерии (ПВСА), СОД — только ЛВСА, каталазы — лишь ЛОСА. Обнаружена обратная регрессионная зависимость сужения ЛОСА от каталазы, ЛВСА и ПВСА — от показателей в крови ЦП.
В группе больных с поражением ЦНС установлена прямая корреляционная связь показателей среднего артериального давления с параметрами в крови ферритина (p = 0,004) и каталазы (p = 0,011), общего периферического сосудистого сопротивления — с ГПО (p = 0,012), ЦП (p = 0,034) и уровнем Se в волосах (p = 0,007), значений эндотелийнезависимой вазодилатации — с содержанием ТФ (обратная корреляция, p = 0,037). В контрольной группе из всех факторов сосудистой реактивности только с параметрами среднего артериального давления позитивно соотносится концентрация в крови ферритина (p = 0,030).
Больные с отдельными вариантами нейропатии и без таковых отличаются между собой по уровням ДК, активности КО и ГПО. Так, при корковой атаксии содержание ДК в крови составляет 3,80 ± 0,26 мкмоль/л/ч, тогда как у остальных пациентов — 2,80 ± 0,13 мкмоль/л/ч (p = 0,003), при дисциркуляторной энцефалопатии и астеновегетативном синдроме активность КО составляет 3,30 ± 0,25 мкмоль/л/мин и 3,20 ± 0,28 мкмоль/л/мин, а без такой патологии — 4,40 ± 0,25 мкмоль/л/мин (p = 0,012) и 4,40 ± 0,33 мкмоль/л/мин (p = 0,021), активность ГПО в случаях кортиконуклеарного синдрома и его отсутствия — соответственно 52,10 ± 3,79 усл.ед. и 59,10 ± 1,45 усл.ед. (p = 0,045).
Для церебральной патологии у больных АС характерен как неферментативный (аскорбатзависимый) вид ПОЛ, так ферментативный (НАДФ-зависимый), который, как известно, локализован только в мембранах эндоплазматического ретикулума клеток [2]. На наш взгляд, при патологии ЦНС в клетках головного мозга может нарушаться гидрофобность фосфолипидного биослоя в результате появления более гидрофильных гидроперекисей липидов, образующихся вследствие свободнорадикального окисления, повышаться пассивное проникновение фосфолипидного биослоя для ионов благодаря образованию перекисных кластеров (полярных каналов), изменяться физико-химические свойства фосфолипидного биослоя, окисливаться сульфгидрильные группы белков с нарушениями структуры и функции ферментов, а в результате вторичных продуктов ПОЛ (например, МД), образовываться поперечные сшивания с аминогруппами белков, завершаясь необратимой полимеризацией и агрегацией белковых молекул. Каталаза при изменениях сосудистой реактивности у больных АС с поражением ЦНС может разрушать перекись водорода, а встроенный в мембраны клеток сосудов ТФ — обеспечивать защиту от гидроксильного и жирнокислотных радикалов. Обращает на себя внимание факт, что в случаях корковой атаксии возрастают в крови только ДК как начальные продукты ПОЛ, тогда как уровень более позднего МД не изменяется.
Выводы
1. Преходящие нарушения мозгового кровообращения у больных АС влияют на интегральное состояние процессов ПОЛ и АОЗ, а также на активность антиоксидантной ГПО.
2. Развитие и тяжесть патологии ЦНС при АС сопровождаются уменьшением активности прооксидантной КО и компенсаторным повышением содержания в волосах антиоксидантного Se.
3. Патогенетические построения при дисциркуляторной энцефалопатии и астеновегетативном синдроме у больных АС связаны с КО, кортиконуклеарный синдром и расстройства мозгового кровообращения — с ГПО, корковая атаксия — с ДК, степень склероза разных ветвей сонных артерий — с КО, СОД и каталазой, изменения сосудистой реактивности — с ферритином, каталазой, ГПО, ТФ, ЦП и Se.
4. В перспективе для прогнозирования течения поражений ЦНС при АС и контроля за эффективностью лечебных мероприятий у такой категории больных можно использовать параметры в крови КО и в волосах Se.
1. Сумбаев В.В. Ксантиноксидаза как компонент системы генерирования активных форм кислорода / В.В. Сумбаев, Ф.Я. Розанов // Совр. пробл. токсикол. — 2010. — № 3. — С. 16-22.
2. Турсунова Ю.Д. Клінічне значення дослідження перекисного окислення ліпідів / Ю.Д. Турсунова, Б.Г. Борзенко, О.М. Бакурова // Арх. клінічн. експерим. мед. — 2009. — Т. 18, № 1. — С. 107-110.
3. Allen B.W. Two faces of nitric oxide: implications for cellular mechanisms of oxygen toxicity / B.W. Allen, I.T. Demchenko, C.A. Piantadosi // J. Appl. Physiol. — 2009. — Vol. 106, № 2. — P. 662-667.
4. Aoyama K. Regulation of neuronal glutathione synthesis / K. Aoyama, M. Watabe, T. Nakaki // J. Pharmacol. Sci. — 2008. — Vol. 108, № 3. — P. 227-238.
5. Carvour M. Chronic low-dose oxidative stress induces caspase-3-dependent PKCdelta proteolytic activation and apoptosis in a cell culture model of dopaminergic neurodegeneration / M. Carvour, C. Song, S. Kaul, V. Anantharam // Ann. NY Acad. Sci. — 2008. — Vol. 1139. — P. 197-205.
6. Dinichert A. Lumboperitoneal shunt for treatment of dural ectasia in ankylosing spondylitis / A. Dinichert, J.F. Cornelius, G. Lot // J. Clin. Neurosci. — 2008. — Vol. 15, № 10. — P. 1179-1182.
7. Duzova A. Central nervous system involvement in pediatric rheumatic diseases: current concepts in treatment / A. Duzova, A. Bakkaloglu // Curr. Pharm. Des. — 2008. — Vol. 14, № 13. — P. 1295-1301.
8. Hayashi M. Oxidative stress in developmental brain disorders / M. Hayashi // Neuropathology. — 2009. — Vol. 29, № 1. — P. 1-8.
9. Karakoc M. Serum oxidative-antioxidative status in patients with ankylosing spondilitis / M. Karakoc, O. Altindag, H. Keles, N. Soran // Rheumatol. Int. — 2007. — Vol. 27, № 12. — P. 1131-1134.
10. Kaur C. Antioxidants and neuroprotection in the adult and developing central nervous system / C. Kaur, E.A. Ling // Curr. Med. Chem. — 2008. — Vol. 15, № 29. — P. 3068-3080.
11. Koeppen A.H. The pathology of superficial siderosis of the central nervous system / A.H. Koeppen, S.C. Michael, D. Li, Z. Chen // Acta Neuropathol. — 2008. — Vol. 116, № 4. — P. 371-382.
12. Rovetta G. Prevalence of C282Y mutation in patients with rheumatoid arthritis and spondylarthritis / G. Rovetta, M.C. Grignolo, L. Buffrini, P. Monteforte // Int. J. Tissue React. — 2002. — Vol. 24, № 3. — P. 105-109.
13. Tynez I. The effect of infliximab on oxidative stress in chronic inflammatory joint disease / I. Tynez, M. Feijyіo, G. Huerta, P. Montilla // Curr. Med. Res. Opin. — 2007. — Vol. 23, № 6. — P. 1259-1267.
14. Wyndham M. Gout / M. Wyndham // Practitioner. — 2008. — Vol. 242, № 1588. — P. 546-547.
15. Yen J.H. Cytochrome P450 1A1 and manganese superoxide dismutase genes polymorphisms in ankylosing spondylitis / J.H. Yen, W.C. Tsai, C.J. Chen., C.H. Lin // Immunol. Lett. — 2005. — Vol. 88, № 2. — P. 113-116.
16. Zhang Y. Animal models of inflammatory spinal and sacroiliac joint diseases / Y. Zhang // Rheum. Dis. Clin. North Am. — 2009. — Vol. 29, № 3. — P. 631-645.
17. Zhou M. EUK-207, a superoxide dismutase/catalase mimetic, is neuroprotective against oxygen/glucose deprivation-induced neuronal death in cultured hippocampal slices / M. Zhou, M. Baudry // Brain. Res. — 2009. — Vol. 9, № 1247. — P. 28-37.