Международный неврологический журнал 4(4) 2005
Вернуться к номеру
Исследование влияния мексидола на функциональное состояние ЦНС у больных с ишемическим инсультом
Авторы: Т.В. Островая, В.И. Черний, Г.А. Городник, И.А. Андронова, Донецкий государственный медицинский университет им. М. Горького, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
В работе представлен анализ эффективности применения мексидола в острейшем периоде нарушения мозгового кровообращения различной этиологии. Обследовано 116 пациентов в возрасте от 30 до 72 лет, находящихся на лечении в нейрореанимационном центре ДОКТМО с диагнозом «острое нарушение мозгового кровообращения» (ишемический инсульт — 78 человек, геморрагический инсульт — 38 человек). Для оценки функции ЦНС проводили клиническое неврологическое обследование и электроэнцефалографию. Характер цереброваскулярного кровотока исследовали с помощью УЗДГ. В результате проведенного исследования можно заключить, что применение мексидола высокоэффективно в лечении мозгового инсульта и уменьшает инвалидизацию после перенесенного инсульта.
мозговой инсульт, интегральный количественный анализ ЭЭГ, УЗДГ, мексидол.
Актуальность
По данным Всемирной организации здравоохранения (ВОЗ), инсульт занимает третье место, после болезней сердца и онкологических заболеваний, среди причин смерти взрослого населения планеты. В отдельные годы смертность от инсульта превышает смертность от инфаркта миокарда. Особенно высок риск развития инсульта у пациентов, достигших 55-летнего возраста. С каждым последующим десятилетием вероятность развития инсульта возрастает почти в 2 раза. В течение первого месяца после развития ишемического инсульта смертность от него составляет 8-20%, тогда как при субарахноидальном кровоизлиянии и геморрагическом инсульте она достигает 50%. При этом около 30% пациентов погибают непосредственно от субарахноидального кровоизлияния, еще столько же — в последующие три месяца в результате рецидива [3]. Высока и степень инвалидизации больных, перенесших инсульт: лишь 20% из них возвращаются к труду, 60% остаются инвалидами и 20% нуждаются в постороннем уходе [11]. Кроме того, после перенесенного ишемического инсульта сохраняется достаточно высокая вероятность его повторения, особенно в течение первого года (около 10%). С каждым последующим годом жизни риск повторного инсульта возрастает на 5-8% [1, 3].
Известно, что существует достаточно четкая временная последовательность патофизиологических механизмов и биохимических реакций, которые «включаются» при острой локальной ишемии головного мозга. В течение первых 3 часов достигает максимума энергетический дефицит ткани мозга; в последующие 3 часа — глутаматная эксайтотоксичность, нарушение кальциевого гомеостаза и лактатацидоз [3].
Так называемые отдаленные последствия ишемии, которые начинают формироваться уже в течение первых 3 часов, достигают наивысшего уровня через 12-36 часов (оксидантный стресс и локальное воспаление), или на 2-е — 3-и сутки (апоптоз). Однако именно данные процессы, сохраняющиеся в течение нескольких месяцев, приводят в постинсультном периоде к прогрессированию явлений атерогенеза и диффузного повреждения тканей мозга с формированием энцефалопатии.
Уровень повреждающего действия ишемии зависит от степени и длительности дефицита мозгового кровотока. Необратимо пораженные участки мозга («ядерная» зона ишемии) — области с максимально выраженной олигемией — формируются в течение первых 6-8 минут с момента развития острого нарушения мозгового кровообращения (ОНМК). «Точечный» инфаркт окружен ишемизированной, но живой зоной «ишемической полутени» (или пенумбры) с сохранением энергетического метаболизма. Именно пенумбра является главной точкой приложения терапии инсульта в первые часы и дни заболевания. Продолжительность ее существования индивидуальна, генетически детерминирована для каждого больного и определяет границы терапевтического окна — временного периода, в течение которого с наибольшей эффективностью могут проводиться лечебные мероприятия. Отсроченность необратимых повреждений мозга от момента ОНМК и проявления первой симптоматики заболевания обусловливают необходимость наиболее ранней интенсивной и патогенетически направленной терапии ишемического инсульта (ИИ) — желательно с первого часа заболевания и до 3-5 дней (острейший период инсульта). Адекватная патогенетическая терапия ИИ, следовательно, должна восстанавливать нарушенный кровоток, прерывать быстрые механизмы глутаматной эксайтотоксичности, минимализировать последствия оксидантного стресса и подавлять явления отсроченного локального воспаления. Она включает в себя прежде всего антиоксидантную терапию, торможение местной воспалительной реакции (антагонисты провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга (нейротрофины), нейроиммуномодуляцию (нейропептиды), регуляцию рецепторных структур (ганглиозиды) [3].
Целесообразность использования в раннем периоде острой локальной ишемии мозга «ловушек» свободных радикалов и препаратов, разрушающих перекиси (с сульфидными и тиоловыми группами: унитиола, тиосульфата натрия и т.д.), была доказана еще в 80-е годы прошлого столетия. Тогда же было патогенетически обосновано одновременное с ними применение токоферолов и каротиноидов, связывающих катализаторы и инактивирующих синглетный кислород. Препарат мексидол — соль 2-этил-6-метил-3-оксипиридина, структурного аналога витамина B6, и янтарной кислоты — является антиоксидантом нового поколения. Он ингибирует процессы перекисного окисления липидов, активирует эндогенную антиоксидантную систему супероксиддисмутазы и церулоплазмин, предупреждает снижение активности глутатионзависимых ферментов (глутатионпероксидазы, глутатионредуктазы), в результате чего достоверно уменьшается активность процессов оксидантного стресса. Модулируя активность мембраносвязанных ферментов (кальцийнезависимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, GABA, ацетилхолинового) и усиливая их способность связывания с лигандами, мексидол способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи.
Он обладает способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активировать энергосинтезирующие функции митохондрий [2].
Таким образом, мексидол обладает широким спектром фармакологических эффектов, реализующихся как на нейрональном, так и на сосудистом уровнях.
Учитывая вышеизложенное, мы решили включить мексидол в комплекс лечения мозгового инсульта.
Цель исследования: изучение действия препарата мексидол на реактивность мозга и церебральные гемодинамические параметры у больных в острейшем периоде ишемического инсульта.
Материал и методы
Обследовано 116 пациентов в возрасте от 30 до 72 лет, находящихся на лечении в нейрореанимационном центре ДОКТМО, с диагнозом «острое нарушение мозгового кровообращения» (ОНМК): ишемический инсульт (ИИ) — 78 человек, геморрагический инсульт (ГИ) — 38 человек. В первые сутки с момента развития инсульта поступили 51,7% больных (18,1% в пределах терапевтического окна), на вторые-третьи сутки — 45,7%, в более поздний период — 2,6% больных.
Обследуемые больные были разделены на 2 группы, сопоставимые по полу, возрасту, степени тяжести инсульта и уровню нарушения сознания при поступлении в отделение. Первая группа состояла из 52 пациентов, получавших лечение по протоколу: 35 — с ИИ и 17 — с ГИ.
Вторую группу (64 человека, 43 — с ИИ, 21 — с ГИ) составляли больные, получавшие дополнительно к протоколу мексидол.
Мексидол вводился внутривенно капельно в дозе 200 мг в первые 7 дней от начала заболевания, а затем внутримышечно по 100 мг 3 раза в сутки. Продолжительность лечения составляла 14 суток. В качестве контрольной группы (КГ) использовались результаты обследования 38 неврологически и соматически здоровых добровольцев в возрасте от 30 до 70 лет.
Основной причиной цереброваскулярной патологии у 25 человек (21,6%) явился атеросклероз экстра- и интракраниальных артерий, у 70 человек (60,3%) — артериальная гипертензия, у 20 пациентов (17,2%) — сочетание этих процессов.
Из сопутствующих заболеваний чаще всего встречалась ишемическая болезнь сердца. Она отмечена у 69 человек (59,5%), причем в анамнезе у 24 пациентов (20,7%) имелось указание на перенесенный инфаркт миокарда. Сахарный диабет II типа выявлен у 30 человек (25,9%), стенозирующее поражение периферических артерий отмечалось у 21 пациента (18,1%). Клинические проявления дегенеративных поражений шейного отдела позвоночника (остеохондроз, деформирующий спондилез, дисгормональная спондилопатия), подтвержденные рентгенологически, обнаружены у 36 больных (31%).
В настоящей работе представлены результаты исследования 78 пациентов, перенесших ишемический инсульт с локализацией очага в бассейнах левой внутренней сонной артерии (ОНМК, ИИ БЛВСА (1-я группа — 12 человек, 2-я группа — 16 пациентов)), правой внутренней сонной артерии (ОНМК, ИИ БПВСА (1-я группа — 10 исследуемых, 2-я группа — 14 пациентов)), в вертебробазилярном бассейне (ОНМК, ИИ ВББ (1-я группа — 13 человек, 2-я группа — 13 больных)). Степень дезорганизации ЭЭГ в исследуемых группах несколько отличалась и составила соответственно по классификации Е.А. Жирмунской, В.С. Лосева [4] в 1 и 2-й группах больных при ИИ БПВСА — 15,8 (среднее арифметическое номера группы), ИИ БЛВСА — 16,7, ИИ ВББ — 17,8.
Исследование функционального состояния центральной нервной системы проводили путем клинического неврологического обследования [9], оценки клинических форм расстройств сознания [8], глубины коматозного состояния с помощью шкалы ком Глазго (ШКГ) [7], а степень тяжести инсульта и динамику его течения — по Скандинавской шкале инсультов (укороченный вариант) (СШИ) [1].
Проводилось исследование церебральной гемодинамики методом ультразвуковой допплерографии интракраниальных отделов магистральных артерий головы и шеи, компьютерная томография головного мозга и магнитно-резонансная томография, позволившие выявить стенотические и окклюзионные изменения в сосудах, выделить клинико-анатомические формы церебральной геморрагии или ишемии. Записывалась электроэнцефалограмма [5]. Регистрация биопотенциалов мозга осуществлялась с помощью нейрофизиологического комплекса, состоящего из 8-канального электроэнцефалографа фирмы «Medicor», персонального компьютера IBM PC AT с аналогово-цифровым преобразователем и специальным программным обеспечением для хранения и обработки электроэнцефалограмм.
Протокол записи ЭЭГ включал регистрацию биопотенциалов головного мозга пациентов «в покое» с последующей ахроматической ритмической фотостимуляцией (ФТС) на частотах 2, 5, 9, 20 Гц. Изучались показатели абсолютной мощности (АМ, мкВ/Гц), относительной мощности (%) для δ- (1-4 Гц), θ- (5-7 Гц), α- (8-12 Гц), α1- (9-11 Гц), β1- (13-20 Гц), β2-частотных диапазонов ЭЭГ (20-30 Гц). Параллельно ЭЭГ-паттерны исследовались методом систематизации, классификации и кодирования электроэнцефалограмм человека (классификация Жирмунской, Лосева) [4]. Для объективизации оценки ЭЭГ использован метод интегрального количественного анализа ЭЭГ-паттерна [7,8].
Для исследования церебральных гемодинамических показателей проводили ультразвуковую транскраниальную допплерографию (УЗДГ) [6] аппаратом DWL EZ-Dop V2.1 (Германия). Характер цереброваскулярного кровотока оценивали по амплитудным и спектральным параметрам (линейной скорости кровотока (ЛСК), систолической скорости кровотока (ССК), гемодинамически значимой асимметрии кровотока (АК), уровню циркуляторного сопротивления (ЦС) в бассейнах исследуемых интракраниальных сосудов мозга) [6].
Время достижения максимальной концентрации мексидола в плазме составляет 0,45-0,5 часа, а среднее время удерживания препарата (MRT — Midle Residence Time) — 0,7-1,3 часа. ЭЭГ-исследования и УДЗГ-исследования проводились за 30 минут до введения препарата. Затем внутривенно капельно вводился мексидол в дозе 200 мг, и через 30 минут после введения препарата исследование повторяли. Третье исследование проводили после завершения внутривенного курса лечения.
Все полученные данные обрабатывались с использованием методов математической статистики [10].
Протокол интенсивной терапии для всех клинических форм инсульта включал мероприятия, направленные на регуляцию функции внешнего дыхания, нормализацию функции сердечно-сосудистой системы, коррекцию водно-электролитного баланса и кислотно-основного состояния, лечение отека-набухания головного мозга и профилактику внутричерепной гипертензии и осложнений инсульта.
Протокол лечения ишемического инсульта включал антиагрегантную (трентал, курантил), вазоактивную (кавинтон, инстенон), нейропротекторную (актовегин, ноотропил, аплегин, церебролизин), противоотечную (лазикс, L-лизин эсцинат), ангиопротекторную терапию. Антиоксидантная терапия (мексидол) проводилась только у больных 2-й группы. Препараты включались в комплекс лечения инсульта в определенном сочетании и определенной временной последовательности, а не вводились все одновременно [1, 3].
Результаты и обсуждение
При поступлении в отделение первичная оценка степени нарушения сознания по ШКГ в обеих группах с ИИ БПВСА и ИИ БЛВСА составила 8-11 баллов, а у больных с ИИ ВББ составила 6-8 баллов. Оценка степени неврологического дефицита по СШИ составила в обеих группах с ИИ БПВСА и ИИ БЛВСА 6-12 баллов, а у больных с ИИ ВББ составила 2-8 баллов.
Степень восстановления по СШИ у больных, выживших после ИИ, была следующей: в 1-й группе после лечения по стандартному протоколу выраженное уменьшение неврологического дефицита отмечалось у 36,5% больных, умеренное — у 32,7%, стабильность неврологических нарушений выявлена у 11,5% больных. Во 2-й группе после проведенного лечения выявлено выраженное снижение неврологического дефицита у 48,6% пациентов. Умеренное восстановление отмечается у 31,4% больных, стабильность состояния у 8,6%. Во 2-й группе больных летальность ниже, чем в 1-й группе (соответственно 14,06% и 21,2%).
В обеих группах пациентов при поступлении методом интегральной количественной оценки ЭЭГ-паттернов выявлены следующие показатели дезорганизации ЭЭГ: достоверный рост абсолютной спектр-мощности (АМ) медленноволновых θ- и δ-диапазонов и значительное повышение уровня интегральных коэффициентов (KFC): KFC3 ( δ + θ + β1 / α1 + β2), KFC8 (θ/α1), KFC9 (δ /α), KFC10 (δ/α1), преимущественно на стороне поражения; повышение АМ θ- и α1-волновой активности и рост уровня KFC1 (δ + θ + β1 / α + β2), KFC7 (θ/α) и KFC10 (δ/α1) на стороне поражения; симметричное доминирование δ-волновой АМ при выраженном замещении спектральной мощности α-диапазона и достоверное повышение уровней интегральных коэффициентов KFC1 (δ + θ + β1 /α + β2), KFC11 (δ/θ).
Через 30 минут после внутривенного введения мексидола у пациентов, перенесших инсульт с локализацией ишемического очага в бассейне левой внутренней сонной артерии (ОНМК, ИИ БЛВСА) (табл. 1), выявлены следующие статистически достоверные (p < 0,05) изменения интегральных коэффициентов: рост значений 6 kfc (θ/δ) справа на 26,2% с 0,9 ± 0,09 до 1,22 ± 0,07, слева, на стороне поражения, — на 21,9% с 0,89 ± 0,11 до 1,14 ± 0,11; справа, в интактной гемисфере, уменьшение уровней 3 kfc (δ + θ + β1) / (α1 + β2) на 23,8%, 10 kfc (δ/α1) на 38,6%, 11 kfc (δ/θ) на 30,2% и 14 kfc (α/α1) на 20,6% за счет смещения доминирующей ЭЭГ-мощности в θ- и α-частотные диапазоны; слева, в пораженном полушарии, снижение уровней 9 kfc (δ/α) на 27,3% и рост 14 kfc (α/α1) на 23,9% за счет увеличения абсолютной спектр-мощности α-волнового диапазона. Следует отметить отсутствие асимметрии интегральных коэффициентов у пациентов данной группы до введения препарата и появление после его применения достоверной ЭЭГ-значимой асимметрии 8 kfc (θ/α1), 10 kfc (δ/α1) и 14 kfc (α/α1), связанной с различиями в изменениях АМ в α1-частотном диапазоне интактной и пораженной гемисфер.
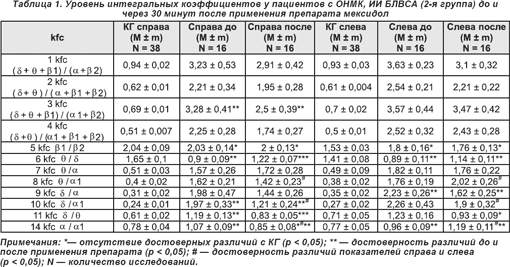
У пациентов 2-й группы, перенесших инсульт с локализацией ишемического очага в бассейне правой внутренней сонной артерии (ОНМК, ИИ БПВСА) (табл. 2), определялось достоверное (p < 0,05) повышение уровня 6 kfc (θ/δ) на 28,6% справа, на стороне поражения, и 3 kfc ((δ + θ + β1) / (α1 + β2)) на 31,1% слева, в сохранном полушарии.
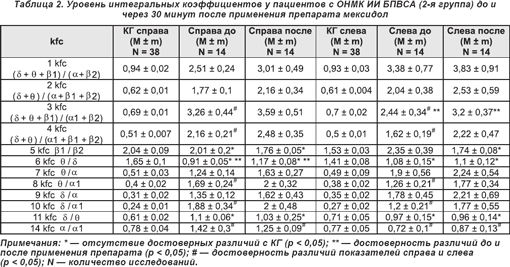
Под влиянием приема препарата мексидол в группе пациентов, перенесших инсульт с локализацией ишемического очага в вертебробазилярном бассейне (ОНМК, ИИ ВББ) (табл. 3), статистически достоверными (p < 0,05) изменениями интегральных коэффициентов являются:
— справа уменьшение уровня 14 kfc на 35,1%, слева снижение показателей 1 kfc ((δ + θ + β1) / (α + β2)) на 36,8%, 7 kfc (θ/α) на 44,2% и 9 kfc (δ/α) на 48,9% за счет увеличения абсолютной спектр-мощности α-волнового диапазона;
— справа повышение уровней 1 kfc ((δ + θ + β1) / (α + β2)) на 30,3%, 7 kfc (θ/α) на 44,9% и 9 kfc (δ/α) на 35,9% за счет смещения доминирующей ЭЭГ-мощности в θ- и δ-частотные диапазоны, слева рост 14 kfc (α/α1) на 40,2% из-за уменьшения абсолютной α1-спектр-мощности.
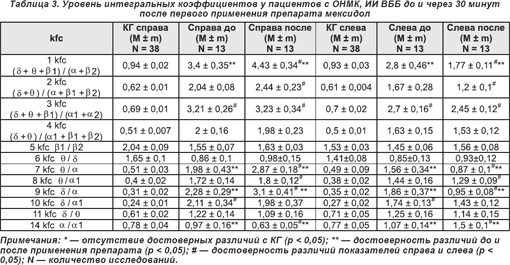
Симметричное снижение уровней интегральных коэффициентов KFC1, KFC3, KFC7, KFC8, KFC9, KFC10 за счет выраженного роста АМ в α- и β2-волновых диапазонах отражает динамику изменений спектральной мощности ЭЭГ в ответ на фармакологическое воздействие мексидола у пациентов 2-й группы. Прогностически благоприятными ЭЭГ-признаками эффективности применения данного препарата при право- или левополушарном мозговом инсульте следует считать также достоверное повышение АМ в диапазонах β1- и особенно β2-волновой активности на стороне поражения одновременно со снижением уровня АМ в медленноволновом диапазоне преимущественно сохранной гемисферы мозга.
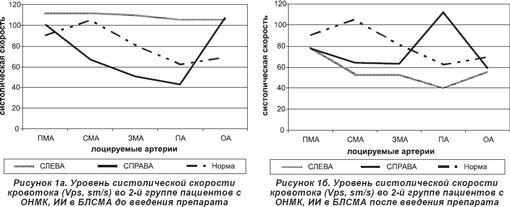
С помощью УЗДГ у пациентов обеих групп при поступлении в отделение выявлены следующие изменения цереброваскулярного кровотока: гемодинамически значимая обратная (доминирование скорости на стороне поражения) асимметрия (более 30%) ЛСК по церебральным артериям или симметричное ускорение мозгового кровотока при изменении спектральных характеристик потока за счет повышения ЦС.
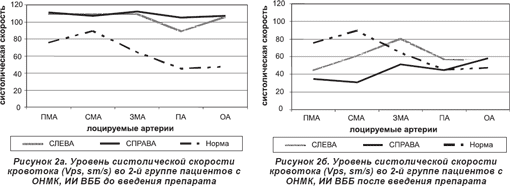
По данным настоящего исследования, прогностически благоприятными изменениями кровотока в интракраниальных сосудах во 2-й группе пациентов после проведенной терапии являются: достоверное уменьшение или отсутствие АК при право- или левополушарном мозговом инсульте (рис. 1б, 2б); достоверный рост скорости венозного оттока, более выраженный на стороне поражения; симметричное снижение ЛСК, ССК, практически до нормальных значений; уменьшение вазоконстрикции интракраниальных сосудов, в том числе в бассейне пораженной артерии.
Применение мексидола в лечении больных с мозговым инсультом различного генеза в 1-14-е сутки на фоне традиционного лечения по протоколу способствует повышению резистентности тканей мозга к гипоксии, снижению выраженности клинических проявлений неврологического дефицита и летальности при острых сосудистых церебральных расстройствах.
Выводы
1. Выявлены особенности фармакологического воздействия мексидола на ЭЭГ-реактивность головного мозга и цереброваскулярный кровоток у пациентов с ОНМК различного генеза в острейшем периоде инсульта.
2. Изменения ЭЭГ-реактивности и основных цереброваскулярных характеристик через 30 минут после однократного введения мексидола пациентам в острейшем периоде инсульта предопределяют необходимость включения данного препарата в состав (протокол) наиболее ранней интенсивной и патогенетически направленной терапии ишемического инсульта.
3. Сочетание метода интегрального количественного анализа ЭЭГ-паттерна с УЗГД повышает достоверность оценки эффективности антиоксидантной терапии.
4. Применение мексидола в комплексном лечении мозгового инсульта в первые 14 суток после ОНМК приводит к снижению летальности до 14,06%, уменьшает уровень неврологического дефицита и вероятность инвалидизации пациентов.
1. Віничук С.М. Мозговой інсульт: Навч. посібник. — Київ, 1998. — 50 с.
2. Воронина Т.А. Мексидол: основные эффекты, механизм действия, применение. — Киев, 2004. — 16 с.
3. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001. — 328 с.
4. Жирмунская Е.А., Лосев В.С. Системы описания и классификация электроэнцефалограмм человека. — М.: Наука, 1984. — 79 с.
5. Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней (Руководство для врачей). — М.: МЕДпресс-информ, 2004. — С. 384-433.
6. Клиническая допплерография окклюзирующих поражений артерий и конечностей: Учеб.-методич. Руководство / Под общ. ред. проф. Е.Б. Куперберга. — М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 1997. — 187с.
7. Острова Т.В. Діагностичний алгоритм оцінки електричної активності мозку людини у нормі і при деяких формах розладів свідомості: Автореф дис... канд. мед. наук: 14.03.03 / Донецький держ. мед. ун-т. — Донецьк, 2002. — 20 с.
8. Острова Т.В., Черній В.І., Шевченко А.І. Алгоритм діагностики реактивності ЦНС методами штучного інтелекту. — Донецьк: ІПШІ «Наука і освіта», 2004. — 180 с.
9. Триумфов А.В. Топическая диагностика заболеваний нервной системы. — М.: Медицина, 1986. — 247 с.
10. Федин А.И., Румянцева С.А., Евсеев В.В. Результаты клинического изучения препарата мексидол у больных с острыми нарушениями мозгового кровообращения. — М.: ООО «Фармасофт», 2000. — 13 с.
11. Яхно Н.Н. Болезни нервной системы. — M.,1995. — T. I.
